急性減壓缺氧對大鼠氧化應激損傷的研究
高迎春,孟盼盼,郭建魁,何 蕾,曹琪璐,張 俊
高原地區空氣中氧氣的含量隨著海拔高度的增加而降低,青藏高原的平均含氧量僅為海平面的60%[1]。當人快速進入高原地區時,空氣中的氧分壓下降,血氧飽和度迅速降低,造成人體組織器官的缺氧性損傷,甚至引發急性高原病,嚴重時導致死亡[2]。在高原缺氧環境下,機體內的自由基代謝發生紊亂,自由基的含量異常增高,引起脂質過氧化,損傷生物大分子和細胞膜結構,導致氧化-抗氧化系統功能失衡,進而使機體發生氧化性損傷[3-4]。近年來,隨著高原經濟建設的發展和交通設施的完善,越來越多的高原從業者和旅游者需要進入高原地區,因此,明確高原病的發病因素及防護機制,提高急進高原人群的缺氧耐受力至關重要[5-6]。本研究通過采用大型低壓低氧動物實驗艙模擬高原海拔8000 m,對缺氧12、24、48 h大鼠心、腦組織進行病理觀察和氧化應激相關生化指標測定,評價高原缺氧不同時間對心、腦組織損傷的影響,以期為高原疾病防治研究提供科學的實驗依據。
1 材料與方法
1.1實驗動物 SPF級Wistar雄性大鼠40只,體重180~220 g。購自蘭州大學動物科。合格證號:SCXK(京)2016-0006。飼養于聯勤保障部隊第九四〇醫院動物實驗科。
1.2儀器 FLYDWC50-ⅡA型低壓低氧動物實驗艙(中航工業貴州風雷航空軍械有限責任公司);SpectraMax i3全自動熒光酶標儀(美國Molecular Devices 公司);IMS-20制冰機(常熟雪科電器有限公司);水浴鍋(上海醫療器械七廠);高速離心機(德國Appendorf公司);L486型-806超低溫冰箱(海爾Biochemical儀器有限公司);Vortex渦旋儀(海門市其林貝爾儀器);DK-8A型電熱恒溫水槽(上海精宏實驗設備有限公司)。
1.3藥品與試劑 甲醛(分析純,成都金山化學試劑有限公司);生理鹽水(四川科倫藥業,批號:C215101607);10%水合氯醛溶液(解放軍第一醫院,批號:20150523);乳酸脫氫酶(LDH)試劑盒(批號:20161219);考馬斯亮藍法蛋白試劑盒(批號:20161203);BCA法蛋白試劑盒(批號:20161212);乳酸(LD)試劑盒(批號:20170106);過氧化氫(H2O2)試劑盒(批號:20161219);過氧化氫酶(CAT)試劑盒(批號:20161220);谷胱甘肽(GSH)試劑盒(批號:20161209);谷胱甘肽過氧化物酶(GSH-PX)試劑盒(批號:20161220);總超氧化物歧化酶(T-SOD)試劑盒(批號:20161221);糖原試劑盒(批號:20161230);一氧化氮(NO)試劑盒(批號:20161216);一氧化氮合酶(NOS)試劑盒(批號:20161219)。以上試劑盒均由南京建成提供。
1.4缺氧方法 取SPF級健康Wistar雄性大鼠,適應飼養3 d后隨機分為常氧對照組、缺氧12、24、48 h組,每組10只。常氧對照組大鼠不缺氧,其余3組置于大型低壓低氧動物實驗艙中,以10 m/s速度減壓上升至海拔8000 m高度,分別缺氧12、24、48 h。缺氧相應時間完成后,以20 m/s速度將氧艙海拔降至3500 m,將大鼠立即處死,取心、腦組織檢測相關指標。
1.5心肌組織和腦組織顯微結構觀察 每組各取2只大鼠取其心、腦組織,經生理鹽水漂洗放入10%甲醛溶液中浸泡1周后,將樣品送至聯勤保障部隊第九四〇醫院病理科,進行石蠟包埋,組織切片,染色以及光鏡觀察。
1.6心肌組織和腦組織超顯微結構觀察 每組各取2只大鼠,取其心、腦組織,并立即投入新鮮固定液中(2.5%戊二醛)固定1周后,取出用鋒利刀片切成1 mm的小塊。樣品送往蘭州大學基礎醫學院電鏡室,進行浸透與包埋工作以及電鏡觀察。
1.7心肌組織和腦組織生化指標測定 取大鼠心、腦組織標本,準確稱取各組織重量后,加入9倍冰生理鹽水,使用組織勻漿器在冰水浴中勻漿,3500 r/min,離心10 min,取上清于-80℃保存待測。指標測定方法按照說明書要求進行。

2 結果
2.1減壓缺氧對大鼠心、腦組織顯微結構的影響 常氧對照組大鼠腦組織結構正常,細胞形態完好,血管清晰可見;與常氧對照組比較,缺氧后大鼠腦組織血管、神經細胞和膠質細胞周圍間隙明顯擴大,細胞核染色質不均勻,呈空泡狀或網狀,間質內空泡狀結構增多,且損傷程度隨著缺氧時間的延長而加重。見圖1。常氧對照組大鼠心組織結構正常,細胞形態完好,心肌纖維排列整齊;與常氧對照組比較,心肌組織損傷隨著缺氧時間的延長而加重,肌細胞腫脹,肌纖維增粗排列不整齊,胞核增大深染,缺氧24 h后,心肌細胞空泡變性;至缺氧48 h后損傷尤其嚴重,肌纖維中部分肌原纖維溶解。見圖2。
2.2減壓缺氧對大鼠心、腦組織超顯微結構的影響 常氧對照組大鼠神經元細胞核膜平整光滑,異染色質少,常染色質多,細胞器多,且狀態良好;與常氧對照組比較,缺氧組大鼠神經細胞組織損傷隨著缺氧時間的延長而加重,缺氧12 h后,血管間隙腫脹,神經元細胞正常;缺氧24 h后損傷較12 h嚴重,線粒體腫脹,內質網擴張,血管間隙腫脹;缺氧48 h后損傷最嚴重,血管外周間隙腫脹,細胞核凋亡早期內質網擴張。見圖3。常氧對照組大鼠心肌纖維排列密集有序,肌絲連接處整齊,肌絲明暗帶交替明顯,寬度正常,線粒體圓形,形態良好,膜完整;與常氧對照組比較,缺氧12、24 h損傷較輕,缺氧12 h后,肌纖維輕度溶解;缺氧24 h后,血管輕度腫脹,肌質網擴張;至缺氧48 h可見明顯損傷,線粒體腫脹,受損嚴重的部分出現收縮帶,肌節縮短。見圖4。
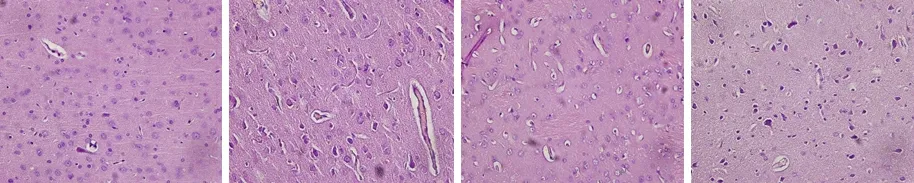
圖1 4組大鼠腦組織病理觀察結果(HE×400)
A.常氧對照組;B.缺氧12 h組;C.缺氧24 h組;D.缺氧48 h組
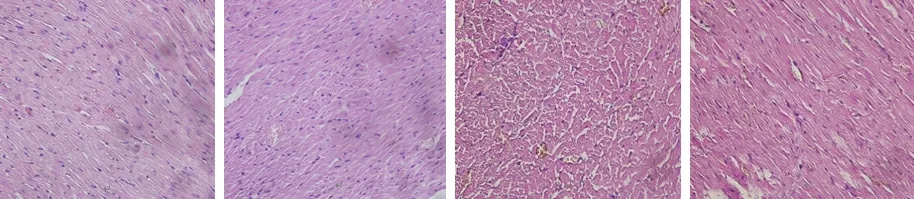
圖2 4組大鼠心組織病理觀察結果(HE×400)
A.常氧對照組;B.缺氧12 h組;C.缺氧24 h組;D.缺氧48 h組
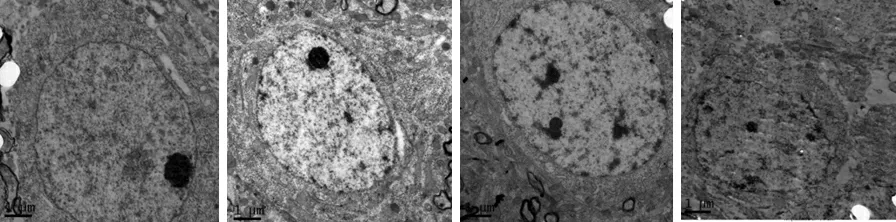
圖3 模擬高原缺氧不同時間對腦組織神經元細胞的影響(×10 000)
A.常氧對照組;B.缺氧12 h組;C.缺氧24 h組;D.缺氧48 h組

圖4 模擬高原缺氧不同時間對心肌肌纖維的影響(×10 000)
A.常氧對照組;B.缺氧12 h組;C.缺氧24 h組;D.缺氧48 h組
2.3減壓缺氧對大鼠心、腦組織氧化應激相關生化指標的影響 與常氧對照組比較,缺氧組大鼠心組織CAT活力隨缺氧時間延長呈先降低后逐漸升高的趨勢,缺氧12 h降低顯著,缺氧24、48 h高于缺氧12 h,且缺氧48 h高于缺氧24 h(P<0.05,P<0.01)。與常氧對照組比較,缺氧組心組織H2O2含量呈先升高后逐漸降低的趨勢,缺氧12、24 h升高顯著,缺氧48 h低于缺氧12、24 h(P<0.05,P<0.01)。與常氧對照組比較,缺氧組心組織GSH含量在缺氧24、48 h時顯著降低,且缺氧24、48 h低于缺氧12 h(P<0.05,P<0.01)。與常氧對照組比較,缺氧組心組織T-SOD活力呈先降低后逐漸升高的趨勢,缺氧12 h降低顯著,且缺氧48 h高于缺氧12 h(P<0.05,P<0.01);MDA含量呈先升高后降低趨勢,但僅缺氧24 h組高于常氧對照組(P<0.05)。與常氧對照組比較,缺氧組腦組織CAT活力呈先降低后逐漸升高的趨勢,缺氧12、24 h顯著降低,但缺氧48 h開始升高,且高于缺氧12、24 h(P<0.05)。缺氧組腦組織H2O2含量隨缺氧時間延長逐漸升高,缺氧48 h高于常氧對照組(P<0.05),與缺氧12、24 h組比較差異無統計學意義(P>0.05)。與常氧對照組比較,缺氧組腦組織GSH含量隨著缺氧時間的延長逐漸降低(P<0.05),但各缺氧組間比較差異無統計學意義(P>0.05)。缺氧組腦組織T-SOD活力呈降低趨勢,缺氧24、48 h低于常氧對照組和缺氧12 h(P<0.05,P<0.01);MDA含量缺氧12 h后逐漸升高,但僅缺氧48 h高于常氧對照組,且高于缺氧12、24 h組(P<0.05,P<0.01)。見表1。

表1 4組大鼠心、腦組織氧化應激相關生化指標變化
注:CAT為過氧化氫酶,GSH為谷胱甘肽,H2O2為過氧化氫,T-SOD為總超氧化物歧化酶,MDA為丙二醛;與常氧對照組比較,aP<0.05,bP<0.01;與缺氧12 h組比較,cP<0.05,dP<0.01;與缺氧24 h組比較,eP<0.05,fP<0.01
3 討論
當機體長時間暴露于缺氧環境中,會使機體的內源性抗氧化酶活性下降,打破生物體內自由基產生和清除之間的動態平衡,從而自由基攻擊體內生物大分子,導致機體一系列氧化性損傷[7-8]。當機體吸入的氧氣不足時,心臟便會啟動代償機制,使血管擴張,加速心率和加大心臟動力,增加單位時間內的血流量,從而提高機體的攝氧能力[9]。但同時也會加重心臟的負擔,導致心臟病、心力衰竭等。大腦是機體內耗氧量最大的器官之一,缺氧環境對腦代謝、腦自動調節、腦血流速度、腦血管反應、腦功能和形態都有一定的影響,因此大腦不可避免地會受到氧化應激的影響[10]。本研究HE染色結果顯示,大鼠腦組織缺氧后可見明顯損傷,腦組織血管、神經細胞和膠質細胞周圍間隙明顯擴大,細胞核染色質不均勻,呈空泡狀或網狀,間質內空泡狀結構增多,但缺氧12、24、48 h損傷無明顯差異;心組織損傷隨著缺氧時間的延長而加重,肌細胞腫脹,肌纖維增粗排列不整齊,胞核增大深染,心肌細胞空泡變性,肌纖維中部分肌原纖維溶解。組織病理學研究發現,缺氧后大鼠腦組織神經元細胞超顯微結構受到嚴重損傷,損傷程度隨著缺氧時間的延長而加重,血管間隙腫脹,線粒體腫脹,細胞核凋亡。缺氧12、24 h對大鼠心肌纖維的超顯微結構損傷較小,至缺氧48 h后,心肌纖維受到嚴重損傷,線粒體腫脹,受損嚴重的部分出現收縮帶,肌節縮短。
在正常生理情況下,機體內產生的少量自由基可隨時被體內的抗氧化物酶清除,二者處于動態平衡。但當機體處于缺氧環境時,由于氧(O2)含量低,體內電子積累量高,更多的電子攻擊可用O2基態形成超氧陰離子(O2-),進而通過鏈式反應形成H2O2和羥基自由基(OH-)[11],體內產生的大量活性氧(ROS)攻擊生物膜中的酶和不飽和脂肪酸,引發脂質過氧化作用,形成以MDA為主的多種過氧化物,對機體造成損傷[12-13]。同時機體的抗氧化能力防御體系包括酶促與非酶促兩個體系均受到干擾,使抗氧化酶活性(CAT、T-SOD)和GSH含量降低[14],最終導致氧化-抗氧化系統功能失衡。本研究結果顯示,隨著缺氧時間的延長心組織H2O2、MDA含量呈先升高后降低趨勢,CAT、T-SOD活力呈先降低后升高趨勢,GSH含量缺氧12 h后開始顯著降低,其中H2O2缺氧12 h、MDA缺氧24 h升高較明顯,CAT、T-SOD缺氧12 h降低較明顯,GSH缺氧24 h降低較明顯;腦組織H2O2含量呈逐漸升高趨勢,MDA、CAT呈先降低后升高趨勢,T-SOD活力和GSH含量呈逐漸降低趨勢,其中H2O2、MDA缺氧48 h升高較明顯,CAT缺氧24 h下降較明顯,GSH、T-SOD缺氧48 h下降較明顯。
綜上所述,本實驗主要從病理學觀察、氧化/抗氧化系統兩方面探討了模擬海拔8000 m不同時間對大鼠心、腦組織損傷的影響,且損傷程度與缺氧時間有關,隨著缺氧時間的延長,腦組織損傷逐漸加重。但是心組織在缺氧暴露12 h時損傷較嚴重,可能是缺氧損傷與機體防衛機制相互對抗的結果。

