膠紅酵母CICC 33013胞外多糖抑制肝癌細胞活性研究
馬文錦 李梅林 王 博 周彥兵 彭 濤 張永顯 于長青 班省華
(甘肅省輕工研究院有限責任公司,甘肅 蘭州 730000)
膠紅酵母是一種抗逆性較強的腐生酵母,含有包括7種人體必需氨基酸在內的16種常見的氨基酸,6種脂肪酸,以及豐富的類胡蘿卜素、VE、核苷酸和蝦青素等微量元素[1]。胞外多糖(exo-polysaccharide,EPS)是由微生物包括細菌、真菌、藻類釋放到周圍環境中促進細胞生長,抑制溶菌酶,儲存營養和加強耐有毒重金屬的一類多糖[2]。近年來,膠紅酵母的研究主要集中在其類胡蘿卜素[3-4]的富集培養條件和優良菌株的篩選[5-6]等方面。研究[7-8]發現,酵母菌胞外多糖(YEPS)具有潛在的抗氧化、抗凝血、抗血栓和抗病毒活性,可用于生產有機體免疫調節劑。目前,國內外對細菌胞外多糖和一些大型真菌胞外多糖的研究較多[9],而對酵母菌胞外多糖的菌株篩選、結構解析和功能活性研究較少[10],尤其膠紅酵母胞外多糖的結構解析和功能活性尚未見報道。
課題組[11]前期通過醇沉,脫蛋白,透析等方法得到膠紅酵母CICC 33013菌株代謝的胞外多糖(REPS),復溶后經DEAE-52纖維素層析和Sephadex G-100凝膠柱層析分離純化,高效凝膠滲透色譜法色譜圖顯示胞外多糖組分REPS2-A是單一、對稱峰,表明得到的膠紅酵母胞外多糖組分REPS2-A是均相樣品,根據葡聚糖標準,胞外多糖組分REPS2-A的平均分子量為7.125×106Da。并基于紅外光譜、核磁共振和甲基化分析,確定了膠紅酵母胞外多糖組分REPS2-A是高度分支的多糖,由(1→3)-連接的Gal為骨架組成,分支是由(1→2)-連接的Glc、(1→4)-連接的Man、(1→3)-連接的Glc、(1→4,6)-連接的Man和(1→2,3,4)-連接的Ara組成。有研究[12-13]表明,具有抗腫瘤活性的甘露聚糖多為(1→6)鍵型,活性半乳糖則以(1→3)糖苷鍵連接。試驗擬從增殖、凋亡與周期等方面分析評價胞外多糖組分REPS2-A對肝癌細胞HepG2的抑制作用,為膠紅酵母胞外多糖在食品與藥品中的應用提供理論支持和技術依據。
1 材料與方法
1.1 材料與儀器
膠紅酵母菌株(RhodotorulamucilaginosaCICC 33013):中國典型培養物保藏中心;
血癌細胞K562、胃癌細胞BGC823、SGC7901、MKN28、肝癌細胞HepG2、BEL7402、Hep3B、胰腺癌細胞HS66T、乳腺癌細胞SKBR3、宮頸癌細胞HeLa:蘭州大學第一醫院中心實驗室;
RPMI 1640培養液:武漢凌飛科技有限公司;
胎牛血清:浙江天杭生物科技股份有限公司;
磷酸鹽緩沖溶液、胰酶:天津科密歐化學試劑有限公司;
青霉素—鏈霉素溶液:國藥集團化學試劑有限公司;
膜聯蛋白V-異硫氰酸熒光素細胞凋亡檢測試劑盒:廣州威佳科技有限公司;
其他試劑:均為分析純;
流式細胞儀:LDZX-30KBS型,上海申安醫療器械廠;
倒置顯微鏡:HH-4型,金壇市宏華儀器廠;
酶聯免疫檢測儀:DG5033A型,上海巴玖實業有限公司;
離心機:CT15RT型,上海天美生化儀器設備有限公司;
搖床振蕩器:ZD-9550型,海門市其林貝爾儀器制造有限公司;
CO2培養箱:UV-1100型,上海美譜達儀器有限公司。
1.2 試驗方法
1.2.1 癌細胞篩選 在倒置光學顯微鏡下觀察各組癌細胞,選取生長良好的各癌細胞[14]。選出的細胞進行分類處理:① 懸浮類細胞直接移入無菌的離心管進行離心;② 貼壁類細胞移除原有的培養基,用PBS清洗2~3次,加入1~2 mL胰酶靜止3~5 min,加入完全培養液終止消化,移入無菌的離心管,離心條件為1 000 r/min、5 min,移除上清液。
將對數生長期的血癌細胞K562、胃癌細胞BGC823、胃癌細胞SGC7901、胃癌細胞MKN28、肝癌細胞HepG2、BEL7402、Hep3B、胰腺癌細胞HS66T、乳腺癌細胞SKBR3、宮頸癌細胞HeLa接種在無菌的96孔板,接種濃度約為104個/mL,重復7次,并設置空白對照組,加入多糖(濃度為1.0 mg/mL),混合均勻放入CO2培養箱中培養24 h。吸去上清液,加入RPMI 1640培養液和MTT溶液,于37 ℃、5% CO2的條件下繼續培養4 h。吸去上清液,分別加入DMSO,置于搖床上低速振蕩10~15 min,使結晶物溶解完全。在波長為490 nm條件下對各孔的吸光值進行測定[15-16]。細胞增殖抑制率按式(1)計算:
(1)
式中:
R——細胞增殖抑制率,%;
Ap——試驗組吸光值;
AC——空白組吸光值。
1.2.2 多糖藥物對HepG2細胞作用濃度及時效性測定 經過篩選肝癌細胞HepG2為后續主要的研究對象。在96孔板內接種對數生長期的HepG2細胞,使每孔細胞數約為1.0×104個。多糖濃度分別為0.0,0.5,1.0,10.0 mg/mL,做6個重復并設置空白對照,并以人正常細胞株(L02)和Oxaliplatin處理HePG2分別為陰性和陽性對照組。加樣完成后振蕩均勻,于37 ℃、5% CO2的條件下培養24,48,72 h進行測定[17]。
1.2.3 HepG2細胞凋亡檢測 多糖作用于HepG2細胞的濃度為1.0 mg/L,未添加多糖的細胞做為空白對照。放入37 ℃、5% CO2的培養箱中培養24,48,72 h形成3個試驗組,每組各做3個平行。培養結束后移除培養液,加入PBS,細胞刮分散細胞,移入離心管離心(1 000 r/min,4 ℃,5 min),移除上清,收集細胞。吸取10 μL細胞沉淀懸于190 μL結合緩沖液,加入膜聯蛋白V-異硫氰酸熒光素細胞凋亡顯像劑,輕輕混勻,避光室溫反應15 min,加入295 μL 結合緩沖液,在1 h內上機檢測,上機前5 min加入5 μL PI(碘化丙啶)[18-19]。
1.2.4 細胞形態學觀察 細胞制成單細胞懸液,細胞數約106個/mL,同時設不加HepG2細胞對照組和濃度為1.0 g/L的多糖作用24,48,72 h的試驗組,培養結束后,在倒置顯微鏡下觀察細胞形態。
1.2.5 細胞周期測定 將培養細胞制成單細胞懸液,細胞數約106個/mL,同時設細胞對照組和濃度為1.0 g/L的多糖作用24,48,72 h的試驗組。用PBS清洗2次,勻漿細胞,用預冷的75%酒精(1~3 mL)固定,加入PI,置4 ℃避光染色30 min,400目尼龍網過濾后,將樣品加入流式細胞儀,氬離子激發PI熒光,波長488 nm處測定。
1.3 數據統計分析
數據采用Sigmaplot 12.5進行統計分析,試驗結果用(x±s)表示,3個平行試驗,采用ANOVA進行Duncana多重比較分析(P<0.05)。
2 結果與分析
2.1 多糖組分REPS2-A對不同癌細胞的作用
采用MTT法研究多糖組分REPS2-A對10種常見癌細胞的抑制作用,效果如圖1所示。結果表明,多糖組分REPS2-A對選取的10種癌細胞都有一定的抑制作用,癌細胞的種類不同,抑制效果亦不相同。其中血癌細胞K562、胃癌細胞BGC823、胃癌細胞SGC7901、胃癌細胞MKN28、肝癌細胞BEL-7402、肝癌細胞Hep3B、胰腺癌細胞HS66T、乳腺癌細胞SKBR3、宮頸癌細胞HeLa 9種癌細胞的抑制率均低于50%,說明多糖組分REPS2-A對這些細胞沒有明顯的抑制效果,可能是自發凋亡引發的結果。對肝癌細胞HepG2的抑制率明顯的高于其他9種癌細胞,其抑制率為62%,高于50%,說明多糖組分REPS2-A對肝癌細胞HepG2的抑制具有特異性。因此后續試驗選取肝癌細胞HepG2作為研究對象。

圖1 多糖REPS2-A對不同癌細胞的抑制結果
2.2 多糖組分REPS2-A溶液的濃度及時效性分析
如圖2所示,隨著多糖組分REPS2-A溶液濃度的增加,其對肝癌細胞HepG2的抑制率逐漸升高,而隨著作用時間的延長,多糖REPS2-A溶液對肝癌細胞HepG2的抑制率變化范圍較小,說明在一定的時間(72 h)內,時間的變化對多糖REPS2-A溶液的作用效果影響不大。當濃度低于1.0 mg/mL時,多糖REPS2-A溶液對肝癌細胞HepG2的抑制率均低于50%,說明多糖組分REPS2-A溶液濃度低于1.0 mg/mL時的研究意義不大。濃度為1.0 mg/mL時,多糖組分REPS2-A溶液對肝癌細胞HepG2的抑制率均高于50%,對正常肝細胞L02的抑制率為31%,說明在該濃度下肝癌細胞HepG2得到了較好的抑制效果。當濃度為10.0 mg/mL時,抑制率接近100%,此時的多糖組分REPS2-A溶液的濃度太高影響了細胞的生長,因此,無實際研究意義。
以經典抗癌藥物奧沙利鉑作為陽性對照,給予鉑類藥物后,肝癌細胞HepG2的生長均受到明顯抑制,細胞生長密度明顯降低,活細胞數量明顯減少。隨著給藥濃度增強和給藥時間延長,鉑類藥物對肝癌細胞的抑制作用逐漸增強,以24~48 h的抑制作用最為明顯。以藥物作用48 h肝癌細胞株的IC50值顯示:HepG2細胞株對鉑類藥物敏感。相比多糖作為抑制劑,10 mg/L多糖對肝癌細胞的抑制率與0.1 mg/L奧沙利鉑藥物的相當。
2.3 多糖組分REPS2-A對HepG2細胞凋亡的影響
由圖3、4可知,未經多糖組分REPS2-A處理的HepG2細胞的自發凋亡率是0.40%;當多糖組分REPS2-A濃度為1 mg/mL作用24,48,72 h時,其細胞早期凋亡率分別為73.74%,36.00%,27.88%,凋亡率分別為77.70%,88.18%,97.08%。與對照組相比,多糖組分REPS2-A能促進肝癌HepG2細胞凋亡。
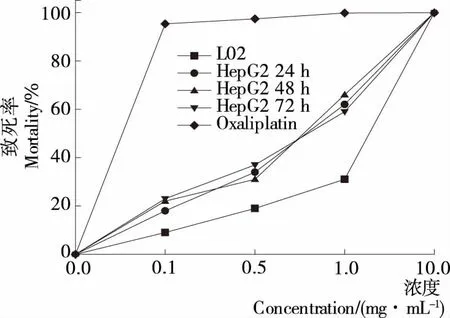
圖2 REPS2-A溶液對肝癌細胞(HepG2)作用的濃度與時效性
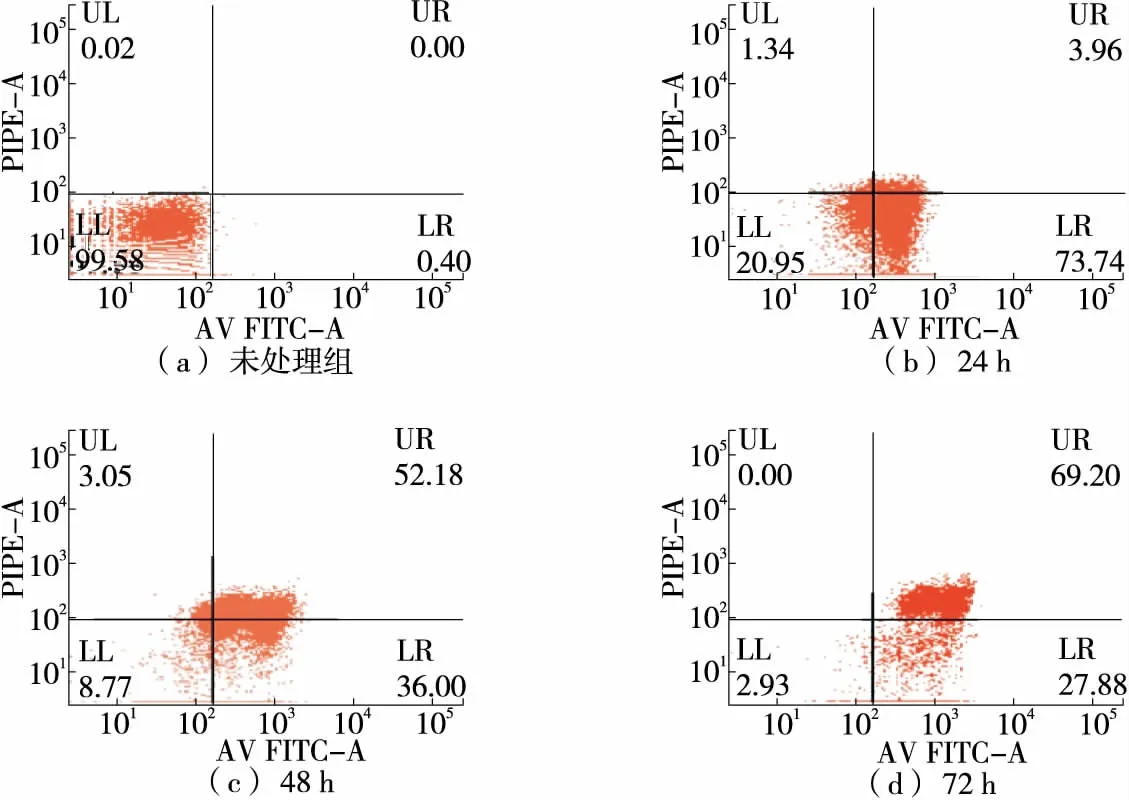
圖3 REPS2-A濃度為1 mg/mL時不同時間HepG2細胞凋亡分析
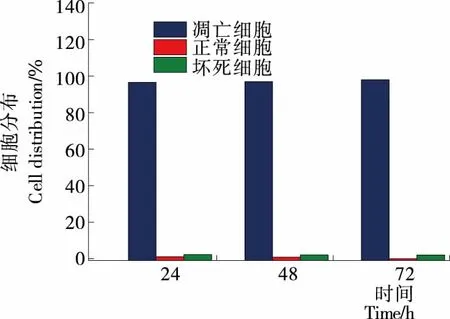
圖4 REPS2-A濃度為1 mg/mL時不同時間(24,
Figure 4 The apoptosis rate of HepG2 cells at different time (24, 48 and 72 h) when the concentration of reps2-a was 1 mg/mL
2.4 多糖組分REPS2-A對HepG2細胞形態學的影響
由圖5可以看出,HepG2細胞在REPS2-A作用下生長、繁殖受到明顯的抑制,并且隨著濃度的增加抑制效果有明顯的增加。
2.5 多糖組分REPS2-A對HepG2細胞周期的影響
用流式細胞儀檢測HepG2細胞在多糖組分REPS2-A濃度為0.0,0.1,0.5,1.0 mg/mL,作用24 h各試驗組細胞周期的變化,結果如圖6和表1所示。隨著濃度的增加,G0~G1期細胞所占百分比升高,表明G1/S期發生阻滯。

圖5 不同多糖REPS2-A濃度處理時HepG2
Figure 5 Morphological characteristics of HepG2 cells treated with different concentrations of polysaccharide REPS2-A
周期分析結果與細胞生長形態影響結果相一致,當REPS2-A濃度為0.0,0.1,0.5,1.0 mg/mL作用24 h后。多糖組分REPS2-A對HepG2細胞的生長有明顯的抑制作用。
3 結論
試驗以膠紅酵母CICC 33013代謝的胞外多糖組分REPS2-A為研究對象,揭示膠紅酵母胞外多糖在肝腫瘤細胞活性中的抑制作用,結果顯示:當多糖組分REPS2-A濃度為1 mg/mL,作用時間分別為24,48,72 h時,肝癌細胞HepG2凋亡率分別為77.70%,88.18%,97.08%。采用流式細胞儀測定多糖對HepG2細胞作用周期,結果顯示:多糖組分REPS2-A溶液使HepG2細胞在G1/S期發生阻滯。試驗證實膠紅酵母胞外多糖能有效抑制肝癌HepG2細胞的增殖,其機制之一是REPS2-A使HepG2細胞阻滯發生在G1/S期,并誘導HepG2細胞凋亡。

]Debris:細胞碎片,Aggregates:聚集體,Dip G1:G1期DNA的相對含量,Dip G2:G2期DNA的相對含量,Dip S:S期DNA的相對含量
圖6 不同濃度的REPS2-A處理24 h的HepG2細胞的流式細胞儀分析圖
Figure 6 Flow cytometry analysis of HepG2 cells treated with REPS2-A of various concentrations:0.0 (control), 0.1, 0.5, 1.0 mg/mL for 24 h
表1多糖REPS2-A不同濃度處理的HepG2細胞的周期分析表
Table1ThecellcyclesofHepG2treatedwithvariousconcentrationofREPS2-A

濃度/(mg·mL-1)細胞所占百分比/%G0~G1期S期G2~M期0.061.00 24.4614.540.168.9627.943.110.571.5628.090.351.075.0923.990.92
膠紅酵母胞外多糖有可能成為治療肝癌的天然產品或作為抗腫瘤藥的輔助藥物,但膠紅酵母胞外多糖對于癌癥的抑制通路機制、膠紅酵母胞外多糖的毒性以及產糖相關的優異基因仍不清楚,需進一步深入研究。

