細葉百合LpPEX7基因克隆及鹽脅迫下的表達特性分析
何 好 朱國慶 陳詩雅 徐 暢 金淑梅
(東北鹽堿植被恢復與重建教育部重點實驗室,生命科學學院,東北林業大學,哈爾濱 150040)
過氧化物酶體含有豐富的各種酶類,如氧化酶、過氧化物酶等,參與活性氧的生成與降解,毒性物質的清除,對保護細胞起了重要作用[1~2]。過氧化物酶體生物合成酶(PEX)是一系列參與過氧化物酶體合成的蛋白,是過氧化物酶體在生物體內合成的關鍵酶,目前已經發現了三十多種PEX蛋白[3],PEX蛋白在植物體提高抗逆能力中起重要作用[4~6]。
構成過氧化物酶體的蛋白質有兩類:膜蛋白(peroxisomal membrane protein,PMP)和基質蛋白[7]。膜蛋白和基質蛋白正確組裝,形成了成熟的過氧化物酶體。基質蛋白的轉運是由其本身肽鏈上的定位信號(peroxisomal targeting signal,PTS)來完成的[8]。PTS有PTS1和PTS2兩種[9]。PTS1是C-末端過氧化物酶體靶向信號類型1,PTS2是N-末端過氧化物酶體靶向信號類型2[10~11]。PEX7是PTS2的受體,由PEX7基因編碼,是形成過氧化物酶體的關鍵蛋白[12~14]。在PEX7突變體中不僅觀察到PTS2蛋白質運輸進入過氧化物酶體的缺陷,而且還觀察到了PTS1運輸進入過氧化物酶體的缺陷[15~16]。
胡楊PePEX11能夠提高擬南芥在鹽脅迫下的抗氧化能力,提升耐鹽能力[5]。超表達擬南芥PEX11基因可促進過氧化物酶體增殖,而RNAi植株則會減少氧化物酶體數量[17]。缺失PEX11基因會降低過氧化氫酶(CAT)和超氧化物歧化酶(SOD)的表達,從而降低對逆境脅迫的抵抗能力[18]。過表達臘梅CpPEX22基因的煙草在受到H2O2脅迫后,CAT、SOD、POD活性和MDA含量都比未轉基因的煙草中有所提高[6]。雖然已知過氧化物酶體是保護細胞、增強植物對鹽堿耐受性的重要細胞器,PEX7蛋白是合成過氧化物酶體的關鍵蛋白,但PEX7蛋白是否在鹽堿或氧化逆境中發生一定的功能未見研究報道,PEX7基因是否也如同PEX11以及PEX22基因一樣,與鹽堿或氧化逆境有一定的應答關系,是本研究要解決的主要問題。
我們對20 mmol·L-1NaHCO3處理后的細葉百合轉錄組分析發現,LpPEX7基因的表達量明顯上調,本研究克隆出LpPEX7基因的開放閱讀框,對LpPEX7的生物信息學進行了分析,在H2O2,NaCl或NaHCO3逆境脅迫條件下,對LpPEX7基因表達量進行了研究,LpPEX7基因轉入模式植物擬南芥中,提高了擬南芥的抗鹽堿和抗氧化的能力,為詳細研究該基因的抗鹽堿功能奠定理論和材料基礎。
1 材料和方法
1.1 材料和試劑
植物材料為組織培養的細葉百合,ES-Taq DNA Polymerase、RT-PCR試劑盒、PMD-18T載體、限制性內切酶購自Takara公司,UltraSYBR Mixture試劑,膠回收試劑盒和質粒小提試劑盒購自康為世紀生物科技有限公司,試驗所需菌株大腸桿菌DH5α和EH105來自本實驗室。
1.2 LpPEX7基因開放閱讀框的克隆
通過分析細葉百合轉錄組數據庫序列,設計了一對特異性引物(上游為LpPEX7F:5′-CGCACCATGCCAGTCTT-3′,下游為LpPEX7R:5′-CAAGTATCAGGCCACTGC-3′),采用CTAB法[19]提取細葉百合的總RNA,使用Reverse transcription-PCR試劑盒對提取的總RNA進行反轉錄,獲得細葉百合cDNA,以cDNA為模板,進行PCR擴增,PCR反應條件為:94℃預變性3 min;94℃變性30 s,55℃退火30 s,72℃延伸30 s,共30個循環;72℃補充延伸10 min。電泳檢測得到的PCR產物,利用膠回收試劑盒進行回收,將回收片段連接到PMD-18T載體并轉化大腸桿菌DH5α感受態細胞,涂布在含有氨芐青霉素的LB平板上,37℃過夜培養,挑取單克隆搖菌,PCR鑒定后,菌液送公司測序。
1.3 生物信息學分析
利用在線工具ProtParam分析蛋白質的理化性質、SignalP-5.0 Server分析預測存在信號肽的概率、TMHMM Server v.2.0分析預測LpPEX7有無跨膜蛋白結構、PSIPRED V4.0預測LpPEX7蛋白的二級結構、SWISS-MODEL分析LpPEX7蛋白三級結構、SMART:Main page分析LpPEX7的保守結構域、MEME分析motif。將克隆基因測序得到的結果在NCBI中進行blast分析,找出相似度較高的其他物種PEX7的氨基酸序列,利用DNA Man軟件進行蛋白質同源氨基酸序列比對,使用MEGA3.1構建進化樹,觀察細葉百合PEX7與其他物種PEX7的親緣關系的遠近。
1.4 LpPEX7基因在細葉百合不同器官中的表達特性
分別提取細葉百合根、鱗莖、葉、花、種子的RNA,并反轉錄成cDNA。根據LpPEX7基因序列設計一對引物(上游為qPCRLpPEX7F:5′-TCCGAGTCTCACGAGTCCAT-3′,下游為qPCRLpPEX7R:5′-CAGTAGGCATGCTCCCGAAA-3′)。利用UltraSYBR Mixture試劑進行實時熒光定量qRT-PCR檢測,反應體系為20 μL(2×SYBR Green Mix 10 μL;10 μmol·L-1上下游引物各0.5 μL;cDNA模板1 μL;ddH2O 8 μL);反應條件為:95℃預變性10 min,95℃ 30 s,55℃ 30 s,72℃ 1 min,40個循環。得到細葉百合不同器官中LpPEX7基因的表達量并進行分析。
1.5 LpPEX7基因在逆境處理后的細葉百合葉和鱗莖中的表達特性
將組織培養瓶中生長一致的細葉百合植株移入到MS培養基(CK)和分別添加200 mmol·L-1NaCl,20 mmol·L-1NaHCO3,11 mmol·L-1H2O2的MS培養基中,不同脅迫處理6、12、24,36、48 h后,提取葉和鱗莖的RNA。將RNA反轉錄為cDNA,利用1.4設計的引物進行qRT-PCR,分析LpPEX7基因在脅迫處理后的細葉百合葉和鱗莖中的表達情況。
1.6 LpPEX7基因過表達擬南芥種子萌發抗鹽堿表型分析
根據1.2測序得到的序列結果,設計添加帶限制性內切酶的引物(上游為:pPEX7BamHⅠF5′-GGATCCATGCCAGTCTTCAAAAC-3′,下游為:pPEX7SalⅠR5′-GTCGACTCAGGCCACTGCTCTG-3′引物中帶下劃線部分分別為限制性內切酶BamHⅠ、SalⅠ的序列),LpPEX7連接到pMD18-T載體上的質粒為模板進行PCR擴增,PCR產物電泳并回收目的條帶,連接到pMD18-T載體上,連接產物轉化大腸桿菌DH5α。轉化后的菌液提取的質粒和pBI121質粒分別用BamHⅠ和SalⅠ雙酶切,回收酶切后的基因和載體片段,利用T4連接酶22℃過夜連接,連接產物轉化大腸桿菌DH5α,KaNa青霉素篩選陽性克隆,酶切鑒定正確后,用電擊法將pBI121-LpPEX7質粒轉入農桿菌EHA105菌株。利用農桿菌介導的花浸法[20]將攜帶pBI121-LpPEX7外源基因的農桿菌EHA105轉入模式植物擬南芥中。收獲的T1代轉基因擬南芥種子消毒后鋪在含有KaNa的1/2MS篩選培養基上萌發,篩選出的能正常生長的綠色植株連續自交2代得到T3代純合種子,利用試劑盒提取生長兩周的T3代種子萌發后的幼苗葉片RNA,利用qRT-PCR檢測8株過表達LpPEX7的擬南芥株系中的LpPEX7基因表達量,qRT-PCR方法同1.4。
含有1/2MS和分別添加H2O2(2,3 mmol·L-1)、NaCl(125,150 mmol·L-1)和NaHCO3(3,5 mmol·L-1)的1/2MS培養基的圓形玻璃平板均分4個扇形結構,野生型擬南芥和T3代過表達LpPEX7基因的擬南芥株系#1、#2、#3的種子播種在4個扇形區域,每個區域14粒種子。播種后的平板于4℃春化48 h,轉移到人工氣候培養箱培養中,10 d后觀察在不同脅迫處理下野生型和過表達LpPEX7基因的擬南芥株系的種子萌發狀況并拍照,實驗均設置3次重復。
2 結果與分析
2.1 LpPEX7基因開放閱讀框的克隆
以細葉百合cDNA為模板,以LpPEX7F,LpPEX7R為引物,進行PCR擴增,經瓊脂糖凝膠電泳顯示,大小約為1 000 bp的位置有PCR產物條帶(圖1)。將條帶回收后與pMD-18T載體連接并轉化到大腸桿菌DH5α中,挑取單克隆菌落搖菌后進行PCR檢測,將檢測條帶位置正確的菌液提取質粒送公司測序,測序結果為957 bp。
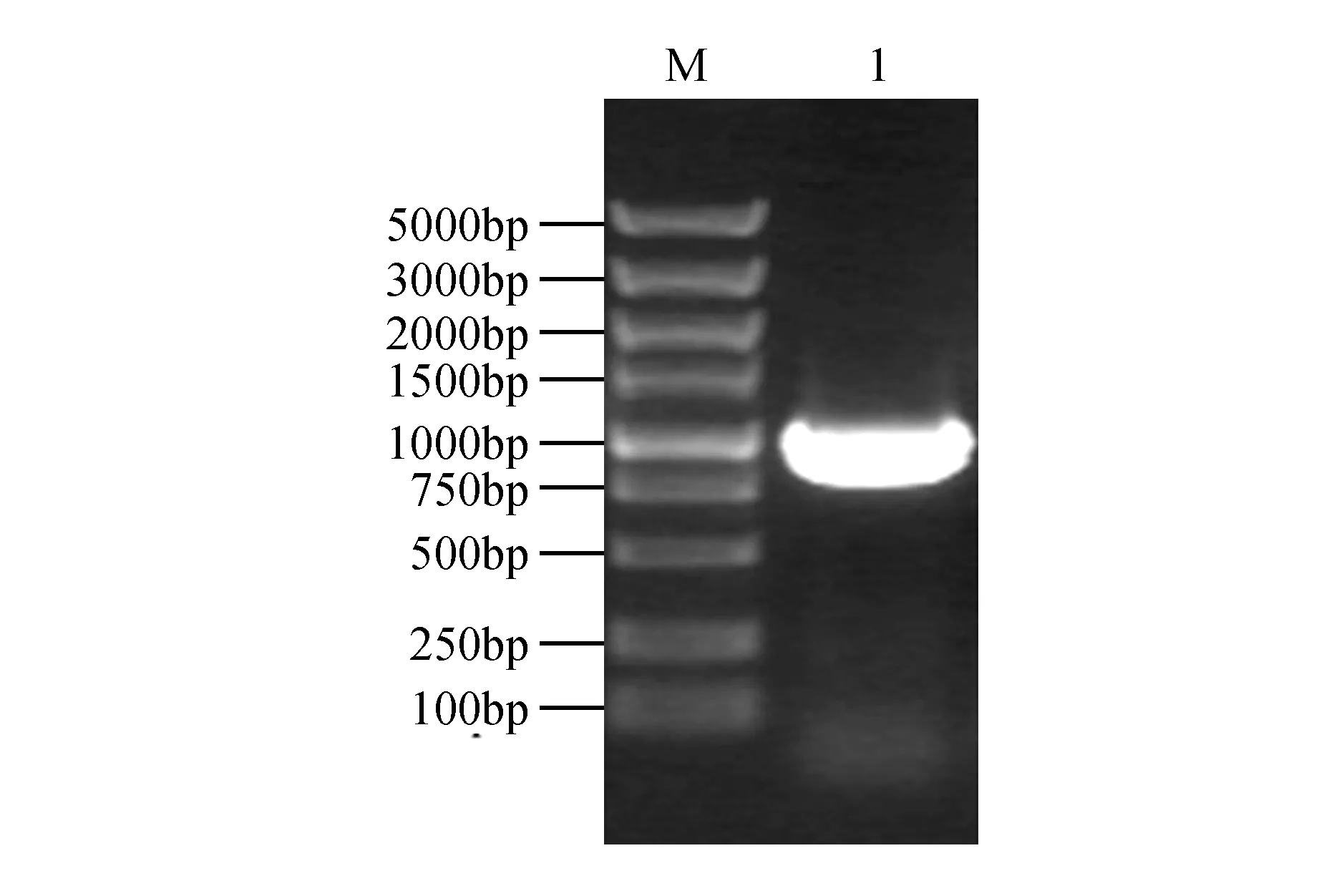
圖1 LpPEX7-T PCR檢測Fig.1 LpPEX7-T PCR assay M.DL5000 marker;1.LpPEX7-T
2.2 生物信息學分析
ProtParam軟件在線分析蛋白質的理化性質:分子式為C1594H2402N436O464S11、相對分子質量為35 449.91 Da、等電點為5.46、不穩定系數為40.24、總平均親水性為-0.108。通過在線分析工具SignalP-5.0 Server:分析預測存在信號肽的概率為0.001 1,TMHMM Server v.2.0分析預測無跨膜蛋白結構。在線分析工具PSIPRED V4.0預測LpPEX7蛋白的二級結構,存在許多股和卷曲結構(圖2A),SWISS-MODEL在線軟件分析其三級結構,與二級結構預測結果相符合(圖2B)。SMART軟件分析LpPEX7的保守結構域,存在6個WD40結構域、1個PQQ結構域和1個6PGD結構域。6個WD40結構域位置分別在50~89、95~135、138~178、181~221、225~265和269~309氨基酸處(圖2C),而PQQ和6PGD結構域在16~56、40~201氨基酸處。
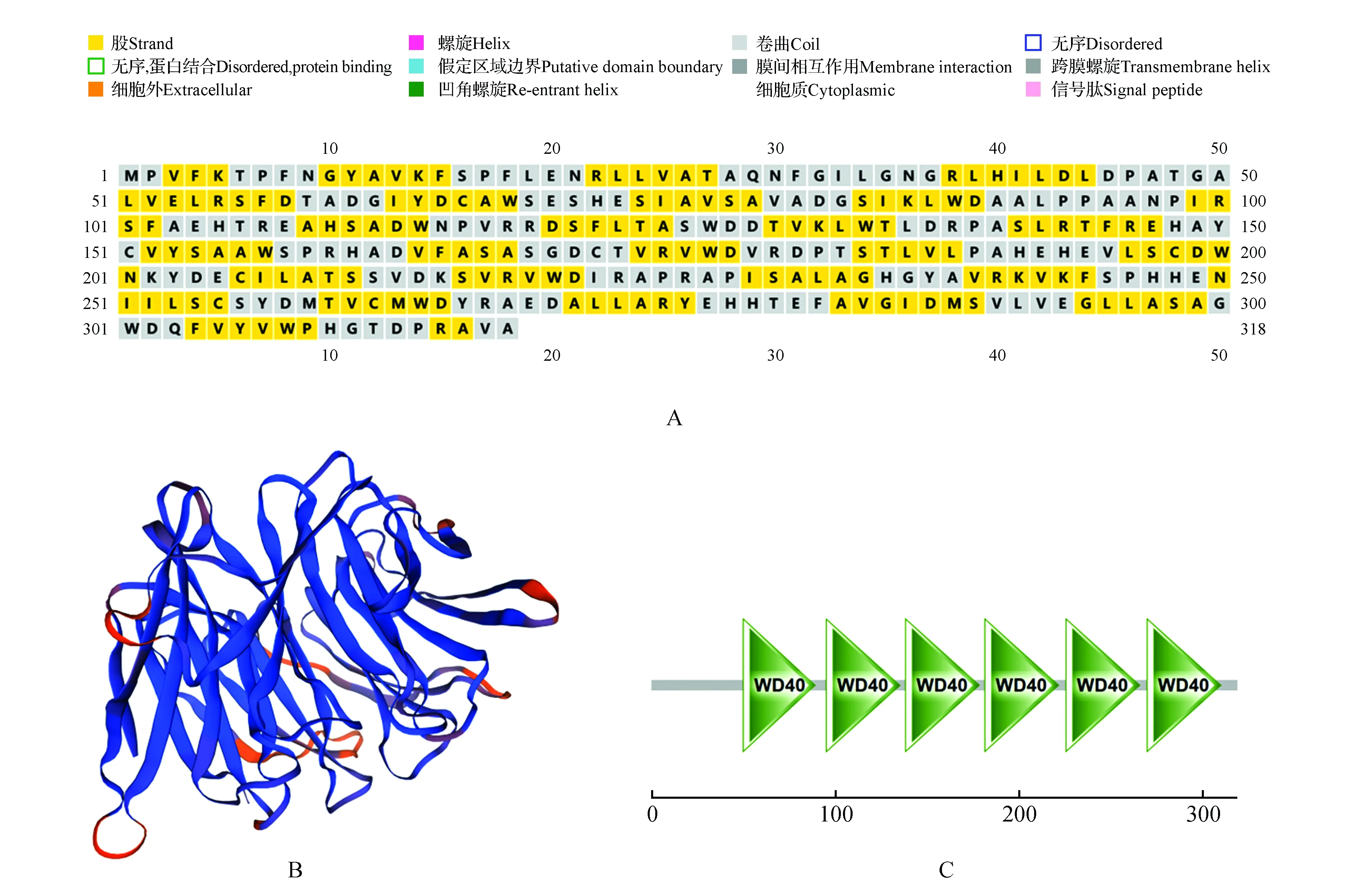
圖2 LpPEX7結構分析 A.LpPEX7二級結構預測;B.LpPEX7三級結構預測;C.LpPEX7保守結構域預測Fig.2 Structural analysis of LpPEX7 A.Prediction for the secondary structure of LpPEX7; B.Prediction for the tertiary structure of LpPEX7; C.Prediction of the conserved domains of LpPEX7
圖3 LpPEX7與其他植物同源蛋白的氨基酸序列比對Fig.3 Amino acid sequence alignment of LpPEX7 with other plant homologous proteins
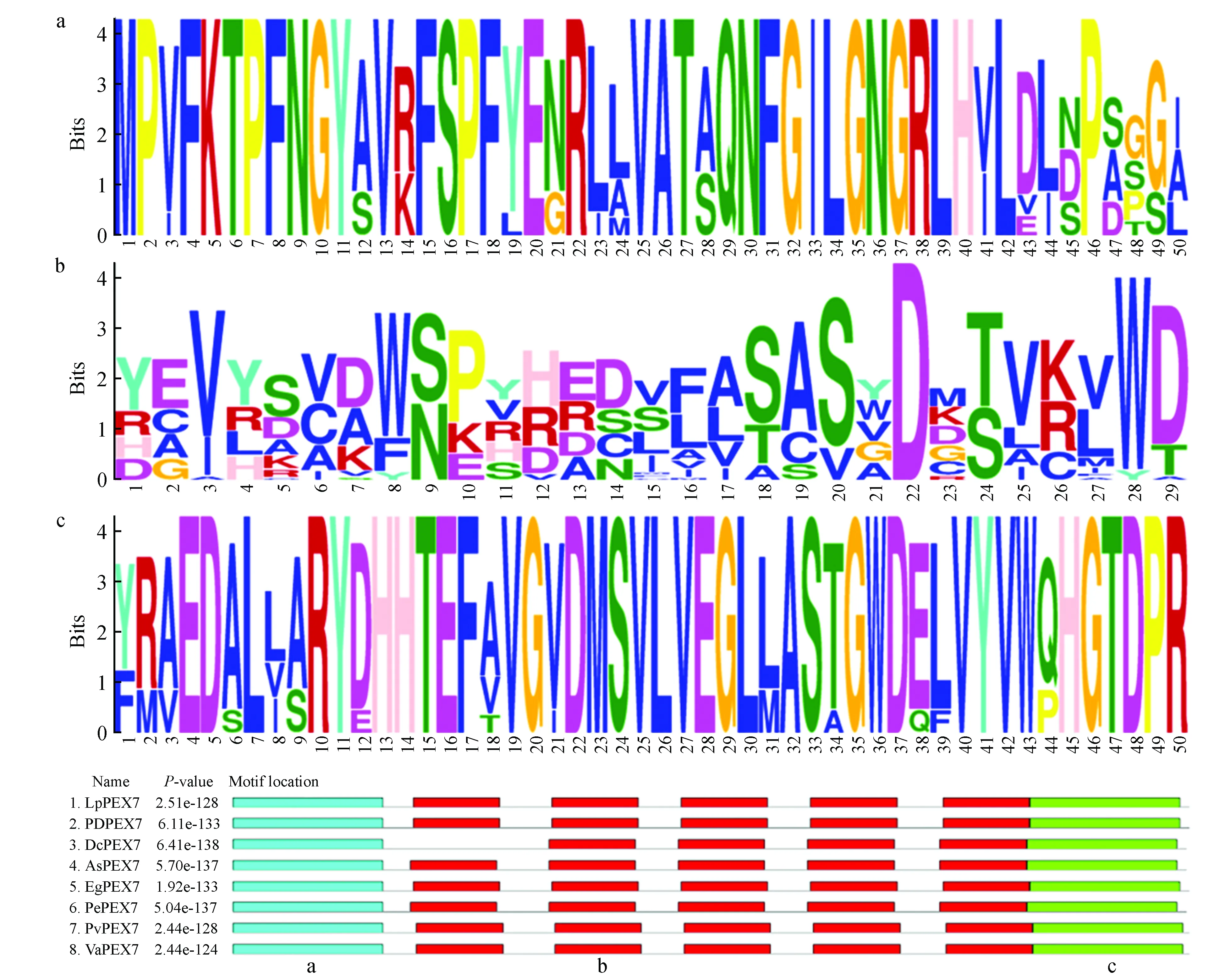
圖4 細葉百合LpPEX7與其他植物PEX7蛋白序列MEME聚類分析Fig.4 MEME cluster analysis of LpPEX7 with other plant PEX7 proteins
利用DNA Man軟件將細葉百合LpPEX7和其他物種PEX7的氨基酸序列(海棗PhoenixdactyliferaXP_008813497.1,83.96%;鐵皮石斛DendrobiumcatenatumXP_020705736.1,82.7%;深圳擬蘭ApostasiashenzhenicaPKA46872.1,83.02%;油棕ElaeisguineensisXP_010925636.1,83.33%;姬蝴蝶蘭PhalaenopsisequestrisXP_020576756.1,80.82%;菜豆PhaseolusvulgarisXP_009404509.1,76.18%;赤豆VignaangularisXP_017436924.1,76.18%)進行對比(圖3),發現該蛋白的氨基酸序列與其他植物的PEX7具有較高的同源性以及相似的保守區,認為從細葉百合cDNA中克隆出來的基因為PEX7,命名為LpPEX7,NCBI登錄號為MN380029。利用MEME在線軟件分析細葉百合LpPEX7與其他植物PEX7蛋白序列排名前三的motif(圖4),細葉百合LpPEX7基序a位置在1~50氨基酸處、基序b和c主要分布在WD40保守區域。
利用MEGA3.1構建進化樹后發現,LpPEX7蛋白與海棗、鐵皮石斛、深圳擬蘭、油棕、姬蝴蝶蘭等植物的PEX7親緣關系較近(圖5)。
2.3 LpPEX7基因在細葉百合不同器官中的表達特性
運用qRT-PCR檢測LpPEX7基因在細葉百合不同器官的表達特異性,3組重復的表達差異較小,數據可靠。本研究中LpPEX7基因在細葉百合的種子中表達量最高、葉片和鱗莖中表達量較高(圖6)。
2.4 LpPEX7基因在逆境處理后的細葉百合葉片和鱗莖中的表達特性
為了分析LpPEX7基因與鹽堿逆境的關系,選取了200 mmol·L-1NaCl、20 mmol·L-1NaHCO3、11 mmol·L-1H2O2三種逆境,對細葉百合進行不同時間梯度的逆境脅迫處理,結果顯示,LpPEX7基因受到這三種逆境的誘導后表達量都有所增加。不同脅迫處理后,隨著處理時間的變化,葉中LpPEX7的表達量先增加后降低,200 mmol·L-1NaCl處理12 h后葉中LpPEX7的表達量達到最大(圖7A)。20 mmol·L-1NaHCO3處理24 h后表達量達到最大(圖7B)。11 mmol·L-1H2O2處理12 h后葉中LpPEX7的表達量達到最大(圖7C)。
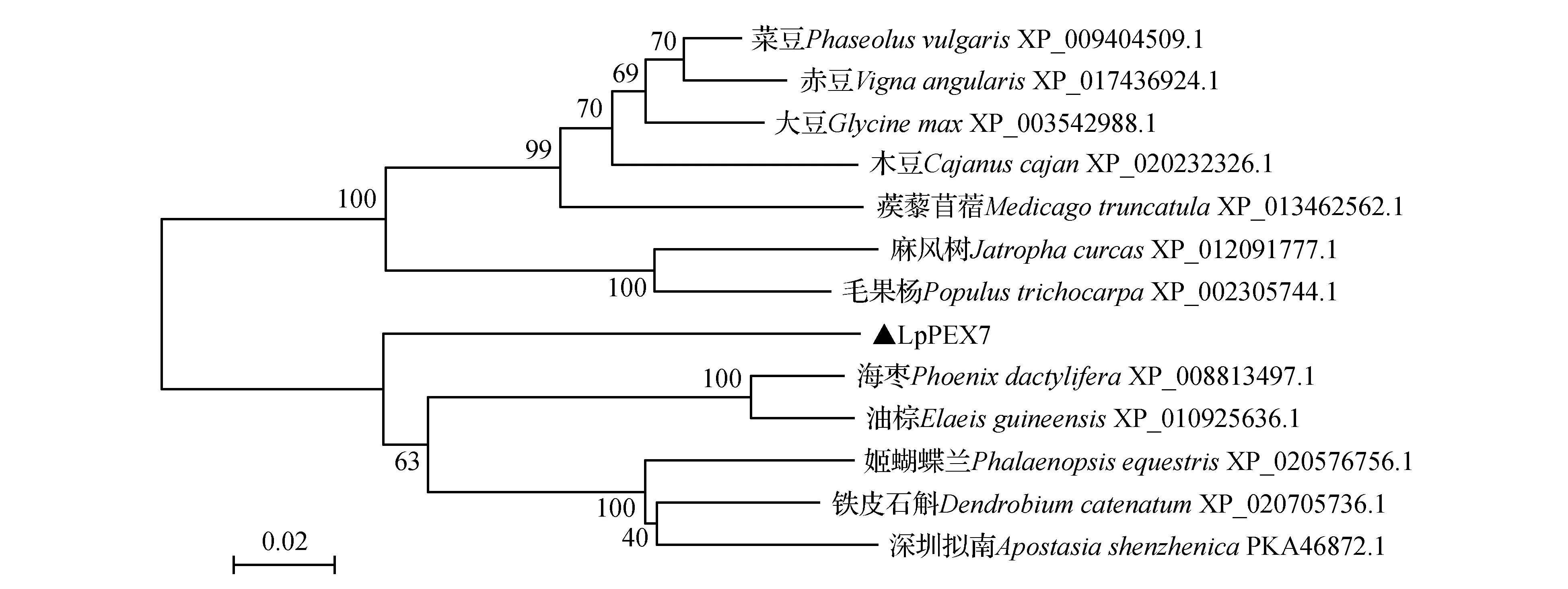
圖5 LpPEX7與其他植物同源蛋白的進化樹分析Fig.5 Phylogenetic tree analysis of LpPEX7 and other plant homologous proteins
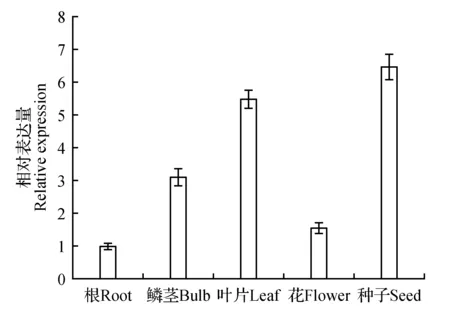
圖6 LpPEX7基因在細葉百合不同部位表達量Fig.6 The expression of LpPEX7 gene in different parts of Lilium pumilum
隨著200 mmol·L-1NaCl處理時間的變化,鱗莖中LpPEX7的表達量先增加,在處理12 h后達到最大(圖7D),降低后再有少量增加。20 mmol·L-1NaHCO3脅迫處理后,隨處理時間的增加鱗莖中LpPEX7的表達量先增加然后降低,在處理24 h時達到最大表達量(圖7E)。11 mmol·L-1H2O2脅迫處理的鱗莖中LpPEX7表達量表達量也是先增加后降低,然后再增加,在H2O2處理12 h后達到最大表達量(圖7F)。LpPEX7基因的表達量在逆境處理的24 h內都得到了大量表達,這說明在遇到脅迫的條件下,LpPEX7基因能立即開始表達,參與到應激反應過程中,從而增加植物的抗逆性。
2.5 LpPEX7基因過表達擬南芥種子萌發抗鹽堿表型分析
為在植物中高效表達LpPEX7這個外源基因,選取了由35S啟動子驅動的植物表達載體pBI121進行了載體構建,將構建的pBI121-LpPEX7質粒進行BamHⅠ/SalⅠ雙酶切,基因與載體位置正確(圖8A),說明pBI121-LpPEX7構建成功。如圖8B所示,以未轉基因的擬南芥為陰性對照,利用qPCR檢測的方法,得到#1~#8轉基因的擬南芥中LpPEX7基因的表達量均比未轉基因的擬南芥中高,最高達到30倍左右,這說明細葉百合中LpPEX7這個基因轉化擬南芥成功,并且得到了高表達。選擇LpPEX7過表達株系中LpPEX7表達量相對較高的#1、#2和#3株系進行后續實驗。
2.6 過表達LpPEX7基因的擬南芥植株抗性分析
LpPEX7基因在細葉百合的種子中表達量最高,為了驗證轉入LpPEX7基因的擬南芥株系的種子對于鹽及氧化逆境是否具有一定的耐受性,我們選取野生型和自交3代的三個轉基因株系#1、#2、#3的種子進行了耐鹽性的初步實驗。各個株系的種子在培養箱中培養10 d左右,觀察種子的萌發結果如圖9,在沒施加任何脅迫的1/2MS培養基中,野生型和三個轉基因植株的萌發狀態幾乎一致,但是在脅迫處理的培養基中,轉基因和非轉基因擬南芥株系的生長狀態有明顯的區別,在2 mmol·L-1H2O2、3 mmol·L-1H2O2、125 mmol·L-1NaCl和3 mmol·L-1NaHCO3脅迫處理培養基中,4種株系的種子都能發芽,但野生型植株的種子萌發比過表達植株#1和#3的種子萌發晚1~3 d。在150 mmol·L-1NaCl和5 mmol·L-1NaHCO3的抗性培養基上,野生型幾乎不能正常萌發,而轉基因株系#1和#3的多數種子可以萌發,種子發芽率比野生型的明顯好,#2過表達和野生型植株種子的萌發率差不多。
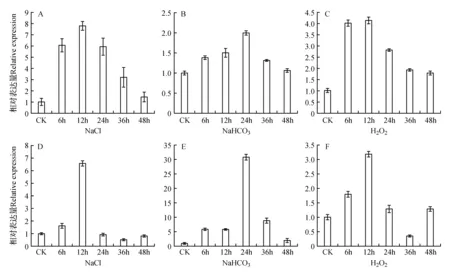
圖7 逆境脅迫下細葉百合葉片和鱗莖中LpPEX7基因的表達量 A~C.LpPEX7基因分別在200 mmol·L-1 NaCl、20 mmol·L-1 NaHCO3、11 mmol·L-1 H2O2處理后細葉百合葉中的表達量;D~F.LpPEX7基因分別在200 mmol·L-1 NaCl、20 mmol·L-1 NaHCO3、11 mmol·L-1 H2O2處理后細葉百合鱗莖中的表達量Fig.7 LpPEX7 gene expression in leaves and bulbs of L.pumilum under stress A-C. The expression of LpPEX7 gene in leaves of L.pumilum after treatment with 200 mmol·L-1 NaCl,20 mmol·L-1 NaHCO3 and 11 mmol·L-1 H2O2,respectively; D-F. The expression of LpPEX7 gene in bulbs of L.pumilum after treatment with 200 mmol·L-1 NaCl,20 mmol·L-1 NaHCO3 and 11 mmol·L-1 H2O2,respectively

圖8 pBI121-LpPEX7的酶切鑒定和實時熒光定量PCR鑒定LpPEX7基因的表達量 A.pBI121-LpPEX7的酶切鑒定(M. DM5000 Marker;1.pBI121-LpPEX7的雙酶切);B.實時熒光定量PCR鑒定LpPEX7基因的表達量(WT.野生型擬南芥;#1~#8.LpPEX7過表達株系)Fig.8 pBI121-LpPEX7 identified by restriction enzymes and identify the expression of LpPEX7 gene by qRT-PCR A.pBI121-LpPEX7 identified by restriction enzymes(M. DM5000 Marker; 1. pBI121-LpPEX7 digested by double enzymes); B.Identify the expression of LpPEX7 gene by qRT-PCR(WT. Wild type A.thaliana;#1-#8. LpPEX7 overexpression lines)
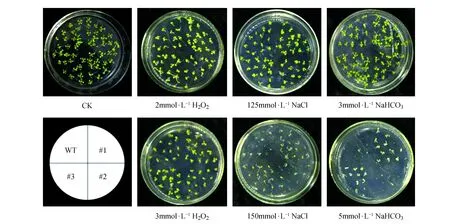
圖9 萌發期野生型和LpPEX7基因過表達擬南芥的抗逆性分析 WT.野生型擬南芥;#1~#3.LpPEX7過表達株系Fig.9 Resistance analysis of wild type and LpPEX7 overexpression A.thaliana on germination stage WT.Wild type A.thaliana;#1-#3.LpPEX7 overexpression lines
3 討論
PEX7蛋白作為帶有PTS2信號基質蛋白的轉運蛋白,對過氧化物酶體的合成起到至關重要的作用。對PEX7突變體的研究發現,PEX7蛋白的缺失,不僅PTS2蛋白的轉運異常,PEX5和PEX7相互作用,致使PTS1蛋白的轉運也發生異常[15,21]。由此看來,LpPEX7蛋白對于過氧化物酶體的形成起著至關重要的作用,過氧化物酶體是一種亞細胞器,富含各種酶類,參與活性氧的生成與降解,毒性物質的清除,其數量的增多,可以提高植物對活性氧毒害的耐受性,進而提高植物的抗逆性,因此對LpPEX7基因的表達性質進行研究,對研究植物的耐鹽堿能力具有重要作用。
通過對NaHCO3處理后的細葉百合轉錄組數據分析,發現LpPEX7基因的表達量明顯上調,我們從細葉百合鱗莖中克隆得到這個基因的ORF區,通過在NCBI數據庫中Blast發現這個基因與其他植物的PEX7相似度很高,同源序列比對和進化樹分析確定這個基因是PEX7。
在LpPEX7基因編碼的氨基酸中存在著與海棗、鐵皮石斛、油棕等Pex7蛋白相同的WD-40蛋白重復序列特征,WD-40結構域介導蛋白質之間的相互作用,并能與其他蛋白互作,形成復合體結構,進而調控下游的反應[22],因此推測,在鹽堿脅迫條件下,LpPEX7可能與其他調控鹽堿逆境的蛋白相互作用,或者調控下游基因的反應來提高植物的抗逆性。G6PD結構域屬于6-磷酸葡萄糖酸脫氫酶典型結構域,能參與多種非生物脅迫[23],LpPEX7蛋白具有一個G6PD結構域,這個結構域可能使LpPEX7蛋白在參與多種非生物脅迫中發揮重要的作用。PQQ(Pyrroloquinoline quinone,吡咯喹啉醌)是一種氧化還原酶的輔酶,PQQ對自由基有清除作用,可以保護機體減少氧化損傷[24]。LpPEX7的保守結構域分析發現,LpPEX7含有一個PQQ結構域,由于鹽堿逆境能產生大量的氧自由基(活性氧),本研究進行了未轉基因和轉基因的擬南芥株系種子在H2O2逆境脅迫下的萌發對比實驗,過表達LpPEX7基因的擬南芥在逆境條件下能夠提高種子的萌發效果,或許就是通過清除逆境所產生的大量自由氧基的作用來實現的。
海棗的PEX7是從海棗線粒體轉錄組中發現的[25],鐵皮石斛Pex7與花發育及適應性進化有關[26],油棕Pex7蛋白在果實后熟過程中表達豐富[27],菜豆Pex7與種子中的高淀粉和低脂肪有關[28]。蛋白質同源序列比對和進化樹分析發現LpPEX7與這些物種的PEX7比較接近,本研究中LpPEX7基因在花和種子中均有表達,并且在細葉百合的種子中表達量最大,這說明LpPEX7基因除了能在提高植物逆境方面起作用外,可能在植物的生長發育過程中也起到重要作用。
用qRT-PCR檢測細葉百合不同器官中LpPEX7的表達量發現,在種子、葉片和鱗莖中表達量高,在根和花中的表達量比較低。從LpPEX7基因在脅迫處理后的細葉百合葉片和鱗莖中表達量來看,LpPEX7基因在H2O2,NaCl或NaHCO3脅迫處理12或24 h的表達量最高,說明在植物受到逆境脅迫后,LpPEX7立刻啟動表達程序來應對環境的改變。PEX7是過氧化物酶體生物合成的關鍵酶,提高LpPEX7的表達量,也許過氧化物酶體合成的數量有所增加,進而提高植物的抗逆能力。
LpPEX7在不同細葉百合器官中的表達量研究發現,LpPEX7基因在種子中表達量高,因此我們做了種子萌發期植物抗逆性的研究。利用農桿菌侵染的方法將LpPEX7轉入擬南芥中,通過KaNa篩選和qRT-PCR鑒定出LpPEX7過表達T3代株系。在鹽堿和氧化處理下,觀察野生型、LpPEX7過表達株系擬南芥種子的萌發狀況,LpPEX7過表達擬南芥株系種子的萌發要優于野生型種子的萌發,初步說明LpPEX7基因過表達增加了擬南芥種子對鹽堿和氧化逆境的抗性,但LpPEX7基因在植物種子中通過什么樣的途徑來提高過表達植株種子的抗性,還有待進一步的研究。
本研究在克隆出細葉百合LpPEX7基因及對該基因進行詳細的生物信息學研究的基礎上,分析了在不同器官和不同鹽堿逆境下細葉百合中的mRNA表達特性,對野生型和基因過表達擬南芥種子的抗逆性表型方面進行觀察。為了解LpPEX7基因與鹽堿、氧化逆境的應答關系,為細葉百合的耐鹽堿性分子機理研究提供重要的候選基因奠定基礎。

