低平均光強下波動光對銅綠微囊藻生長的影響
孫 昕 湯加剛 李鵬飛 孫 杰 何飛飛 由 黎 賀健程
(西安建筑科技大學陜西省環境工程重點實驗室, 西北水資源與環境生態教育部重點實驗室, 西安 710055)
光照是浮游植物生長的重要能量來源, 具有復雜的空間和時間變化模式。水體中浮游植物接受光照的變化分為兩種, 一種是水面入射光變化, 這主要由一天中太陽光的光強、氣候的變化等引起;另一種是藻類在水中由于湍流、內波等垂直混合作用引起浮游植物在水中位置的改變, 進而影響其接受的光強大小。
目前研究主要集中于兩種形式的波動光: 一種是矩形波動光[1,2], 主要由兩種不同強度的恒定光不斷循環交替產生。另一種是非矩形波動光[3,4],由正弦波動或余弦波動演變而來。
波動光通過影響光合作用和呼吸作用等重要生理過程而影響浮游植物的生長[5,6]。Litchman[7]研究表明在波動光下浮游植物的生長速率變化具有物種特異性, 在低平均光強[25 μmol photons/(m2·s)]條件下, 矩形波動光[15/35 μmol photons/(m2·s)]促進了硅藻Nitzschiasp生長, 抑制了藍藻Phormidium luridumd和綠藻Sphaerocystis schroeteri的生長, 所以當其作用于浮游植物群落時, 群落組成和結構就會有較大的變化; Litchman[8]還發現在高平均光強[100 μmol photons/(m2·s)]條件下, 矩形波動光[65/135 μmol photons/(m2·s)]組的浮游植物的種類比恒定光照組多; 同時波動光對浮游植物的色素[4]、油脂[9]等合成也有顯著的影響, 所以探究波動光對浮游植物的生長影響具有重要意義。
關于不同頻率的矩形波動光對浮游植物的研究很多。Liao等[10]發現隨著光暗轉換頻率的增加,其生物量和生長速率也隨之增加, Iluz等[11]用自制的生物反應器得出相似的結論。浮游植物在垂直運動過程中, 接受的波動光強可以從完全黑暗到超過1500 μmol photons/(m2·s)的強度, 其經歷的光照是由光限制到光抑制的一種漸變過程, 而非瞬變過程, 所以用矩形波動光代替浮游植物垂直運動過程中的光變化有很大的局限性。目前關于非矩形波動光的變化頻率(即波動周期)對藻類影響的研究甚少。Nicklishch[12]發現在平均光照相同時, 周期為60min非矩形波動光[1—1000 μmol photons/(m2·s)]下浮游植物的增長速率普遍比周期為30min波動光大, 但尚未針對波動周期對浮游植物影響進行系統性的研究。
浮游植物在自然水體中接受的光照受到表面光照與位置變化的共同作用。在水體表面光強恒定的條件下, 本研究注重浮游植物因內波運動作垂直運動而接受的波動光。通過采用一種新型的基于單片機系統的裝置, 分別模擬了內波作用下的波動光強和波動過程的平均光強, 以及對葉綠素熒光技術的應用, 旨在探究波動光的周期性變化對銅綠微囊藻Microcystis aeruginos生長的影響以及其在不同光照條件的光合響應機制。
1 材料與方法
1.1 實驗裝置
如圖 1所示, 實驗裝置是由外部水浴加熱系統、內部培養系統及單片機控制系統三部分組成。外部加熱系統由水浴箱、碳纖維潛水加熱線和溫控系統構成。內部培養系統由培養箱和LED燈組成, 通過恒溫水浴箱調控培養箱中藻液溫度, LED燈為藻類生長提供光源。單片機系統由單片機、電機驅動片機模塊、直流電源、調光驅動器等構成。單片機是整個系統的核心, 通過編寫不同時刻的PWM波的占比(范圍為0—100%), 可以實現LED光強的周期性變化。
1.2 模擬方法
實驗所采用的光是基于水體中出現的內波現象而引起的波動光。在內波作用下藻類位置會發生垂直往復變化; 當水面光強一定時, 水下光照強度隨水深增加而不斷衰減, 所以藻類接受的光強也會隨之變化。在內波條件下, 藻類的運動可以理想化為如式(1)所示的簡單的波動方程:
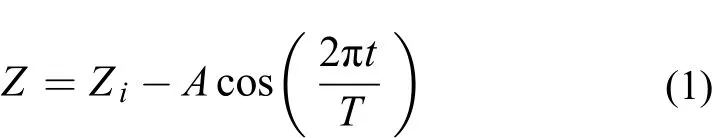
式中,Zi為內波產生的水深,A為波動振幅,T為波動周期, 本實驗中Zi取7.9 m,A取2 m,T分別取10min、1h和6h。
根據Lambert-Beer光衰減特性方程, 在任意水深Z處的光強可用式(2)表示如下:
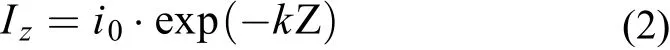
式中,Iz為水深為Z處的光強,i0為水體表面光強取1000 μmol photons/(m2·s),k為光的衰減系數取0.5/m。
將式(1)與式(2)合并, 得水深Zi處藻類在內波作用下接收的波動光FL形式, 如式(3)
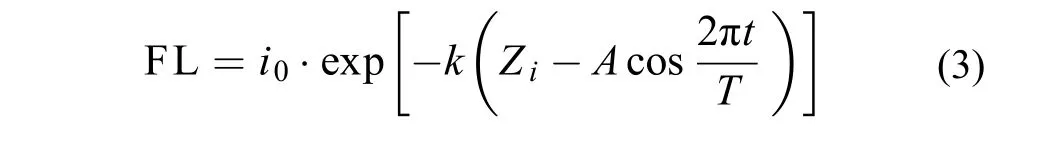
圖 2表示在波動周期為10min的波動光強條件下, 一個周期內光照強度隨時間的變化關系。在0時, 藻類受內波作用達到波動的最高點, 即水深5.9 m處, 光強為52.34 μmol photons/(m2·s); 在300s時, 藻類達到波動最低點, 即水深9.9 m處, 光強為7.08 μmol photons/(m2·s)。
在一個波動周期內, 水深Zi處藻類在垂向波動過程中接受的平均光強AL可用式(4)計算如下:
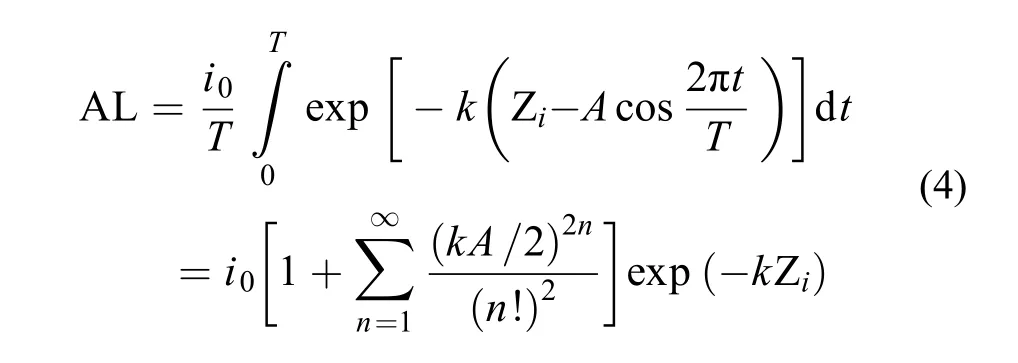
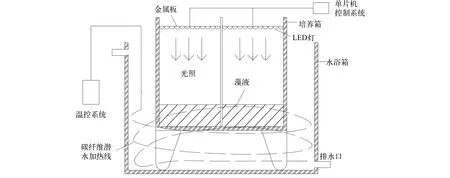
圖 1 基于單片機的光強控制實驗裝置Fig. 1 The experimental device based on a single-chip system for controlling light intensity
由式(4)可知, 波動光在一個周期內的平均光強AL大小與其周期無關。根據上述條件, 可計算出本實驗中的平均光強AL≈25 μmol photons/(m2·s)。
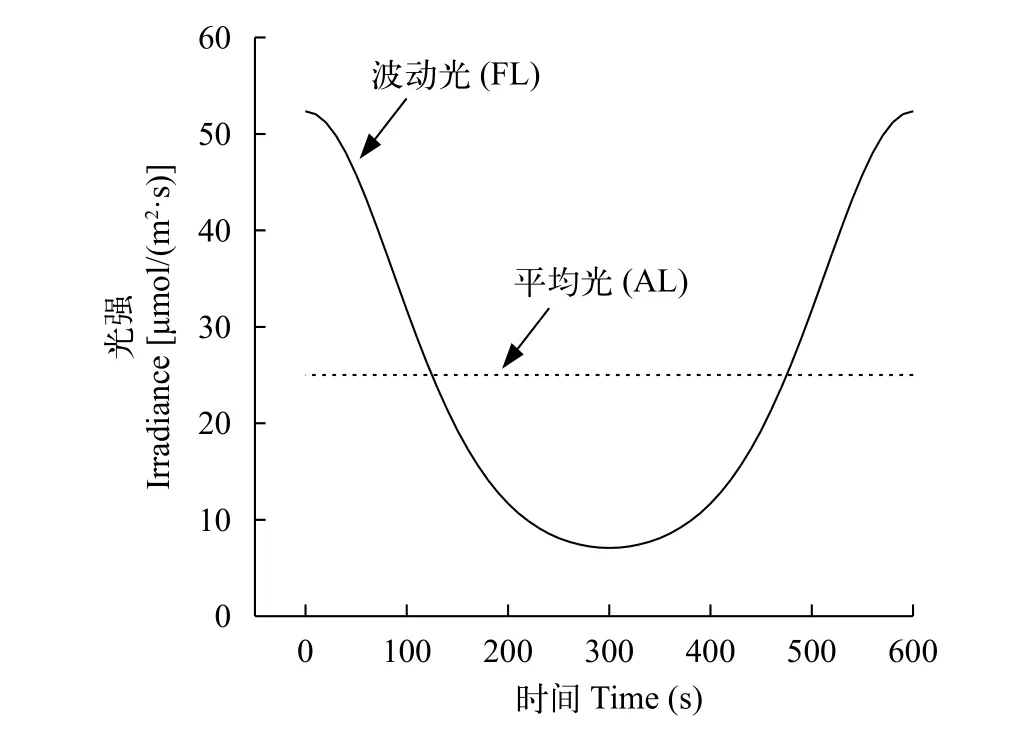
圖 2 理論光強變化機制Fig. 2 Theoretical light intensity change mechanism
通過光照強度測量和單片機編程的調節, 可以實現不同特性的光照條件。理論上波動光時刻都在變化, 但是由于單片機程序的局限性無法實現這種變化頻率, 本實驗模擬的實際光強的變化頻率為0.1 Hz(圖 3)。
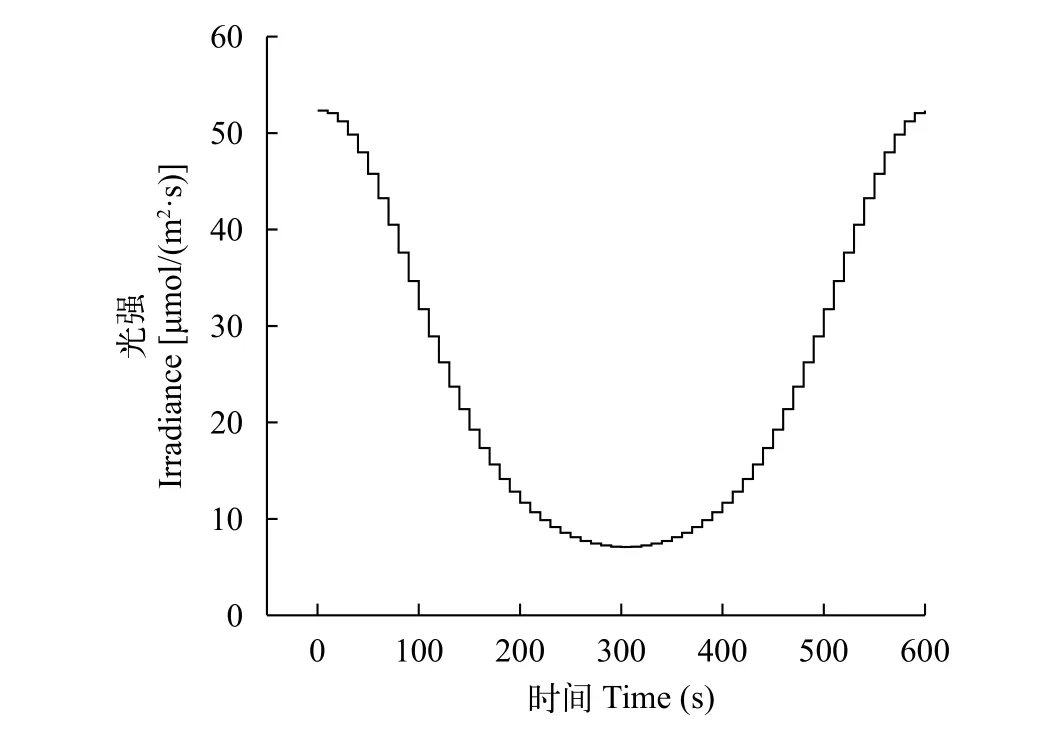
圖 3 實際光強調節機制Fig. 3 Actual light intensity adjustment mechanism
1.3 實驗條件
實驗選用的銅綠微囊藻(Microcystis aeruginosaFACHB-569)購買于中國科學院淡水藻種庫。參考文獻[13], 銅綠微囊藻初始藻密度為2.0×106cells/mL, 培養基為BG11, 藻液溫度為25℃。在實驗裝置中單格反應器中所盛藻液體積為1 L, 藻液厚度為4 cm左右, 可以減少藻類自身互遮影響。
將銅綠微囊藻置于恒定光照和波動光照等四組不同光照條件下培養, 并且每組光照均設置3個平行樣。三組不同周期波動光照, 分別為10min FL、1h FL和6h FL, 其中10min FL表示波動周期為10min的波動光強, 其余類同。三種波動光照條件下的平均光強相同, 均為25 μmol photons/(m2·s)和一組恒定光強AL組[光強為25 μmol photons/(m2·s)]。在所有光照條件的實驗中, 均采用12h∶12h的光暗(L∶D)培養。
1.4 藻密度
每隔一天取適量藻液, 采用血球計數板計數法測定銅綠微囊藻密度。
1.5 比增長速率
銅綠微囊藻的比增長速率計算公式見(5),
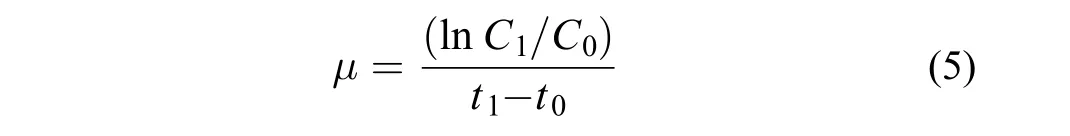
式中C1為銅綠微囊藻培養t1天的藻密度,C0為銅綠微囊藻培養t0天的藻密度
1.6 類胡蘿卜素
采用文獻[14]所述方法測定類胡蘿卜素含量。在紫外可見分光光度計下測定待測樣在波長分別為663、645和450 nm的吸光值, 利用式(6):
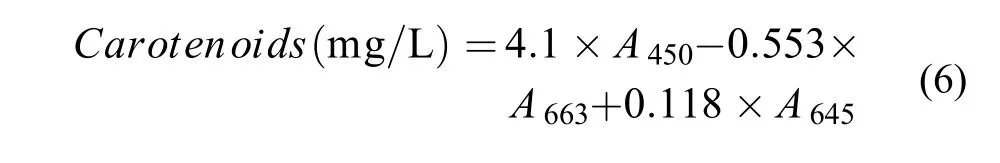
待測樣的制備: 取藻液5 mL放入離心管中, 在離心機上以9000 r/min離心15min, 離心后棄掉上清液, 向離心濃縮沉淀中加入80%丙酮溶液, 并均勻混合。然后將離心管用錫箔紙裹住, 放入4℃冰箱中靜置24h, 進行脂溶性色素提取,色素提取后, 再將其在8000 r/min離心10min, 上清液即為待測樣。
1.7 熒光參數
取1.5 mL藻樣于離心管中, 暗適應10min后使用調制葉綠熒光成像測試系統(Imaging-pam, 德國WALZ)測定。
1.8 數據的處理和分析
采用Excel 2003和SPSS 16.0軟件對數據進行統計分析, 使用Origin 8.5數據圖繪制。
2 結果
2.1 藻密度和比增長速率
從圖 4中可以看出, 銅綠微囊藻在不同光照條件下的生長趨勢基本一致。四組光照條件下的銅綠微囊藻藻密度在培養末期差異顯著(P<0.05), 其中平均光強AL組較波動光FL組增殖較慢且提前進入穩定期。在22d時, 6h FL、1h FL和10min FL組的銅綠微囊藻藻密度相對于AL組分別增加了28.3(P<0.05)、18.2%(P<0.05)和7.7%(P>0.05)。
在低平均光強下, 在不同光照條件下銅綠微囊藻的比增長速率差異顯著(P<0.05), 6h FL、1h FL和10min FL組的銅綠微囊藻比增長速率相對于AL組分別增加了10.1(P<0.05)、6.8%(P<0.05)和3.0%(P<0.05, 圖 5)。
2.2 單個細胞類胡蘿卜素含量
在低平均光強下, 單個銅綠微囊藻細胞所含的類胡蘿卜素含量隨著波動光周期的增大而顯著降低(P<0.05), 在第10天時, 6h FL、1h FL和10min FL組的單個細胞類胡蘿卜素含量比AL組分別降低了18.1%(P<0.05)、16.7%(P<0.05)和6.9%(P<0.05,圖 6)。
2.3 葉綠素熒光參數(Fv/Fm、ETR、NPQ)
從圖 7可以看出, 在四種光照條件下, 銅綠微囊藻的最大量子產量Fv/Fm值在前4d都是呈現逐漸增大趨勢, 這是由于初期藻細胞濃度較低, 細胞間的互遮效果不明顯, 保證了單位藻體的最佳光強需求,從而造成了在藻類生長前期Fv/Fm值的增大。在低平均光強下, 銅綠微囊藻Fv/Fm值隨著波動光周期的增大而顯著升高(P<0.05), 其與藻密度和比增長速率相對大小關系一致。
從圖 8中可以看出, 每組光照條件的相對電子傳遞速率(rETR)隨光合有效輻射(PAR)強度的增大而增大。當光照強度大于110 μmol photons/(m2·s)時, 不同光照條件下的rETR差異顯著(P<0.05), 且6h FL組擁有最大的rETR值, 其次為1h FL、10min FL、AL組, 與Fv/Fm值相對大小關系一致。
從圖 9可以發現, AL組的NPQ一直處于緩慢上升的狀態, 其6h的NPQ值相對于0時增加了104%(P<0.05)。6h FL組的NPQ值在0、3h和6h時值分別為0.025、0和0.023, 其趨勢在一個周期內先減小后增大, 這表明銅綠微囊藻在三種機制下的熱耗散能力有差異。各組光機制下熱耗散NPQ平均值大小關系為: NPQ(AL)>NPQ(1h FL)>NPQ(6h FL)。
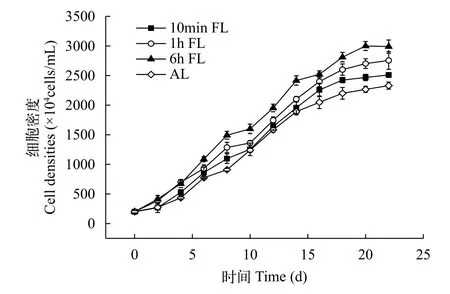
圖 4 不同光照條件銅綠微囊藻的生長曲線Fig. 4 Growth curves of Microcystis aeruginosa under different light conditions
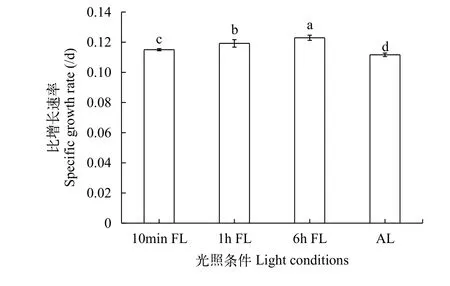
圖 5 不同光照條件對銅綠微囊藻比增長速率的影響Fig. 5 Effects of different light conditions on the specific growth rate of Microcystis aeruginosa
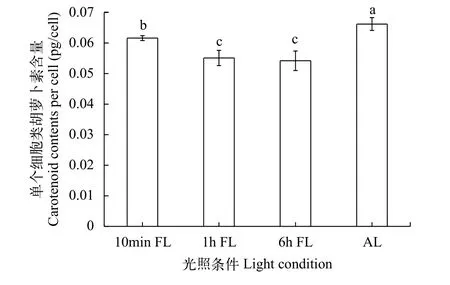
圖 6 不同光照條件對單個細胞類胡蘿卜素的影響Fig. 6 Effects of different light conditions on carotenoids in single cells
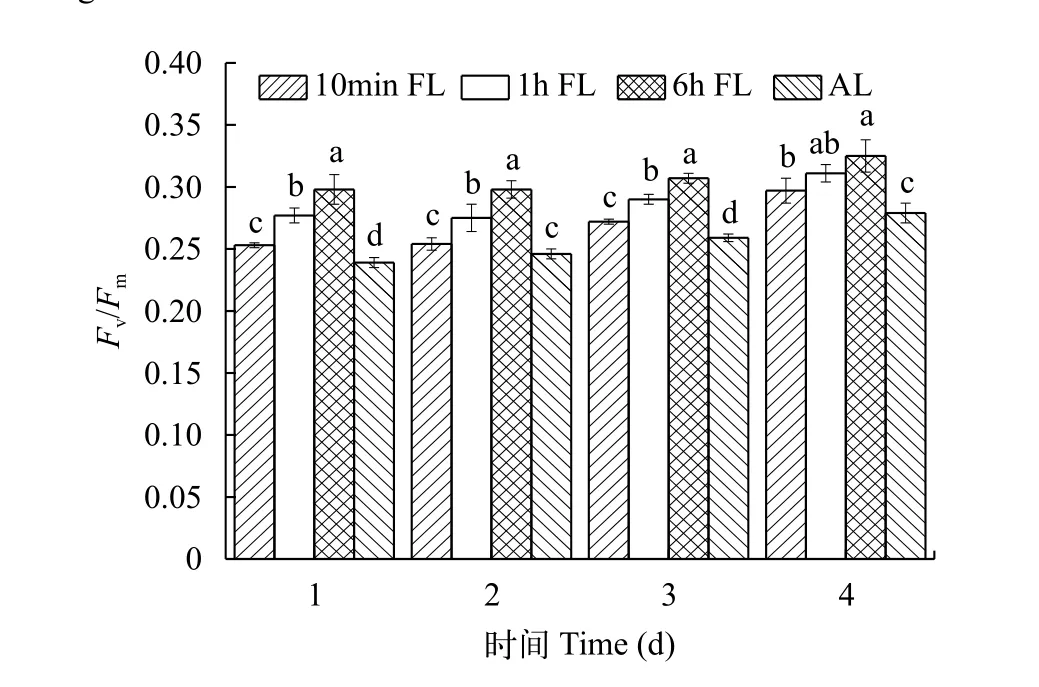
圖 7 不同光照條件下Fv/Fm值變化Fig. 7 Changes in Fv/Fm values under different light conditions
3 討論
類胡蘿卜素廣泛存在于藻類和植物中, 其重要的功能就是通過猝滅三線態及單線態氧的能量, 保護光合系統正常工作。有關研究表明, 藻類在不利的條件下為了保護組織不受傷害而提高類胡蘿卜素的合成[15—17]。本研究結果顯示各組波動光下的單位類胡蘿卜含量差異顯著(P<0.05), 且隨著波動光周期的減小而增大。藻類的中間電子受體在低光或者無光的環境下可再生和再氧化, 從而改善電子傳遞過程, 而連續的恒定光照會損傷質體醌中的中間電子受體[10,18]。為了維持細胞自身的生長, 銅綠微囊藻通過增加類胡蘿卜素的合成量以緩解由于葉綠素分子受到光損傷而導致的光合機能的衰減[16]。由于波動光的特殊性, 其在高光和低光狀態的不斷轉換, 減少對藻類的持續性光損傷。波動光周期越小, 高光到低光變化頻率越大, 這種快速的環境改變也會對藻類產生脅迫, 相應地, 也會提升類胡蘿卜素含量的合成來保護自身的光組織。
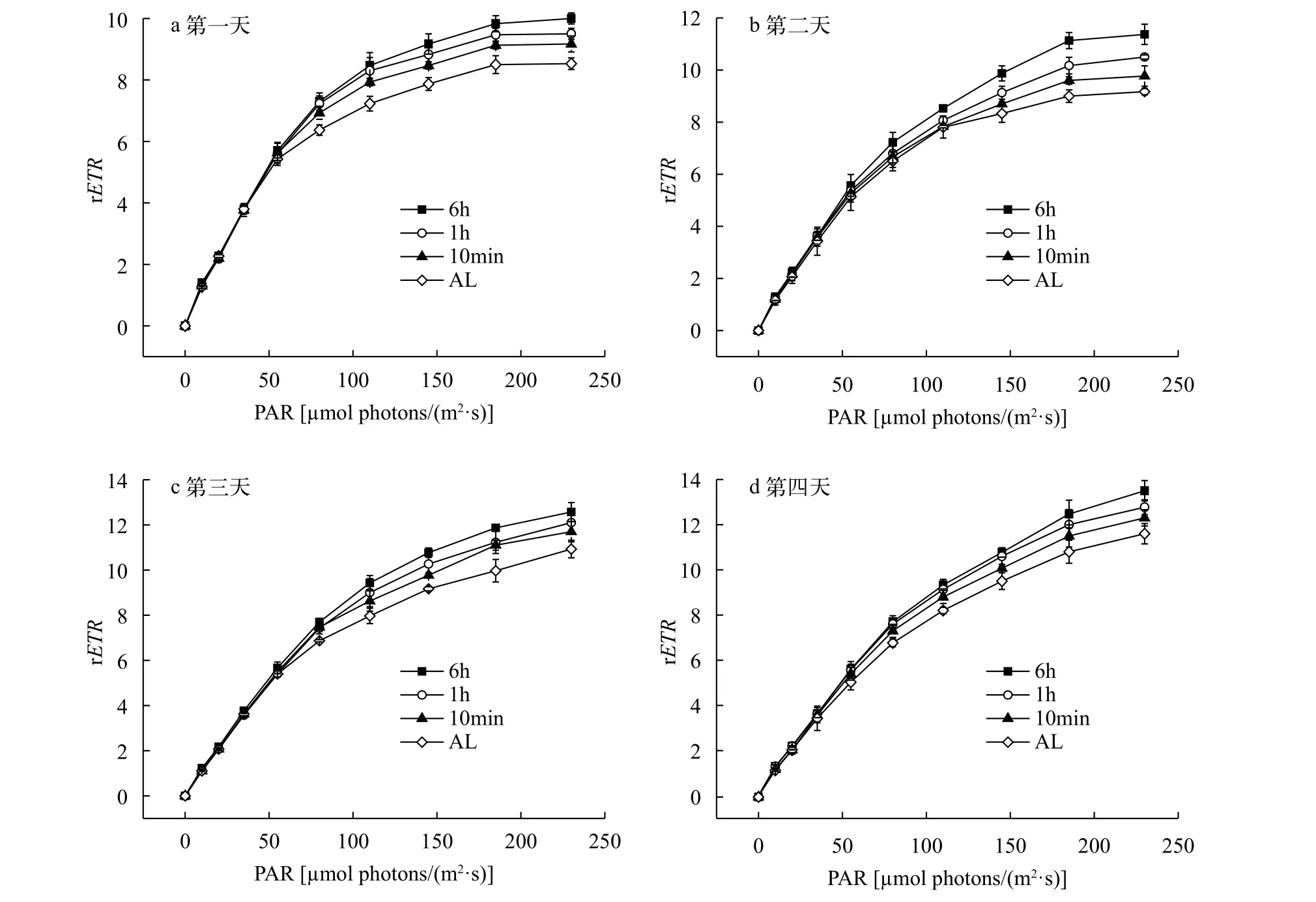
圖 8 不同光照條件下相對電子傳遞速率隨光強變化Fig. 8 Changes in the relative electron transfer rate with light intensity under different light conditions
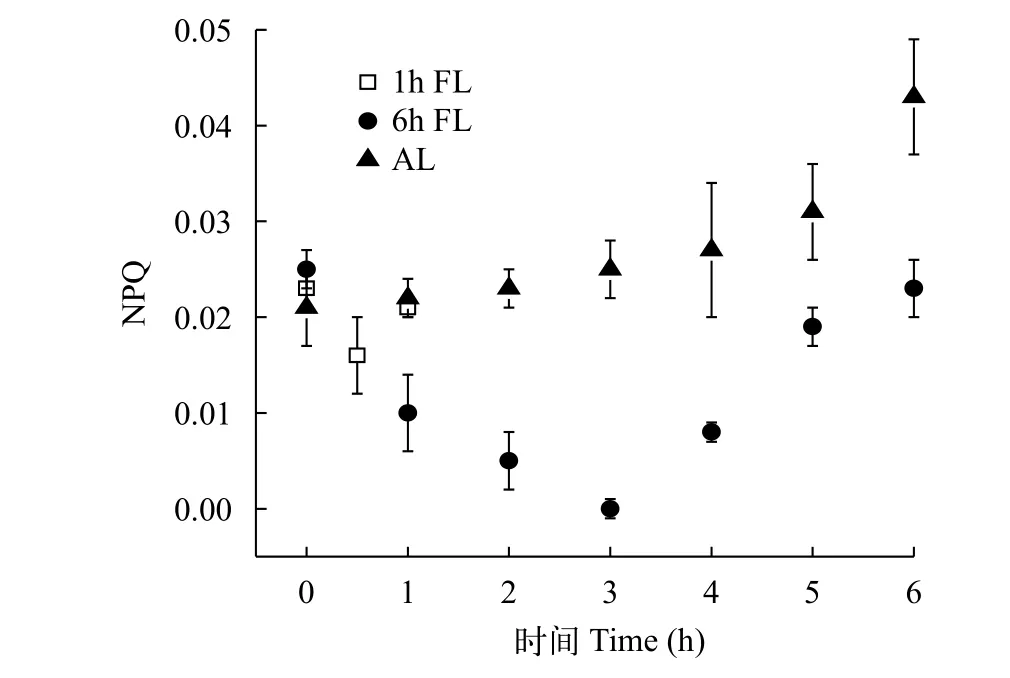
圖 9 非光化學猝滅的時變化Fig. 9 Temporal variation in non photochemical quenching
葉綠素熒光技術是近年來研究植物光合作用機理的一種重要手段。如圖 4、圖 7、圖 8, 雖然在前4天銅綠微囊藻密度差異不顯著(P>0.05), 但Fv/Fm值和rETR值差異明顯, 因為當外界條件變化時, 會在很短的時間反應在藻類的生理效應上。在本實驗中波動光強組的Fv/Fm值和rETR值都顯著大于平均光強組, 這與Wedchaparn等[19,20]研究結果一致。微藻吸收的光能, 一部分用于光合作用, 另一部分多余的能量以熱能的形式耗散掉。光照強度會影響藻的非光化學淬滅(NPQ), 而且隨著光照強度升高, NPQ會逐漸增大[21—23], 本實驗也得出相似結論。各組光照條件下NPQ大小關系與Fv/Fm、rETR值相反。這表明周期越小的波動光卡爾文循環的活性受抑制增強, 銅綠微囊藻為了保護自身,潛在的熱耗散能量增加。
孫昕等[24]研究發現在0—20000 lx的波動光抑制了銅綠微囊藻的生長, 因為藻類在高平均光強波動時, 其接受的絕大部分光照已經超過最適光強,既而其生長受到抑制。而本實驗是在低平均光強條件下進行, 研究結果表明相比于恒定光照, 銅綠微囊藻在波動光下能夠更好地調節自身光合作用機制去利用光能。產生這樣的原因可能來自兩方面: 一方面是恒定光照會產生活性氧中間體, 這可能會產生光抑制現象, 從而限制了微藻生長[25]; 另一方面由于連續的恒定光照損傷了質體醌中的中間電子受體, 限制了光合作用電子傳遞的關鍵步驟[17]。由于波動光是從高光到低光或者無光狀態不斷的轉換, 避免了恒定光照狀態, 增強了光合作用的電子傳遞。同時波動光周期越小對電子傳遞限制越明顯, 原因可能是高光到低光變化頻率越大, 導致藻細胞頻繁適應高光與低光之間轉換的機制, 間接地損害了光反應系統, 從而降低了光合作用效率。

