Akkermansia muciniphila在腸道消化 模擬系統中的變化
王 磊,姚 泓,湯 新,吳希陽
(暨南大學理工學院,廣東 廣州 510632)
Akkermansia muciniphila定植在人類腸道黏液層,是可特異性降解黏蛋白的革蘭氏陰性嚴格厭氧菌,2004年Derrien等[1]從人體糞便中分離得到,其豐度占腸道總細菌豐度的比率約為1%~5%[2-3],是豐度較高的菌屬之一。A. muciniphila作為偏好定植在腸道黏液層中的細菌,既降解黏蛋白維持自身豐度,又刺激機體黏液層增厚[1-3],維持機體健康狀況。有報道發現A. muciniphila的豐度在患腸道紊亂或某類疾病的人群中較低,如炎癥性腸病、自閉癥、肥胖或先天性過敏癥等[4],其定植情況是機體健康水平的標志之一[5-7]。
越來越多的研究證明A. muciniphila在人體腸道中具有重要的功能性,但是有部分人群腸道中A. muciniphila的豐度可能較低,甚至沒有定植[8-10]。對已有研究成年人體腸道中的A. muciniphila定植率分析發現:巴西人群的定植率為79.17%[11],歐洲人群為97.98%[12],中國南方地區人群約為54%[13],說明因地域不同,人群居住的環境和飲食結構存在差異,可能對A. muciniphila定植率存在影響[14]。根據以上研究成果,提出對應的假設:中國人群的A. muciniphila定植率可能低于國外人群,因此需要通過一些方式去改變現狀。本研究通過收集廣東廣州地區健康的成年人體糞便,分析A. muciniphila的定植情況;將團隊設計的符合東方人飲食習慣的人體胃腸道微生態消化模擬系統[15]為研究基礎,選擇3 個無A. muciniphila定植的志愿者糞便為接種物,進行 1×108CFU/mL豐度的A. muciniphila干預,通過宏基因組測序技術聯合實時聚合酶鏈式反應(real-time quantitative polymerase chain reaction,real-time PCR)系統研究A. muciniphila的干預所引起的腸道菌群變化。
1 材料與方法
1.1 材料與試劑
A. muciniphilaBAA-835 ATCC 美國菌種保藏中心。
Mucin Type II 美國Sigma公司;SYBR?Premix DimerEraser? 日本TaKaRa公司;MRS培養基、腦心浸液肉湯(brain heart infusion broth,BHI) 北京陸橋技術有限責任公司;糞便基因組DNA提取試劑盒(DP328)、半胱氨酸、血紅素、細菌組DNA提取試劑盒、糞便DNA提取試劑盒 天根生化科技(北京)有限公司;阿拉伯半乳聚糖、果膠、木聚糖、吐溫80 青島海博科技有限公司;淀粉、葡萄糖、酵母提取物、蛋白胨 上海立菲生物技術有限公司;碳酸氫鈉、氯化鈉、磷酸氫二鉀、氯化鈣 天津市大茂化學試劑廠。
1.2 儀器與設備
EM05時間控制器、H0001速率調節器 上海臺松電子科技有限公司;pH/ORP pH控制器、HM550紅外測溫儀 廣州聯測儀表電子有限公司;RS48蠕動泵 重慶杰恒蠕動泵廠;LZDX-50KBS立式壓力蒸汽滅菌器 上海申安醫療器械廠;HH-4恒溫水浴鍋 上海歐蒙實業有限 公司;20 L氮氣瓶 泰順醫療康復有限公司;PL602-S電子天平 梅特勒-托利多儀器有限公司;GT16-3高速離心機 北京時代北利離心機有限公司;KDC-12低速離心機 中佳設備有限公司。
1.3 方法
1.3.1A. muciniphila的培養
將100 μLA. muciniphila接種到10 mL BHI液體培養基(添加1% Mucin Type II粉末,下同),37 ℃厭氧培養48 h;再將培養后的A. muciniphila菌液擴大培養,于BHI液體培養48 h后10 000 r/min、4 ℃離心5 min,洗滌后與糞便上清液混勻,作為接種液添加到體外腸道消化模擬系統[2,16-18]。
1.3.2 志愿者的選擇和接種液的配制
收集廣東廣州地區131 位健康人(年齡18~60 歲)的新鮮糞便,所有志愿者在過去半年內未服用過抗生素類藥物、益生元和益生菌等補充劑。將收集到的新鮮糞便及時保存于-80 ℃冰箱,待到使用時統一解凍,使用糞便基因組DNA提取試劑盒提取DNA,用于real-time PCR分析。
從所有人群中挑選3 個無A. muciniphila定植的志愿者(2 男1 女),每人取糞便20 g,總共60 g,加入無菌生理鹽水210 mL,無菌甘油30 mL,在無菌的勻漿儀中勻漿約5 s。放于6 支50 mL離心管中,通入N2。 2 000 r/min、4 ℃冷凍離心5 min,將上清液分別轉移到6 支50 mL離心管中(每支約35 mL),在4 ℃中保存(當天使用)。
1.3.3 營養液和消化液的配制
營養液配方參照S H I M E 體系培養基[19-20]:阿拉伯半乳聚糖1 g/L、果膠2 g/L、木聚糖1 g/L、淀粉3 g/L、葡萄糖0.4 g/L、酵母提取粉3 g/L、蛋白胨1 g/L、半胱氨酸0.5 g/L、NaHCO30.4 g/L、吐溫1 mL/L、Mucin Type II 4 g/L、NaCl 0.08 g/L、 K2H P O40 . 0 4 g / L 、 C a C l20 . 0 0 8 g / L 、MgSO4·7H2O 0.008 g/L、MnSO4·H2O 0.559 67 g/L、FeSO4·7H2O 0.183 02 g/L、CoSO4·7H2O 0.181 37 g/L、ZnSO4·7H2O 0.178 10 g/L、CuSO4·5H2O 0.017 90 g/L、 AlK(SO4)2·12H2O 0.018 37 g/L、H3BO30.01 g/L、NiCl2·6H2O 0.1 g/L、NaMoO4·2H2O 0.014 24 g/L、Na2SeO3·5H2O 0.015 21 g/L、生物素0.002 g/L、泛酸鹽0.01 g/L、煙酰胺0.005 g/L、VB120.000 5 g/L、硫胺0.004 g/L、甲萘醌0.001 g/L、對-氨基苯甲酸0.005 g/L、血紅素0.005 g/L。將所有元素按照此配方配制,高溫高壓滅菌15 min后備用。
胃液配方:N a C l 2 g/1 0 0 m L、胃蛋白酶3.2 g/100 mL、濃鹽酸7 mL/100 mL;胰液配方:胰蛋白酶0.9 g/L、膽汁鹽6 g/L、NaHCO312.5 g/L。胰液和胃液使用無菌水溶解后紫外照射30 min,現配現用。
1.3.4 儀器的調試與運行
將消化模型按照實驗需要進行組裝,組裝完成后進行高壓滅菌;連接腸道消化模擬罐,分別為實驗組(接種液為已經混合1×108CFU/mL A. muciniphila菌液,2 組平行A1和A2)、對照組(C),提前通入N230 min保證厭氧條件,運行37 ℃水浴系統保持溫度穩定性。
胃消化階段:準確取200 mL營養液與120 mL胃液(比例為5∶3),通過pH值控制系統調節pH 2.0~2.3,每小時通氣10 min,總共反應2 h。小腸消化階段:向消化罐中分別加入90 mL胰液,控制pH 6.0~7.5,pH 6.75最佳,每小時通氣10 min,總共反應4 h。大腸消化階段:將消化罐的pH值調節在6.7左右,整個過程保持N2的通入,再分別加入上述配制的接種液70 mL,取接種液作為起點,并分別在2、14、24 h進行取樣,大腸消化階段共24 h,過程保證pH 6.5~6.8,保證N2的不斷注入,維持厭氧環境;取出的消化液注入到離心管中,快速放入 -80 ℃冰箱,待后續分析。
1.3.5 發酵液DNA的提取
將每個時間段的樣品在37 ℃水浴解凍,上下顛倒搖勻后,吸取500 μL液體至離心管中,10 000 r/min、4 ℃離心2 min后,按照試劑盒的方法提取DNA。
1.3.6 不同菌屬的real-time PCR定量分析
不同菌屬real-time PCR 標準曲線的建立:將Escherichia coliBNCC 133264(用于總菌屬的定量)、Bifidobacterium lactisCIP 105265、Lactobacillus rhamnosusATCC 7469、Bacteroides fragilisATCC 25285以及A. muciniphilaBAA-835 ATCC作為標準菌株培養,再通過血球計數板分別測定每種菌液濃度后,提取相應菌液DNA;將每種菌液DNA進行10 倍梯度稀釋(跨度為1~107倍),作為模板進行real-time PCR,且進行模板濃度與菌液濃度換算,其中所有擴增引物均對應菌屬的16S rDNA[21];保證每條標準曲線的擴增效率均在90%~110%之間,如樣品模板DNA濃度超過濃度范圍,對模板進行稀釋后重新分析。
采用SYBR Green I染料法,對樣品DNA進行定量反應(每種菌屬的所有樣本同時進行反應,設置3 組平行),使用ABI StepOne Plus系統對數據進行分析,其體系為20 μL:10 μL SYBR Green PCR Master Mix,6.4 μL ddH2O,0.4 μL ROX染料),0.6 μL 10 μmol/L上下游引物(表1),2 μL模板;反應程序見表2。

表 1 不同菌株的引物序列Table 1 Primer sequences for different bacteria
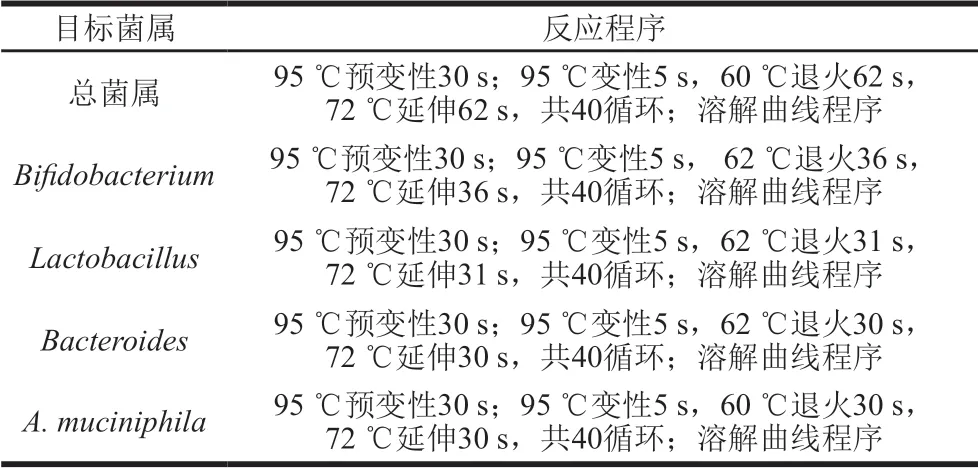
表 2 不同菌屬的反應程序Table 2 Real-time PCR programs for different species
1.3.7 發酵液的高通量測序分析
將發酵液2、14、24 h時間段的DNA樣本(9 個)利用瓊脂糖凝膠電泳檢測DNA的純度和濃度,取適量的樣品于離心管中,由上海歐易生物有限公司提供Illumina MiSeq測序服務,主要針對細菌的16S rRNA基因的V3-V4區相應分析。
1.4 數據分析
本研究real-time PCR數據分析為Stepone plus system軟件處理,其余數據處理為Excel 2016與SPSS 22.0處理, P<0.05,差異顯著。作圖軟件為GraphPad Prism 7.0。
2 結果與分析
2.1 A. muciniphila定植情況分析

圖 1 不同區域的A. muciniphila定植率比較Fig. 1 Comparison of colonization rates of A. muciniphila in populations from different regions
經過real-time PCR分析,在131 人中有117 人A. muciniphila 定植陽性,定植率為89.31%,本研究與歐洲[2]、華南地區[16]定植率對比如圖1所示。A. muciniphila定植平均豐度為5.825 (lg(CFU/mL))。
2.2 菌屬的real-time PCR標準曲線
總菌屬標準曲線的菌落計數為4.52×109CFU/mL,擴增效率為92.039%,標準曲線擬合度R2為0.999;Bifidobacterium標準曲線的菌落計數為2.56×108CFU/mL, 擴增效率為90.509%,標準曲線擬合度R2為0.991;Lactobacillus標準曲線的菌落計數為4.74×109CFU/mL, 擴增效率為97.251%,標準曲線擬合度R2為0.995;Bacteroides標準曲線的菌落計數為5.645×108CFU/mL,擴增效率為105.919%,標準曲線擬合度R2為0.997;Akkermansia標準曲線的菌落計數為3.84×108CFU/mL,擴增效率為94.859%,標準曲線擬合度R2為1.0,所有菌屬系數均為合理范圍內,具有定量意義。
2.3 不同菌屬real-time PCR定量結果
表 3 不同菌屬的定量結果Table 3 Real-time PCR results for different genera (lg(CFU/mL))
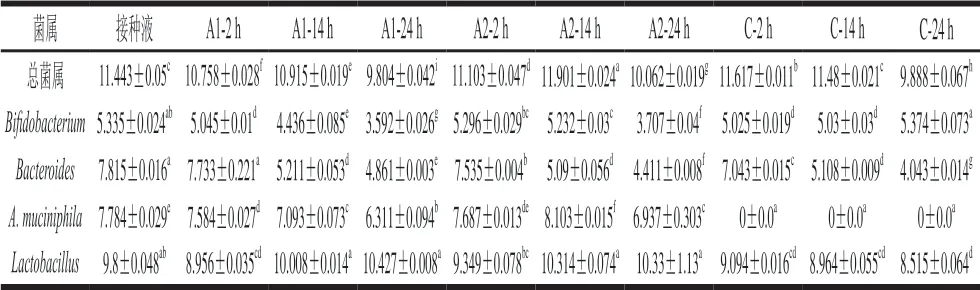
表 3 不同菌屬的定量結果Table 3 Real-time PCR results for different genera (lg(CFU/mL))
注:同行字母不同表示差異顯著(P<0.05)。
菌屬 接種液 A1-2 h A1-14 h A1-24 h A2-2 h A2-14 h A2-24 h C-2 h C-14 h C-24 h總菌屬 11.443±0.05c 10.758±0.028f 10.915±0.019e 9.804±0.042i 11.103±0.047d 11.901±0.024a 10.062±0.019g 11.617±0.011b 11.48±0.021c 9.888±0.067h Bifidobacterium 5.335±0.024ab 5.045±0.01d 4.436±0.085e 3.592±0.026g 5.296±0.029bc 5.232±0.03c 3.707±0.04f 5.025±0.019d 5.03±0.03d 5.374±0.073a Bacteroides 7.815±0.016a 7.733±0.221a 5.211±0.053d 4.861±0.003e 7.535±0.004b 5.09±0.056d 4.411±0.008f 7.043±0.015c 5.108±0.009d 4.043±0.014g A. muciniphila 7.784±0.029e 7.584±0.027d 7.093±0.073c 6.311±0.094b 7.687±0.013de 8.103±0.015f 6.937±0.303c 0±0.0a 0±0.0a 0±0.0a Lactobacillus 9.8±0.048ab 8.956±0.035cd 10.008±0.014a 10.427±0.008a 9.349±0.078bc 10.314±0.074a 10.33±1.13a 9.094±0.016cd 8.964±0.055cd 8.515±0.064d
從表3可知,與接種液中的總菌屬比較,所有組的總菌屬在14 h后豐度呈現顯著性下降,說明營養物質開始出現不足。對照組的A. muciniphila未檢測出,說明志愿者的糞便中不含A. muciniphila定植,即使在檢測限外的豐度也不會出現大量增長;實驗組(A1、A2)的A. muciniphila在14 h前保持初始的高豐度(7(lg(CFU/mL)) 以上),以及出現少量增長,說明A. muciniphila可以在腸道菌群環境中維持生長。
實驗組(A1、A2)的Bacteroides屬與Bifidobacterium屬豐度均不斷下降,說明A. muciniphila的加入可能增加了兩者的生存壓力;對照組的Bifidobacterium屬的豐度出現波動性上升,說明無A. muciniphila的存在對其生長抑制性較小。在14 h前,實驗組的Lactobacillus屬的豐度均出現上升,但對照組的豐度降低,說明A. muciniphila可能對Lactobacillus屬具有促進生長的作用。
2.4 發酵液16S rDNA測序分析
由樣本菌屬水平分析(圖2)可知,實驗組的Bacteroides屬均總體呈現下降的趨勢,對照組的24 h的Bacteroides呈現小幅上升,結果與real-time PCR的分析相匹配;24 h,實驗組A1和A2的Lactobacillus屬豐度比對照組要高,而Bifidobacterium屬要低于對照組,整體趨勢與real-time PCR的分析相似。
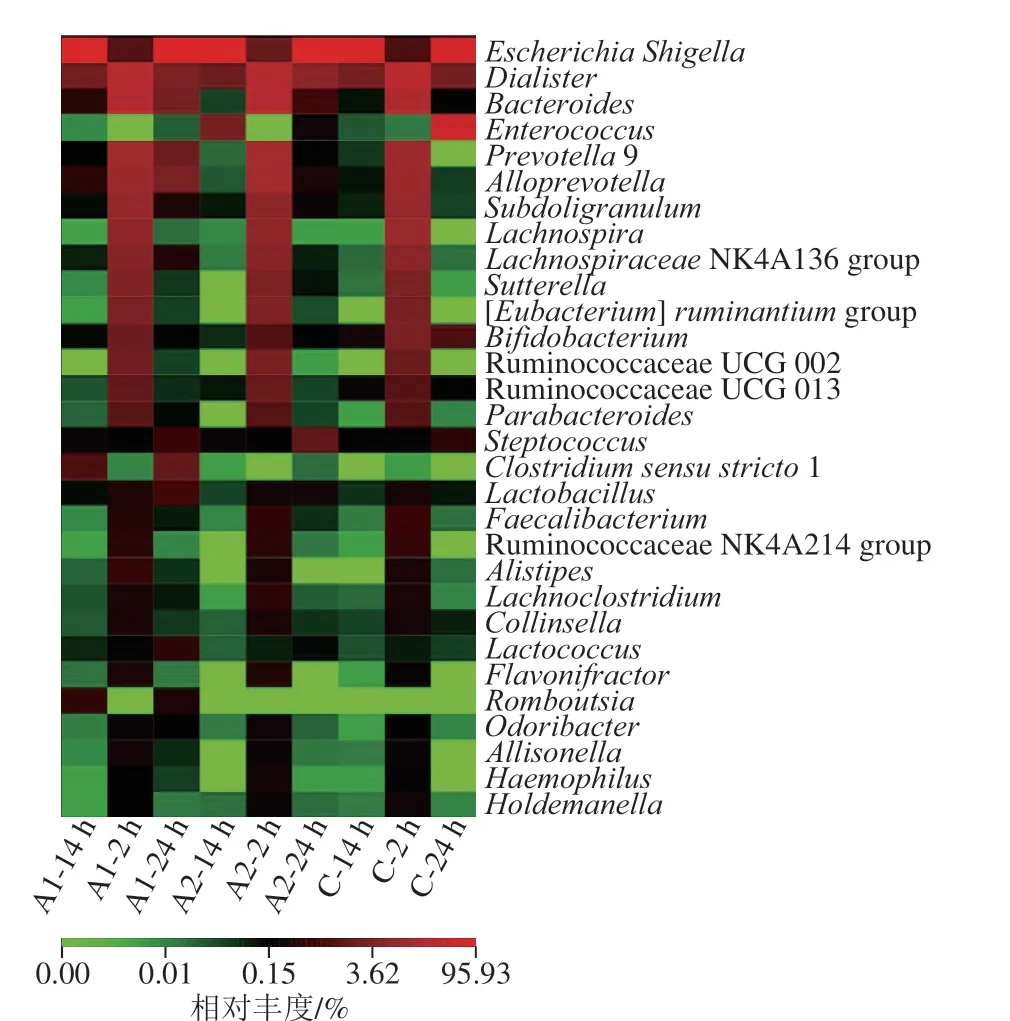
圖 2 發酵液中的菌屬相對豐度的變化熱圖Fig. 2 Heat map showing changes in microbial abundance at the genus level in different samples
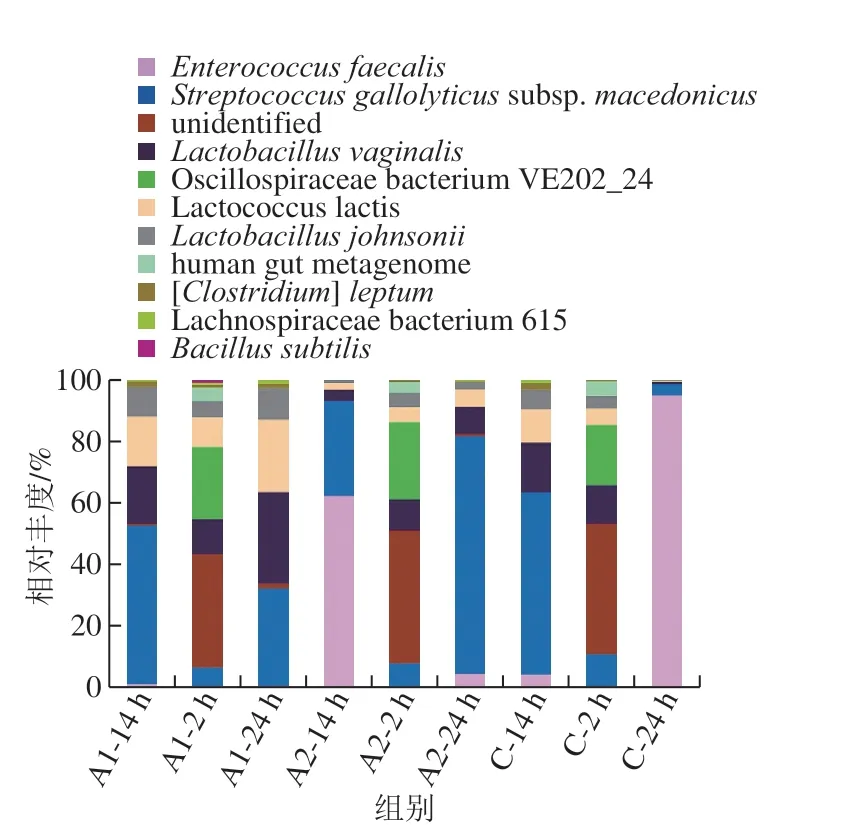
圖 3 發酵液中排名前30的菌種相對豐度變化Fig. 3 Changes in relative abundance of top 30 majormicrobial species in different fermented samples
如圖3所示,實驗組A1和A2的菌種變化情況總體相同,說明測序結果平行性較好,其主要變化趨勢為:發酵2、14 h和24 h,Bacillus subtilis相對豐度持續降低;兩組Lactobacillus lactis相對豐度總體呈現增長;Oscillospiraceae bacterium VE202_24相對豐度均大量下降;Streptococcus gallolyticussubsp.macedonicus相對豐度均持續增長;Lachnospiraceae bacterium 615相對豐度較為穩定。
對照組S. gallolyticus subsp.macedonicus相對豐度在2 h和14 h呈現大量增長后,24 h降低到低于2 h;L. vaginalis、L. lactis和L. johnsonii均在小幅增長后,大量降低;Oscillospiraceae bacterium VE202_24相對豐度顯著下降;Enterococcus faecalis持續增長,成為相對豐度最高的菌屬。
實驗組與對照組的對比可知,A. muciniphila加入到穩定的腸道微生態中,主要使L. vaginalis、L. lactis和L. johnsonii呈現增殖,趨勢與real-time PCR的檢測結果匹配。對照組因為無明顯優勢菌群的存在,可能使容易生存的菌種生長較快,如E. faecalis和S. gallolyticus,讓營養來源單一的菌種逐漸衰亡,如Oscillospiraceae bacterium VE202_24。Oscillospiraceae bacterium主要吸收宿主聚糖存活[26],而發酵液中的關鍵營養成分為Mucin,結構中有大部分為聚糖,但因A. muciniphila的干預使黏蛋白大量消耗,因此可能使這類菌種營養物質匱乏。
2.5 主坐標分析
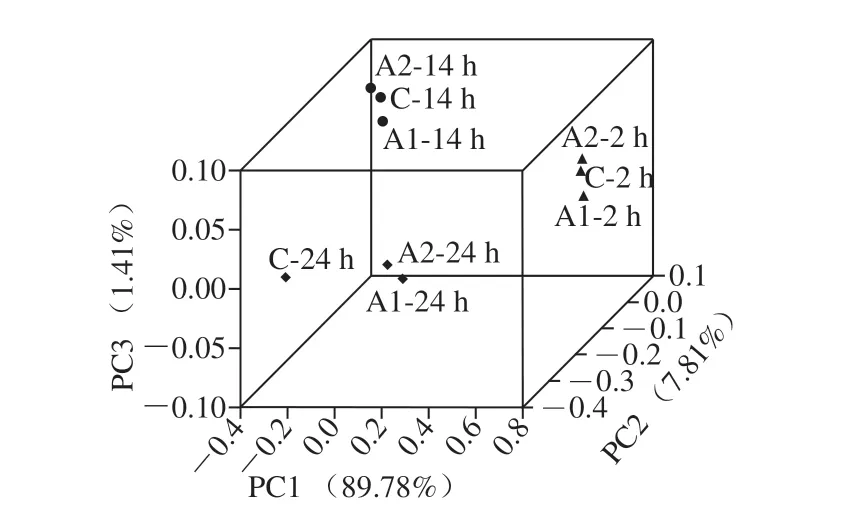
圖 4 不同組間的主坐標分析Fig. 4 Difference among groups shown in PCoA
主坐標分析是基于由物種組成計算得到的距離矩陣得出,不同組作比較時距離越近則表示差距越小。從圖4可知,按照時間點分組,2、14 h和24 h的空間距離較大,顯示樣本群的差異較大;按照實驗組和對照組分析,組間距離較小,相同時間點的樣本聚在一起,顯示其差異較小。因此在菌落總體結構上,A. muciniphila添加后對腸道微生態的結構無顯著影響,說明其對腸道菌群組成沒有破壞性。
3 結論與討論
在廣州地區人群的A. muciniphila定植率為89.31%,平均豐度為5.825(lg(CFU/mL))。
腸道消化模擬不同時間點的real-time PCR結果顯示,A. muciniphila在模擬人類腸道微生物菌群環境中具備生存能力;對Bifidobacterium屬和Bacteroides屬具有抑制效果,對Lactobacillus屬具有促進作用。16S rDNA基因組測序結果顯示:實驗組L. lactis、S. gallolyticussubsp.macedonicus相對豐度均呈現增長,Oscillospiraceae bacterium VE202-24相對豐度大幅降低,Lachnospiraceae bacterium 615相對豐度較為穩定;在菌落總體結構上,A. muciniphila添加后對腸道微生物菌群的結構無顯著影響,說明其對腸道菌群組成沒有破壞性。
本研究選擇無A. muciniphila定植的腸道菌群作為接種液,再添加一定豐度的A. muciniphila活菌進行干預,但有報道表明1%~5%為接近最健康人群的豐度[4]。 這是本研究疏漏的一個需要探究的點,未來將進行改進。本研究采用時長為24 h的腸道消化模擬系統,僅能作為參考評估A. muciniphila對腸道菌群的作用。今后應設置長時間段的評估實驗,其中包括3~5 d的菌群穩定期和7 d以上的長期定植評估等。
A. muciniphila將可能作為益生菌應用于工業、醫療等,其對人體健康的安全性需要研究清楚[27-28]。目前為止,A. muciniphila的致病性尚鮮有文獻報道,A. muciniphila潛在可能的致病性是因其具備依附黏和降解黏蛋白的能力,這些能力使A. muciniphila可能參與到最開始的致病活動[1,29-31]。本研究中,A. muciniphila添加到新的腸道微生物菌群中,可能增加了營養物質的消耗,尤其是黏蛋白的利用,使需要黏蛋白作為能源的菌群生長受到抑制。在14 h后總菌數出現大幅下降,說明營養物質開始缺乏,使營養要求不高的腸道菌群豐度出現額外的增長,生存競爭能力較強;16S rDNA基因組測序結果顯示14 h后Escherichia Shigella屬出現明顯增長,可能對其他菌屬有限制或競爭作用,影響菌群的結構組成。但由總體菌落結構可知,A. muciniphila的添加對腸道微生物菌群的結構無顯著性破壞作用,表明其可能具備活菌攝入的基本要求。
對于低豐度或無A. muciniphila定植的人群,需找出對應的合理方式幫助A. muciniphila定植或者大量增長。有報道指出,中國南方人群A. muciniphila的定植率及其豐度較低,不及腸道菌群總量的1%[13],刺激與定植途徑顯得極其重要。因此利用體外腸道消化系統探究A. muciniphila在腸道中初次定植更具有參考價值。本研究完成A. muciniphila在人體腸道微生態的變化評估,還需對體內進一步深入研究,因此將此類腸道微生態移殖到無菌動物模型中,再攝入A. muciniphila活菌可能更具合理性,這也是本團隊后續的研究工作之一。

