腎小管上皮細胞來源包含miroRNA-21的微囊泡在心肌肥大中的作用
狄 佳,周 華,李 旻,徐 婷,趙家璧
(1.蘇州大學第三附屬醫院 a.腎內科;b.免疫風濕科,江蘇 常州 213003;2.南京醫科大學附屬常州第二人民醫院 病理科,江蘇 常州 213003)
心血管疾病(CVD)是影響慢性腎臟病(CKD)患者預后最重要的因素,CKD患者心血管死亡率約占總死亡率的44%[1],其中慢性心力衰竭為主要死因之一。心肌重構是心力衰竭發展的一個重要病理機制,目前認為抑制心肌重構是預防和治療心力衰竭的重要手段,而心肌細胞肥大是心力衰竭發展過程中心肌重構的一個主要特征之一。microRNA(miRNA)在心肌細胞肥大和凋亡中起到重要作用,其參與心力衰竭的發生和發展,并可作為心力衰竭診斷、治療和預后的新的生物學標志物及治療靶點[2]。近年來,一種被稱為“MVs”的細胞間通訊方式越來越受到研究者們的關注[3-4]。2007年,Valadi發現微囊泡(MVs)中含有miRNA。生理和病理狀態下最基礎的細胞代謝、增殖、分化和死亡等過程均受到miRNA 的調節[5],包含miRNA的MVs作為重要的細胞間通訊的分子平臺在疾病中的作用正成為新的研究前沿。心肌肥大時心臟miRNA-21(miR-21)表達明顯增多,有趣的是這些miR-21大多數包含于MVs,存在于心臟周圍液體中[6],這些MVs的來源尚不清楚。本文觀察了腎小管上皮細胞產生的包含miR-21的微囊泡在心肌肥大中的作用,從而可能拓展對疾病機制的理解,并可能為CKD導致心力衰竭的治療新策略提供實驗依據和理論基礎。
1 材料與方法
1.1細胞培養和處理 大鼠近端腎小管上皮細胞系(NRK-52E)和大鼠心肌細胞(H9C2)購自美國模式菌種收集中心(ATCC)。用含10%胎牛血清(FBS,Life Technology)和100 U/ml青-鏈霉素(Life Technology)的D-MEM/F12培養液(Life Technology),在37 ℃,含5% CO2的孵箱中培養細胞。細胞貼壁生長達到80%融合后,換成無血清的 D-MEM/F12 培養液孵育過夜(16 h),再次更換無血清的 D-MEM/F12培養液,加入重組人轉化生長因子β1(rhTGF-β1,R&D Systems)處理,換成無血清的D-MEM/F12培養液再孵育細胞 48h,收集此無血清、無rhTGF-β1的D-MEM/F12培養液,依次在4℃的環境下離心:300 g×5 min,1 200 g×20 min,10 000 g×30 min,棄沉淀,再經用濾器濃縮上清液,即為條件培養液。對照培養液的收集方法同上,但細胞未經TGF-β1處理。受體心肌細胞用條件培養液處理并檢測。用脂質體轉染試劑(Life Technology)將miR-21的抑制物或陰性對照(均購自Qiagen)轉染H9C2。依據試劑說明書,細胞50%融合后,換成無抗生素、含10%胎牛血清(FBS)的D-MEM/F12培養液將適量miR-21抑制物或陰性對照與250 μl無血清培養基(Life Technology)混合,室溫5 min,5 μl脂質體轉染試劑與250 μl無血清培養基混合,室溫20 min,在37 ℃,含5% CO2的孵箱中培養細胞6 h后,更換為含抗生素、含10% FBS的培養液培養并給予相應的處理。
1.2MVs的提取和觀察 采用差速離心的方法提取條件培養液中的MVs,方法概述如下:收集細胞培養液依次在4 ℃的環境下離心,300 g×5 min,1 200 g×20 min,10 000 g×30 min,棄沉淀,收集上清液在4 ℃的環境下離心110 000 g×60 min,沉淀物即為MVs。用適量的PBS重懸MVs。用TRIzol? LS試劑(Life Technology)提取MVs中的總RNA。用透射電鏡觀察MVs的形態,熒光染色觀察MVs,方法參照文獻[7],概括如下:Dil-C18是一種膜的熒光染料,用Dil-C18染料預處理供體NRK-52E細胞1h,用磷酸緩沖淮(PBS)清洗細胞3次,依據前文所述方法收集條件培養基,并離心得到被Dil-C18染色的MVs。對照MVs的收集方法類似,將MVs重懸在D-MEM/F12培養液中,孵育受體心肌細胞,用熒光顯微鏡觀察受體細胞并拍照。
1.3miRNA的實時定量 PCR(qPCR) 用TRIzol(Life Technology)提取組織或細胞中的總RNA,用miScript RT II試劑盒(Qiagen),以1 μg 的總RNA 為模板合成miRNA的cDNA文庫,反應體系為20 μl(其中總RNA 模板2 μl),充分混勻,37 ℃×60 min,95 ℃×5 min,立即置于冰上冷卻,-20 ℃保存。用miScript SYBR Green PCR試劑盒Qiagen),以10 ng的miRNA的cDNA為模板擴增,反應體系為20 μl(其中10×miScript miR-21 或U6 引物2 μl,miRNA 的cDNA 模板1 μl),充分混勻,95 ℃×15 min×1 次,(94 ℃×15 s,55 ℃×30 s,70 ℃×34 s)×40 次,在70 ℃×34 s步驟收集熒光信號。每個樣本重復3次,采用ABI7300默認的閾值讀取CT值,3次平均值得到CT樣本,ΔCT=CTmiR-21-CTU6,ΔΔCT=ΔCT 處理-ΔCT 對照,取2-ΔΔCT作miRNA 相對定量的柱狀圖。
1.4心肌細胞長徑的測量 H9C2心肌細胞消化后,培養基重懸細胞并進行計數,分別取2×105個細胞到6孔板中,待細胞培養24 h貼壁后更換細胞培養基為含2% FBS的DMEM培養基繼續培養24 h使細胞處于靜止期。不同條件培養結束后,用目鏡測微尺測量心肌細胞長徑。400倍鏡下每組隨機選取6個胞漿橫紋清晰、細胞核完整、形態規則的心肌細胞,測量細胞長徑。
1.5二喹啉甲酸(BCA)蛋白定量的檢測 H9C2心肌細胞每孔分別加入100 μl蛋白裂解液冰浴下對細胞進行充分裂解,細胞裂解后,收集裂解液于1.5 ml離心管中,12 000 g離心取上清,后按照BCA蛋白試劑盒說明進行定量。
1.6酶聯免疫吸附檢測人心內肽(ANP)水平 H9C2心肌細胞不同條件培養后,吸去H9C2心肌細胞的培養液,PBS清洗2遍后胰酶消化細胞,800 g離心收集細胞,200 μl PBS重懸細胞并轉移到新的1.5 ml離心管中。將離心管置于冰浴中超聲(45 W,15 s超聲3次,間隔15 s)以充分裂解。按照CUSABIO公司ANP試劑盒的檢測方法測定ANP濃度。每個試驗條件設3復孔同時進行實驗,以其均值作為統計數據。
1.7統計學方法 用SigmaStat 軟件(版本3.5,Jandel Scientific Software)分析實驗數據。組間比較采用方差分析和t檢驗,P<0.05為差異有統計學意義。
2 結 果
2.1TGF-β1 可誘導供體腎小管上皮細胞產生MVs 以體外培養的NRK-52E為研究對象,收集對照培養液及5 ng/ml的TGF-β1處理細胞24 h后的條件培養液,分別超速離心,留取沉淀用透射電鏡觀察,發現條件培養液沉淀物中有呈簇狀的雙層膜結構的小囊泡,直徑在50~200 nm,符合MVs的形態學特征,見圖1。
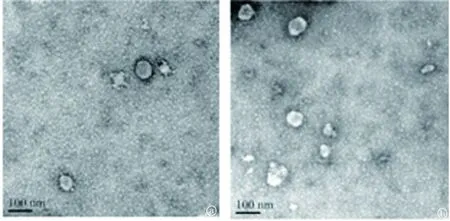
圖1 腎小管上皮細胞產生的條件培養液超速離心獲得的沉淀物的冷凍電鏡照片a.無TGF-β1 處理的供體腎小管上皮細胞產生的條件培養液超速離心獲得的沉淀物;b.5 ng/ml的TGF-β1處理的供體腎小管上皮細胞產生的條件培養液超速離心獲得的沉淀物。標尺=100 nm
2.2Dil-C18 染料標記的MVs可進入受體心肌細胞 用Dil-C18染料標記培養的腎小管上皮細胞并收集TGF-β1處理后的條件培養液,超速離心獲得Dil-C18染料標記的MVs,加入受體心肌細胞培養液中,并于不同時間點觀察,受體心肌細胞內可見Dil-C18紅色熒光陽性的小顆粒,且數量隨著處理時間的延長而增加,提示MVs能從TGF-β1處理的腎小管上皮細胞傳遞到受體心肌細胞中,見圖2。
2.3TGF-β1 誘導產生的MVs可促使受體心肌細胞肥大 為探討MVs對心肌細胞的作用,我們分別用條件培養液經超速離心后的上清液和沉淀的MVs處理培養的心肌細胞,200 μl條件培養液沉淀的MVs處理心肌細胞48 h,能導致細胞長徑、蛋白濃度及ANP含量的增加,而上清液沒有上述效應。因此,結果提示TGF-β1處理后的供體腎小管上皮細胞分泌的 MVs能促使受體心肌細胞發生肥大效應,見圖3。
2.4TGF-β1誘導腎小管上皮細胞分泌的MVs中包含miR-21 為探討腎小管上皮細胞產生MVs促使心肌細胞肥大的機制,我們收集了對照組和5 ng/ml的TGF-β1處理后的腎小管上皮細胞的培養液,超速離心分離條件培養液沉淀的MVs后,分別提取總RNA并檢測其中的miR-21含量,qPCR分析顯示,與對照組相比,TGF-β1處理的供體腎小管上皮細胞分泌的MVs中miR-21的含量顯著增高。在此基礎上,我們進一步確定MVs能否將外源性miR-21導入受體心肌細胞。同樣,與含有miR-21的供體NRK-52E細胞條件培養液中分離的MVs作用24 h后,受體心肌細胞中miR-21的含量較對照組顯著增加,見圖4。
2.5包含miR-21 的MVs誘導心肌細胞肥大 為進一步探討外源性miR-21在促進心肌細胞肥大中的作用,我們將miR-21抑制劑預轉染受體心肌細胞,并將收集的含有MVs的條件培養液繼續誘導心肌細胞48 h。轉染miR-21抑制劑的心肌細胞與轉染NC的對照組相比,條件培養液誘導組細胞長徑、蛋白濃度和ANP含量均明顯增加,而預轉染miR-21抑制劑的受體心肌細胞則未發生肥大效應。這些結果表明,MVs誘導的心肌細胞肥大可被miR-21抑制劑所消除,見圖5。
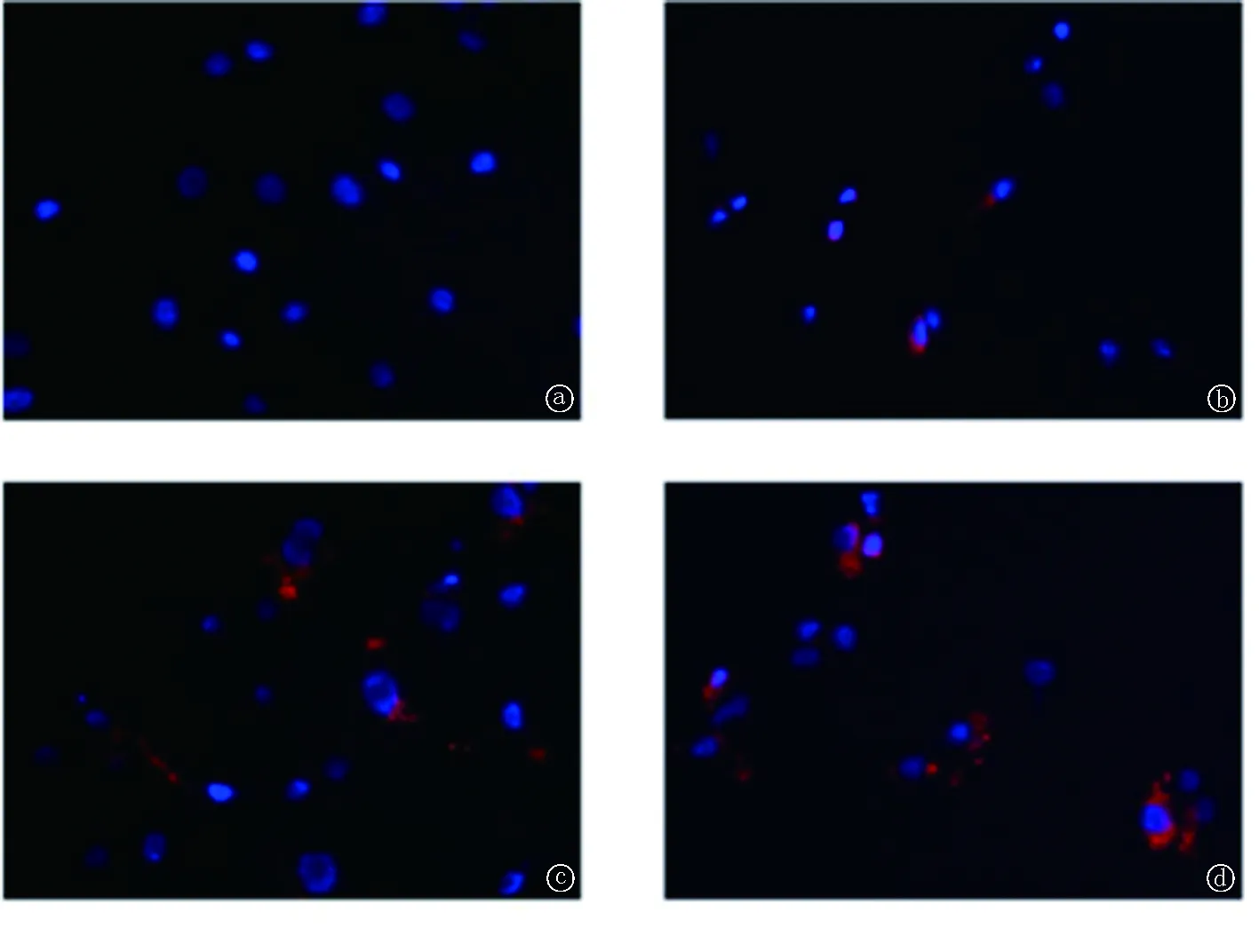
圖2 用Dil-C18 染料標記MVs,處理受體H9C2細胞不同時間后的熒光顯微鏡照片a-d.供體NRK-52E細胞經Dil-C18染料標記,超速離心獲得條件培養液的MVs,處理受體NRK-52E細胞0 h(a)、6 h(b)、12 h(c)、24 h(d)。紅色:Dil-C18標記的MVs,藍色:細胞核

圖3 200 μl條件培養液沉淀的MVs處理心肌細胞48 h后細胞肥大效應分別用條件培養液經超速離心后的上清液和沉淀的MVs處理培養的心肌細胞細胞長徑(a)、蛋白濃度(b)及ANP含量(c)。*P<0.05
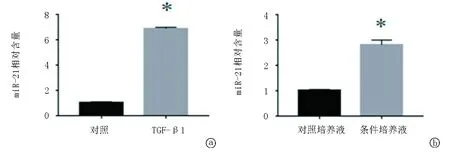
圖4 腎小管上皮細胞分泌的微囊泡中及受體心肌細胞中miR-21的含量a.對照培養液和條件培養液超速離心分離的MVs中miR-21的q-PCR結果;b.對照培養液及條件培養液中分離的MVs作用受體心肌細胞24h后miR-21的q-PCR結果。*P<0.05

圖5 MiR-21抑制劑預轉染受體心肌細胞后用含有MVs的條件培養液誘導48 h后細胞的肥大效應分別用轉染對照、含有MVs的條件培養液、轉染miR-21抑制劑、含有MVs的條件培養液+轉染miR-21抑制劑處理后的心肌細胞長徑(a)、蛋白濃度(b)和ANP含量(c)。*P<0.05
3 討 論
心力衰竭是CKD患者死亡的重要原因,并發心力衰竭的CKD患者數量呈持續增長,而CKD患者普遍存在多種并發癥,如高血壓、糖尿病和動脈粥樣硬化等,其均可獨立地增加心臟風險,因此很難完全明確CKD介導心力衰竭的潛在機制。腎素-血管緊張素-醛固酮系統(RAAS)抑制劑有逆轉左心室肥厚,改善左心室功能的作用[8],但可能導致腎小球濾過率下降及血肌酐水平上升,引起高鉀血癥的危險性增加,限制了其在嚴重腎功能不全中的應用。而即使積極采取多種治療手段如調整血流動力學、減輕液體超負荷、糾正貧血、營養不良,糾正骨礦物質代謝紊亂乃至透析治療,仍不能完全逆轉CKD時心力衰竭的發生發展,提示腎-心交互作用的復雜性,需要積極探索其他心、腎相互作用的調控因子。細胞通訊是心、腎之間相互影響的重要方式。研究發現MVs是介導非接觸的細胞間信息通訊的重要載體[9]。本研究通過觀察腎小管上皮細胞產生的MVs在心肌肥大中的作用,為臨床提供新的策略及手段。
細胞在正常生理條件下可以產生少量MVs,在某些病理生理情況下產生明顯增多[10]。本實驗中我們首先用TGF-β1誘導腎小管上皮細胞損傷并收集這些細胞的條件培養液,采用低溫超速離心方法觀察到離心后獲得的沉淀物在電鏡下符合MVs的形態學特征,且較正常對照明顯增多。MVs是細胞狀態的縮影,一般情況下,細胞膜磷脂如磷脂酰絲氨酸(phosphatidylserine,PS)和磷脂酰乙醇胺(phosphatidylethanolamine,PE)位于細胞膜內側,當細胞內鈣離子濃度升高時,PS從細胞膜內側翻向外側[11]。本研究中我們用熒光染料Dil-C18標記供體細胞,因Dil-C18是一種脂質染料,可用于標記供體細胞的細胞膜,MVs的脂質膜結構中通常包含部分來源細胞的細胞膜成分,故當細胞分泌MVs時MVs也被Dil-C18標記,從而可用來驗證供體細胞產生的MVs能否進入受體細胞[12]。我們用供體細胞產生標記有Dil-C18的MVs處理受體心肌細胞,結果顯示MVs可以從腎小管上皮細胞傳遞到心肌細胞,并且處理時間越長,進入細胞的MVs數目越多。
為進一步驗證這些MVs的作用,我們用TGF-β1處理腎小管細胞,將收集的培養液經超速離心得到的上清液和沉淀的MVs分別作用于心肌細胞,結果證實沉淀中的MVs能夠誘導心肌細胞肥大,而不含有MVs的上清液則沒有該效應,提示TGF-β1處理腎小管細胞產生的MVs才是真正誘導心肌細胞肥大的原因。雖然MVs是介導細胞間通訊的重要載體,然而真正介導細胞間作用的是MVs中包含的各類分子。循環miRNA由于受到MVs的保護非常穩定,避免了核糖核酸酶(RNase)的降解,作為運輸miRNA的主要載體受到廣泛關注[13]。其中,miR-21能促使病理性心臟重塑和血管生成,成為心肌肥大作用中的研究熱點[14]。有研究發現miR-21在高血壓腎損害中呈高表達,并推進高血壓及其相關腎損害的病理進程[15],更提示外泌性MVs在心肌肥大中的重要作用。在參與腎纖維化的多種miRNAs中,miR-21也被證實起著十分重要的作用[16]。已證實纖維化腎臟小鼠模型中腎臟來源的miR-21明顯上調,且研究發現血循環中miR-21的水平與腎纖維化程度亦呈正相關[17],提示腎臟纖維化時腎臟細胞分泌的miR-21可能通過MVs進入血循環。因此在慢性心、腎疾病的進展中,miR-21均發揮著重要的調節作用。我們觀察到用TGF-β1處理腎小管細胞產生的MVs中含有大量的miR-21,且這些MVs作用于受體心肌細胞后可使心肌細胞中miR-21含量顯著增加,而轉染miR-21的抑制劑下調腎小管上皮細胞中miR-21含量后,能夠消除其導致的心肌肥大效應,進一步驗證了腎臟來源的包含miRNA-21的MVs可作用于心肌細胞導致心肌肥大。
綜上所述,本研究發現TGF-β1處理后損傷的腎小管上皮細胞能夠分泌包含miR-21的MVs,并可介導miR-21從腎小管上皮細胞傳遞到心肌細胞并引起心肌細胞的肥大。系統研究包含miRNA的MVs在心、腎細胞間的通訊作用及對靶基因的調控將進一步拓展對疾病機制的理解,并可能為CKD導致心力衰竭的治療新策略提供實驗依據和理論基礎。

