西青果多酚對甲基苯丙胺誘導PC12細胞損傷的保護作用及機制
(江漢大學武漢生物醫學研究院,湖北武漢 430056)
甲基苯丙胺(Methamphetamine,METH)是目前最常見且最具代表性的合成毒品之一[1]。近年來,METH的濫用趨勢日益嚴重。長期濫用METH會使濫用者的前額葉皮層、海馬及紋狀體等腦區出現神經元損傷和核團萎縮,這與大腦功能變化,如情感認知、記憶障礙等關系密切,可能是METH產生精神損害的結構基礎。METH濫用可引起動物大腦灰質減少、多巴胺能等神經元末梢損傷[2]和細胞凋亡[3-4]。此外,METH濫用可致體外培養的神經細胞凋亡[5]。目前,METH神經毒性的機制尚未完全明確[6-7]。研究顯示氧化應激是METH所致神經損傷的重要作用機制之一。METH能使多巴胺(Dopamine,DA)水平升高,過量的DA可引起自由基如活性氧(Reactive oxygen species,ROS)的不斷生成[8],攻擊生物大分子[9-10],進而引發下游級聯反應最終產生神經毒性[11-12]。以往METH導致氧化應激主要是研究ROS引起脂質、蛋白質過氧化損傷,但是對于METH造成的DNA損傷的相關研究甚少。
研究表明,N-乙酰半胱氨酸等抗氧化劑對自由基引起的DNA氧化損傷具有顯著的保護作用[13-15]。西青果多酚(Terminalia chebula polyphenol extract,TCPE)是本實驗室前期從西青果中提取純化的產物,經過體外綜合評價,發現西青果多酚具有較強的抗氧化能力[16],而關于西青果多酚對METH神經損傷的保護作用目前尚無報道。
本研究以大鼠腎上腺嗜鉻細胞瘤(PC12)細胞為研究對象,建立體外PC12細胞METH損傷模型,并用不同濃度西青果多酚進行干預,探討西青果多酚對METH誘導的PC12細胞損傷的保護作用及其作用機制,以期為西青果多酚的進一步開發利用提供理論依據。
1 材料與方法
1.1 材料與儀器
大鼠腎上腺髓質嗜鉻細胞瘤(PC12)細胞 中國科學院昆明細胞庫;甲基苯丙胺 湖北省公安廳;西青果多酚 本實驗室提取[16];RPMI-1640培養基、胎牛血清、胰蛋白酶、磷酸緩沖鹽溶液(Phosphate buffered saline,PBS)、青/鏈霉素溶液 美國Gibco公司;MTT、DMSO、DCFH-DA熒光探針 美國Sigma公司;Muse Annexin V & Dead Cell試劑盒 德國Merck & Millipore公司;超氧化物歧化酶(Superoxide dismutase,SOD)、谷胱甘肽過氧化物酶(Glutathione peroxidase,GSH-Px)、丙二醛(Malondialdehyde,MDA)檢測試劑盒、BCA蛋白定量試劑盒 南京建成生物工程研究所;GAPDH抗體(鼠抗)、羊抗鼠二抗、羊抗兔二抗 武漢博士德生物有限公司;γ-H2AX抗體(兔抗) 上海愛必信生物科技公司;ECL化學發光試劑 美國Thermo Fisher Scientific公司。
1300 Series A2超凈工作臺、3308 CO2培養箱、Multiskan Go全波長酶標儀、Multifuge X1R冷凍離心機、Fluoroskan Ascent FL熒光酶標儀 美國Thermo Fisher Scientific公司;UP-250超聲波細胞粉碎機 寧波新芝生物科技有限公司;MuseTM流式細胞儀 德國Merck & Millipore公司;Olympus IX71倒置熒光顯微鏡 日本Olympus公司;Mini-Protean Tetra電泳槽、PowerPac Basic電源、Trans-Blot TurboTM轉印系統 美國Bio-Rad公司;Gene Gnome 5化學發光成像系統 香港基因有限公司。
1.2 實驗方法
1.2.1 西青果多酚制備及溶液配制 西青果多酚粉末由本實驗室前期提取,冷凍干燥[16],樣品中多酚含量為71.1%。將西青果多酚溶于無水乙醇制成100 mg/mL的西青果多酚儲存液,再依次溶于1640完全培養基配制成不同終濃度的西青果多酚溶液,其濃度分別為6.25、12.5、25、50、100、200及400 μg/mL(無水乙醇濃度在不同終濃度的西青果多酚溶液中占比小于0.5%)。
1.2.2 細胞培養 采用RPMI-1640完全培養基(10%胎牛血清+100 U/mL青霉素+0.1 mg/mL鏈霉素溶液)對PC12細胞進行培養。PC12細胞為貼壁細胞,當培養細胞達到一定數量,且呈對數生長時,用0.25%的胰蛋白酶消化后1000 r/min離心6 min,棄上清,加入1640完全培養基重懸細胞,將密度調整約為1×105個/mL,根據實驗需要分別將細胞接種至96孔板(每孔100 μL)、6孔板(每孔2 mL)和培養瓶(每瓶5 mL)中。
1.2.3 細胞存活率檢測 96孔板內細胞培養24 h后棄去原1640培養液,分別用不同濃度的西青果多酚(6.25、12.5、25、50、100、200及400 μg/mL)干預后檢測細胞存活率,然后根據此實驗結果篩選出的合適濃度的西青果多酚(25、50、100、200、400 μg/mL)與3 mmol/L METH混合后共同給藥處理PC12細胞(100 μL/孔),每組6個重復。繼續培養24 h。顯微鏡下觀察細胞形態,隨后每孔加入10 μL無菌的MTT溶液(5 mg/mL),置于培養箱中繼續培養4 h,棄去培養液,每孔加入150 μL二甲基亞砜(DMSO)溶液,振蕩混勻,通過酶標儀在570 nm波長檢測各孔吸光度(OD)值,計算細胞存活率:
細胞存活率(%)=暴露組OD值/對照組OD值×100
1.2.4 細胞凋亡檢測 6孔板內細胞培養24 h后棄去原1640培養液,加入不同濃度的西青果多酚(25、50、100和200 μg/mL)與3 mmol/L METH,繼續培養24 h。將細胞用0.25%的胰蛋白酶消化后離心,棄上清,用PBS洗兩次,按照Muse Annexin V & Dead Cell試劑盒說明書處理細胞并染色30 min。隨后用流式細胞儀檢測細胞凋亡。
1.2.5 DNA損傷水平檢測 6孔板內細胞培養24 h后加入不同濃度的西青果多酚(25、50、100、200 μg/mL)與3 mmol/L METH,繼續培養24 h后消化離心進行彗星電泳實驗[17]。細胞消化后用正常熔點和低熔點膠制成膠板。將膠板置于裂解液應用液(2.5 mol/L NaCl,100 mmol/L Na2EDTA·2H2O,10 mmol/L Tris,使用前加入1% TritonX-100,pH10)中,4 ℃避光裂解1.5 h。漂洗兩次,電泳液(0.3 mmol/L NaOH和1 mmol/L Na2EDTA,pH>13)中4 ℃避光解旋20 min,25 V電壓下電泳15 min。漂洗兩次,中和液(0.4 mol/L Tris,pH7.5)中浸泡5 min,2.5 μg/mL溴化乙錠避光染色20 min。用熒光顯微鏡(激發波長515~560 nm)觀察并拍照。結果使用CASP軟件進行分析。
1.2.6 Western Blot檢測細胞γ-H2AX蛋白表達水平 6孔板內細胞培養24 h后加入不同濃度的西青果多酚(25、50、100、200 μg/mL)與3 mmol/L METH,繼續培養24 h,用胰蛋白酶消化收集細胞。按RIPA∶PMSF∶廣譜磷酸酶抑制劑∶cocktail=100∶1∶1∶2的比例(體積比)配好裂解液,每組細胞沉淀加入100 μL裂解液,冰上裂解30 min,4 ℃、12000×g離心15 min,吸取上清用BCA法測量蛋白濃度。將蛋白樣品沸水浴5 min變性。進行SDS-PAGE電泳,并將蛋白轉移至PVDF膜。隨后用5%脫脂奶粉振搖封閉1 h,分別加一抗后室溫孵育1 h,4 ℃孵育過夜,TBST洗膜,加二抗室溫孵育1 h,TBST洗膜,ECL化學發光試劑顯色,化學發光成像系統成像觀察并拍照[5]。用Image J軟件處理圖片,分析條帶灰度值,進行歸一化處理。
1.2.7 SOD、GSH-Px活性和MDA含量檢測 培養瓶內細胞培養24 h后按上述實驗中相同的給藥和分組方法處理細胞,繼續培養24 h后用胰蛋白酶消化后離心,棄上清,PBS重懸,超聲破碎細胞,按照SOD、GSH-Px和MDA試劑盒說明書的要求,嚴格進行實驗,每組設置3個重復,通過酶標儀檢測OD值,按照說明書計算各組的SOD、GSH-Px活性和MDA含量。
1.2.8 ROS水平檢測 6孔板內細胞培養24 h后按上述實驗中相同的給藥和分組方法處理細胞,繼續培養24 h,棄上清,PBS漂洗2次,隨后加入終濃度為100 μmol/L的DCFH-DA,置于37 ℃的恒溫培養箱中30 min,棄去上清,加入PBS漂洗3次。胰蛋白酶消化收集細胞,加入1 mL PBS重懸細胞,通過熒光酶標儀設置激發波長485 nm,發射波長538 nm測定各組熒光強度值[18],每組設置3個重復。分析各組熒光強度,進行歸一化處理。
1.3 數據處理
2 結果與分析
2.1 西青果多酚對PC12細胞存活率的影響
如圖1所示,與對照組相比,25~400 μg/mL西青果多酚干預組PC12細胞存活率極顯著升高(P<0.01)。因此,用25~400 μg/mL西青果多酚進行后續實驗。
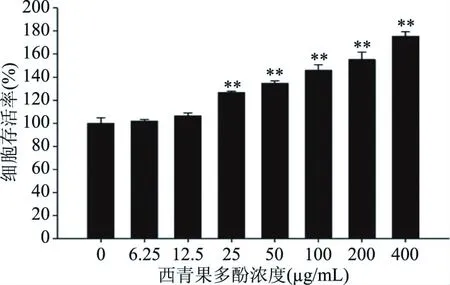
圖1 西青果多酚對PC12細胞存活率的影響(n=6)Fig.1 Effect of TCPE on the survival rates of PC12 cells(n=6)注:與對照組相比,**表示極顯著(P<0.01)。
2.2 西青果多酚對METH誘導后PC12細胞存活率的影響
如圖2所示,與對照組相比,3 mmol/L METH組PC12細胞存活率極顯著下降(P<0.01)。與METH組相比,25 μg/mL西青果多酚處理組PC12細胞存活率顯著升高(P<0.05),50、100、200、400 μg/mL西青果多酚處理組PC12細胞存活率極顯著升高(P<0.01)。
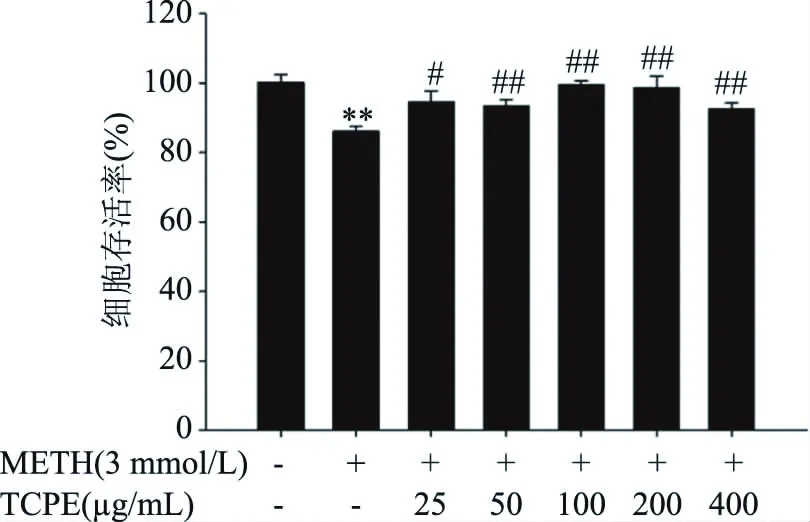
圖2 西青果多酚對METH染毒后PC12細胞存活率的影響(n=6)Fig.2 Effect of TCPE on the survival rates of PC12 cells after METH treatment(n=6)注:與對照組相比,*表示顯著(P<0.05),**表示極顯著(P<0.01);與3 mmol/L METH組相比,#表示顯著(P<0.05),##表示極顯著(P<0.01)。圖3B、圖4B、圖5B、圖6同。
2.3 西青果多酚對METH誘導后PC12細胞凋亡的影響
如圖3所示,與對照組相比,3 mmol/L METH組PC12細胞凋亡率極顯著升高(P<0.01);與3 mmol/L METH組相比,50、100、200 μg/mL西青果多酚均極顯著降低PC12細胞的凋亡率(P<0.01)。以上結果表明西青果多酚能明顯抑制METH誘導的PC12細胞凋亡。
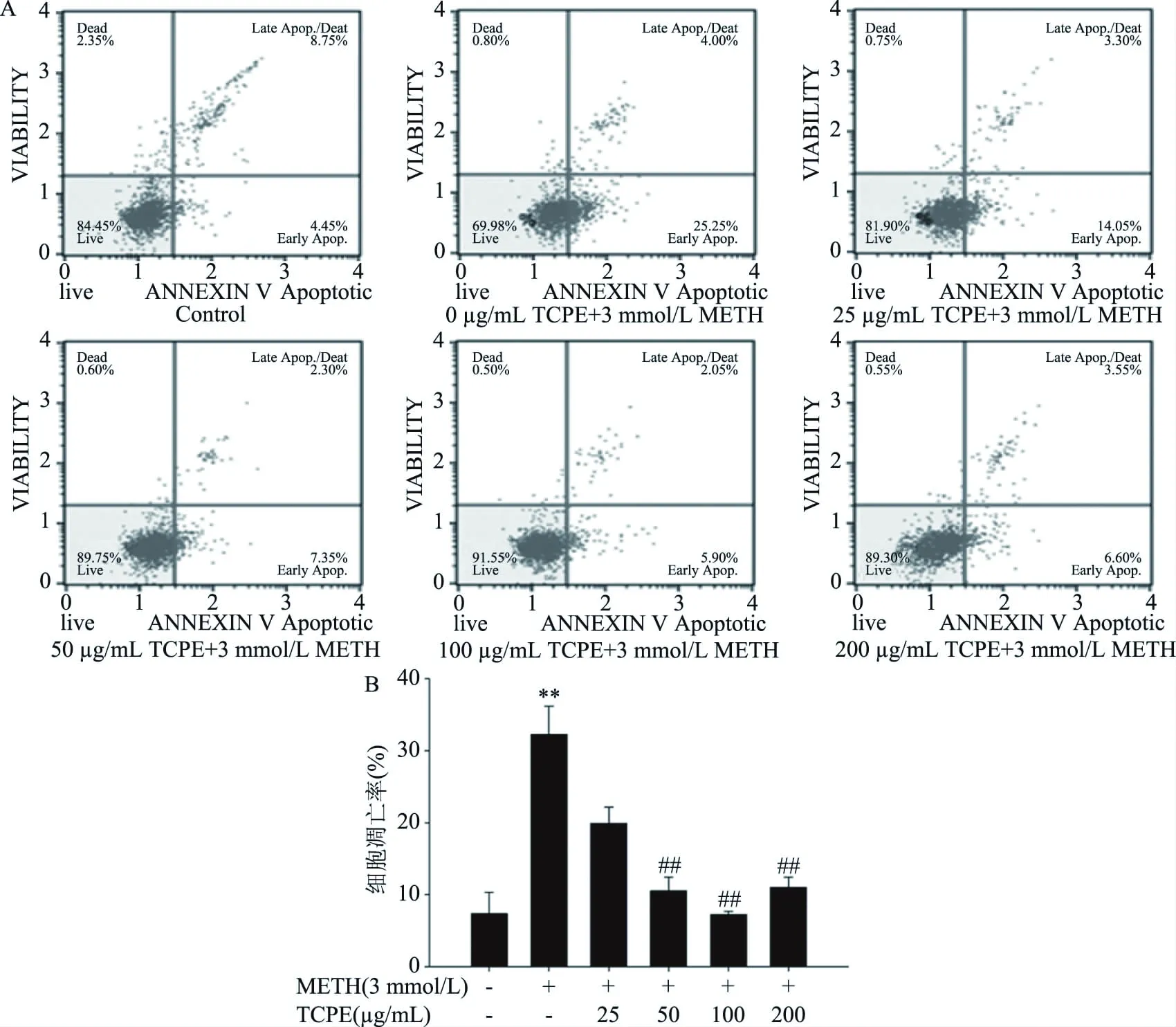
圖3 西青果多酚對METH染毒后的PC12細胞凋亡的影響(n=3)Fig.3 Protective effect of TCPE on apoptosis of PC12 cells after METH treatment(n=3)注:A:流式細胞儀凋亡代表圖;B:PC12細胞凋亡結果統計圖。
2.4 西青果多酚對METH誘導后PC12細胞DNA損傷的影響
如圖4所示,與對照組相比,3 mmol/L METH組細胞尾部DNA含量百分比極顯著升高(P<0.01);與3 mmol/L METH組相比,25、50、100、200 μg/mL西青果多酚組細胞尾部DNA含量百分比極顯著降低(P<0.01),表明西青果多酚能明顯抑制METH引起的PC12細胞DNA損傷。
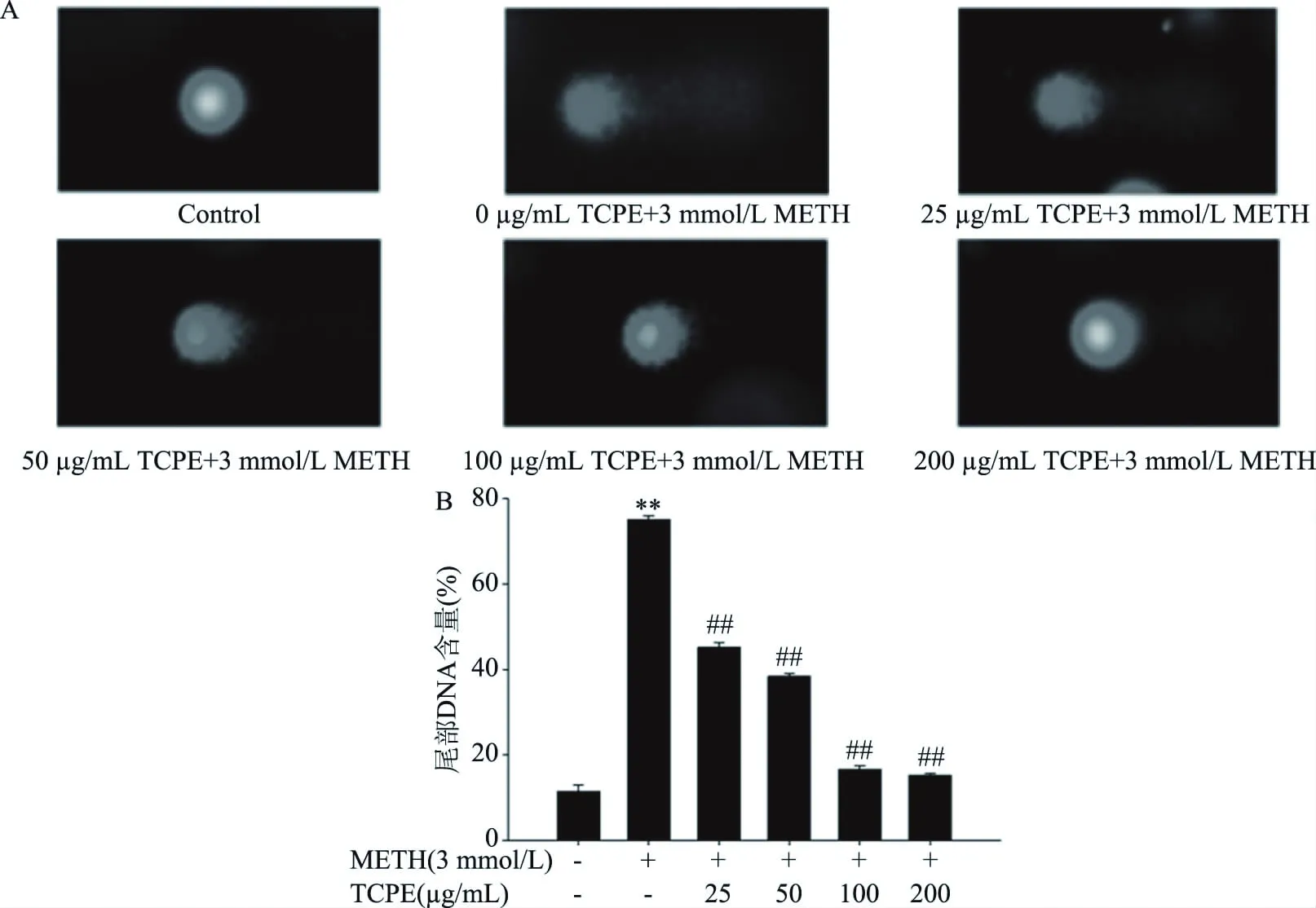
圖4 西青果多酚對METH染毒后的PC12細胞DNA損傷水平Fig.4 Effect of TCPE on DNA damage level in PC12 cells after METH treatment
2.5 西青果多酚對METH染毒后PC12細胞γ-H2AX蛋白表達的影響
如圖5所示,與對照組相比,3 mmol/L METH組細胞γ-H2AX蛋白表達極顯著升高(P<0.01),與3 mmol/L METH組相比,50、100、200 μg/mL西青果多酚組細胞γ-H2AX的蛋白表達極顯著降低(P<0.01),表明西青果多酚對METH造成的DNA損傷具有明顯的保護作用。
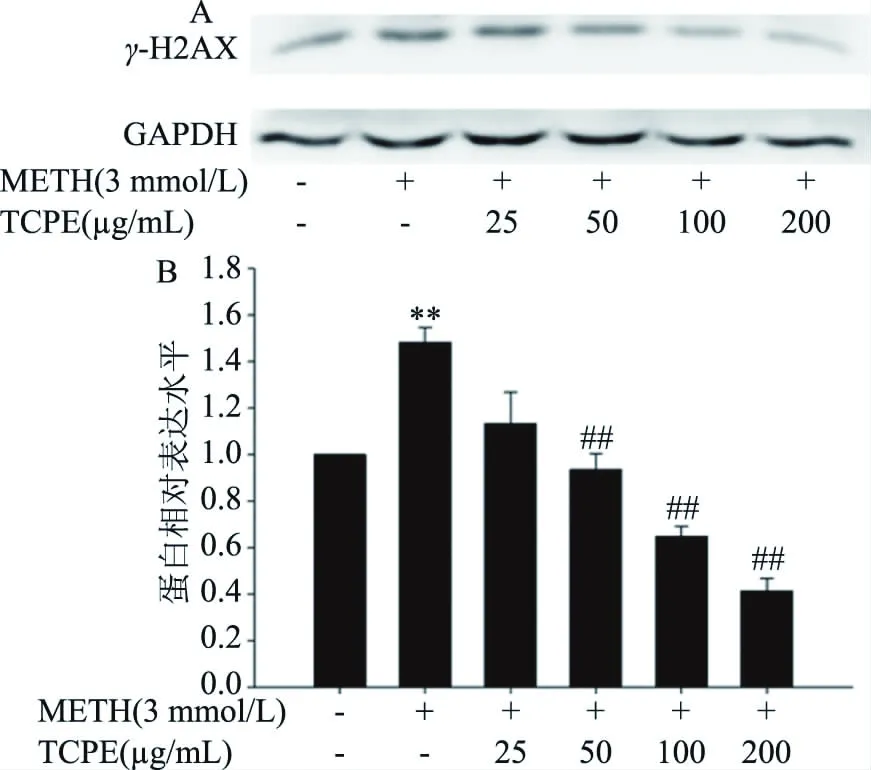
圖5 西青果多酚對METH染毒后的PC12細胞γ-H2AX蛋白表達的影響Fig.5 Effect of TCPE on γ-H2AX expression in PC12 cells after METH treatment
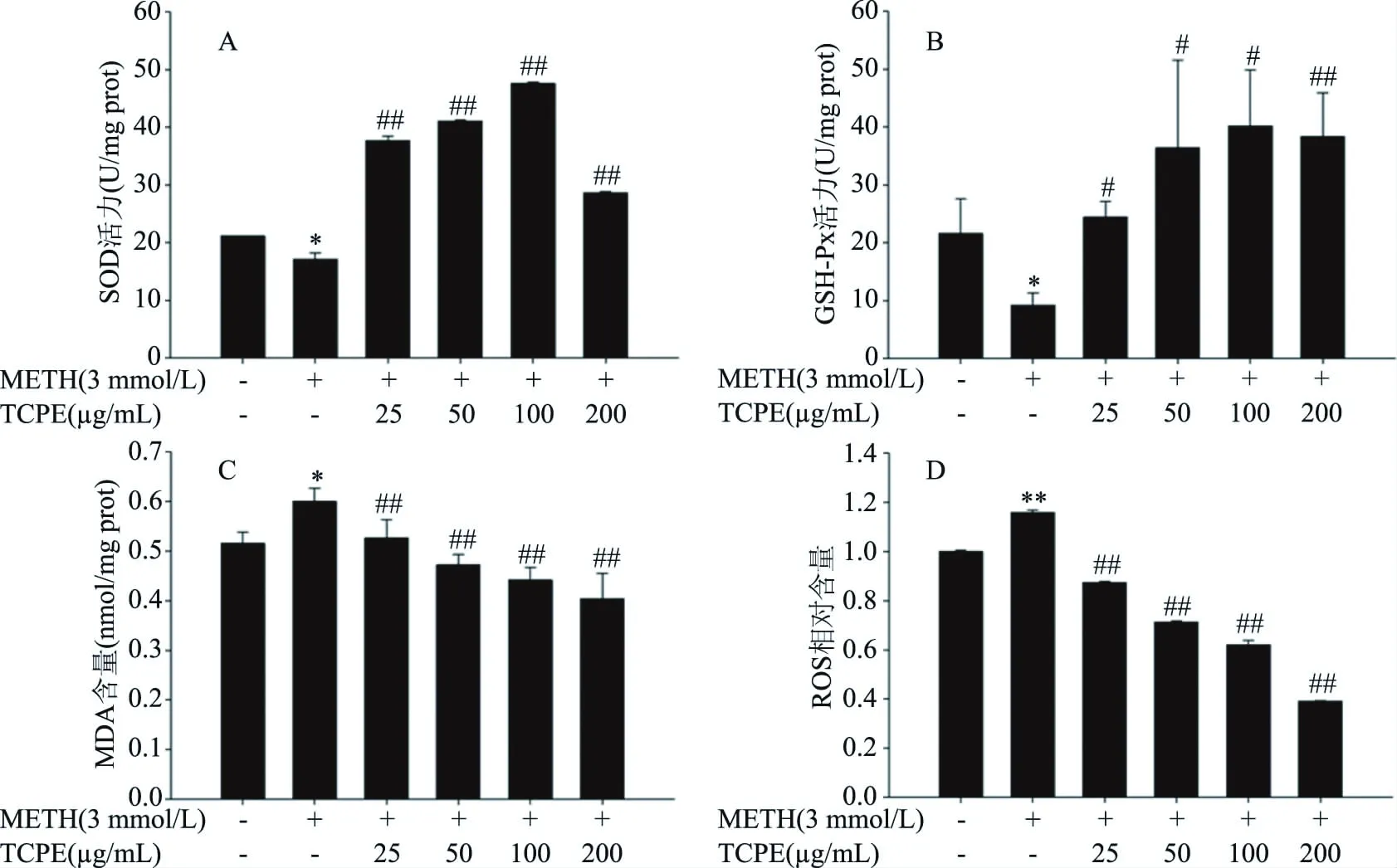
圖6 西青果多酚對METH染毒PC12細胞SOD、GSH-Px活力、MDA和ROS水平的影響(n=3)Fig.6 Effect of TCPE on SOD,GSH-Px activities,MDA and ROS levels of PC12 cells after METH treatment(n=3)
2.6 西青果多酚對METH染毒后PC12細胞SOD、GSH-Px活性和MDA、ROS水平的影響
SOD和GSH-Px是機體內重要的抗氧化酶,能夠有效清除自由基[19-20]。MDA是脂質過氧化產物,也是氧化應激的重要指標之一[21]。如圖6所示,與對照組相比,METH組細胞SOD和GSH-Px活力顯著降低(P<0.05),MDA含量顯著升高(P<0.05),ROS相對含量極顯著升高(P<0.01),與METH組相比,25~200 μg/mL西青果多酚組細胞SOD活力極顯著升高(P<0.01),GSH-Px活力顯著升高(P<0.05),MDA和ROS含量極顯著降低(P<0.01)。
3 討論與結論
研究表明,METH濫用會使神經元細胞ROS升高,引起氧化應激,導致細胞凋亡[22-24]。DNA損傷與氧化應激密切相關,有文獻報道METH能導致大鼠紋狀體和伏隔核DNA損傷[25]。本實驗結果發現,METH能明顯增加細胞凋亡、DNA損傷、胞內MDA和ROS含量,降低細胞存活率、胞內SOD和GSH-Px活性,西青果多酚能明顯抑制METH誘導的細胞凋亡、DNA損傷、胞內MDA和ROS含量增加,抑制METH誘導的細胞存活率、胞內SOD和GSH-Px活性下降。因此推測西青果多酚可能通過緩解METH導致的氧化損傷,減輕DNA損傷,從而對PC12細胞損傷起到保護作用。
本實驗結果顯示西青果多酚能明顯提高PC12細胞的存活率,抑制METH造成的細胞凋亡,表明西青果多酚對METH引起的神經損傷具有保護作用。文獻報道多酚類物質能通過抗氧化作用減輕過氧化氫引起的神經損傷[26-28],與本研究結果相似,因此西青果多酚的神經損傷保護作用可能與西青果多酚的抗氧化作用有關。
文獻報道抗氧化劑能緩解自由基引起的DNA損傷[29-31],本研究中彗星試驗結果顯示西青果多酚能明顯降低METH誘導的PC12細胞DNA損傷程度,Western Blot結果顯示西青果多酚能明顯降低METH誘導的DNA損傷標志蛋白的表達,表明西青果多酚對METH誘導的PC12細胞DNA損傷具有保護作用。前期研究表明葡萄籽提取物[32]、馬蹄紫菀提取物[33]等可通過清除自由基,減輕自由基引起的DNA損傷,前期實驗已發現西青果多酚具有很好的體外清除自由基能力[16],因此推測西青果多酚對METH引起的DNA損傷的保護作用可能與其提高細胞自由基清除能力有關。
此外,本研究還發現西青果多酚能顯明顯提高PC12細胞中SOD和GSH-Px活性,降低PC12細胞中MDA和ROS含量,這與文獻報道中褪黑素能明顯降低METH誘導的氧化應激、保護神經細胞[34]的結果相似。結合上述結果推測西青果多酚可能提高機體抗氧化酶活性,減少自由基的產生,抑制METH誘導的DNA損傷,從而起到對PC12細胞神經損傷的保護作用。
綜上所述,本研究發現西青果多酚對METH誘導的PC12細胞損傷具有保護作用,主要表現在提高細胞存活率、SOD和GSH-Px活性,降低細胞凋亡率、DNA損傷水平、MDA和ROS含量。其作用機制可能是通過緩解氧化應激、降低PC12細胞DNA損傷實現。今后將進行動物體內實驗進一步研究METH引起DNA損傷以及西青果多酚對METH神經損傷的保護作用及機制,為研究METH神經毒性機制和西青果多酚的進一步開發利用提供實驗基礎和理論依據。

