PO-Cu-BDC材料的合成及其對鈾的吸附性能研究*
肖靜水,劉 敏,彭安國
(南華大學核科學技術學院,湖南 衡陽 421001)
金屬-有機框架(Metal-Organic Frameworks),簡稱MOFs,是由有機配體和金屬離子或團簇通過配位鍵自組裝形成的具有分子內孔隙的有機-無機雜化材料。由于自組裝時配位鍵形成的方向性,不同有機配體與金屬離子或團簇能夠形成具有各自特點的孔隙結構,從而不同的金屬-有機框架材料具有不同的吸附特性、光學特性和電磁學性質等。目前金屬-有機框架材料因其較豐富的多孔結構在吸附、分離、催化等領域表現出巨大的發展潛力和誘人的應用前景[1-2]。目前,合成MOFs 的主要方法有水熱溶劑熱法、擴散法、微波法、電化學法和超聲波法[3-4]等,上述方法中,水熱或溶劑熱法為重要合成方法,大多數MOFs都可利用該方法合成,即在密封的壓力容器中,以水為溶劑,在高溫高壓的條件下進行的化學合成方法。
鈾是重要的核工業原料,同時又是射性元素,也是環境中有害有毒元素。在鈾礦中鈾的提取、分離、分析以及礦山含鈾廢水的處理都與到鈾的富集方法有關,目前鈾的富集方法如溶劑萃取法、離子交換法、沉淀法等多具有處理工藝流程長、費時、效率不高和環境不友好等特點。金屬-有機框架材料因其特別的吸附性能為鈾的富集分離方式提供了新的可能性,具備一定的發展潛力成為鈾的新型吸附材料,但是目前用金屬有機框架材料作為吸附劑吸附鈾的文獻報道并不多[7],本文以N,N-二甲基甲酰胺、對苯二甲酸和四丁基溴化銨為原料采用電化學法合成了Cu-BDC金屬有機骨架材料,利用二丁基氧磷對金屬有機骨架材料進行氧磷基修飾,得到了PO-Cu-BDC材料,探究了利其作為吸附材料應用于含鈾廢水中的鈾的分離富集處理。
1 實 驗
1.1 儀器與試劑
丙酮,5-Br-PADAP,無水乙醇,硝酸,濃硫酸,過氧化氫,對苯二甲酸,N,N-二甲基甲酰胺,甲苯,二丁基氧磷,四丁基溴化銨,均為分析純,購自天津科密歐試劑公司;鈾標準溶液:稱取1.2016 g U3O8于250 mL燒杯中,加15 mL濃硫酸,加5~6滴過氧化氫,加熱至溶解,冷卻后轉入裝用300 mL超純水的燒杯中,冷卻后轉入1000 mL的容量瓶中定容,該溶液鈾的濃度為1 mg/mL;0.05% 5-Br-PADAP溶液,5-Br-PADAP溶解于無水乙醇制得;試驗用水均為超純水。
AX324ZH電子天平,奧豪斯儀器(常州)有限公司;TDZ4-WS自動平衡實驗室離心機,長沙湘智離心機儀器公司;Lamder35型紫外可見光度計,Perkin Elmer Instruments;SHA-C型水浴恒溫振蕩器,江蘇常州金壇良友儀器有限公司;DZ-2BE型真空干燥箱,天津泰斯特公司;PHS-25型酸度計,上海雷磁儀器廠;MJ-1200型超聲波清洗機,無錫市美極超聲設備有限公司;SKGL-1200管式爐,上海鉅晶公司;SZCL-3B型l智能數顯控溫磁力攪拌器,鄭州生化儀器有限公司。
1.2 實驗方法
1.2.1 PO-Cu-BDC材料制備
(1)取銅片(純度為99.5%),置于丙酮溶液中用超聲波清洗機清洗1 h,以有效清潔銅片,去除其表面污物,取出后再置于稀硝酸溶液中10 min,以去除銅電極表面氧化層,然后再用超純水多次反復洗滌,清洗干凈后再進行電化學拋光,用配制好的100 mL體積比為1:4的硝酸溶液與無水乙醇混合后作電解液,銅片作為陽極,石墨電極為陰極,在3 V電壓下電化學拋光10 min,取出,反復用超純水清洗到完全干凈后,自然晾干備用。
(2)用天平稱取0.5 g干燥后的對苯二甲酸,將其溶于100 mL N,N-二甲基甲酰胺中,攪拌至對苯二甲酸完全溶解后,再加入一定量的四丁基溴化銨,待所加物質全部溶解后,用同尺寸的鋅片作為陰極,處理后的銅片電極作為陽極,調控不同電壓進行反應。待反應一段時間后,取出金屬銅陽極,用N,N-二甲基甲酰胺溶液清洗電極3~4次,放置于真空干燥箱中干燥后,取出,將銅電極表面產物剝落、研磨制成一定粒度備用。
(3)將步聚(2)已制備好的材料放置于管式爐中,在充氮氣保護下,將爐溫升高到240 ℃,并保溫5 h,然后讓其自然冷卻至室溫,再將Cu-BDC材料取出,分取一定量的Cu-BDC材料,加入100 mL 二甲苯溶液,攪抖后再加入一定量的二丁基氧磷,于磁力攪拌器攪拌反應一定時間后,過濾,將所得固體洗滌幾次后,放置于真空干燥箱中干燥后,得到外觀顏色為淺綠色的固體物。

1.2.3 PO-Cu-BDC材料的洗脫實驗
待PO-Cu-BDC材料吸附飽和好后,移取一定量的PO-Cu-BDC裝填于口徑0.2 cm自制小玻璃柱管中,用一定體積的洗脫液過柱,收集洗液,5-Br-PADAP光度法分析洗液中鈾含量,據洗液中鈾含量和材料吸附的鈾總量計算其洗脫率。
1.2.4 PO-Cu-BDC材料的再生性實驗
取0.2 g PO-Cu-BDC材料,用鈾酰離子溶液吸附飽和后,計算材料對鈾的吸附量,再用1.5 mol/L NaNO3時洗脫至洗液不含鈾,材料再用水洗滌干凈后,按上述吸附實驗再重復進行試驗,以檢驗材料的可重復利用性。
2 結果與討論
2.1 吸附性能
2.1.1 吸附選擇性
PO-Cu-BDC材料是否對鈾具有特異性吸附性能,實驗選取二價汞離子作了對比性吸附實驗,材料的吸附對比試驗結果見表1。結果說明,經氧磷基修飾后的PO-Cu-BDC材料對鈾的吸附選擇性并不顯著。

表1 吸附選擇性(n=7)
2.1.2 pH的影響
pH值通常是影響鈾的吸附效率的一個重要因素,實驗中選取了2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0等八個不同的pH值 點,由圖1結果可看出:當吸附底液的pH值 處于5.0~7.0之間時,PO-Cu-BDC金屬有機骨架材料吸附鈾可達90%以上;但是當溶液的pH小于5時吸附率有降低的現象出現,應該是當溶液pH的減少時,溶液中的氫離子增多有關(氫離子與鈾酰離子竟爭吸附點位);pH大于7時,吸附效果降低,基于鈾酰離子其離子勢較大,易于在堿性溶液中水解生成氫氧化物,從而影響了其吸附效果。由是在后面實驗中控制吸附的pH值為5.0。
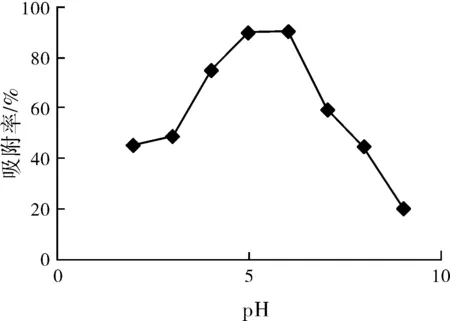
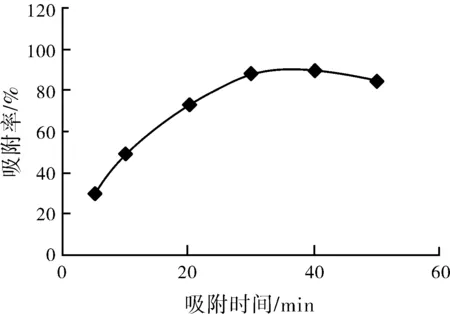
圖1 pH和時間對吸附的影響
2.1.3 吸附時間的影響
保持吸附底液的pH值為5.0,PO-Cu-BDC金屬有機骨架材料用量為100 mg,對吸附時間改變,以試驗吸附時間對PO-Cu-BDC金屬有機骨架材料吸附鈾酰離子效果影響,實驗結果如圖1所示,從圖1中能夠得到以下結論:當材料的吸附時間在50 min左右時,其對鈾酰離子的吸附效果最好,對鈾吸附率可至90%以上。
2.2 洗脫性能
2.2.1 不同洗脫劑的選擇與洗脫劑濃度的影響
從圖2所示結果看可得到以下結論:采用NaNO3作洗脫劑時,NaNO3的濃度位于1.5 mol/L以上時洗脫效果就可比較好,達到2.0 mol/L時洗脫效果下降。選用其他無機酸試劑如一定濃度的硫酸、硝酸、鹽酸溶液作為洗脫劑時,其中只有硝酸溶液洗脫效果較好,但材料再生性能下降較快,導致這一現象可能與材料的有機結構被氧化性硝酸破壞相關,而在鹽酸作洗脫劑時未曾觀觀察到材料的再生性下降快速現象,故實驗中都采用1.5 mol/L NaNO3溶液為洗脫劑。

圖2 NaNO3濃度對洗脫的影響
2.2.2 洗脫時間及體積的影響
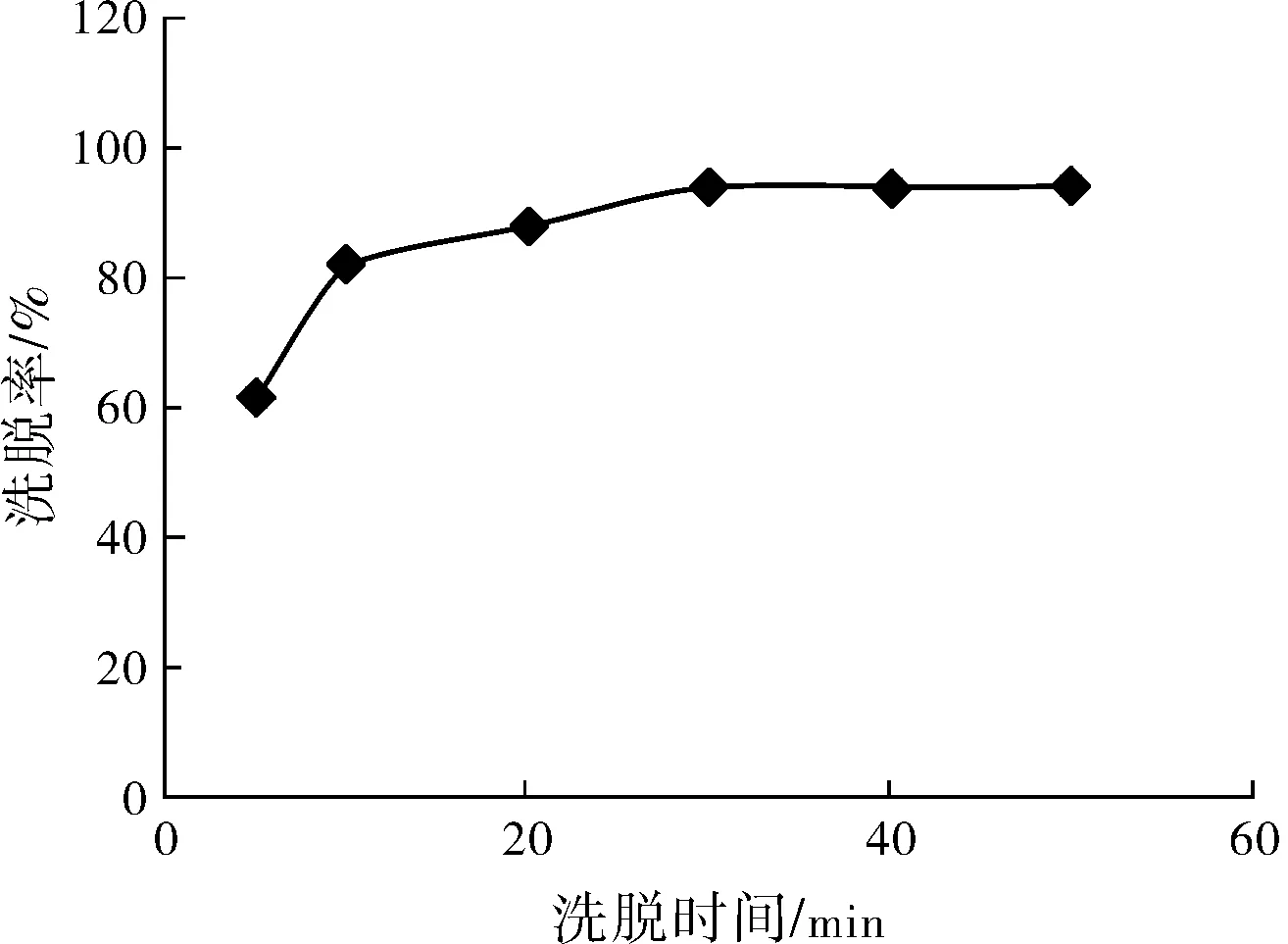

圖3 洗脫時間及洗脫體積的影響
據圖3可以看出,采用1.5 mol/L NaNO3作洗脫劑時,洗脫時間在30 min時就可將吸附的鈾酰離子基本上洗脫,在30~60 min的洗脫時間試驗中洗脫效果基本變化不大,實驗中選擇洗脫時間為40 min。保洗脫時間40 min不變,洗脫液體積為吸附材料體積4倍以上時,對鈾的洗脫率可達95%以上。
2.3 再生性能
從表2的吸附再生實驗結果可以看出,重復利用三次后吸附率降為原來的66.8%,PO-Cu-BDC作為吸附劑且具有一定的穩定性,可重復使用,但對酸的穩定性較差。

表2 PO-Cu-BDC材料(0.2 g)對鈾酰離子的吸附再生實驗結果
3 結 論

(2)吸附飽和鈾后的PO-Cu-BDC材料用1.5 mol/L NaNO3作洗脫劑,洗脫液體積在4倍以上,洗脫時間在30 min時對鈾的洗脫率可達95%以上。
(3)PO-Cu-BDC材料循環吸附3次后其對鈾酰離子的吸附量降為原來的66.8%,說明PO-Cu-BDC作為吸附劑具有一定的穩定性,可以作為鈾的吸附劑重復利用,但該PO-Cu-BDC金屬有機骨架材料對鈾酰離子的吸附選擇性表現不太明顯。

