一株芝麻香型白酒高溫大曲細菌Q2B1的鑒定及其產酶活性研究
王志山,李 苗,陳文浩,劉 洋*
(1.北京科技大學 化學與生物工程學院,北京 100083;2.宜賓學院 固態發酵資源利用四川省重點實驗室,四川 宜賓 644000)
中國白酒是世界六大著名蒸餾酒之一,是中國食品工業的重要組成部分,在中國傳統文化中占有獨特的地位[1]。大曲以小麥、大麥、豌豆等為原料,經自然接種發酵而成,不僅是白酒釀造過程中的酒化劑與糖化劑,也是必不可少的生香劑,均含有大量的用于大分子水解和代謝的微生物和酶,在傳統的白酒釀造過程中起著至關重要的作用[2-3]。研究人員對比研究強化大曲和傳統大曲時發現,強化大曲可以顯著提高白酒生產的效率,使白酒中酯類及芳香族化合物得到顯著提高,進而影響白酒的風味[4-5];其中中低溫大曲淀粉酶活性與多樣性最高,而在高溫大曲中蛋白酶起主導作用[6]。
利用傳統的微生物分離培養方法與分子生態學研究技術對包括醬香型白酒[7-10]、濃香型白酒[5,11-12]及清香型白酒[13-14]等不同香型的白酒大曲微生物群落結構及其多樣性進行探究發現:不同香型的白酒大曲微生物種類與群落組成之間存在著顯著的差異,由于微生物種群組成的多樣性使得微生物來源的各類酶系也極為復雜,其中包括蛋白酶、淀粉酶等許多重要酶系。不同微生物來源的酶,由于其酶學特性的不同,在白酒釀造過程中所起的作用也不盡相同[15],這是不同白酒風味類型形成的重要影響因素之一[1]。相關研究指出在白酒釀造過程中,芽孢桿菌對釀酒酵母的生長幾乎不造成影響,但可以通過提高芳香族化合物的含量以及大曲中酶的含量與活性進而促進白酒風味的形成[16-17]。
芝麻香型白酒是中國傳統的白酒香型之一,是以芝麻香為主體,兼具濃、清、醬三種香型風味,這種香型的白酒也是以高粱、小麥、麩皮等為主要原料,經傳統固態發酵、蒸餾、貯存、勾調而成,因酒中主體香氣與焙炒芝麻的香氣類似,故稱為芝麻香型白酒[18]。高溫制曲是芝麻香型白酒釀造的特點之一,也是芝麻香型白酒特殊風味形成的關鍵環節之一,對保障該香型白酒的生產與品質發揮著重要作用[19]。芝麻香白酒高溫大曲的發酵溫度一般保持在45 ℃以上,制曲過程中最高溫度可達65 ℃,高溫制曲不僅可以提供用于芝麻香型白酒發酵的各種微生物和酶,還可以形成包括呋喃、吡喃、吡嗪和醛類等在內的多種風味物質成分[10,20]。目前,研究發現與芝麻香型白酒釀造相關的芽孢桿菌屬種類主要涉及枯草芽孢桿菌(Bacillus subtilis)、嗜熱芽孢桿菌(Bacillus thermophilus)、臘狀芽孢桿菌(Bacillus cereus)、地衣芽孢桿菌(Bacillus licheniformis)、解淀粉芽孢桿菌(Bacillus amyloliquefaciens)等,其中以嗜熱芽孢桿菌為主[21-22]。
菌株Q2B1是前期在芝麻香型白酒高溫大曲微生物群落結構與多樣性的研究中分離獲得的,并發現以其為代表菌株的微生物類群是供試大曲樣品的優勢菌[23]。芝麻香主體香是在醛、醇、酸、酯達到一定比例后再輔以一些雜環化合物以及含硫化合物而形成的復合香[24],而這些風味物質的形成必須通過降解原料中蛋白質、淀粉等在內的多種大分子物質并經多步化學反應得到,因此芝麻香型白酒釀造過程中相關酶類物質的產生對于這種復合香的形成具有很重要的意義。本研究以菌株Q2B1為研究對象,利用分子生物學鑒定方法明確其菌種分類學地位,并對其產生蛋白酶和淀粉酶的能力與活性進行檢測,還利用全基因組學測序與分析技術富集與探尋與該菌株產生蛋白酶和淀粉酶的能力相關的功能基因與代謝通路,以期在基因組水平揭示其產酶相關的分子機制。
1 材料與方法
1.1 材料與試劑
1.1.1 菌株
貝萊斯芽孢桿菌(Bacillus velezensis)Q2B1:本實驗室在芝麻香型白酒大曲中分離并保存。
1.1.2 化學試劑
葡萄糖(分析純)、3,5-二硝基水楊酸(dinitrosalicylic acid,DNS)(分析純):北京化工廠;可溶性淀粉(生化試劑):北京西隴化工有限公司;脫脂奶粉:黑龍江省完達山乳業股份有限公司;聚合酶鏈式反應(polymerase chain reaction,PCR)Mix、脫氧核糖核酸(deoxyribonucleic acid,DNA)Marker:北京全式金生物技術公司;細菌基因組提取試劑盒:天根生化科技(北京)有限公司;PCR引物由北京諾賽生物公司合成。
1.1.3 培養基
LB液體固培養基:北京陸橋技術股份有限公司。
1.2 儀器與設備
FTC-3000P型實時熒光定量PCR儀:加拿大Funglyn Biotech公司;GelDocEZ型凝膠成像系統:美國Bio-Rad公司;DYY-8C型電泳儀:北京六一生物科技有限公司;BPH-9402精密恒溫培養箱:上海一恒科學儀器有限公司;VS-840-1超凈工作臺:上海博迅實業有限公司;YX-280A手提式壓力蒸汽滅菌器:合肥華泰集團有限公司。
1.3 實驗方法
1.3.1 菌株Q2B1的分子生物學鑒定
利用細菌基因組提取試劑盒提取菌株Q2B1基因組DNA,并以提取獲得的DNA為模板,采用16S rRNA基因擴增引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')[25]以及gyrA基因擴增引物BS-gyrA-F(5'-CAGTCAGGAAATGCGTACGTCTT-3')和BS-gyrA-R(5'-CAAGGTAATGCTCCAGGCATTGCT-3')[26]。16S rRNA和gyrA基因擴增條件為94 ℃,5 min;94 ℃,1 min,55 ℃,1 min,72 ℃,1.5 min,30個循環;72 ℃,10 min。擴增產物經1.0%瓊脂糖凝膠電泳檢測后,由北京諾賽基因組研究中心有限公司完成測序。測序結果在EzBioCloud數據庫[27]和GenBank數據庫中進行比對分析,利用CLUSTAL_X v1.8對菌株Q2B1及其若干近緣種的16S rRNA和gyrA基因序列進行比對與長度均一化處理[28],并利用MEGA 5軟件的鄰接(neighbor-joining,N-J)法構建上述兩個基因的系統發育樹與進行系統發育分析[29]。
1.3.2 菌株Q2B1最適生長溫度的測定
設置4 ℃、20 ℃、28 ℃、37 ℃、45 ℃、52 ℃、60 ℃、65 ℃共8個溫度梯度,將菌株Q2B1接種于LB培養基平板中并分別置于不同溫度梯度中培養48 h,觀察最終各平板有無菌落產生及菌落大小來確定其最適的生長溫度。
1.3.3 菌株Q2B1產淀粉酶與蛋白酶活性定性檢測
將菌株接種在含1%淀粉LB瓊脂培養基平板上,置于30 ℃培養48 h后,在培養基平板上滴加適量碘液,由于碘液可使添加可溶性淀粉的培養基變藍,因此若菌落周圍呈現透明圈,則表示該菌株產生淀粉酶并分解平板中的淀粉;將菌株接種在含1%的脫脂奶粉的LB瓊脂培養基平板上,置于30 ℃培養48 h,由于培養基添加脫脂奶粉使平板含有大量的蛋白質,呈現乳白色,若菌落周圍出現透明圈,則表示該菌株能夠產生蛋白酶分解平板中脫脂奶粉的蛋白成分。
1.3.4 菌株Q2B1產淀粉酶與蛋白酶活性定量檢測
葡萄糖標準曲線的繪制:配制葡萄糖溶液質量濃度分別為0.2mg/mL、0.4mg/mL、0.6mg/mL、0.8mg/mL、1.0mg/mL,在試管中精確加入0.5 mL標準葡萄糖糖溶液和1.5 mL DNS試劑,在沸水中煮沸15 min,之后冷卻,并加入10.5 mL蒸餾水,充分搖勻后,在波長550 nm條件下測吸光度值A。以葡萄糖含量(x)為橫坐標,以吸光度值(y)A550nm為縱坐標,繪制葡萄糖標準曲線,得到標準曲線回歸方程為y=0.701 1x+0.100 7,相關系數R2為0.998 03。
菌株Q2B1淀粉酶活力的定量測定參照DNS法進行[30]:1 mL適當稀釋的酶液加入9 mL的1%淀粉緩沖液(pH5.5)中,50 ℃恒溫水浴中反應20 min,迅速吸取0.5 mL反應液加入1.5 mL DNS試劑中,終止反應,在波長520 nm條件下測定吸光度值。按照葡萄糖標準曲線回歸方程計算生成還原糖(以葡萄糖計)含量。淀粉酶活力單位定義為1 mL粗酶液(或1 g固體發酵物)在pH 5.0、50 ℃的條件下,1 h水解1.0%淀粉液生成1 μmol葡萄糖為1個酶活力(U/mL)。菌株Q2B1蛋白酶活力按照GB/T 23527—2009《蛋白酶制劑》中的酸性蛋白酶檢測方法進行定量測定,蛋白酶的活力單位定義為在一定pH值(pH 3.6或7.0)和40 ℃溫度條件下,每分鐘水解酪蛋白產生1 μg酪氨酸定義為一個蛋白酶活力單位[30](U/mL)。
1.3.5 菌株Q2B1的全基因組測序與生信分析
將基因組DNA經Covaris破碎儀隨機打斷成長度為350 bp的片段,經末端修復和加A尾后在片段兩端分別連接接頭制備DNA文庫,文庫構建完成后,先使用Qubit 2.0進行初步定量,隨后使用Agilent 2100對文庫的進行檢測,符合預期后,使用定量實時聚合酶鏈反應(quantitative-real time-polymerase chain reaction,Q-RT-PCR)方法對文庫的有效濃度(2 nmol/L)進行準確定量,以保證文庫質量。庫檢合格,根據文庫的有效濃度及數據產出需求進行Illumina HiSeq PE150測序。測序結果經過堿基質量分布和kmer分布分析等質量控制后,低質量的測序讀長(low quality reads)被過濾掉;采用spade程序對質控后得到的可用測序數據進行基因組序列拼裝[31],并對拼接后數據進行評價,最終選取>500 bp的scaffold序列進行后續分析。后續生信分析主要涉及非編碼核糖核酸(ribonucleic acid,RNA)預測[32-33]、蛋白編碼基因的預測[34]、蛋白編碼基因的基因本體(gene ontology,GO)和直源同源群集(clusters of orthologous groups,COG)注釋[35],以及蛋白編碼基因的《京都基因和基因組百科全書》(kyoto encyclopedia of genes and genomes,KEGG)注釋[36]等,并通過GO與KEGG注釋富集與探尋與該菌株產生蛋白酶和淀粉酶的能力相關的功能基因與代謝通路。
2 結果與分析
2.1 菌株Q2B1的分子生物學鑒定結果
菌株Q2B1的16S rRNA和gyrA基因擴增產物全長分別為1 429 bp和949 bp,并將序列提交至GenBank,登錄號分別為MK629006和MK642700。通過菌株Q2B1與其近緣菌種模式菌株的16S rRNA基因序列的比對分析顯示,Q2B1與Bacillus siamensisKCTC 13613T的序列相似性最高,為99.79%;Q2B1與Bacillus屬中16S rRNA基因序列相似度高于99.30%的其他近緣菌種模式菌株依次為貝萊斯芽孢桿菌(Bacillus velezensis)CR-502T(99.78%)、Bacillus subtilissubsp.stercorisD7XPN1T(99.68%)、枯草芽孢桿菌枯草亞種(Bacillus subtilissubsp.subtilis)NCIB 3610T(99.65%)、解淀粉芽孢桿菌(Bacillus amyloliquefaciens)DSM 7T(99.51%)、中村芽孢桿菌(Bacillusnakamurai)NRRLB-41091T(99.51%)、特基拉芽孢桿菌(Bacillustequilensis)KCTC13622T(99.44%)、枯草芽孢桿菌沙漠亞種(Bacillus subtilissubsp.inaquosorum)KCTC 13429T(99.44%)和死亡谷芽孢桿菌(Bacillus vallismortis)DV1-F-3T(99.37%)。利用上述近緣菌種模式菌株并選擇嗜鹽桿菌(Halobacillushalophilus)DSM2266T(HE717023)作為外群,構建菌株Q2B1與模式菌株的16S rRNA和gyrA基因系統發育樹,結果見圖1和圖2。

圖1 基于16S rRNA序列菌株Q2B1的系統發育樹Fig.1 Phylogenetic tree of strain Q2B1 based on 16S rRNA sequences
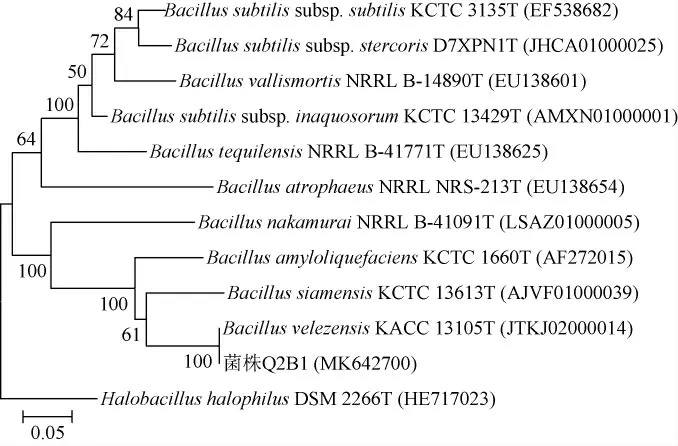
圖2 基于gyrA基因菌株Q2B1的系統發育樹Fig.2 Phylogenetic tree of strain Q2B1 based on gyrA gene
由圖1可知,16S rRNA基因系統發育分析確定菌株Q2B1歸屬為芽孢桿菌屬(Bacillus);由圖2可知,通過gyrA基因系統發育分析,結果顯示菌株Q2B1與Bacillus velezensisCR-502T在系統發育樹中聚在了一個單獨的分支,可將其鑒定為貝萊斯芽孢桿菌(Bacillus velezensis)。
2.2 菌株Q2B1在不同溫度條件下生長狀況
菌株Q2B1接種于LB培養基平板,分別置于4 ℃、20 ℃、28 ℃、37 ℃、45 ℃、52 ℃、60 ℃、65 ℃共8個溫度梯度條件下培養48 h后觀察菌株菌體在培養基上生長情況,結果見表1。由表1可知,菌株Q2B1能夠在試驗設定的28~52 ℃溫度范圍生長,最適生長溫度為45 ℃。結果表明,菌株Q2B1可以在芝麻香型白酒高溫大曲制曲過程中在較寬的溫度范圍隨制曲溫度的逐步升高而得到富集與積累,但到達制曲溫度的峰值(60~65 ℃)附近,菌體的生長受到了限制。

表1 不同溫度條件下菌株Q2B1的生長狀況Table 1 Growth status of strain Q2B1 under different temperature conditions
2.3 菌株Q2B1產淀粉酶與蛋白酶活性定性定量檢測結果
菌株Q2B1接種于含1%的淀粉和脫脂奶粉的LB瓊脂培養基平板,置于30 ℃培養48 h,結果見圖3。由圖3可知,菌株Q2B1能夠在含有淀粉和脫脂奶粉的LB平板上生長良好,由于菌株在生長過程中產生能夠分解蛋白質和可溶性淀粉的酶,因此明顯觀察到加入脫脂奶粉的平板上菌體周圍產生了透明圈,加入可溶性淀粉的平板在滴加碘液后菌體周圍形成明顯的透明圈。菌株Q2B1具有產淀粉酶與蛋白酶的能力,其酶活力測定結果分別為5.852 U/mL和26.770 U/mL,這也說明這株菌很可能對芝麻香型白酒風味的形成產生。

圖3 菌株Q2B1產淀粉酶(A)和蛋白酶(B)活性的效果Fig.3 Effect of amylase (A) and protease (B) activity by strain Q2B1
2.5 菌株Q2B1的全基因組測序與分析結果
基于基因組測序結果的生物信息學分析結果見圖4。由圖4可知,菌株Q2B1基因組全長為3 475 602 bp,注釋獲得基因總數3 749個,GC含量為46.43%;rRNA與tRNA基因數目經過預測分別為10個和80個;通過蛋白編碼基因的GO和COG注釋,發現參與菌株代謝過程和催化活性,尤其是與能量產生與轉換、碳水化合物轉運和代謝與催化過程相關的基因數目明顯較高。此外,蛋白編碼基因的KEGG注釋結果也能夠反映出菌株Q2B1在生物合成與參與代謝等方面相關的代謝通路與反應網絡相對集中,其中代謝通路中注釋獲得的與氨基酸和碳水化合物代謝相關的基因數量最多,分別為176和198個,這與該菌株具有產蛋白酶和淀粉酶活力的實驗結果相符合。通過基因注釋發現,在菌株Q2B1基因組中編碼蛋白酶的基因包括多種肽酶(谷氨酰氨肽酶、甲硫氨酰氨肽酶、PfpI肽酶、Gpr肽酶、AprX肽酶、RseP肽酶、IspA肽酶、HtpX肽酶等)、轉肽酶、信號肽酶、D-Ala-D-Ala羧肽酶、氨基甲酰磷酸合成酶、γ-聚谷氨酸水解酶、D-氨基肽酶、γ-谷氨酰轉移酶、谷氨酸合成酶、膠原蛋白水解酶和氨基脫氧膽酸鹽合成酶等編碼基因;基因組中編碼淀粉酶的基因包括α-淀粉酶和麥芽糖淀粉酶等編碼基因。這些注釋獲得的編碼基因及其相關的代謝通路能夠在基因組水平揭示菌株Q2B1具有合成蛋白酶和淀粉酶能力的分子機制。
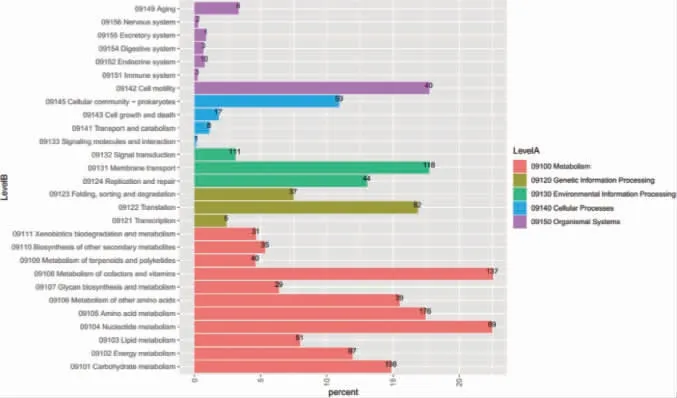
圖4 菌株Q2B1的KEGG代謝通路注釋圖Fig.4 Annotated map of KEGG metabolic pathway of strain Q2B1
3 結論
本研究在前期關于芝麻香型白酒高溫大曲微生物群落結構與多樣性的研究基礎上,以分離自供試大曲樣品的絕對優勢菌代表菌株Q2B1為研究對象,通過分子鑒定技術將菌株Q2B1鑒定為貝萊斯芽孢桿菌(Bacillus velezensis),并通過平板實驗檢測到該菌具有產生蛋白酶和淀粉酶的活性,其淀粉酶與蛋白酶活力分別為5.852 U/mL和26.770 U/mL;同時利用全基因組學測序與分析技術富集與探尋得到其產生蛋白酶和淀粉酶的能力相關的功能基因與部分代謝通路,菌株Q2B1基因組全長為3 475 602 bp,通過基因注釋發現在菌株Q2B1基因組中存在肽酶、轉肽酶、羧肽酶、氨基甲酰磷酸合成酶等蛋白酶編碼基因,以及α-淀粉酶和麥芽糖淀粉酶等淀粉酶編碼基因,實現在菌株Q2B1基因組水平揭示其產酶相關的分子機制。

