大腸桿菌分泌表達(dá)裂解性多糖單加氧酶發(fā)酵條件的優(yōu)化
郭宵,安亞靜,柴成程,路福平,劉夫鋒
(工業(yè)發(fā)酵微生物教育部重點(diǎn)實(shí)驗(yàn)室,天津市工業(yè)微生物重點(diǎn)實(shí)驗(yàn)室,工業(yè)酶國(guó)家工程實(shí)驗(yàn)室,天津科技大學(xué) 生物工程學(xué)院,天津,300457)
木質(zhì)纖維素類(lèi)生物質(zhì)是地球上含量最豐富的可再生資源,包括纖維素(40%~50%)、半纖維素(20%~40%)和木質(zhì)素(20%~30%),在能源轉(zhuǎn)化方面具有廣泛的應(yīng)用前景。纖維素是木質(zhì)纖維素中含量最多的組分,通過(guò)降解后可以生成不同的寡糖,其中可發(fā)酵糖可以發(fā)酵生成乙醇,緩解石油資源緊張這一現(xiàn)狀[1-3]。在一般情況下,纖維素以不溶的晶體狀態(tài)存在于自然界中。但是目前存在纖維素酶對(duì)晶體狀態(tài)的纖維素降解效率較低的問(wèn)題[4-8]。然而最近發(fā)現(xiàn)了一種裂解性多糖單加氧酶(lytic polysaccharide monooxygenases, LPMOs)可以降解晶體狀態(tài)的纖維素[9]。LPMOs是一種銅離子依賴型的氧化酶,可以通過(guò)氧化斷裂糖苷鍵的方式降解晶體纖維素[9-11]。而且研究表明,當(dāng)LPMOs與纖維素酶協(xié)同作用時(shí),可以顯著提高對(duì)纖維素的水解效率[10, 12]。
根據(jù)LPMOs的序列相似性可將其分為7個(gè)家族,分別為AA9-AA11[13-15]和AA13-AA16[16-19]。其中AA9家族主要降解纖維素,由于纖維素是木質(zhì)纖維素中含量最豐富的組分,因此AA9家族是轉(zhuǎn)化木質(zhì)纖維素生物質(zhì)為生物燃料的關(guān)鍵[10, 20]。其中來(lái)源于真菌嗜熱毀絲霉(MyceliophthorathermophileC1)的MtC1LPMO (GenBank: AKO82493.1)蛋白,以C1和C4兩種氧化方式斷裂纖維素的糖苷鍵,同時(shí)纖維素存在時(shí),可以斷裂木聚糖的糖苷鍵[21]。因?yàn)槟揪厶鞘前肜w維素的組成部分,而半纖維素是木質(zhì)纖維素的重要組分[22]。半纖維素包裹著纖維素極大地阻礙了工業(yè)酶制劑對(duì)纖維素的降解。因此,對(duì)半纖維素的降解也是高效利用生物質(zhì)的關(guān)鍵。
MtC1LPMO在生物質(zhì)轉(zhuǎn)化過(guò)程中具有重要的作用,這類(lèi)酶價(jià)值高且需求量較大,因此異源表達(dá)是一種非常有效的供應(yīng)手段。大腸桿菌作為人們研究的最深入的微生物之一,是生產(chǎn)重組蛋白最常用的宿主,為許多外源蛋白提供了最經(jīng)濟(jì)快速的表達(dá)系統(tǒng)[23-25]。但是大腸桿菌中表達(dá)的蛋白質(zhì)常常在細(xì)胞質(zhì)中以包涵體的形式積累[25-27]。因此,不同的信號(hào)肽被廣泛用于將外源蛋白輸出到大腸桿菌胞質(zhì)空間或者直接分泌到胞外培養(yǎng)基中[26, 28]。如來(lái)源于蘇云金芽孢桿菌的BtLPMO10A利用載體自身信號(hào)肽實(shí)現(xiàn)了在大腸桿菌胞內(nèi)的可溶性表達(dá)[29];來(lái)源于粘質(zhì)沙雷氏菌的CBP21(LPMO10)通過(guò)不同的信號(hào)肽嘗試,最終實(shí)現(xiàn)了在大腸桿菌的胞外表達(dá)[30]。但是目前利用大腸桿菌分泌表達(dá)真菌來(lái)源LPMO的相關(guān)研究較少。實(shí)現(xiàn)重組蛋白在大腸桿菌中的胞外表達(dá),可以簡(jiǎn)化下游處理工藝,因此酶的胞外表達(dá)可以降低工業(yè)生產(chǎn)的成本,提高工業(yè)應(yīng)用的經(jīng)濟(jì)效益。
為了進(jìn)一步研究MtC1LPMO,該研究利用大腸桿菌將MtC1LPMO進(jìn)行異源表達(dá),實(shí)現(xiàn)MtC1LPMO在大腸桿菌中的分泌表達(dá),提高了可溶性目標(biāo)蛋白的總含量。最后通過(guò)優(yōu)化培養(yǎng)條件和誘導(dǎo)參數(shù)來(lái)獲得MtC1LPMO在大腸桿菌的最大化生產(chǎn)。
1 材料與方法
1.1 材料與試劑
大腸桿菌JM109、BL21(DE3),pET22b表達(dá)載體質(zhì)粒保存于本實(shí)驗(yàn)室;高保真DNA聚合酶、T4 DNA連接酶和限制性內(nèi)切酶NdeI、XhoI均購(gòu)自大連寶生物公司;質(zhì)粒小量提取試劑盒、膠回收試劑盒購(gòu)自北京索來(lái)寶科技有限公司;2,6-二甲氧基苯酚購(gòu)自上海源葉生物科技有限公司。其他未注明試劑均為分析純,購(gòu)自上海生工生物工程股份有限公司。
1.2 儀器與設(shè)備
ZXGP-B2080隔水恒溫箱、ZHJH-C1106C超凈工作臺(tái),上海智城分析儀器制造有限公司;Mastercycler nexus PCR儀,德國(guó)eppendorf公司;Multifuge X1R高速冷凍離心機(jī)、NanoDrop 2000蛋白核酸定量?jī)x,美國(guó)ThermoFisher Scientific公司;可見(jiàn)分光光度計(jì),上海精科實(shí)業(yè)有限公司。
1.3 pET22b-MtC1LPMO不同信號(hào)肽載體的構(gòu)建
首先根據(jù)大腸桿菌宿主密碼子偏好性進(jìn)行密碼子優(yōu)化后合成MtC1LPMO基因,然后在C端添加(His)6標(biāo)簽。根據(jù)2個(gè)不同的信號(hào)肽構(gòu)建2個(gè)不同的載體,1個(gè)是MtC1LPMO基因本身的信號(hào)肽(MLTTTFALLTAALGVSA),另1個(gè)是pET22b載體上的PelB信號(hào)肽(MKYLLPTAAAGLLLLAAQPAMA)。將MtC1LPMO成熟肽分別與2個(gè)不同的信號(hào)肽連接,然后插入到pET22b的NdeI 和XhoI 2個(gè)限制性酶切位點(diǎn)之間。最終經(jīng)測(cè)序正確的質(zhì)粒命名為pET22b-MtC1LPMO。
1.4 信號(hào)肽對(duì)MtC1LPMO表達(dá)的影響
構(gòu)建好的pET22b-MtC1LPMO質(zhì)粒轉(zhuǎn)入大腸桿菌EscherichiacoliBL21 (DE3)細(xì)胞中,然后在LB (lysogeny broth)瓊脂平板37 ℃培養(yǎng)過(guò)夜。挑取單克隆接入含氨芐霉素的5 mL的LB試管中培養(yǎng)12 h,然后以2%的接種量接種到含有氨芐霉素的LB培養(yǎng)基中進(jìn)行發(fā)酵。當(dāng)培養(yǎng)基OD600達(dá)到0.6時(shí),添加異丙基-β-D-硫代半乳糖苷(isopropyl β-D-1-thiogalactopyranoside, IPTG)至終濃度為0.5 mmol/L,然后置于16 ℃發(fā)酵16 h或者30 ℃發(fā)酵4 h。發(fā)酵結(jié)束后,培養(yǎng)基和細(xì)胞在4 ℃通過(guò)8 000 r/min離心10 min進(jìn)行分離,獲得的細(xì)胞重懸于裂解緩沖液buffer A (20 mmol/L Tris-HCl pH 7.4, 20 mmol/L 咪唑, 500 mmol/L NaCl, 1 mmol/L DTT)。添加1%的溶菌酶后在冰上孵育30 min,然后通過(guò)超聲破碎(功率250 W,開(kāi)啟2.5 s,關(guān)閉3 s,總時(shí)間15 min)將細(xì)胞進(jìn)行裂解。上清和沉淀通過(guò)12 000 r/min離心30 min進(jìn)行分離。測(cè)定不同組分中目標(biāo)蛋白的含量及純度,分析不同信號(hào)肽對(duì)MtC1LPMO表達(dá)的影響。
1.5 重組MtC1LPMO表達(dá)條件優(yōu)化
1.5.1 優(yōu)化誘導(dǎo)時(shí)間
將含有PelB信號(hào)肽pET22b-MtC1LPMO重組質(zhì)粒的大腸桿菌表達(dá)宿主E.coliBL21 (DE3)在LB培養(yǎng)基發(fā)酵。為了獲得種子培養(yǎng)基,挑取單菌落于5 mL的含有100 mg/L氨芐霉素的LB試管中220 r/min培養(yǎng)12 h。然后以2%的接種量分別接種到含有100 mg/L氨芐霉素的LB三角瓶培養(yǎng)基中于37 ℃進(jìn)行發(fā)酵。當(dāng)培養(yǎng)基OD600分別達(dá)到0.3、0.6、0.9、1.2和1.5時(shí)添加IPTG終濃度至0.5 mmol/L誘導(dǎo)重組MtC1LPMO表達(dá)。添加IPTG后將培養(yǎng)基置于30 ℃,200 r/min發(fā)酵4 h。發(fā)酵結(jié)束后,發(fā)酵液與細(xì)胞通過(guò)離心進(jìn)行分離(8 000 r/min, 4 ℃, 10 min)。
1.5.2 優(yōu)化IPTG誘導(dǎo)濃度
將上述的種子培養(yǎng)基以2%的接種量分別接種到含有100 mg/L氨芐霉素的LB三角瓶培養(yǎng)基中于37 ℃進(jìn)行發(fā)酵。當(dāng)培養(yǎng)基OD600達(dá)到0.9時(shí),添加IPTG終濃度分別為0.05、0.1、0.25、0.5和1 mmol/L。然后將培養(yǎng)基置于30 ℃,200 r/min發(fā)酵4 h。發(fā)酵結(jié)束后,發(fā)酵液與細(xì)胞通過(guò)離心進(jìn)行分離(8 000 r/min, 4 ℃, 10 min)。
1.5.3 優(yōu)化誘導(dǎo)溫度及表達(dá)時(shí)間
將上述的種子培養(yǎng)基以2%的接種量分別接種到含有100 mg/L氨芐霉素的LB三角瓶培養(yǎng)基中于37 ℃進(jìn)行發(fā)酵。當(dāng)培養(yǎng)基OD600達(dá)到0.9時(shí),添加IPTG終濃度為0.5 mmol/L,然后將培養(yǎng)基分別置于16、30、37 ℃下分別發(fā)酵4、8和16 h。發(fā)酵結(jié)束后,發(fā)酵液與細(xì)胞通過(guò)離心進(jìn)行分離(8 000 r/min, 4 ℃, 10 min)。
1.5.4 優(yōu)化乙醇濃度
將上述的種子培養(yǎng)基以2%的接種量分別接種到含有100 mg/L氨芐霉素的LB三角瓶培養(yǎng)基中于37 ℃進(jìn)行發(fā)酵。當(dāng)培養(yǎng)基OD600達(dá)到0.9時(shí),添加IPTG終濃度為0.5 mmol/L,同時(shí)分別添加乙醇至最終體積分?jǐn)?shù)為0%、1%、2%、3%、4%。然后將培養(yǎng)基在30 ℃下發(fā)酵16 h。發(fā)酵結(jié)束后,發(fā)酵液與細(xì)胞通過(guò)離心進(jìn)行分離(8 000 r/min, 4 ℃, 10 min)。重組蛋白表達(dá)條件優(yōu)化實(shí)驗(yàn)重復(fù)了3次。
1.6 重組MtC1LPMO蛋白可溶性表達(dá)及純化
將上述收集的細(xì)胞重懸于裂解緩沖液buffer A。添加1%的溶菌酶后在冰上孵育30 min,然后通過(guò)超聲破碎將細(xì)胞進(jìn)行裂解。上清和沉淀通過(guò)12 000 r/min離心30 min進(jìn)行分離。
將收集的發(fā)酵液與細(xì)胞可溶性上清分別用0.22 μm濾膜(Millipore, Molsheim, France)過(guò)濾后,分別與Ni-NTA樹(shù)脂(Qiagen, Hilden, Germany)進(jìn)行結(jié)合。結(jié)合之前樹(shù)脂用buffer A進(jìn)行平衡。然后用清洗液buffer B (20 mmol/L Tris-HCl, pH 7.4, 500 mmol/L NaCl, 50 mmol/L咪唑, 1 mmol/L DTT)進(jìn)行洗脫,最后用洗脫液buffer C (20 mmol/L Tris-HCl, pH 8.0, 500 mmol/L NaCl, 500 mmol/L 咪唑, 1 mmol/L DTT)洗脫帶(His)6標(biāo)簽的重組蛋白MtC1LPMO。收集純化的蛋白溶液,用Nanodrop ND-2000 spectrophotometer (Thermo Fisher Scientific) 在280 nm下測(cè)定蛋白質(zhì)濃度,用12%的蛋白膠進(jìn)行SDS-PAGE分析蛋白的純度[31],洗脫的蛋白用pH 6.0,20 mmol/L的磷酸緩沖液進(jìn)行透析。
1.7 重組MtC1LPMO酶活力分析
酶活力測(cè)定基于2,6-二甲氧基苯酚(2,6-dimethoxyphenol: 2,6-DMP)和H2O2作為共底物[32]。1 mL 反應(yīng)體系包含860 μL 116 mmol/L pH 7.5磷酸緩沖液,100 μL 10 mmol/L 2,6-DMP溶液,20 μL 5 mmol/L H2O2原液和20 μL純化的MtC1LPMO。酶活力在469 nm下測(cè)定反應(yīng)300 s的前后吸光值的變化來(lái)計(jì)算,0.5 μM CuSO4作為空白對(duì)照。一個(gè)單位酶活力定義為反應(yīng)條件下每分鐘生成1 μmol氧化產(chǎn)物[ε469= 53 200 (M·cm)-1。
2 結(jié)果與分析
2.1 重組質(zhì)粒的構(gòu)建
由于不同的信號(hào)肽對(duì)蛋白的表達(dá)水平有不同的影響。因此,首先研究了2種不同信號(hào)肽對(duì)MtC1LPMO表達(dá)水平的影響。首先,利用SignalP 4.0[33]網(wǎng)頁(yè)分析了MtC1LPMO自身的信號(hào)肽為MLTTTFALLTAALGVSA,將其作為第1種信號(hào)肽構(gòu)建至質(zhì)粒中。第2個(gè)信號(hào)肽是PelB信號(hào)肽,其是CBP21 (LPMO10)在大腸桿菌中表達(dá)量最高的信號(hào)肽,氨基酸序列為MKYLLPTAAAGLLLLAAQPAMA[30]。因此,選擇PelB信號(hào)肽構(gòu)建到質(zhì)粒中來(lái)表達(dá)MtC1LPMO,以期待提高重組MtC1LPMO的分泌表達(dá)水平。因此,以上述2種信號(hào)肽分別構(gòu)建表達(dá)載體,質(zhì)粒圖譜如圖1-A和圖1-B所示。

A-含有MtC1LPMO自身信號(hào)肽的表達(dá)載體; B-含有PelB信號(hào)肽的表達(dá)載體; C-PCR驗(yàn)證結(jié)果; D-NdeI 和XhoI雙酶切驗(yàn)證結(jié)果;M-1kb Marker; Lane 1-質(zhì)粒pET22b-MtC1LPMO-1; Lane 2-質(zhì)粒pET22b-MtC1LPMO-2
將重組質(zhì)粒分別用PCR擴(kuò)增和雙酶切鑒定,然后進(jìn)行瓊脂糖凝膠電泳檢測(cè),結(jié)果如圖1-C和圖1-D所示,2個(gè)質(zhì)粒的PCR擴(kuò)增條帶均為單一條帶,且NdeI 和XhoI雙酶切也出現(xiàn)正確的目標(biāo)條帶。測(cè)序結(jié)果也進(jìn)一步證實(shí)重組載體pET22b-MtC1LPMO構(gòu)建成功。
2.2 不同信號(hào)肽對(duì)MtC1LPMO表達(dá)的影響
為了分析不同的信號(hào)肽及發(fā)酵溫度對(duì)重組MtC1LPMO表達(dá)水平的影響,將含有不同信號(hào)肽重組質(zhì)粒的表達(dá)宿主分別在16 ℃發(fā)酵16 h或30 ℃發(fā)酵4 h表達(dá)目標(biāo)蛋白。結(jié)果如圖2所示,SDS-PAGE結(jié)果顯示目標(biāo)蛋白主要存在于包涵體中(圖2,泳道6),發(fā)酵液和細(xì)胞中的可溶性MtC1LPMO比較少。
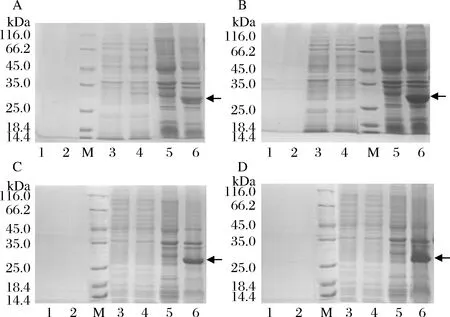
A, B-MtC1LPMO自身信號(hào)肽; C, D-PelB信號(hào)肽; A, C-16 ℃發(fā)酵; B, D-30 ℃發(fā)酵;M-標(biāo)準(zhǔn)蛋白; 條帶1, 3, 5-BL21原始菌發(fā)酵液,菌體上清,菌體沉淀; 條帶2, 4, 6-pET22b-MtC1LPMOBL21發(fā)酵液,菌體上清液,菌體沉淀
為了進(jìn)一步獲得有活性的可溶性MtC1LPMO,將培養(yǎng)基發(fā)酵液與細(xì)胞可溶性上清中的目標(biāo)蛋白利用Ni樹(shù)脂進(jìn)行純化,然后利用SDS-PAGE進(jìn)行蛋白純度檢測(cè),結(jié)果如圖3所示。MtC1LPMO自身信號(hào)肽表達(dá)的蛋白只存在于細(xì)胞可溶性上清中(泳道2和4),而PelB信號(hào)肽表達(dá)的蛋白存在于發(fā)酵液與細(xì)胞可溶性上清中(泳道5~8),而且由于發(fā)酵液中雜蛋白比較少,所以純化得到的目標(biāo)蛋白純度更高。測(cè)定不同體系的蛋白濃度,30 ℃下PelB信號(hào)肽表達(dá)的發(fā)酵液中(圖3,泳道7)的目標(biāo)蛋白含量最高。此外,目標(biāo)蛋白分泌到細(xì)胞外,工業(yè)應(yīng)用中其下游處理則更為簡(jiǎn)單,可以降低工業(yè)生產(chǎn)成本。因此在這種情況下,需要進(jìn)一步優(yōu)化E.coliBL21(pET22b-PelB-MtC1LPMO)的發(fā)酵條件,來(lái)獲得重組MtC1LPMO更高的總產(chǎn)量及細(xì)胞外比率。

條帶1~4-MtC1LPMO自身信號(hào)肽; 條帶5~8-PelB信號(hào)肽;M-標(biāo)準(zhǔn)蛋白;條帶1, 5-16 ℃發(fā)酵液; 條帶2, 6~16 ℃菌體上清液;條帶3,7~30 ℃發(fā)酵液;條帶4,8~30 ℃菌體上清液
2.3 發(fā)酵條件的優(yōu)化
2.3.1 優(yōu)化誘導(dǎo)時(shí)間
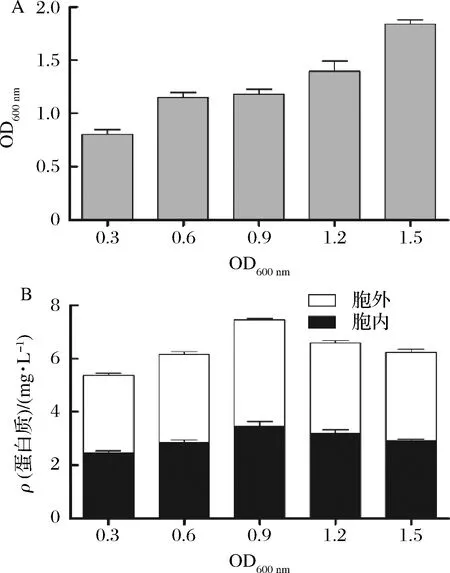
添加誘導(dǎo)劑的時(shí)間一般在菌體生長(zhǎng)的對(duì)數(shù)前期或中期[34],為了選擇合適的誘導(dǎo)時(shí)間點(diǎn),我們分別在培養(yǎng)基OD600分別達(dá)到0.3、0.6、0.9、1.2和 1.5時(shí)添加IPTG終濃度至0.5 mmol/L誘導(dǎo)重組蛋白MtC1LPMO的表達(dá)。然后將培養(yǎng)基在30 ℃,200 r/min發(fā)酵4 h。發(fā)酵結(jié)束后,測(cè)定培養(yǎng)基的菌體濃度(圖4-A),然后分別純化發(fā)酵液與細(xì)胞可溶性上清中的目標(biāo)蛋白,測(cè)定蛋白濃度(圖4-B)。由圖4-A可以看出,隨著誘導(dǎo)劑添加時(shí)的培養(yǎng)基OD600的增高,發(fā)酵結(jié)束后培養(yǎng)基OD600也是逐步增高。但是圖4-B可以看出,重組蛋白MtC1LPMO的總產(chǎn)量在OD600為0.9時(shí)達(dá)到最高,為7.46 mg/L,細(xì)胞內(nèi)外的可溶性MtC1LPMO含量都得到了一定的提高。
2.3.2 優(yōu)化IPTG濃度
由于pET22b的啟動(dòng)子是誘導(dǎo)型的T7啟動(dòng)子,因此IPTG誘導(dǎo)濃度也是影響重組蛋白產(chǎn)量的重要原因。為了得到合適的IPTG誘導(dǎo)濃度,我們?cè)谂囵B(yǎng)基OD600達(dá)到0.9時(shí),添加IPTG終濃度分別為0.05、0.1、0.25、0.5 和 1 mmol/L。然后將培養(yǎng)基置于30 ℃,200 r/min發(fā)酵4 h。然后測(cè)定培養(yǎng)基的菌體濃度(圖5-A),然后分別純化發(fā)酵液與細(xì)胞可溶性上清中的目標(biāo)蛋白,測(cè)定蛋白濃度(圖5-B)。由圖5-A可以看出,隨著IPTG濃度的增高,發(fā)酵結(jié)束的培養(yǎng)基OD600逐漸降低,這是由于IPTG對(duì)細(xì)胞有一定的毒性[35-36]。由圖5-B可以看出,總可溶性蛋白產(chǎn)量在IPTG為0.5 mmol/L時(shí)達(dá)到最高,相比于其他IPTG濃度,細(xì)胞外比率也明顯提高,為51.93%。IPTG為1 mmol/L時(shí)總的可溶性蛋白產(chǎn)量下降可能是由于菌體的減少,或者高濃度誘導(dǎo)劑條件下形成更多錯(cuò)誤折疊的包涵體。
A-發(fā)酵結(jié)束的菌體濃度; B-可溶性蛋白產(chǎn)量

A-發(fā)酵結(jié)束的菌體濃度; B-可溶性蛋白產(chǎn)量
2.3.3 優(yōu)化誘導(dǎo)溫度及表達(dá)時(shí)間
為了確定合適的誘導(dǎo)溫度及表達(dá)重組蛋白的時(shí)間,當(dāng)培養(yǎng)基在OD600達(dá)到0.9時(shí),添加IPTG終濃度為0.5 mmol/L后,分別置于16、30、37 ℃下分別發(fā)酵4、8和16 h。發(fā)酵結(jié)束后分別測(cè)定培養(yǎng)基的菌體濃度(圖6-A),然后分別純化發(fā)酵液與細(xì)胞可溶性上清中的目標(biāo)蛋白,測(cè)定蛋白濃度(圖6-B)。由圖6-A可以看出,同一個(gè)的溫度下,菌體濃度和蛋白產(chǎn)量都隨著時(shí)間的增長(zhǎng)而增高。但是不同的溫度差異明顯,其中30 ℃發(fā)酵16 h的菌體濃度和蛋白產(chǎn)量是所有優(yōu)化方案中最高的,總可溶性蛋白產(chǎn)量為10.49 mg/L,其中分泌至細(xì)胞外的蛋白產(chǎn)量為6.51 mg/L,細(xì)胞外比率為62.00%。

A-發(fā)酵結(jié)束的菌體濃度; B-可溶性蛋白產(chǎn)量
2.3.4 氧化應(yīng)激
利用乙醇氧化應(yīng)激是以往研究中用于重組蛋白過(guò)表達(dá)的一種策略[37]。在本研究中,研究了不同體積分?jǐn)?shù)的乙醇對(duì)可溶性重組蛋白產(chǎn)量的影響。在添加IPTG的同時(shí)分別在不同的培養(yǎng)基添加乙醇至終體積分?jǐn)?shù)為0%、1%、2%、3%、4%。然后在上述最優(yōu)條件下發(fā)酵,發(fā)酵結(jié)束后的菌體濃度隨著乙醇體積分?jǐn)?shù)增高而降低(圖7-A),總可溶性蛋白含量在添加乙醇終體積分?jǐn)?shù)為2%時(shí)達(dá)到最高(圖7-B),為12.65 mg/L,其中細(xì)胞外蛋白含量也達(dá)到了最高,為8.51 mg/L,細(xì)胞外比率為67.30%。當(dāng)乙醇添加更高時(shí)蛋白產(chǎn)量的下降可能是由于高濃度乙醇抑制了菌體的生長(zhǎng),導(dǎo)致重組酶的產(chǎn)率下降。

A-發(fā)酵結(jié)束的菌體濃度; B-可溶性蛋白產(chǎn)量
2.4 MtC1LPMO酶活力分析
最終優(yōu)化方案獲得的重組MtC1LPMO蛋白,用20 mmol/L, pH 6.0的磷酸緩沖液進(jìn)行透析后凍干,然后在文獻(xiàn)描述的標(biāo)準(zhǔn)條件下測(cè)定酶活力[32],即30 ℃,pH7.5條件下以2,6-DMP為底物測(cè)定其酶活力,經(jīng)計(jì)算比活力為10.3 U/g。來(lái)源于粗糙脈孢菌(Neurosporacrassa) 的NcLPMO9F在標(biāo)準(zhǔn)條件下以2,6-DMP為底物的比活力為2.2 U/g[32]。因此,在此標(biāo)準(zhǔn)反應(yīng)條件下,MtC1LPMO的比活力是NcLPMO9F的4.68倍。
3 結(jié)論
本研究異源表達(dá)了來(lái)源于真菌嗜熱毀絲霉的MtC1LPMO,首先構(gòu)建了不同信號(hào)肽的載體,確定了PelB信號(hào)肽可以分泌表達(dá)MtC1LPMO。為了獲得更多的胞外酶,對(duì)表達(dá)條件進(jìn)行了優(yōu)化,確定了E.coliBL21 (DE3)/ pET22b-PelB-MtC1LPMO菌株在37 ℃培養(yǎng)基OD600為0.9時(shí)添加終濃度為0.5 mmol/L的IPTG和終體積分?jǐn)?shù)為2%的乙醇,然后30 ℃誘導(dǎo)16 h,重組蛋白的可溶性表達(dá)量最高,為12.65 mg/L,為優(yōu)化前的2.05倍。且細(xì)胞外比率也達(dá)到最高,為67.30%,其比活力為10.3 U/g。
- 食品與發(fā)酵工業(yè)的其它文章
- 氣味指紋技術(shù)在水產(chǎn)品品質(zhì)評(píng)價(jià)中的應(yīng)用研究進(jìn)展
- 紫菜的營(yíng)養(yǎng)成分、功能活性及綜合利用研究進(jìn)展
- 低溫微萃取-GCMS/MS聯(lián)用技術(shù)檢測(cè)食用油中20種持久性污染物
- 黑果枸杞酵素發(fā)酵前后主要成分分析及其體外抗氧化活性研究
- 超高效液相色譜-四極桿-飛行時(shí)間質(zhì)譜快速篩查中成藥、保健品中26種非法添加化合物
- QuEChERS結(jié)合超高效液相色譜質(zhì)譜法測(cè)定禽蛋及其制品中42種農(nóng)藥及其代謝物

