鈉與硫酸銅溶液反應的探究
學習了金屬活動性順序后,我們知道排在前面的金屬能把排在后面的金屬從它們的鹽溶液中置換出來。鈉排在銅的前面,鈉能像鐵那樣把銅從硫酸銅溶液中置換出來嗎?鈉與硫酸銅溶液反應會生成什么物質呢?化學興趣小組的同學對此頗感興趣,決定一探究竟。
同學們查閱資料了解到,鈉是銀白色的軟金屬,可用小刀切割,熔點97.81 ℃,沸點882.9 ℃,密度0.97 g/cm3;鈉是一種很活潑的金屬,能跟氧氣反應,還能與水劇烈反應生成氫氧化鈉和氫氣,同時放出大量的熱;少量鈉通常保存在煤油中;難溶性堿通常在遇熱時會分解,如氫氧化銅受熱分解為氧化銅和水。
同學們設計好實驗方案,征得老師同意后,開始進行實驗:用鑷子夾取一塊鈉,用濾紙吸干表面的煤油,放在玻璃片上,用小刀切下綠豆大小的一小塊,放入盛有少量2%的硫酸銅溶液的燒杯中,觀察到鈉浮在水面上,迅速熔化成閃亮的小球,四處游動,并發出“嘶嘶”的響聲,溶液中產生藍色絮狀沉淀,還有少量黑色固體出現。
一、探究產生的氣體成分
鈉四處游動,發出“嘶嘶”聲,說明產生了氣體,那產生的氣體是什么呢?化學興趣小組的同學根據資料內容作出猜想:氣體可能是氫氣。為了驗證氣體的成分,他們在老師的指導下設計了如下圖所示實驗裝置并進行實驗。
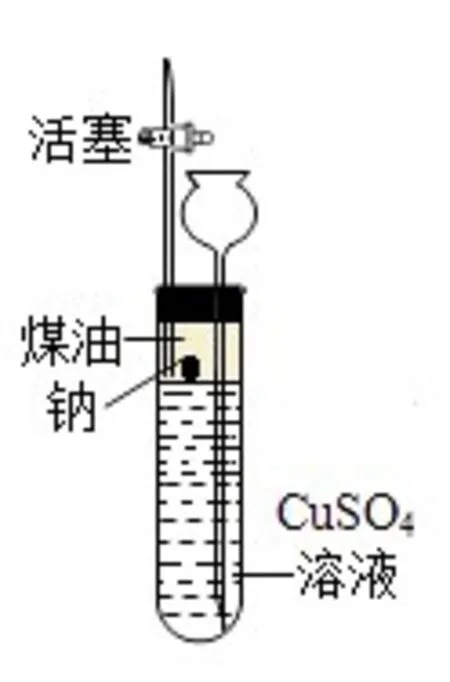
向大試管中加入高度約3 cm的煤油;用小刀切下一小塊鈉,放入大試管中,塞上橡膠塞;打開活塞,通過長頸漏斗(便于添加硫酸銅溶液,同時防止因壓強過大而沖開活塞)向試管中加入硫酸銅溶液;當煤油的液面升至橡膠塞時,關閉活塞,觀察現象。可以看到鈉在煤油與溶液交界處上下來回運動,表面產生氣泡,鈉逐漸變小直至消失,溶液顏色逐漸變淺,有藍色絮狀沉淀產生,還有少量黑色固體出現。然后打開活塞,用燃著的木條在尖嘴管口處點火,發現氣體能被點燃,發出淡藍色火焰。這說明鈉與硫酸銅溶液反應產生的氣體是氫氣。將反應后的混合物過濾,得到濾液和濾渣。
二、探究濾渣的成分
將濾渣置于試管中,滴加足量稀硫酸,發現濾渣完全溶解,溶液變為藍色。這說明鈉與硫酸銅溶液反應沒有銅生成。這是因為鈉先與水發生置換反應,生成氫氧化鈉和氫氣,化學方程式為:2Na+2H2O=2NaOH+H2↑;氫氧化鈉再與硫酸銅發生復分解反應,生成藍色絮狀沉淀氫氧化銅和硫酸鈉,化學方程式為:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4;總的化學方程式為:2Na+CuSO4+2H2O=Cu(OH)2↓+Na2SO4+H2↑。反應過程中放出大量的熱,使產物氫氧化銅部分分解為黑色的氧化銅和水,所以看到有少量黑色固體出現,反應的化學方程式為:
三、探究濾液的成分
同學們又提出問題:濾液中溶質的成分是什么呢?根據分析作出猜想:一定有硫酸鈉,可能含有氫氧化鈉或硫酸銅中的一種。同學們設計并進行實驗:取少量濾液于試管中,向其中滴加無色酚酞溶液,無明顯現象,說明濾液中不含氫氧化鈉;同學們觀察到濾液為淡藍色,說明濾液中含有硫酸銅。由此得出結論:濾液中含有生成的硫酸鈉和剩余的硫酸銅。
綜合以上探究可知,鈉與硫酸銅溶液反應生成氫氣、硫酸鈉和氫氧化銅,氫氧化銅受熱分解生成氧化銅和水。
- 農村青少年科學探究的其它文章
- 七色陽光
- 電影《八佰》里中國軍隊的武器
- 探究土壤酸堿性實踐活動
- 本期問題答案
- 巧匠楊生辰
- 假鈔

