臨床藥師優化1例CRRT膿毒癥休克患者行抗感染治療的病例分析
李偉華 范國榮 高岸
摘 要 目的:探討連續性腎臟替代療法(continuous renal replacement therapy, CRRT)治療膿毒癥休克患者的抗菌藥物給藥方法及臨床藥師在參與藥物治療中的作用。方法:臨床藥師參與1例術后混合細菌感染致膿毒癥休克并行床邊CRRT的患者抗感染治療的全過程,基于病原菌的藥敏結果、抗菌藥物特性、CRRT對藥物的清除以及膿毒性休克病理生理的改變,分析抗菌藥物的品種選擇及美羅培南初始給藥劑量、給藥方式的調整。結果:患者感染得到控制,未發生明顯的不良反應。結論:在CRRT所致膿毒癥休克患者治療中,臨床藥師發揮專業優勢,可協助醫師優化抗感染治療方案,提高臨床療效。
關鍵詞 混合細菌感染 膿毒癥休克 連續腎臟替代療法 美羅培南延長輸注 聯合用藥
中圖分類號:R631.2; R969.3 文獻標志碼:C 文章編號:1006-1533(2020)03-0060-05
Analysis of a case of CRRT patient with septic shock undergoing anti-infective therapy by clinical pharmacists*
LI Weihua1,2**, FAN Guorong1, GAO An1***(1. Department of Clinical Pharmacy, Shanghai General Hospital, Shanghai Jiao Tong University, Shanghai 200080, China; 2. Department of Pharmacy, Xian Daxing Hospital, Xian 710000, China)
ABSTRACT Objective: To explore the efficacy of antibacterial drug regimen in a CRRT patient with septic shock and the role of clinical pharmacists in participating in medication. Methods: Clinical pharmacists participated in the whole process of anti-infective treatment of a patient with postoperative mixed bacterial infection and septic shock combined with bedside continuous renal replacement therapy (CRRT) and the selection of antibiotics and the adjustment of the initial dose and mode of administration of meropenem were conducted based on the susceptibility results of pathogens, antibacterial properties, and drug clearance by CRRT as well as the pathophysiological changes of septic shock. Results: The patients infection was controlled and no obvious adverse reactions occurred. Conclusion: Clinical pharmacists can play a professional advantage to assist physicians in optimizing anti-infective treatment programs and improving clinical efficacy in the treatment of patients with septic shock caused by CRRT.
KEY WORDS mixed bacterial infection; septic shock; continuous renal replacement therapy (CRRT); meropenem prolonged infusion; drug combination
膿毒癥是指因感染引起的宿主反應失調導致的危及生命的器官功能障礙,在膿毒癥基礎上出現嚴重的循環障礙以及細胞和代謝的紊亂即為膿毒癥休克[1],通常病死率較高,而急性腎損傷(acute kidney injury, AKI)又是導致膿毒血癥死亡率升高的獨立危險因素,因此,必要時臨床上會采取連續性腎臟替代療法(continuous renal replacement therapy, CRRT)。同時,對危及生命的感染采取早期恰當的抗菌藥物治療也非常關鍵。然而,膿毒癥休克患者的病理生理學改變和CRRT的應用均會對抗菌藥物的藥代動力學特點產生影響。本文通過ICU臨床藥師參與1例膿毒癥休克合并AKI的患者行CRRT過程中抗菌藥物的選擇及劑量調整,為臨床合理使用提供參考。
1 臨床資料
患者,男,66歲,體重75 kg。入院4 d前,因食用變質螃蟹后,出現腹痛、腹瀉、高熱(39.5 ℃)、神志萎靡等癥狀,自行到藥店買藥(具體藥物不詳)服用后癥狀有所緩解。2018年12月2日因病情進一步加重,高熱伴意識不清,被送入上海市第一人民醫院急診科就診。CT提示膽囊壁明顯炎性增厚伴壞疽,肝臟近膽囊床處一膿腫,急診擬“壞疽性膽囊炎合并肝膿腫”收治入院。于2018年12月3日凌晨1: 05全麻下行膽囊切除+肝膿腫切開引流術,術中患者出現發熱,體溫38 ℃、心率136次/min、血壓下降至79/69 mmHg,qSOFA評分≥2分,立即留取膽汁做培養。術后轉入ICU監測。查體:體溫38.2 ℃,心率120次/min,血壓79/69 mmHg,神志模糊,伴抽搐,全腹無壓痛、反跳痛;輔助檢查:白細胞計數(white blood cell count, WBC)28.48×109/L↑,中性粒細胞比率(N%)88.2%↑,血紅蛋白(hemoglobin, Hb)90 g/L↓,血小板(blood platelet, PLT)37×109/L↓,C反應蛋白(C-reaction protein, CRP)228.7 mg/L↑;血肌酐(serum creatinine, Scr)235.0 μmol/L↑;門冬氨酸氨基轉移酶(aspartate transaminase, AST)750.0 U/L↑,谷丙轉氨酶(alanine aminotransferase, ALT)221.0 U/L↑,血清總膽紅素(total bilirubin, TBil)318.3 μmol/L↑,血乳酸(lactate, Lac)6.5 mmol/L↑;降鈣素原(procalcitonin, PCT)62.58 ng/ml↑;胸部CT示雙肺炎癥、少量胸腔積液,上腹部CT示腹腔游離氣體影,血管彩超提示肝內積氣影。患者平素體健,有長期糖尿病病史。根據患者病史、臨床癥狀以及相關檢查,入院診斷為膿毒癥休克,多器官功能障礙綜合征(multiple organ dysfunction syndrome, MODS),急性壞疽性膽囊炎,肝膿腫,腹腔感染,糖尿病。
2 主要治療過程
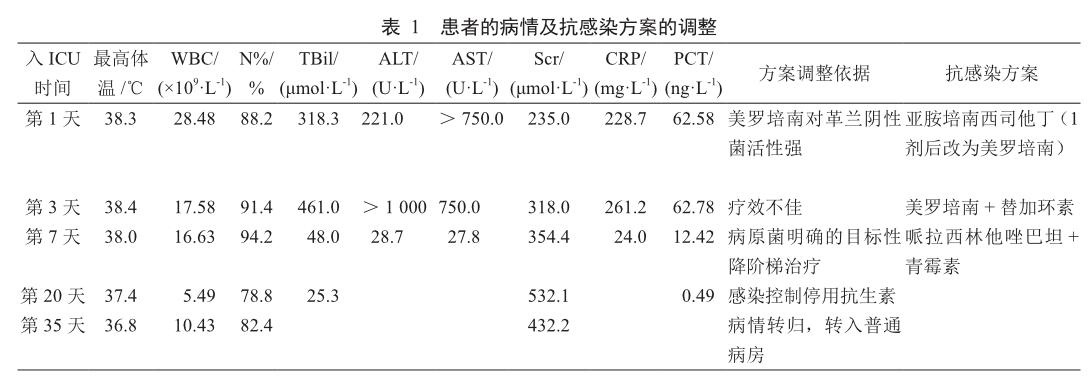
患者術后繼發膿毒癥休克合并多器官功能障礙,緊急給予呼吸機輔助通氣、液體復蘇、血管活性藥物維持血壓及其他支持治療。入ICU第1天,患者感染嚴重伴隨肝腎功能衰竭,Scr、膽紅素及炎癥介質等明顯升高,緊急行CRRT清除并經驗性給予亞胺培南西司他丁(0.5 g,ivgtt,q6h)抗感染。考慮美羅培南抗陰性菌活性強,遂1劑后結合患者腎功能,臨床藥師建議給予美羅培南1 g,ivgtt,q12h,首劑加倍。入ICU第3天,患者高熱38.4℃,WBC 17.58×109/L,N% 91.4%,CRP 261.2 mg/L,PCT 62.78 ng/ml,Scr 318.0 μmol/L,呈上升趨勢,抽血有溶血現象,立即送檢血標本做高通量基因測序(metagenomics next generation sequencing, mNGS)和血培養。同時臨床藥師建議優化給藥方案,將美羅培南延長輸注3 h,并聯合替加環素(首劑100 mg,維持劑量50 mg,ivgtt,q12h)治療。入ICU第4天,患者血流動力學好轉,仍有血管內溶血,體溫最高37.8 ℃,WBC 21.88×109/L,N% 94%,CRP 120.0 mg/L,PCT 39.44 ng/ml,均呈下降趨勢,僅中性粒比率仍然較高。膽汁培養示產超廣譜β-內酰胺酶(extended-spectrumβ-lactamase, ESBLs)大腸埃希菌(耐藥:頭孢噻肟、頭孢吡肟、左氧氟沙星;敏感:哌拉西林他唑巴坦、亞胺培南、美羅培南、替加環素),當前抗菌藥物可覆蓋,未更換治療方案。入ICU第7天,患者生命體征平穩,體溫最高38 ℃,WBC 16.63×109/L,CRP 24.0 mg/L,PCT 12.42 ng/ml,Scr 354.4 μmol/L,感染指標以及肝功能均有好轉趨勢,Scr呈上升趨勢。送檢的血標本mNGS回報:產氣莢膜梭菌,同時血培養示大腸埃希菌(產ESBLs)與膽汁培養結果一致。基于病原菌及藥敏結果,臨床藥師建議停用替加環素,并將美羅培南降階梯為哌拉西林他唑巴坦(4.5 g,ivgtt,q12h),同時針對產氣莢膜梭菌給予青霉素(160萬U,ivgtt,q6h)治療。入ICU第20天,患者無發熱,WBC 5.49×109/L,N% 78.8%,PCT 0.49 ng/ml,患者感染癥狀控制,感染指標明顯轉歸,血培養、痰涂片及痰培養均為陰性,臨床藥師建議停用抗菌藥物。入ICU第35天,患者肌酐呈好轉趨勢,繼續觀察患者病情,無特殊情況,近期即可轉入普通病房。患者具體實驗室指標及治療方案見表1。
3 分析和討論
3.1 膿毒癥休克治療方案的調整
國內外膿毒癥指南均要求,一旦確診為嚴重膿毒性休克的患者需要在1 h以內靜脈應用抗菌藥物,推薦使用1種或多種藥物聯合治療,盡可能覆蓋所有可能的病原菌[1-2]。結合患者壞疽性膽囊炎合并肝膿病手術史,可能的致病菌多為耐藥的革蘭陰性桿菌,如產ESBLs的大腸埃希菌、肺炎克雷伯菌、陰溝腸桿菌、銅綠假單胞菌,腸球菌和條件致病菌,有些患者合并厭氧菌感染,以脆弱擬桿菌為主等[3]。美羅培南是重癥感染時常用的廣譜b-內酰胺類抗菌藥物,對革蘭陽性菌、革蘭陰性菌及厭氧菌均有強大的抗菌作用,查閱文獻資料知與亞胺培南相比美羅培南抗革蘭陰性菌活性是亞胺培南的2~8倍[4],可能與美羅培南結構中的C2位接有一個二甲基氨甲酰基吡咯烷硫鏈有關[5],兩者在腹腔均有較好的分布,腹水濃度/血藥濃度≥50%[6]。因此,藥師建議將亞胺培南改為美羅培南治療。而對于接受CRRT的危重癥患者,臨床藥師調整美羅培南的劑量為1 g,ivgtt,q12h,首劑加倍。
入ICU第3天,已經驗性使用美羅培南48 h,患者仍然高熱38.4 ℃,感染指標(WBC、N%、CRP、PCT)及Scr均有所上升,并出現血管內溶血現象,可能與感染的病原菌有關。考慮目前沒有微生物標本培養陽性及藥敏結果,治療效果不佳,同時患者Scr呈持續上升趨勢,不宜增加美羅培南劑量,因此,臨床藥師建議將美羅培南延長輸注3 h,并經驗性聯合替加環素。替加環素對腎功能不全、CRRT、輕中度肝功能障礙的患者,即肝功能分級(Child Pugh評分)為A和B級無需調整劑量,此患者Child Pugh評分為9分,屬B級,給予100 mg負荷劑量,50 mg,ivgtt,q12h維持的常規劑量,同時密切監測肝功能。入ICU第4天,患者感染癥狀明顯好轉,熱峰有下降趨勢,最高體溫37.8 ℃,PCT 39.44 ng/ml,CRP 120.0 mg/L,均下降明顯,僅中性粒比率仍然較高。膽汁培養示產ESBLs大腸埃希菌,考慮患者目前溶血未糾正,且當前抗菌藥物可以覆蓋檢出的病原菌,因此,方案未做調整。
入ICU第7天,患者生命體征平穩,但溶血現象還存在。血標本mNGS示產氣莢膜梭菌,血培養示產 ESBLs大腸埃希菌,與膽汁培養結果一致,結合細菌微生物標本檢驗結果、影像學特點(腹腔及肝內游離氣體影)及患者溶血的臨床表現,系產氣莢膜梭菌與大腸埃希菌混合感染所致。針對“產氣莢膜梭菌”,最主要的治療方法之一是靜脈給予高劑量青霉素[7],給藥劑量一般為300~400萬U,ivgtt,q6h,其他有效的藥物包括哌拉西林他唑巴坦、碳青霉烯類等。對于大腸埃希菌(產ESBLs),哌拉西林他唑巴坦(MIC≤4 μg/ml)是高度敏感的。基于病原菌、藥敏結果以及患者的臨床表現,臨床藥師建議停用替加環素并將美羅培南降階梯為哌拉西林他唑巴坦,針對產氣莢膜梭菌給予青霉素治療。此時,患者已改為間歇血透模式,臨床藥師給予青霉素160萬U,q6h,哌拉西林他唑巴坦(4.5 g,q12h)透析日透后給藥。
入ICU第20天,患者近期未出現血管內溶血,且血培養陰性,中性粒細胞比率明顯轉歸,PCT 0.49 ng/ml(<0.5 ng/ml),下降幅度為99.2%(>80%)。對于ICU患者PCT下降至0.5 ng/ml以下或者下降幅度>80%的患者,不建議繼續使用抗菌藥物[8]。臨床藥師建議停用青霉素和哌拉西林他唑巴坦,醫師采納。
3.2 膿毒癥休克患者接受CRRT時美羅培南初始給藥劑量調整
膿毒癥休克患者會伴隨多種病理生理的改變,通常這種改變會影響抗菌藥物體內藥動學特點。對于危重癥患者,如果早期延遲或者開始不適當的經驗性抗感染治療,會顯著增加感染相關死亡率[9]。膿毒癥休克患者由于細菌感染可刺激機體釋放大量炎癥介質,直接損傷血管內皮細胞,引起血流分布不均和毛細血管滲漏。然而,大量的毛細血管滲漏入組織間隙,會導致機體嚴重的低血壓,全身灌注不足甚至多器官衰竭,相應的,臨床醫師會給予大量的復蘇液體,這些液體也可能分布在組織間隙中。對于親水性的抗生素,間隙體積的增加可能導致分布容積(Vd)的增加。此外,機械通氣、低蛋白血癥(增加毛細血管滲漏)、術后體腔引流等都可以使親水性藥物的Vd增加。研究表明[10],水溶性β-內酰胺類抗生素在膿毒癥休克等危重癥患者中的Vd可能為非危重癥患者的2倍。由于美羅培南屬于親水性β-內酰胺類抗菌藥物,所以,在初始用藥時,應該給予美羅培南負荷劑量,以達到靶濃度。
患者入ICU時,發生急性腎損傷,Scr 235 μmol/L、無尿、尿素氮上升幅度>8.93 mmol/(L·d)且持續上升。對于嚴重的膿毒癥休克合并急性腎損傷的患者,接受CRRT可以控制Scr、尿素等物質,同時也可清除有害炎癥介質,使患者的腎臟得到保護。然而,CRRT在去除有害炎癥介質的同時也會增加對治療藥物的消除。CRRT通常對分子量小、Vd小、蛋白結合率低、水溶性藥物的影響較大;除這些藥物特性外,透析程序的技術方面(如濾孔大小、血液或超濾率、透析時間)也可能影響透析去除藥物的程度。目前ICU常使用具有較大的表面積(高通量透析器膜),相對分子質量小于5 000的藥物可通過彌散的作用被清除。美羅培南屬于Vd小,血漿蛋白結合率低(約2%)的小分子(分子量為437.51)物質,經CRRT的清除率約為31.6%±5.3%[11]。該患者CRRT采用的是連續靜脈-靜脈血液濾(continuous veno-venous hemofiltration, CVVH)模式,對抗菌藥物的清除主要取決于CVVH的濾過率。參考《熱病(第46版)》與相關共識,給予美羅培南1 g,q12h維持劑量,首劑加倍。
3.3 根據美羅培南藥代動力學/藥效學(PK/PD)特性調整給藥方式
在初始治療效果不佳時,臨床藥師采取聯合用藥以及將美羅培南延長輸注的調整措施,使得患者感染及早得到控制。美羅培南為時間依賴性抗菌藥物,評價其藥效學的主要指標為游離藥物濃度超過最低抑菌濃度(minimum inhibitory concentration, MIC)的時間占給藥間隔的百分比(%T>MIC)。研究表明,危重癥感染時,碳青霉烯類抗菌藥物的%T>4×MIC達到40%,就可發揮較好的殺菌作用[12]。一般可采用增加給藥劑量、縮短給藥間隔和延長輸注時間來提高碳青霉烯類藥物的臨床療效。Lee等[13]應用蒙特卡洛模擬法證實,延長美羅培南的單次給藥時間為3 h與傳統的輸注30 min比較有優化臨床結局及減少耐藥菌產生的可能。查閱說明書,美羅培南配制溶液在室溫條件下6 h內穩定,延長輸注3 h是安全有效的。美羅培南約75%主要以原型經腎排泄,CRRT中少尿或無尿的患者,美羅培南的t1/2明顯延長,在實際臨床中,不宜采取增加給藥劑量的方式。因此,該患者采取1 g,q12h,延長輸注3 h的給藥方式。
3.4 聯合替加環素的用藥分析
美羅培南初始經驗性治療效果不佳,患者N% 91.4%,PCT 62.78 ng/ml,Scr 318 μmol/L,較前明顯升高。結合患者“壞疽性膽囊炎合并肝膿腫術后”病史,社區獲得性及醫院獲得性的腸桿菌科細菌均需覆蓋。依據本院細菌耐藥分析,耐碳青霉烯類腸桿菌科細菌(carbapenem resistant Enterobacteriaceae, CRE)的檢出率明顯升高,且患者具備感染CRE的高危因素,如侵入性操作(留置導尿、中心靜脈置管)、高齡(≥65歲)等,不能排除有CRE感染的可能;同時術后膿毒性休克的患者存在腸球菌感染風險,需經驗性覆蓋腸球菌(2-B級)[3]。替加環素體外抗菌譜廣,對包含腸桿菌科、腸球菌在內的多數革蘭陽性需氧菌、革蘭陰性需氧菌、厭氧菌以及不典型病原體均具有良好的抗菌活性[10],而且組織分布廣泛,尤其是在膽汁(給藥4 h后,濃度是血藥濃度的38倍)和腹水(腹水濃度/血藥濃度≥50%)中[6],同時替加環素主要排泄途徑為膽道/糞便,次要排泄途徑為腎臟,是腎功能障礙者較好的選擇。因此,結合替加環素抗菌譜及藥動學特點,在患者Scr呈持續上升趨勢的階段不宜增加美羅培南給藥劑量時,臨床藥師建議聯合替加環素,并在病原菌明確時,及時給予停藥降階梯治療。
4 結語
嚴重的膿毒癥休克常伴隨多種病理生理改變及臟器功能障礙,會影響抗菌藥物體內的藥動學特征,特別是水溶性抗菌藥物;合并AKI的患者臨床上往往會接受CRRT,這就使得水溶性抗菌藥物在體內的藥動學更加復雜,既要使得抗菌藥物達到臨床治療效果,又要將藥物劑量控制在安全范圍內。在行CRRT的膿毒癥休克患者中,根據美羅培南PK/PD特征,給予初始負荷劑量,療效不佳時延長輸注時間并聯合廣譜、肝腎雙通道排泄的替加環素,使得患者病情及早控制。本文臨床藥師結合患者病情發展,通過協助醫師制定抗感染方案,調整給藥劑量,以及評估停藥指癥參與膿毒癥休克患者臨床治療的全過程,旨在充分利用藥學專業知識在臨床實踐中為患者提供藥學服務。
參考文獻
[1] Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock(sepsis-3)[J]. JAMA, 2016, 315(8): 801-810.
[2] 曹鈺, 柴艷芬, 鄧穎, 等. 中國膿毒癥/膿毒性休克急診治療指南(2018)[J]. 臨床急診雜志, 2018, 19(9): 567-588.
[3] Mazuski JE, Tessier JM, May AK, et al. The surgical infection society revised guidelines on the management of intra-abdominal infection[J]. Surg Infect (Larchmt), 2017, 18(1): 1-76.
[4] 楊帆, 張嬰元, 吳衛紅, 等. 三種碳青霉烯類抗生素的體外抗菌作用[J]. 中國抗生素雜志, 2000, 25(2): 120-123.
[5] 張曉梅, 侯柏春, 鞠福娟. 兩種碳青霉烯類抗生素體外抗菌活性比較[J]. 中國熱帶醫學, 2005, 5(2): 327-328.
[6] 中國醫藥教育協會感染疾病專業委員會. 抗菌藥物藥代動力學/藥效學理論臨床應用專家共識[J]. 中華結核和呼吸雜志, 2018, 41(6): 409-446
[7] Khan MS, Ishaq MK, Jones KR. Gas-forming pyogenic liver abscess with septic shock[J/OL]. Case Rep Crit Care, 2015, 2015: 632873. doi: 10.1155/2015/632873.
[8] Schuetz P, Beishuizen A, Broyles M, et al. Procalcitonin(PCT)-guided antibiotic stewardship: an international experts consensus on optimized clinical use[J]. Clin Chem Lab Med, 2019, 57(9): 1308-1318.
[9] Roberts JA, Abdul-Aziz MH, Lipman J, et al. Individualised antibiotic dosing for patients who are critically ill: challenges and potential solutions[J]. Lancet Infect Dis, 2014, 14(6): 498-509.
[10] Delattre IK, Taccone FS, Jacobs F, et al. Optimizing b-lactams treatment in critically-ill patients using pharmacokinetics/ pharmacodynamics targets: are first conventional doses effective?[J]. Expert Rev Anti Infect Ther, 2017, 15(7): 677-688.
[11] 徐穎鶴, 樓永海, 鄭貞蒼, 等. 美羅培南在連續性腎臟替代治療患者中的藥代動力學[J].中國臨床藥理學雜志, 2008, 24(5): 410-412.
[12] MacVane SH, Kuti JL, Nicolau DP. Prolonging β-lactam infusion: a review of the rationale and evidence, and guidance for implementation[J]. Int J Antimicrob Agents, 2014, 43(2): 105-113.
[13] Lee LS, Kinzig-Schippers M, Nafziger AN, et al. Comparison of 30-min and 3-h infusion regimens for for imipenem/ cilastatin and for meropenem evaluated by Monte Carlo simulation[J]. Diagn Micr Infec Dis, 2010, 68(3): 251-258.

