碳酸銀光催化性能研究
安偉佳,謝婉麗
(華北理工大學,河北唐山063210)
光催化技術自誕生起因在能源和環境問題上的潛在應用吸引了人們的廣泛關注,其在水分解[1]、二氧化碳還原[2]、有機污染物降解[3]等方面都有重要的應用。 隨著科技的進步和工業化的快速發展,環境污染、能源短缺等問題日益嚴峻,利用光催化材料催化降解有機污染物成為目前環境領域研究的熱點。在可見光作用下,光催化劑能將有機污染物轉化為H2O 和CO2且無二次污染,反應條件簡單,能耗低[4-6]。TiO2是目前應用最多的傳統光催化劑,然而TiO2的帶隙能量較寬(3.2 eV),只能在波長小于400 nm 的紫外光照射下激發[7]。 由于紫外光的能量在太陽光中所占比例很小, 嚴重限制了僅對紫外光有響應的半導體光催化劑對太陽光的利用率[8]。 除此之外,傳統的半導體光催化材料還存在光生空穴-電子復合快、難以分離回收等問題,大大限制了光催化劑在環境方面的實際應用[9]。 針對上述問題,一方面人們開發設計并控制合成新型的可見光響應的窄帶隙半導體光催化材料[10-11],主要集中在氧化物半導體、氮氧化物半導體、硫化物半導體以及相應的固溶體光催 化 材 料 的 研 究 制 備 上[12],如BiVO4[13]、Bi2WO6[14]、g-C3N4[15]、CdS[16]、Cu2ZnSnS4[17];另 一 方 面 對 傳 統 的光催化材料進行修飾改性,使其提高對可見光波段的響應能力,通過摻雜金屬/非金屬離子、貴金屬沉積、半導體復合、染料敏化等方法提高光催化活性[18]。 銀系光催化劑在可見光范圍內具有較好的光催化性能,因此受到人們的廣泛關注,如AgBr[19]、Ag2S[20]、Ag3PO4[21]、Ag3VO4[22]。 而碳酸銀(Ag2CO3)可通過沉淀法或離子交換法制備, 帶隙分布在2.08~2.46 eV,引入非金屬元素C 后,在提高其帶隙能的同時,也增加了其反應穩定性[23],具有很強的可見光吸收和良好的光催化活性。 羅丹明B(RhB)是一種應用范圍廣泛的染料,能破壞蛋白質、可致癌致突變,嚴重影響人類的健康,因此急需能有效降解RhB 的方法和途徑[24]。 Xu 等[25]在2011 年首次制備出棒狀Ag2CO3并發現能在可見光下降解苯酚。作為新型光催化劑,Ag2CO3被證實能對亞甲基藍(MB)、甲基橙(MO)、RhB 等染料進行有效降解,具有較高的可見光響應和良好的光催化性能[26-27]。 筆者選擇對pH 不敏感的RhB 為降解物,在模擬可見光條件下探究Ag2CO3在不同環境因素中的光催化性能。除了活性實驗測試外, 還從價鍵理論出發分析了pH偏低時Ag2CO3光催化活性較強的現象;同時選擇降解物濃度和光催化劑用量作為其他變量,分別測試其對Ag2CO3降解RhB 效果的影響, 得出最佳降解條件后進行TOC 礦化分析,排除染料在光照下自脫色的影響,測試染料被降解礦化的程度,以此來表征實際最佳降解效果。
1 實驗部分
1.1 試劑與儀器
試劑:硝酸銀、無水碳酸鈉,無水乙醇、RhB 均為分析純;實驗用水為去離子水。
儀器:JM-X14B 箱式電爐;HWCL-1 集熱式恒溫磁力攪拌浴;TU-1901 雙光束紫外可見光光度計;XPA-G4 光化學反應儀;TOC-L 型總有機碳分析儀;D/MAX2500PC X 射線衍射儀;F-7000 熒光分光光度計。
1.2 Ag2CO3 的制備
將1.02 g AgNO3溶解于60 mL 去離子水中,將0.318 g 無水碳酸鈉溶解于60 mL 去離子水中,邊攪拌邊將碳酸鈉溶液緩慢滴入AgNO3溶液中,滴加1 h 后靜置沉淀,將沉淀物用去離子水洗滌2 次、無水乙醇洗滌1 次,80 ℃真空干燥2 h,得到Ag2CO3。
1.3 Ag2CO3 光催化劑的活性評價
在光反應儀中, 利用400 W 金鹵燈、420 nm 截止濾光片,在模擬可見光條件下進行Ag2CO3光催化降解RhB 的實驗,比較在不同因素影響下Ag2CO3對RhB 的降解效果。在光催化反應過程中,每隔20 min用移液槍取4 mL 溶液,將溶液放入離心機中以8 000 r/min 高速離心8 min,取上層清液,利用紫外可見分光光度計設定550 nm 處測試其吸光度。根據Lambert-Beer 定律可知, 在一定條件下吸光度與濃度成正比, 因此可用所得的吸光度代表光催化反應中RhB 的濃度,用C表示RhB 溶液吸光度線性對應的質量濃度,計算最終降解率(C0-C)/C0,繪制C/C0-t曲線,以此表征Ag2CO3的光催化活性。
2 結果與討論
2.1 Ag2CO3 和TiO2 光催化降解RhB 效果比較
分別將50 mg Ag2CO3和TiO2加入到50 mL 質量濃度為5 mg/L 的RhB 溶液中,在模擬可見光條件下光照80 min,Ag2CO3和TiO2光催化降解RhB 的效果見圖1。 由圖1 看出,以TiO2為光催化劑,RhB溶液C/C0-t曲線下降速率較慢,C/C0最終值為0.293,說明二氧化鈦光催化降解能力有限,降解效率較低。以Ag2CO3為光催化劑,RhB 溶液C/C0-t曲線有明顯的下降趨勢,60 min 時RhB 已基本完成降解, 說明Ag2CO3在模擬可見光條件下對RhB 能夠進行有效降解,光催化活性較強。 實驗結果表明,在同等條件下Ag2CO3光催化性能明顯優于TiO2, 這是由于Ag2CO3帶隙能普遍在2.08~2.46 eV, 相比于3.2 eV的TiO2其帶隙能更小,光譜響應范圍更寬,對可見光吸收程度更好,因此光催化活性更強。
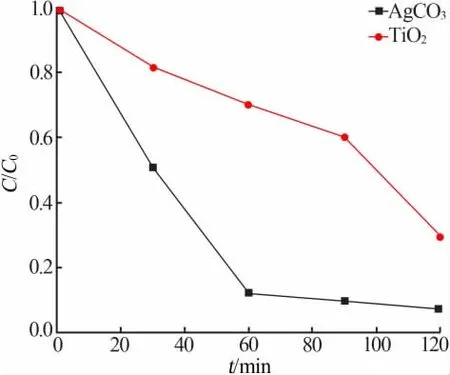
圖1 Ag2CO3 和TiO2 光催化降解RhB 的效果
2.2 各因素對Ag2CO3 光催化降解RhB 效果的影響
2.2.1 RhB 質量濃度的影響
分別將50 mg Ag2CO3投入到不同質量濃度的RhB 溶液中,光催化降解120 min,RhB 質量濃度對降解效果的影響見圖2。 由圖2 可知,隨著RhB 溶液質量濃度增大,降解曲線下降速率減小,其中RhB質量濃度為5 mg/L 時,Ag2CO3能對RhB 快速降解,最終降解率高達97%; 而RhB 質量濃度為20 mg/L和30 mg/L 時,降解曲線變化趨勢不明顯,最終降解率均小于5%,說明Ag2CO3存在降解RhB 的濃度上限,超過該限度則幾乎無降解現象,光催化活性大幅減弱。 這可能是由于一定質量的光催化劑比表面積有限,RhB 濃度過高導致Ag2CO3表面被大量吸附,影響自由基生成,光催化降解速率大幅降低。
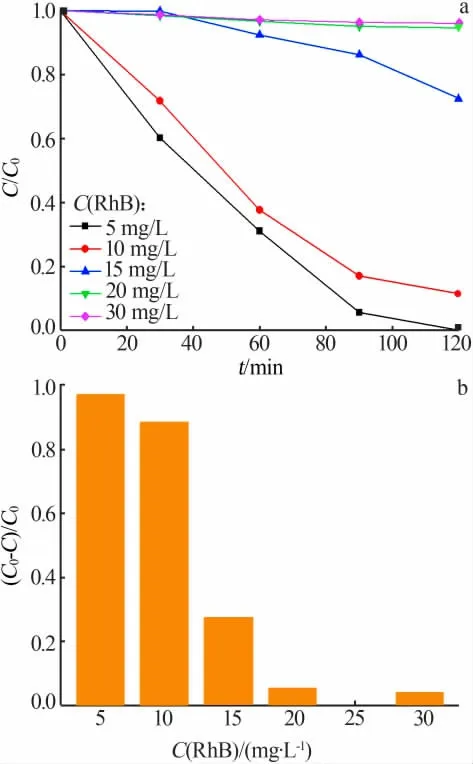
圖2 RhB 溶液質量濃度對其降解效果(a)和最終降解率(b)的影響
2.2.2 Ag2CO3用量的影響
在50 mL 質量濃度為5 mg/L 的RhB 溶液中分別添加不同質量的Ag2CO3光催化降解120 min,實驗結果見圖3。 由圖3 可知, 隨著Ag2CO3用量增加,RhB 降解曲線下降速率加快,其中Ag2CO3添加量為75 mg 和100 mg 時,RhB 在60 min 時已基本完成降解。這是由于,隨著Ag2CO3用量增加,光生電子和空穴數量增多,產生更多強氧化性的·O2-自由基與降解物進行反應,使得光催化降解速率增大。實驗結果表明,在一定范圍內,投入Ag2CO3質量越多,光催化速率越大,RhB 最終降解率越大。
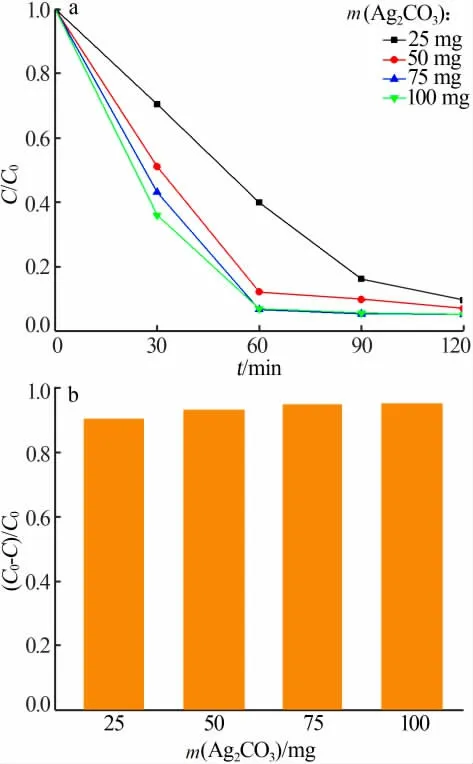
圖3 Ag2CO3 用量對RhB 降解效果(a)和最終降解率(b)的影響
2.2.3 pH 的影響
取50 mL 質量濃度為5 mg/L 的RhB 溶液用鹽酸和NaOH 溶液調節至不同pH, 投入50 mg Ag2CO3,光催化反應100 min,同時設置空白組進行對照,實驗結果見圖4。 由圖4 可知,在不加催化劑條件下,RhB 最終降解率均小于10%, 可見RhB 結構穩定,自降解效果較弱;加入催化劑實驗組,在pH小于9 時均維持較高降解率, 而在強堿性環境下降解率大幅下降。 這是由于RhB 屬于陽離子染料,其R—CO2-上O 原子的孤電子轉移到催化劑的Ag原子4d軌道上形成配位鍵, 在酸性條件下RhB 主要通過共價鍵大量吸附到Ag2CO3[28]上,而隨著溶液pH 升高Ag2CO3主要靠電性引力吸附RhB[29]。 由于共價作用的強度遠強于靜電吸附作用, 因此在pH偏低的情況下Ag2CO3的光催化活性較強。
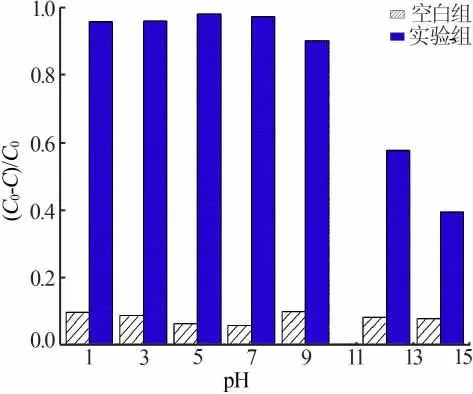
圖4 pH 對Ag2CO3 降解RhB 最終降解率的影響
2.3 Ag2CO3 的礦化性能分析
RhB 的脫色不全是Ag2CO3光催化降解的結果。為分析Ag2CO3對RhB 實際的降解效果, 對添加Ag2CO3的RhB 溶液測試光照100 min 的TOC 去除率,同時設定空白對照組進行比較,實驗結果見圖5。 由圖5 可知,空白組的RhB 溶液幾乎未被礦化,無自降解現象,而實驗組的RhB 溶液在光照100 min 時C/C0為34%,最終降解率(C0-C)/C0為66%,礦化程度較高,光催化降解能力強。
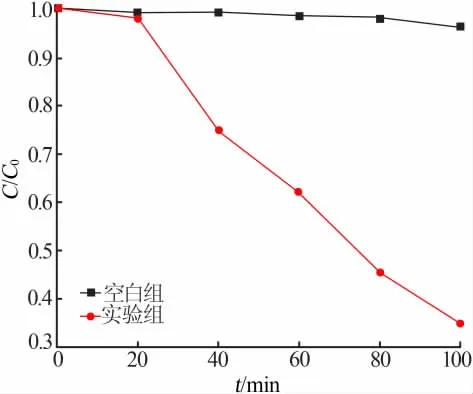
圖5 空白組和實驗組降解過程TOC 分析
2.4 Ag2CO3 樣品表征
圖6a 為Ag2CO3樣品XRD 譜圖。 在XRD 譜圖上樣品特征峰在不同晶面(020)(110)(011)(101)(130)(200)(031)(220)(131)(230)(211)(150)(231)(231)(002)都與單斜結構的Ag2CO3標準晶體卡片(JCPDS No.26-0339)的特征峰相對應,衍射峰半峰寬小,說明制得的樣品為Ag2CO3,且結晶度好,樣品較為純凈。
圖6b 為Ag2CO3樣品紫外-可見漫反射光譜圖。由圖6b 可知,Ag2CO3在紫外和可見光區域的250~700 nm 有較強的吸收能力,吸收峰能延續到500 nm左右,對應帶隙為2.46 eV[30],說明Ag2CO3在紫外光區域有非常強烈的吸收, 在可見光區域也有一定的吸收能力。
圖6c 為Ag2CO3樣品拉曼光譜圖。 由圖6c 可知,Ag2CO3樣品在200~400 cm-1處出現一個寬峰,對應Ag—C 的拉伸振動;705 cm-1和851 cm-1處的峰對應CO32-的彎曲振動;1 340 cm-1和1 537 cm-1處的峰,對應O—C—O 的拉伸振動[31]。

圖6 Ag2CO3 樣品XRD(a)、UV-Vis(b)、Raman(c)、FT-IR(d)圖
圖6d 為Ag2CO3樣品FT-IR 圖。 由圖6d 看出,3 419 cm-1和1 637 cm-1處的吸收峰分別為催化劑表面—OH 伸縮振動和表面吸附水H—O—H 的彎曲振動;1 078 cm-1處的吸收峰和1 300~1 500 cm-1處的寬吸收帶是CO32-的ν1和ν3振動引起;702 cm-1處和756 cm-1處的吸收峰歸因于CO32-的ν4振動[32]。證明Ag2CO3表面有大量吸附水,這些水分子能與經過光照而激發產生的空穴反應生成大量強氧化性自由基,從而降解RhB。 根據拉曼光譜圖和FT-IR 圖可知,制得的樣品為Ag2CO3,較為純凈,且表面的吸附水有利于光催化降解的進行。
3 小結
研究了不同因素對Ag2CO3降解RhB 染料的影響,在中酸性環境、RhB 質量濃度為5 mg/L 以及Ag2CO3用量為1 g/L 條件下能有效降解RhB。Ag2CO3對RhB 有較高的降解率,礦化程度較好,說明Ag2CO3催化劑能在可見光條件下有效降解RhB染料,具有良好的光催化降解性能。

