農桿菌介導的杜仲葉片愈傷組織遺傳轉化體系*
劉閔豪 徐郡儡 葉 靖 李周岐 范睿深 李 龍
(西北農林科技大學林學院 楊凌 712100)
杜仲(Eucommiaulmoides)是我國特有的重要經濟樹種。杜仲樹皮為傳統中藥材,現代藥理學研究表明,其主要藥用成分為木質素、環烯醚萜類、黃酮類、苯基丙烷、多糖、氨基酸、其他萜類和脂肪族(張京京等,2014)。此外,杜仲樹皮、樹葉及果實中含有杜仲膠(反式聚異戊二烯),具有耐水性、耐腐蝕性、低溫塑性、良好的韌性和溶解性,在化工領域具有巨大的潛力(Fang,2016)。
由于木本植物生長周期長與生長環境控制難等原因,傳統的杜仲雜交育種要經過很長時間才能獲得新的品種,嚴重制約了杜仲資源的開發利用。隨著現代生物技術的發展,組織培養與農桿菌介導的遺傳轉化技術廣泛運用于林木育種研究中,克服了傳統育種的不足,具有良好的前景(Girietal.,2004)。杜仲組織培養的研究早在20世紀80年代就開始進行,到目前為止,已有以子葉和下胚軸為外植體的再生體系,以及葉和腋芽的組織培養研究報道(張朝成,1988;Chenetal.,1995;2008;李琰等,2006;袁云香,2012),在此基礎上,對愈傷組織的繼代條件進行了研究,初步構建了以葉片為外植體的再生體系(金曉玲等,2014)。盡管如此,杜仲組織培養仍存在愈傷組織不定芽誘導率低、不定芽再生困難等問題(劉慧敏等,2016),這導致杜仲目前沒有以成熟植株組織為受體的遺傳轉化體系研究的報道,僅有以下胚軸為受體的遺傳轉化體系(趙丹等,2009;李巖等,2011),下胚軸屬于子代材料,不能代表原優良品種的遺傳背景(Sidorovaetal.,2017),這一局限性嚴重制約了杜仲基因功能與遺傳改良的研究。
本研究以杜仲優良品種‘華仲4號’成年植株葉片為材料,優化了葉片愈傷組織的再生體系,并在此基礎上研究了愈傷組織對抗生素與抑菌劑的敏感性。以獲得的葉片愈傷組織受體系統為基礎,通過正交試驗探索不同轉化因子對GUS瞬時表達率的影響。使用最適轉化因子組合對約200個愈傷組織進行了遺傳轉化操作,共篩選獲得3個抗卡那霉素(Km)的抗性芽,PCR檢測證明這些抗性芽中存在NPTⅡ基因。本研究構建的體系使得在杜仲成熟材料中進行基因遺傳轉化的研究成為可能,為杜仲基因功能的研究與定向改良奠定基礎,對杜仲資源的開發利用具有重要意義。
1 材料與方法
1.1 試驗材料
杜仲成年植株葉片采集于西北農林科技大學林學院試驗苗圃種植的‘華仲4號’(杜蘭英等,2014),該優良品種于2005年從河南靈寶引種至西北農林科技大學試驗苗圃,樹齡14年。采集時間為4—5月,此時間段采集的外植體具有最低的污染率(羅麗,2009)。
遺傳轉化使用的植物表達載體為pBI121,含有該表達載體的農桿菌(Agrobacteriumtumefaciens)菌株EHA105 由西北農林科技大學劉雅莉教授惠贈。
1.2 杜仲葉片的表面滅菌
采集的葉片在自來水中沖洗3 h,然后使用75%(V/V)酒精清洗30 s,再浸泡在5%(M/V)次氯酸鈉溶液中5 min進行表面滅菌,消毒后用無菌蒸餾水沖洗3次,放在無菌濾紙上干燥,切成約0.5 cm×0.5 cm的小片備用。
1.3 愈傷組織的誘導與增殖
將切成小片的葉片接種于愈傷組織誘導培養基,每瓶3到4片,葉片誘導愈傷組織培養基為MS + 8.1 μmol·L-1NAA + 4.4 μmol·L-16-BA。接種后在(24±2)℃的溫度下暗培養4天,再在光照條件下培養30~40天,光照周期為每日16 h,溫度為(24±2) ℃。獲得的葉片愈傷組織采用MS + 0.27 μmol·L-1NAA + 6.7 μmol·L-16-BA的繼代培養基(金曉玲等,2014),繼代周期為18天。
1.4 不定芽誘導與復壯培養基的優化
將繼代培養2個周期的愈傷組織接種于含不同濃度大量元素的MS(MS,3/4MS)培養基中,添加不同濃度的NAA(0、0.27、0.54 μmol·L-1)和6-BA(0、4.4、6.7、8.8 μmol·L-1),培養3周后,統計不定芽誘導率(誘導出不定芽的愈傷組織/所有愈傷組織)。將愈傷組織誘導的不定芽接種到含不同濃度NAA(0.054、0.27 μmol·L-1)和6-BA(4.4、8.8 μmol·L-1)的MS(MS,3/4MS)培養基上進行復壯,3周后測量不定芽伸長長度。每個處理50個愈傷組織,培養條件同1.3的光照培養條件,整個試驗重復3次,使用SPSS17.0對數據進行處理,采用Tukey檢驗進行差異分析。
1.5 杜仲愈傷組織抑菌劑和抗生素敏感性試驗
遺傳轉化的抗性芽選擇培養基以不定芽誘導培養基為基礎培養基,抑菌劑為頭孢霉素(Cef),篩選用的抗生素為卡那霉素(Km)。將愈傷組織分別接種于含不同濃度Cef(0、50、100、200、300 mg·L-1)和Km(0、25、50、100、200 mg·L-1)的不定芽誘導培養基中,每個處理30塊愈傷組織,培養條件同1.3的光照培養條件。3周后統計不定芽誘導率,分析愈傷組織對抑菌劑和抗生素的敏感性,以獲得最適合的選擇培養基。
1.6 農桿菌介導的杜仲葉片愈傷組織遺傳轉化轉化因子正交試驗設計
根據農桿菌介導的杜仲下胚軸遺傳轉化體系(趙丹等,2009;李巖等,2011)和其他植物愈傷組織為受體的遺傳轉化系統(Yangetal.,2010;Abdallatetal.,2011;Trivellini,2015;黃天帶等,2010;陳子龍等,2014),本試驗選擇了4個可能影響農桿菌介導杜仲葉片愈傷組織遺傳轉化效率的轉化因子(預培養時間、侵染時間、共培養時間和乙酰丁香酮濃度)進行研究,通過L16(45) 的正交試驗表進行試驗設計,轉化因子的水平如表1所示。
1.7 遺傳轉化操作
將-80 ℃冰箱中保存的農桿菌甘油菌使用接種環接種于固體LB培養基上劃線活化,28 ℃倒置培養16 h,再挑取平板上的單克隆接種于50 mL含50 mg·L-1卡那霉素的液體LB培養基中,于28 ℃、180 r·min-1的搖床震蕩過夜培養,直到OD600值達到0.6~0.7。將農桿菌懸浮液在室溫下以4 000 r·min-1離心10 min收集菌體,再使用不含激素的無菌液體MS培養基重懸農桿菌,重懸至OD600值達到0.6后加入不同水平濃度的乙酰丁香酮(AS)備用。
正交試驗的每個處理均使用50塊愈傷組織,接種于不定芽誘導培養基中進行預培養。將預培養后的愈傷組織置于農桿菌重懸液中進行侵染,侵染后使用無菌濾紙吸干菌液,接種于普通的不定芽誘導培養基,于(24±2)℃條件下進行暗培養。
1.8 GUS組織化學染色
使用GUS組織化學染色法(Jefferson,1987)檢測GUS瞬時表達效率。具體為各處理的愈傷組織在共培養后,置于X-Gluc染色液(GUS染色液,Solarbio)中,37 ℃染色6 h,使用90%(V/V)和70%(V/V)的酒精分別脫色24 h,以除去葉綠素。統計愈傷組織的染色情況,進行染色強度的評級(孟妮等,2018),并以GUS組織化學染色結果代表GUS瞬時表達效率(含藍色GUS染色位點愈傷組織/所有愈傷組織),使用SPSS17.0進行數據處理并進行方差分析。
1.9 抗性芽的篩選
使用獲得的瞬時轉化體系對愈傷組織進行遺傳轉化操作,將共培養后愈傷組織使用CEFO水(含200 mg·L-1Cef的無菌蒸餾水)沖洗3次,再在含100 mg·L-1Cef的液體MS培養基中浸泡10 min脫毒,使用無菌濾紙吸干多余液體后,接種于選擇培養基上培養,篩選獲得抗性芽,培養條件同1.3的光照培養條件。篩選出的抗性芽使用GUS組織染色法(同1.8)和PCR法進行檢測。
1.10 抗性芽的PCR檢測
使用CTAB法從獲得的抗性芽葉片中提取總DNA,以沒有進行遺傳轉化操作的不定芽葉片DNA和pBI121質粒作為對照進行PCR檢測。以NPTⅡ基因為檢測標準設計特異性引物:上游引物為5′-TCACTTCGCTCGCGGAGAA-3′,下游引物為5′-AGAGGVGATAGAGCGAGATGC-3′,擴增片段長度為465 bp。PCR反應體系為:94 ℃ 3 min預變性;98 ℃變性10 s,60℃退火20 s,72 ℃延伸70 s,共30個循環;再72 ℃延伸5 min。PCR產物通過1%瓊脂糖凝膠電泳進行檢測。
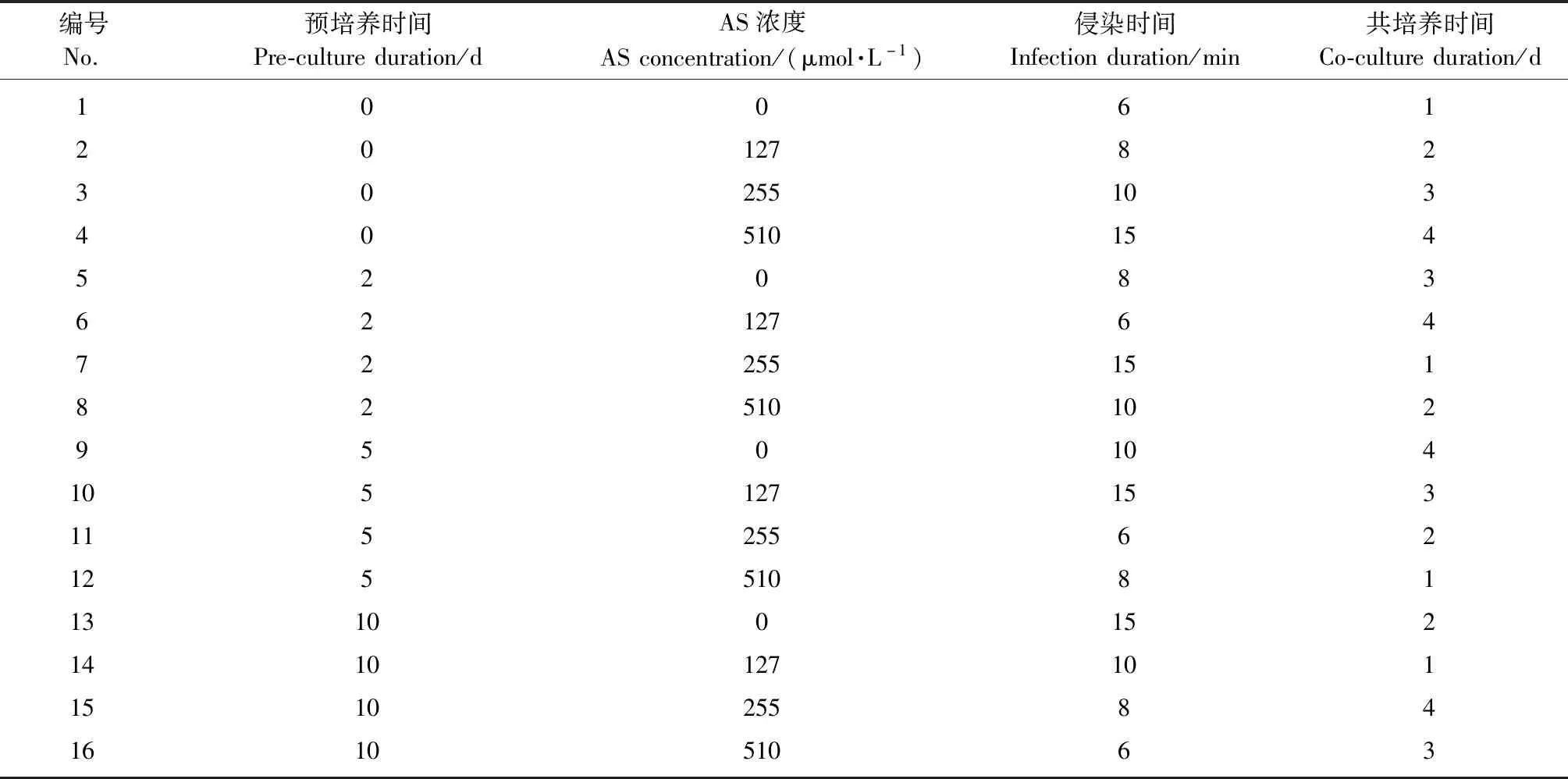
表1 轉化因子正交試驗①Tab.1 Factors and levels of L16 (45) orthogonal experiments
①AS:乙酰丁香酮 Acetosyringone.
2 結果與分析
2.1 大量元素與生長調節劑對杜仲葉片愈傷組織再生體系的影響
葉片接種到愈傷組織誘導培養基(MS + 8.1 μmol·L-1NAA+ 4.4 μmol·L-16-BA)上培養25天左右,葉片逐漸膨大,并在切口處出現小塊愈傷組織,誘導率達90%,這些愈傷組織在幾天內迅速生長(圖1a),35天左右即需進行繼代培養。愈傷組織接種到繼代增殖培養基(MS + 0.27 μmol·L-1NAA+ 6.7 μmol·L-16-BA)進行增殖培養時,會在繼代培養20天后出現褐化,因此適宜的繼代培養周期為18~20天,胚性愈傷組織約在連續繼代培養2次后形成(圖1b),能夠進行不定芽誘導。這些試驗結果與金曉玲等(2014)的研究結果相似。
不定芽誘導和復壯培養基的優化試驗結果(表2)表明:愈傷組織誘導不定芽的誘導率受到6-BA和NAA配比的影響,當6-BA與NAA濃度比為16∶1時,不定芽的誘導率最高。此外,3/4濃度大量元素的MS培養基的不定芽誘導率更高。在3/4MS + 0.27 μmol·L-1NAA + 4.4 μmol·L-16-BA的培養基上,不定芽誘導率最高(83%±10%),并且誘導的芽更加健康(圖1c)。不定芽復壯的結果與不定芽誘導的結果相似,不定芽的伸長長度受大量元素濃度影響更顯著,在3/4MS + 0.054 μmol·L-1NAA + 4.4 μmol·L-1的6-BA的培養基中芽伸長長度最長,為(2.47±1.33) cm(圖1d)。
2.2 頭孢霉素與卡那霉素對不定芽誘導的影響
抑菌劑與抗生素敏感性試驗(表3)表明:在含有300 mg·L-1Cef和50 mg·L-1Km的MS培養基上,愈傷組織仍呈黃褐色,但是無法誘導不定芽;在含400 mg·L-1Cef和70 mg·L-1Km的MS培養基上,愈傷組織則完全褐化死亡。因此,遺傳轉化的選擇培養基中,抑菌劑頭孢霉素的濃度為200 mg·L-1,能抑菌并不會對愈傷組織產生過大影響;篩選用的抗生素卡那霉素濃度為70 mg·L-1,能夠導致不含Km抗性的野生型愈傷組織死亡,從而篩選出有Km抗性的抗性芽。

圖1 杜仲葉片誘導愈傷組織及其再生過程Fig.1 Callus induction and plant regeneration in E.ulmoidesa.葉片在愈傷組織誘導培養基(MS + 8.1 μmol·L-1NAA + 4.4 μmol·L-16-BA)上培養5周形成的愈傷組織;b.在繼代增殖培養基(MS + 0.27 μmol·L-1 NAA + 6.7 μmol·L-1 6-BA)上繼代培養2個周期的愈傷組織;c.愈傷組織在不定芽誘導培養基(3/4MS + 0.27 μmol·L-1 NAA + 4.4 μmol·L-1 6-BA)上培養2周誘導的不定芽;d.在不定芽復壯培養基(3/4MS + 0.054 μmol·L-1 NAA + 4.4 μmol·L-1)上復壯2周的不定芽;e.在不定芽復壯培養基上繼代培養2次獲得的植株。a.Callus induction on callus induction medium (MS with 8.1 μmol·L-1 NAA and 4.4 μmol·L-1 6-BA) after 5 weeks;b.Callus multiplication on callus subculture medium (MS with 0.27 μmol·L-1 NAA and 6.7 μmol·L-1 6-BA) after sub-cultured twice;c.Adventitious bud induction on shoot induction medium (3/4MS with 0.27 μmol·L-1 NAA and 4.4 μmol·L-16-BA) after 2 weeks;d.Shoot multiplication on shoot regeneration medium (3/4MS with 0.054 μmol·L-1 NAA and 4.4 μmol·L-1 6-BA) after 2 weeks;e.Plants on shoot regeneration medium after sub-cultured twice.
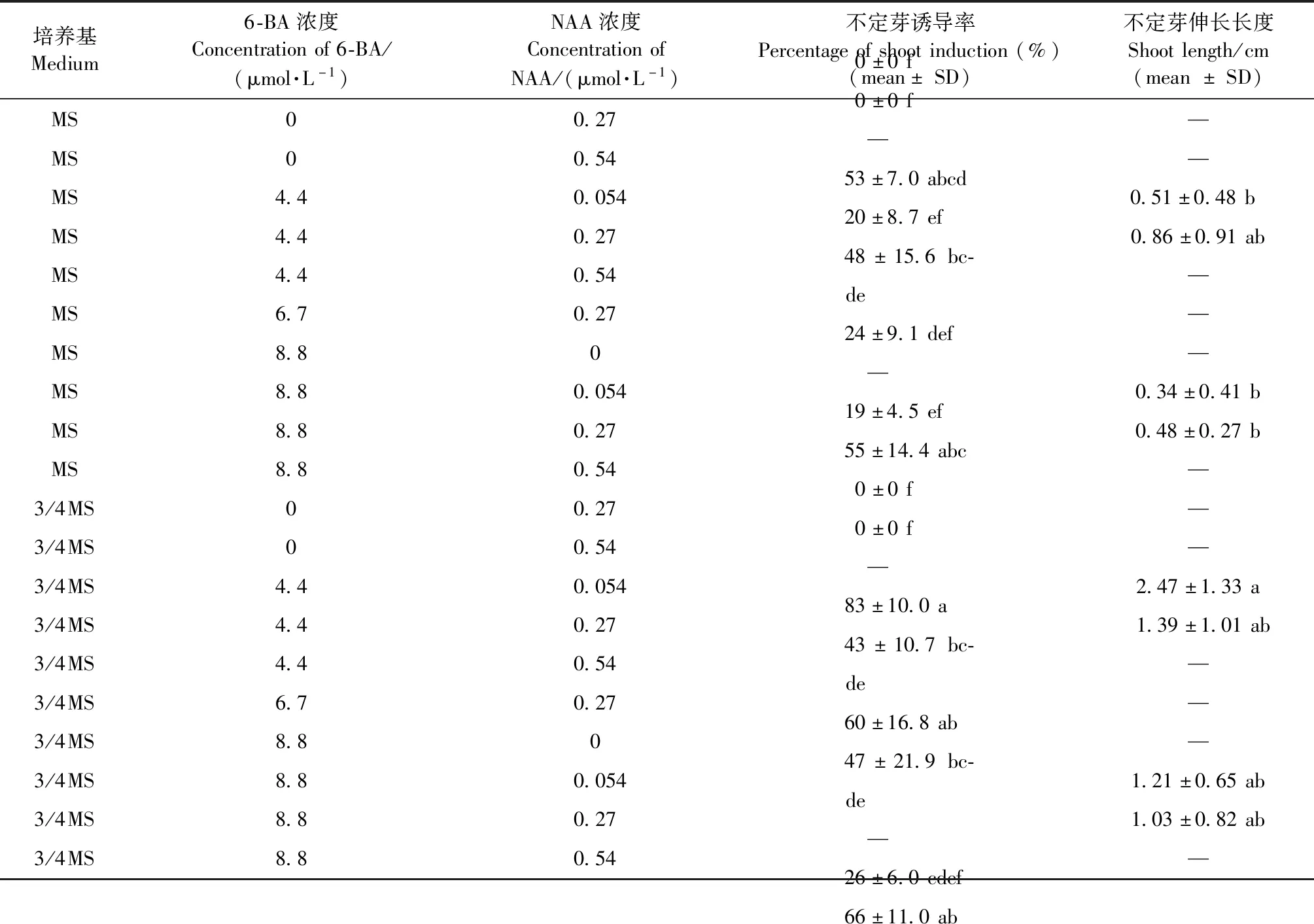
表2 不同濃度的大量元素、NAA、6-BA對杜仲不定芽誘導和復壯的影響①Tab.2 Effect of different concentrations of macro-element,NAA and 6-BA on shoot induction and regeneration
①SD表示來自3次試驗重復的標準差。數據后的小寫字母表示使用Tukey (P≤0.05)均值差異顯著性檢驗所劃分的差異顯著性。Data represent means ± SD from 3 biological replicates.Means followed by different letters are signicantly different using a Tukey test (P≤0.05).
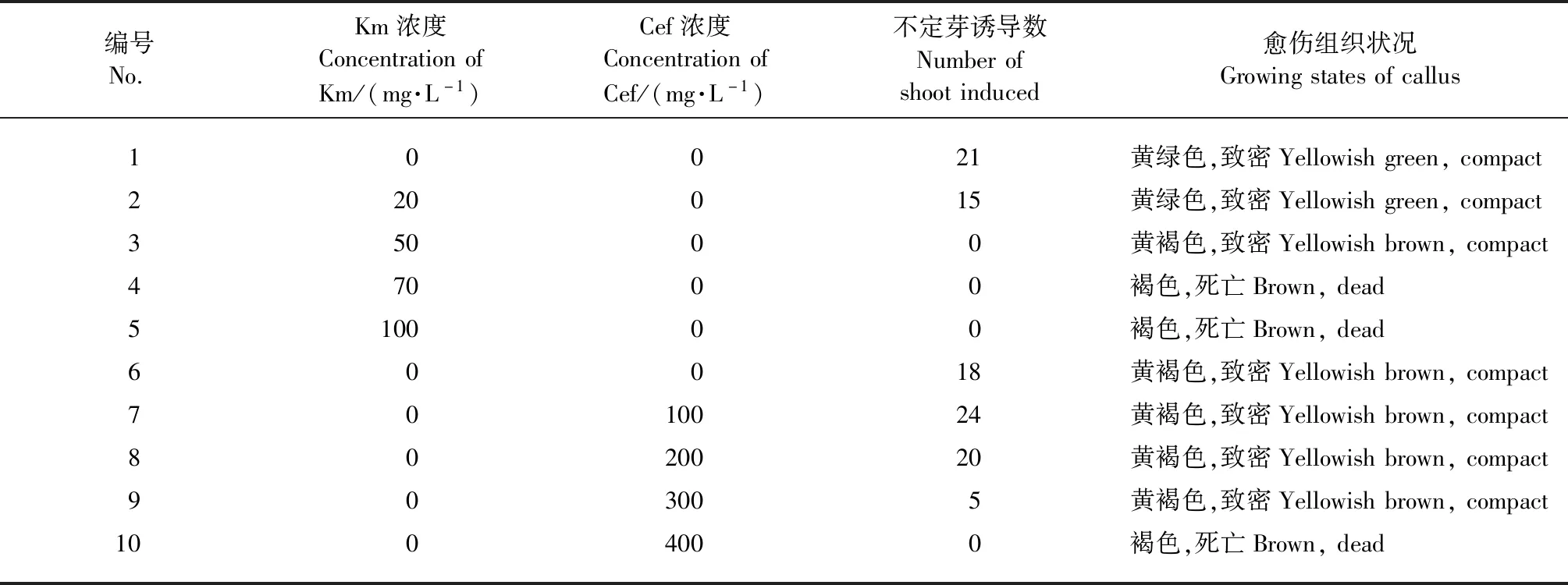
表3 頭孢霉素(Cef)與卡那霉素(Km)對不定芽誘導的影響Tab.3 Effects of different concentrations of Cef and Km on shoot induction
2.3 農桿菌介導的杜仲葉片愈傷組織遺傳轉化的轉化因子
通過L16(45)的正交試驗設計(表1),共進行了16組不同水平處理的轉化因子組合試驗,試驗結果表明:GUS瞬時表達率高的處理組合其愈傷組織染色程度(圖2)也更強(表4),其中侵染時間與共培養時間對GUS瞬時表達率有顯著影響(P≤0.05),即侵染時間與共培養時間顯著影響農桿菌介導杜仲葉片愈傷組織遺傳轉化效率,而AS濃度和預培養時間的影響不顯著(表5)。比較均值可以發現GUS瞬時表達率隨著侵染時間和共培養時間的增加以“S形”曲線上升(侵染時間的GUS瞬時表達率均值為:6 min 22.0%、8 min 16.0%、10 min 35.0%、15 min 33.8%;共培養時間的GUS瞬時表達率均值為:1天10.8%、2天16.5%、3天38.5%、4天41.0%),侵染10 min和共培養3天的GUS瞬時表達率達到了高值;4天的共培養時間雖然瞬時表達率均值更高,但提升較小并且對愈傷組織傷害較大。此外,雖然預培養時間對GUS瞬時表達率沒有顯著影響,但預培養5天的GUS瞬時表達率均值高于其他預培養時間(預培養時間的GUS瞬時表達率均值為:0天24.0%、2天17.8%、5天37.5%、10天27.5%)。根據這些試驗結果可以獲得農桿菌介導杜仲葉片愈傷組織遺傳轉化的最佳轉化因子組合是:預培養5天,侵染10 min,共培養3天。
2.4 抗性芽的檢測
總計約200塊愈傷組織進行了最適轉化因子組合的農桿菌介導的遺傳轉化,在選擇培養基上共獲得3個抗Km的抗性芽(圖3)。對抗性芽的葉片進行GUS組織化學染色,3個抗性芽葉片均呈藍色,而未進行遺傳轉化操作的愈傷組織和不定芽葉片的GUS組織化學染色均為無色(圖4),這表明GUS基因在抗性芽中得到了表達。使用NPTⅡ基因的特異引物對抗性芽、未進行遺傳轉化操作的不定芽葉片和pBI121質粒的PCR分析(圖5)表明:在抗性植株和pBI121質粒中檢測到NPTⅡ基因的465 bp擴增產物,而在未進行遺傳轉化的不定芽葉片中沒有該擴增產物。GUS檢驗與PCR分析初步證明T-DNA已經整合到了這些抗性芽的基因組中。

圖2 愈傷組織GUS組織化學染色評級模式Fig.2 Pattern of scoring for the histochemical GUS assay of callusa.空白對照;b.未染色;c.+(染色程度淺);d.++(染色程度中等);e.+++(染色程度強)。a.Blank control;b.Unstained;c.+(staining is shallow);d.++(staining moderate);e.+++(staining the strongest).
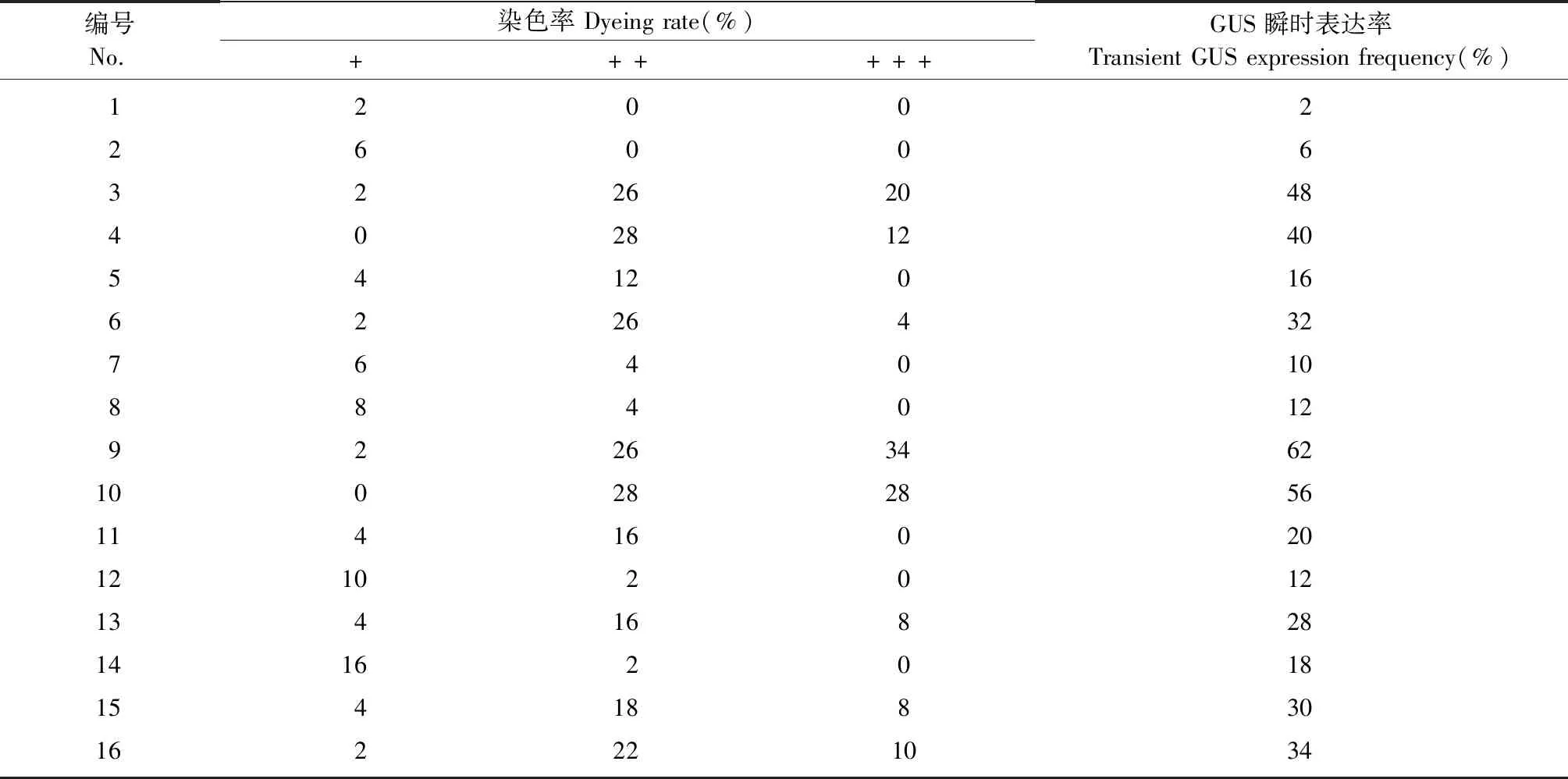
表4 轉化因子正交試驗的GUS瞬時表達①Tab.4 Transient GUS expression in L16 (45) matrix of factors of genetic transformation
① +、++和+++分別表示染色程度淺、中等和強的愈傷組織染色率(圖2)。+,++,and +++ indicate the staining rate of the callus with a light,medium and strong level(Fig.2).
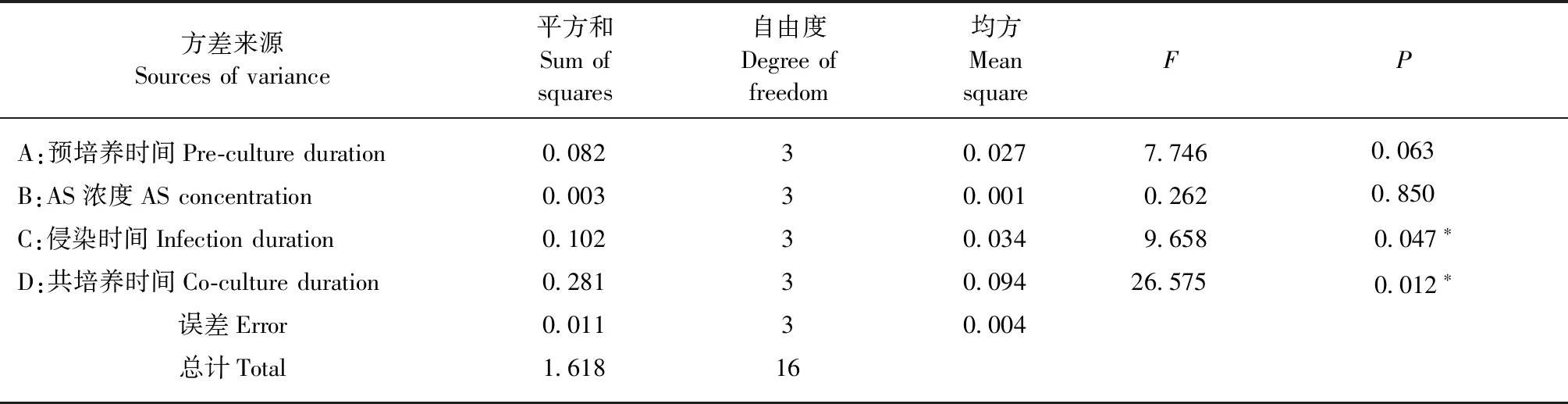
表5 轉化因子正交試驗GUS瞬時表達的方差分析①Tab.5 ANOVA of transient GUS expression frequency in L16 (45) matrix of factors of genetic transformation
①*:差異顯著Significant difference(P<0.05).

圖3 抗Km的抗性芽Fig.3 Km-resistant budsa,b,c.愈傷組織在篩選培養基上培養2周誘導出的3個抗性不定芽。a,b,c.A total of 3 Km-resistant buds induced on the selection medium (3/4MS + 0.054 μmol·L-1 NAA + 4.4 μmol·L-1 6-BA + 200 mg·L-1 Cef + 70 mg·L-1 Km) after 2 weeks.
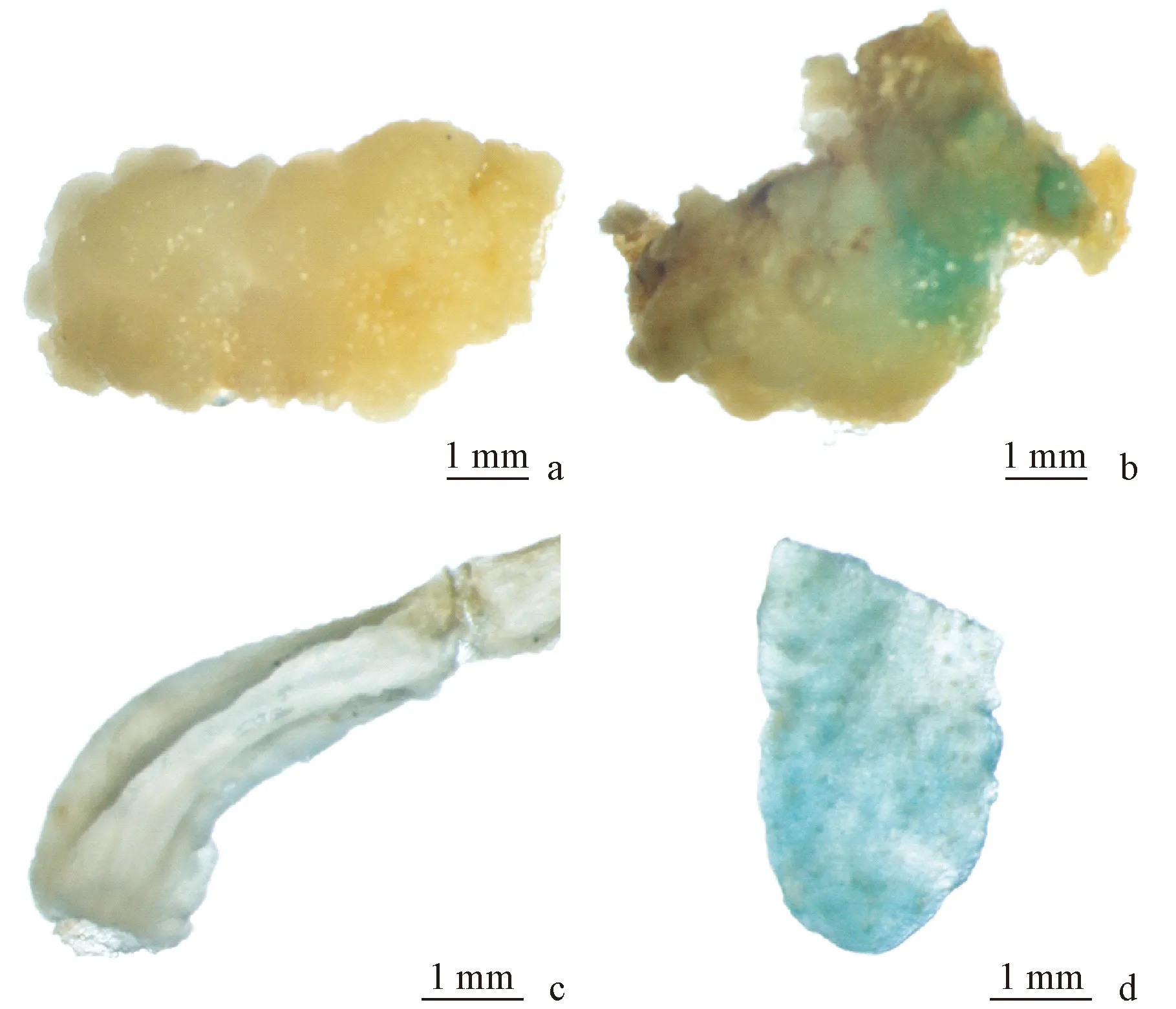
圖4 愈傷組織和抗性芽葉片的GUS組織化學染色Fig.4 Transient GUS expression of callus and leaf tissues of Km-resistant budsa,c.對照組(未進行遺傳轉化操作)愈傷組織和不定芽葉片的GUS組織化學染色;b.最適轉化因子組合進行遺傳轉化的愈傷組織的GUS組織化學染色;d.抗Km的抗性芽的GUS組織化學染色。a,c.GUS expression in callus and leaf tissues of controls (untransformed plants);b.GUS expression in callus of optimum transforming factors combination:pre-culture duration of 5 days,infection duration of 10 min and co-culture condition of 3 days;d.GUS expression in leaves of Km-resistant buds.

圖5 抗性芽、未進行遺傳轉化操作的不定芽葉片和pBI121質粒的PCR分析Fig.5 PCR analysis of putative transformants, binary vector pBI121 and controlsp:pBI121質粒;c:未進行遺傳轉化操作的不定芽葉片;1,2,3:獲得的3個抗性芽。p:Binary vector pBI121;c:Untransformed plant;1,2,3:Putative transformants.
3 討論
本研究優化了杜仲葉片愈傷組織的再生體系,對影響農桿菌介導的杜仲葉片愈傷組織遺傳轉化的轉化因子進行了研究。長期以來,杜仲只有一種以下胚軸為受體的遺傳轉化體系(趙丹等,2009;李巖等,2011),下胚軸為子代材料,無法代表該優良品種的遺傳背景(Sidorovaetal.,2017)。如今,這一缺點可以通過使用成年杜仲葉片愈傷組織的遺傳轉化體系來克服。
構建農桿菌介導的遺傳轉化體系,建立受體系統的再生體系是前提條件(Gorpenchenkoetal.,2006)。本研究分析了NAA和6-BA對杜仲愈傷組織誘導不定芽以及不定芽復壯的影響,其結果與金曉玲等(2014)的研究結果相似;此外,本研究還發現MS培養基只添加3/4濃度的大量元素對杜仲葉片愈傷組織誘導不定芽以及不定芽的復壯有顯著的促進作用。植物組織培養中,大量元素濃度是重要的影響因素之一,然而由于大部分試驗中均使用MS培養基,大量元素濃度對杜仲再生體系的影響被忽視。一些研究表明,大量元素濃度能夠顯著影響不定芽的培養(Azadietal.,2010;Zhaoetal.,2014;周新華等,2017),甚至影響農桿菌介導的轉化效率(Naiketal.,2011)。其原因可能是大量元素的減少使得培養基中鹽濃度降低,促使酚的代謝減少,大大減輕褐化現象,而褐化是愈傷組織繼代培養和不定芽誘導最主要的干擾因素之一。此外,早在1980年,Lloyd和McCown就發現山月桂(Kalmialatifolia)的莖尖培養更適合于低鹽培養基,從而開發了WPM(woody plant medium)木本植物培養基(Lloydetal.,1980)。本研究的結果也表明,杜仲更加適合于低鹽培養基中培養,這一結果值得進一步研究。
考慮到多因素研究的復雜性,本研究采用了正交試驗研究4種轉化因子(預培養時間、AS濃度、侵染時間、共培養條件)對GUS瞬時表達率的影響。結果表明侵染時間和共培養條件是影響農桿菌介導杜仲愈傷組織遺傳轉化的主要因素,而AS濃度和預培養時間對其影響不明顯。與其他植物相同,侵染時間對杜仲愈傷組織的遺傳轉化至關重要,較長的時間能夠提高轉化效率。在本研究中,10 min的侵染時間達到了最高的GUS瞬時表達率并且有較低的愈傷組織死亡率,這一侵染時間與杜仲的下胚軸轉化體系相同,但比大部分木本植物短,這可能是由于杜仲對農桿菌EHA105有更高的敏感性(李巖等,2011)。較長的共培養時間則有利于農桿菌將T-DNA轉化到植物基因組中(Kondoetal.,2000)。不過,本研究的結果表明,4天共培養時間的GUS瞬時表達率均值雖高于3天,但提升較小并且對愈傷組織傷害較大,一些其他植物遺傳轉化的研究結果表明共培養時間不宜超過3天,長期的共培養會使農桿菌過度生長從而導致轉化效率降低(Cerveraetal.,1998;Curtisetal.,1999;Yangetal.,2010)。
本研究中獲得的3個抗性芽經PCR分析和GUS組織化學染色檢驗證明,T-DNA已整合到了抗性芽基因組中,表明這一遺傳轉化體系能夠將基因導入成熟植株的組織培養材料中,為杜仲基因功能與遺傳改良的研究奠定了基礎。在今后的研究中可以進一步優化不定芽復壯后的再生體系,完善整個轉化系統,獲得轉基因植株。
4 結論
本研究對杜仲以葉片為外植體的再生過程進行了優化,并對影響農桿菌介導的杜仲愈傷組織遺傳轉化因子進行了研究。結果表明,添加3/4大量元素濃度的MS培養基對不定芽誘導和復壯有顯著的促進作用,愈傷組織誘導不定芽最適培養基:3/4MS + 0.27 μmol·L-1NAA + 4.4 μmol·L-16-BA,不定芽復壯的最適培養基:3/4MS + 0.054 μmol·L-1NAA + 4.4 μmol·L-16-BA。農桿菌介導杜仲葉片愈傷組織遺傳轉化最適合的轉化因子組合為:預培養5天、侵染10 min和共培養3天,篩選培養基為3/4MS + 0.054 μmol·L-1NAA + 4.4 μmol·L-16-BA+200 mg·L-1Cef + 70 mg·L-1Km。利用此體系共獲得了3個抗性芽,PCR分析和GUS組織化學染色都表明T-DNA已整合到抗性芽基因組中。

