人源溶菌酶在大腸桿菌中的表達與復性研究
張春晨 胡雙艷 阮海華
(天津商業大學生物技術與食品科學學院,天津 300134)
溶菌酶,又稱胞壁質酶,是由亞歷山大·弗萊明發現并命名的一種多糖水解酶[1],能夠水解細菌細胞壁肽聚糖中N-乙酰胞壁酸和N-乙酰-D-葡萄糖胺之間的β-1,4-糖苷鍵,導致細菌死亡[2]。基于溶菌酶的氨基酸序列和生物化學性質,其被分為3種類型:C型(Chicken or Conventional type),G型(Goose type)和 I型(Invertebrate type)[3]。人源溶菌酶(Human lysozyme,HLZ)屬于C型溶菌酶,是一種由130個氨基酸組成的分子量約為14.7 kD的單體蛋白[4-5]。其氨基酸序列中富含堿性氨基酸、帶正電荷、等電點(pI)約為11.0[6]。人源溶菌酶的空間結構如圖1所示,它是由3個α螺旋(H1、H2和H3)與3個β折疊(S1、S2和S3)進一步卷曲折疊構成的具有特定構象的緊湊結構(圖1-A)[7-8]。其結構中所含有的4對二硫鍵(-S-S-)在穩定其空間結構和蛋白復性中具有重要作用(圖1-B)[9]。
人源溶菌酶廣泛分布于人體器官、細胞和體液中[6,10]。已報道的含有人源溶菌酶的器官有肺、腎、胎盤等;細胞有巨噬細胞、白細胞等;體液有眼淚、唾液、尿液、血清和乳汁等[11]。其作為一種非特異性免疫因子和抗炎因子,人源溶菌酶在人體防御機制中扮演著重要角色[12]。此外,很多研究表明人源溶菌酶還具有抗真菌和抗病毒的作用[13-14]。在活性方面,其抗菌活性是雞蛋清溶菌酶的3倍,是牛溶菌酶的10倍[15]。目前,人源溶菌酶已經被廣泛應用于食品加工(食品防腐劑、保鮮劑、嬰幼兒奶粉配方)、畜牧業、化妝品及醫藥等領域[16-19]。
然而,天然人源溶菌酶來源缺乏,不能充分提供產品,限制了人源溶菌酶的廣泛應用。基因工程技術的發展使得人源溶菌酶已經在很多微生物系統中成功表達,如真菌、植物和動物等[20-22]。和這些生物反應器相比,大腸桿菌表達系統作為蛋白質異體表達最常用的宿主系統,具有成本低、蛋白表達量高、繁殖周期短、操作簡便以及產品純凈等優點[23-24]。然而,在大腸桿菌中表達的重組人源溶菌酶在細胞內常以不溶性的沒有生物活性的包涵體形式累積,從這些包涵體中恢復其生物活性成為DNA重組技術廣泛應用的一個難題[25]。對于富含二硫鍵的人源溶菌酶而言,如何在體外復性過程中有效地形成正確配對的二硫鍵是復性的關鍵性問題之一[26-27]。
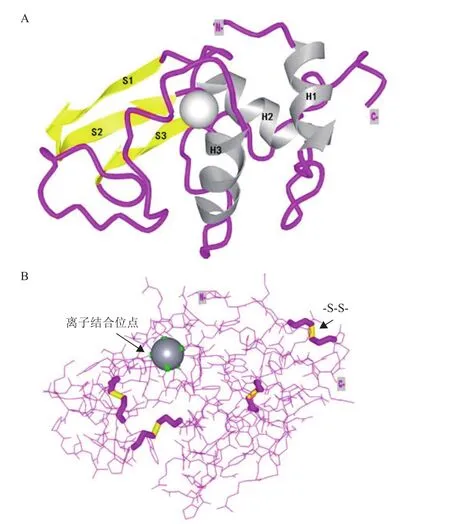
圖1 人源溶菌酶的空間結構圖
本研究旨在將人源溶菌酶編碼基因的密碼子進行優化,構建能夠在大腸桿菌中高效表達的系統,并進一步通過包涵體體外復性技術獲得具有高生物活性的人源溶菌酶。同時探究一步透析、梯度透析和梯度稀釋3種復性方式以及復性液中谷胱甘肽氧化還原對(GSSG/GSH)、精氨酸、甘油等復性物的濃度對重組人源溶菌酶復性的影響,獲得最佳的復性方案[28-30]。
1 材料與方法
1.1 材料
1.1.1 質粒和菌株 原核表達載體pET21a由本實驗室提供;大腸桿菌Trans10和BL21(DE3)感受態細胞購買于北京全式金生物有限公司;溶壁微球菌由北京北納創聯生物技術研究院提供。
1.1.2 酶和試劑 人源溶菌酶標準品購買于北京經科宏達生物技術有限公司;NdeⅠ和XhoⅠ限制性核酸內切酶購買于日本TaKaRa公司;T4 DNA連接酶購買于美國Promega公司;DNA Marker 5000購買于康為世紀生物科技有限公司;瓊脂糖、尿素、DTT、EDTA、Triton X-100、IPTG、PMSF購買于美國Amresco公司;普通瓊脂糖凝膠DNA回收試劑盒、質粒DNA提取試劑盒購買于北京天根公司;PageRuler Prestained Protein Marker購買于美國Thermo Scientific公司。
1.1.3 儀器與設備 Allegra-64R高速低溫離心機(美國Beckman公司);SpectraMax M5多功能讀板機(美國Molecular Device公司);AlphaImager Mini凝膠成像系統(美國ProteinSimple公司);5430R小型臺式高速冷凍離心機(美國Eppendorf公司);SPX-150生化培養箱(上海申賢恒溫設備廠);HZQ-QX全溫振蕩器(哈爾濱東聯電子技術開發有限公司);JY98-Ⅲ超聲波細胞破碎儀(寧波新芝生物科技有限公司)。
1.2 方法
1.2.1 人源溶菌酶基因的優化與合成 利用NCBI網站對人源溶菌酶的氨基酸序列進行BLAST比對,得到其基因序列(基因號:D00413.1)。由于大腸桿菌對密碼子的偏好性會影響到基因的表達水平,因此,根據大腸桿菌密碼子使用頻率表對人源溶菌酶基因進行優化。根據pET21a質粒多克隆位點,選擇在基因序列的5'端引入NdeⅠ酶切位點(5'CA^TATG3'),在3'端引入XhoⅠ酶切位點(5'C^TCGAG3')。最后,將設計好的目的基因序列交由南京金斯瑞生物科技有限公司進行合成。
1.2.2 在大腸桿菌中表達重組人源溶菌酶表達載體的構建 利用NdeⅠ和XhoⅠ對含有合成人源溶菌酶基因的pUC57-HLZ質粒進行雙酶切后,利用瓊脂糖凝膠回收試劑盒回收目標DNA片段。將回收后的HLZ基因與pET21a連接后篩選pET21a-HLZ陽性克隆交由上海生工有限公司進行DNA測序驗證。
1.2.3 人源溶菌酶在大腸桿菌中的誘導表達及可溶性檢測 將重組質粒pET21a-HLZ轉化至大腸桿菌BL21(DE3)感受態細胞,挑取單克隆至5 mL 含氨芐的LB液體培養基中,并于37℃、200 r/min條件下振蕩培養過夜。將過夜培養物按照1%接種量接入LB培養基中,繼續振蕩培養至菌液OD600nm在0.6-0.8之間。向培養物中加入終濃度為0.5 mmol/L的IPTG誘導劑,于37℃下誘導培養6 h;將培養液于4℃、4 000 r/min條件下離心30 min,棄上清,保留菌體沉淀;將上述收集的菌體利用50 mmol/L Tris-HCl(pH8.0),內含 150 mmol/L NaCl、1 mmol/L PMSF的緩沖溶液于冰上進行超聲破碎,超聲3 s、間隔7 s,超聲約20 min至懸液半透明;將上述菌液于12 000 r/min、4℃條件下離心20 min,分離上清和沉淀。取適量誘導前后菌體以及菌體破碎后的上清和沉淀,加入5×SDS上樣緩沖液混勻,煮沸10min后離心1 min,進行SDS-PAGE檢測,觀察蛋白表達情況,以未經IPTG誘導的菌為陰性對照。
1.2.4 人源溶菌酶包涵體復性條件的研究 首先,利用洗滌液(50 mmol/L Tris-HCl pH 8.0、100 mmol/L NaCl、2 mol/L尿素、1 mmol/L EDTA)對包涵體進行洗滌以除去包涵體中的脂類和部分雜蛋白。然后,將上述溶液于12 000 r/min、4℃條件下離心20 min,保留沉淀,沉淀即為粗制的包涵體。最后,利用變性液(50 mmol/L Tris-HCl pH8.0、20 mmol/L DTT、8mol/L尿素)對洗滌后的包涵體進行溶解,在4℃攪拌變性1-2 h,離心20 min,收集上清,上清即為包涵體溶解液。
1.2.4.1 復性方式對人源溶菌酶復性的影響 利用 復 性 液(50 mmol/L Tris-HCl pH 8.0、50 mmol/L NaCl、1 mmol/L EDTA)分別探究一步透析、梯度透析和梯度稀釋3種復性方式對人源溶菌酶復性的效果。一步透析法是將適量的包涵體溶解液置于上述復性液中進行透析,4℃磁力攪拌12-24 h,中途換一次復性液。然后,將復性后溶液于12 000 r/min、4℃條件下離心20 min,保留上清。梯度透析法是以2倍的梯度將包涵體溶解液依次置于含有4 mol/L、2 mol/L、1 mol/L、0.5 mol/L和0.25 mol/L,以及不含尿素的復性液中進行透析,每隔3 h換液,將透析后溶液離心后保留上清。梯度稀釋法是以2倍的梯度(2、4、6、8和16倍)對包涵體溶解液進行逐級稀釋直至尿素濃度達到0.5 mol/L,稀釋過程中要將含有目標蛋白的溶液緩慢滴加至復性液中以減少蛋白聚集,稀釋完畢后將蛋白溶液于不含尿素的復性液中進行透析。
1.2.4.2 GSSG/GSH濃度比值對人源溶菌酶復性的影響 當復性液中分別添加濃度比為1∶1、1∶2、1∶3、1∶4和1∶5的GSSG/GSH時,利用上一步確定好的最佳復性方式對包涵體進行復性,然后依據方法1.2.5進行抗菌活性檢測,進而確定GSSG/GSH最佳濃度比例。
1.2.4.3 精氨酸濃度對人源溶菌酶復性的影響 同樣地,當復性液中分別添加1、2、3、4和5 mmol/L精氨酸時,利用最佳復性方式進行復性,根據不同條件下的酶比活力值來確定精氨酸的最佳濃度。
1.2.4.4 甘油濃度對人源溶菌酶復性的影響 當復性液中分別添加2%、4%、6%、8%和10%甘油時,同樣通過最佳復性方式對包涵體進行復性,探究甘油的最佳添加量。最后,根據上述實驗結果,利用最佳復性方式以及同時添加最佳濃度的GSSG/GSH、精氨酸和甘油的復性液對包涵體進行復性,然后測定人源溶菌酶的最佳酶比活力,與人源溶菌酶標準品的比活力值進行比較。
1.2.5 人源溶菌酶抗菌活性的檢測 利用瓊脂板擴散法來檢測上述復性后人源溶菌酶的抗菌活性[6],即根據樣品能否抑制底物(溶壁微球菌)生長從而產生透明的抑菌圈來初步判斷復性是否成功。以復性液和人溶菌酶標準品分別作為空白對照和陽性對照,重復3次。
利用比濁法來測定人源溶菌酶的比活力值[6]。酶比活力的定義是:在pH 6.2、25℃反應條件下,單位質量的溶菌酶每分鐘引起細菌懸液OD450nm的變化值為1個酶活力單位(U)[5]。利用磷酸鈉緩沖液(pH 6.2)制備溶壁微球菌懸液使其OD450nm約為0.7;將底物與酶液或緩沖液(空白對照)按照一定比例混合后立即測定OD450nm,每隔10 min測一次。每組設定3個平行。酶比活力計算公式為:酶比活力(U/mg)= 酶活力(U/mL)/濃度(mg/mL)。
2 結果
2.1 人源溶菌酶基因的優化與合成
為了提高人源溶菌酶在大腸桿菌中的表達效率,根據大腸桿菌密碼子使用頻率表對人源溶菌酶基因中的密碼子使用頻率進行分析,結果如圖2所示,縱坐標代表密碼子的使用頻率,橫坐標為氨基酸對應的密碼子,綠色和紅色分別代表使用頻率高于和低于10%的密碼子。從圖中可知,該序列中使用頻率低于10%的密碼子數量占總數的12%(17/131),在理想范圍內(0-30%)。經過優化后的人源溶菌酶基因序列如下圖3所示。
2.2 在大腸桿菌中表達重組人源溶菌酶表達載體的構建
將含有合成人源溶菌酶基因片段的pUC57-HLZ質粒進行亞克隆連接至pET21a構建重組表達質粒pET21a-HLZ,挑取陽性克隆進行測序驗證,測序結果表明重組質粒中的目的基因序列正確,表明重組表達質粒pET21a-HLZ構建成功。
2.3 人源溶菌酶的誘導表達及可溶性檢測
如圖4-A所示,在37℃誘導溫度下,利用0.5 mmol/L IPTG誘導重組菌表達后發現與未誘導的大腸桿菌相比,IPTG成功誘導了一條分子量介于10-17 kD間的蛋白質的表達,該蛋白的分子量與預期的人源溶菌酶的分子量(14.7 kD)相近。將大腸桿菌進行超聲破碎后離心,分別取上清和沉淀進行SDSPAGE電泳,發現表達人源溶菌酶的大腸桿菌上清中幾乎沒有重組蛋白的存在,絕大部分人源溶菌酶在沉淀中以包涵體的形式存在。
如圖4-B所示,利用含有2 mol/L尿素的洗滌液對包涵體進行洗滌3次,除去雜蛋白后再使用含有8 mol/L尿素的變性液對洗滌后的包涵體進行變性溶解,得到了較純的分子量為14.7 kD的溶菌酶。
2.4 人源溶菌酶包涵體復性條件的研究
2.4.1 復性方式對人源溶菌酶復性的影響 包涵體經一步透析、梯度透析及梯度稀釋3種復性方式進行復性后進行抑菌活性檢測,結果如圖5-A所示,空白對照未產生抑菌圈,經梯度透析復性后人源溶菌酶產生的抑菌圈最大,其次是經梯度稀釋和一步透析復性后樣品,但遠小于人源溶菌酶標準品產生的抑菌圈。比濁法實驗結果如圖5-B所示,以上3種復性方式以及標準品對應的酶比活力值分別為147 U/mg、335 U/mg、176 U/mg 和 1 732 U/mg,表明最佳復性方式是梯度透析復性法。
2.4.2 GSSG/GSH濃度比值對人源溶菌酶復性的影響 如圖6-A所示,空白對照無抑菌活性,當復性液中分別添加濃度比為1∶1、1∶2、1∶3和1∶4的GSSG/GSH時,經梯度透析復性后人源溶菌酶產生的抑菌圈均大于未加及添加1∶5的GSSG/GSH時復性后人源溶菌酶產生的抑菌圈,其中1∶2的GSSG/GSH對應的抑菌圈最大,但比標準品產生的抑菌圈小。
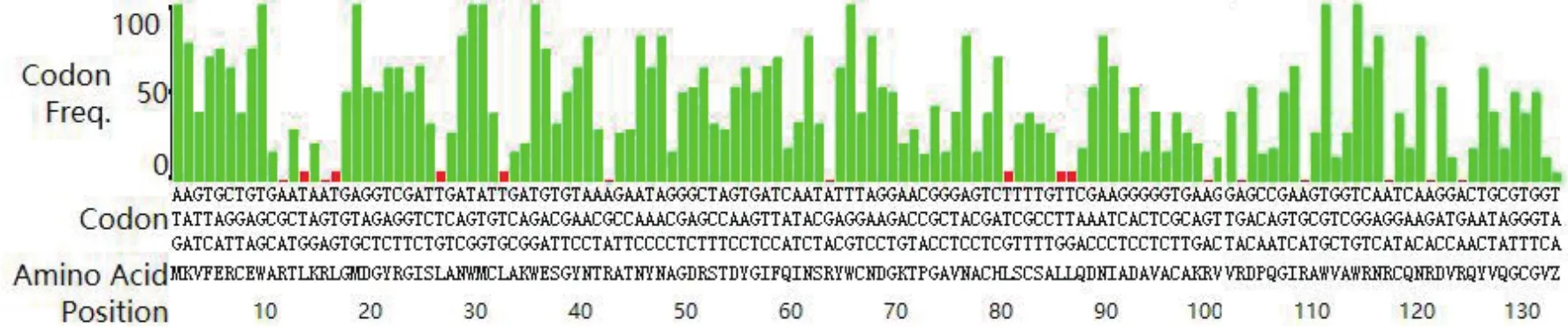
圖2 人源溶菌酶基因的密碼子分析結果

圖3 人源溶菌酶的DNA序列
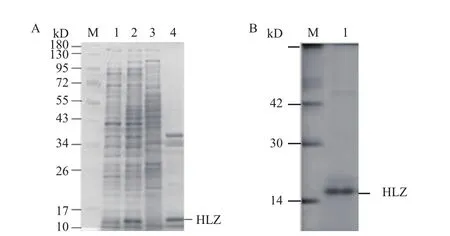
圖4 人源溶菌酶在大腸桿菌中誘導表達及純化的SDSPAGE電泳圖
從圖6-B可知,0∶0、1∶1、1∶2、1∶3、1∶4和1∶5的GSSG/GSH以及標準品對應的酶比活力分別為 335 U/mg、642 U/mg、928 U/mg、766 U/mg、574 U/mg、517 U/mg和1 732 U/mg,表明GSSG/GSH的最佳濃度比例是1∶2。
2.4.3 精氨酸濃度對人源溶菌酶復性的影響 如圖7-A所示,空白對照未產生抑菌圈,當復性液中未加以及分別添加1、2、3、4和5 mmol/L精氨酸時,4 mmol/L精氨酸條件下復性的人源溶菌酶產生的抑菌圈比其他濃度精氨酸條件下復性的人源溶菌酶的抑菌圈大,但小于標準品產生的抑菌圈。
從圖7-B可知,當復性液中未加以及分別添加1、2、3、4和5 mmol/L精氨酸時,測得酶比活力值分別為 335 U/mg、485 U/mg、519 U/mg、636 U/mg、786 U/mg和703 U/mg,均低于標準品1 732 U/mg的比活力值,表明精氨酸的最佳濃度是4 mmol/L。
2.4.4 甘油濃度對人源溶菌酶復性的影響 如圖8-A所示,空白對照未產生抑菌圈,當復性液中添加6%甘油時,復性后人源溶菌酶產生的抑菌圈明顯比未加以及添加2%、4%、8%和10%甘油條件下的抑菌圈大,但比標準品的抑菌圈小。
從圖8-B中可以看出,當復性溶液中不加以及分別添加2%、4%、6%、8%和10%甘油時,測得復性后人源溶菌酶的比活力分別為335 U/mg、422U/mg、504 U/mg、612 U/mg、571 U/mg 和 562 U/mg,均低于標準品1 732 U/mg的比活力值。因此,甘油的最佳添加量為6%。
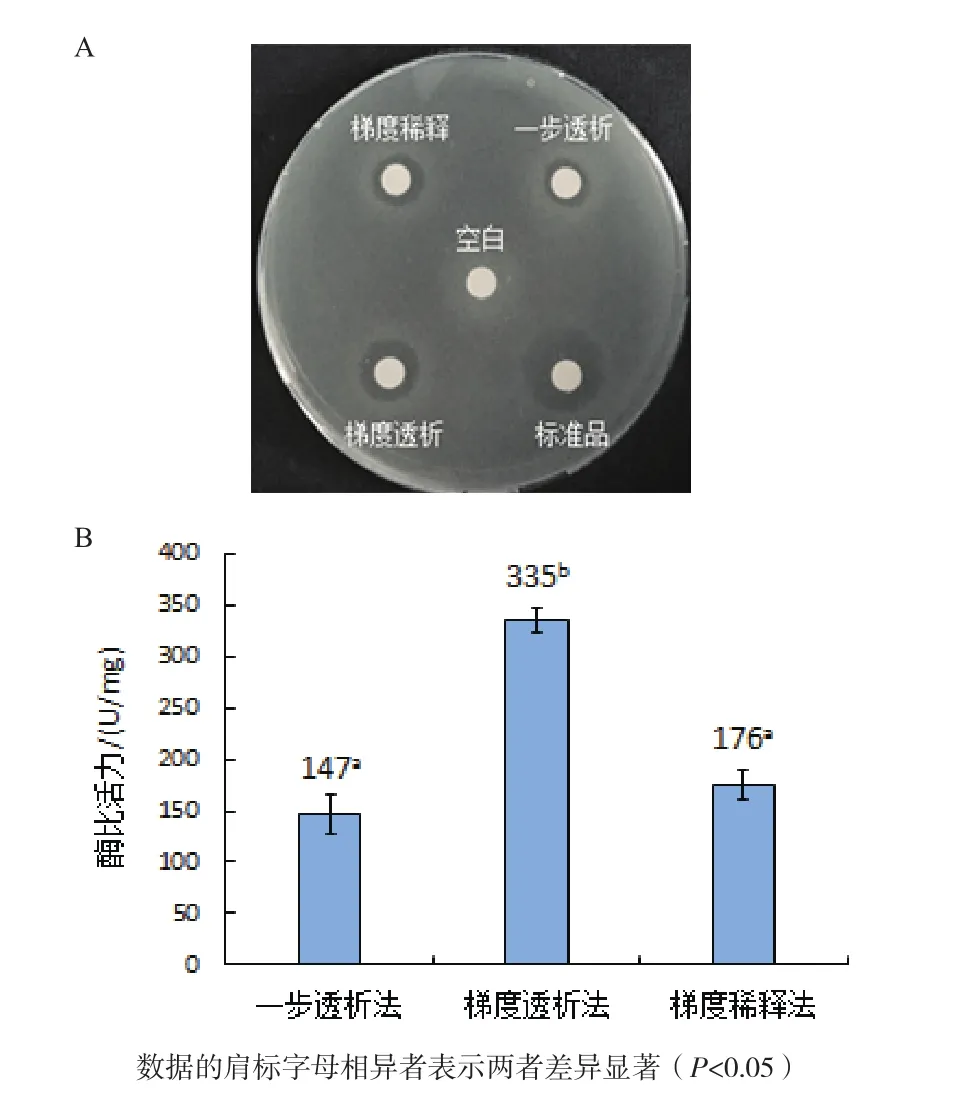
圖5 復性方式對人源溶菌酶復性的影響
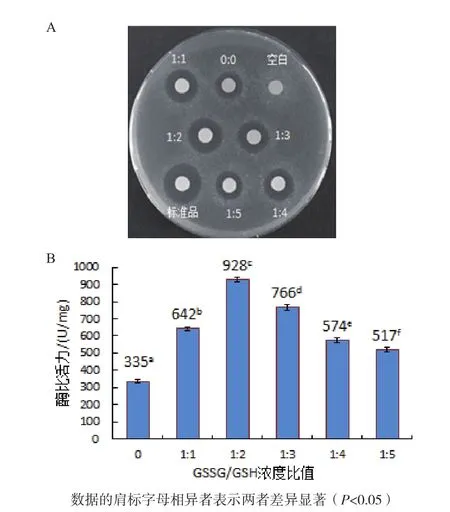
圖6 GSSG/GSH濃度比值對人源溶菌酶復性的影響
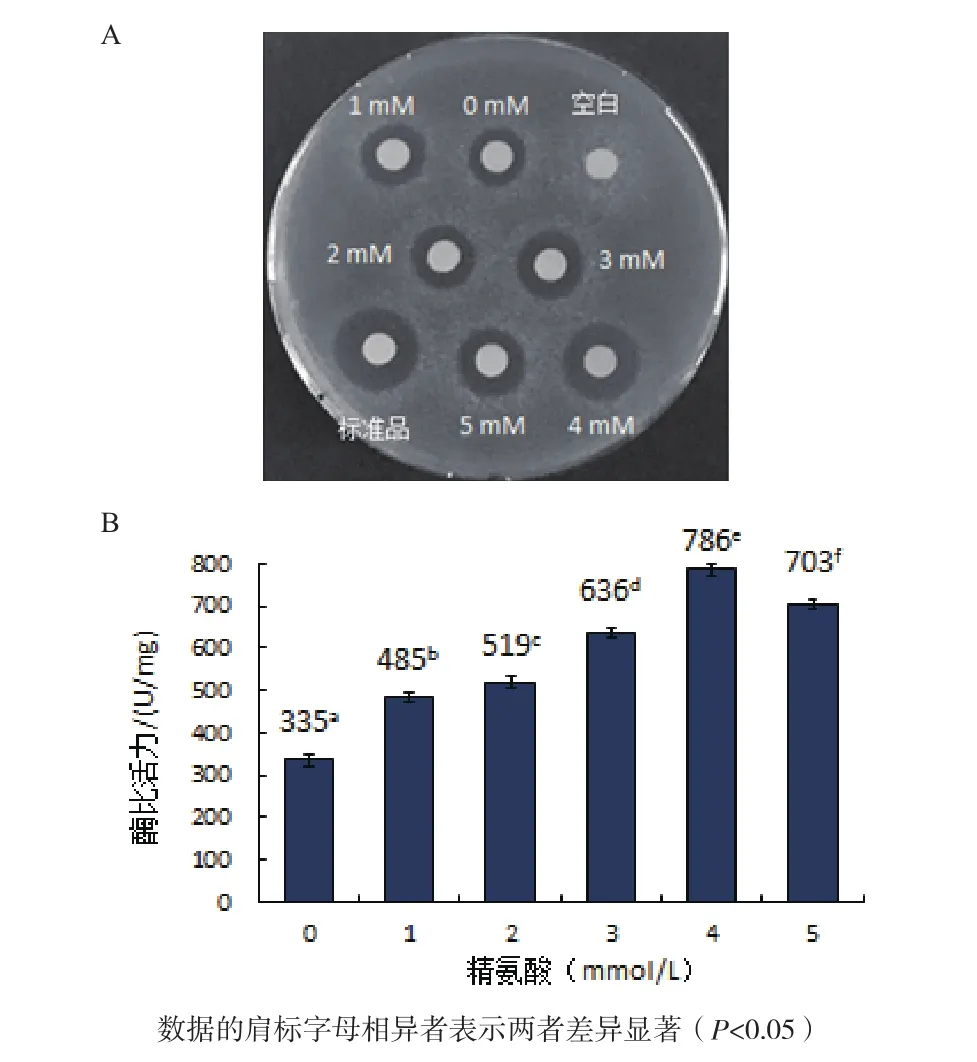
圖7 精氨酸濃度對人源溶菌酶復性的影響
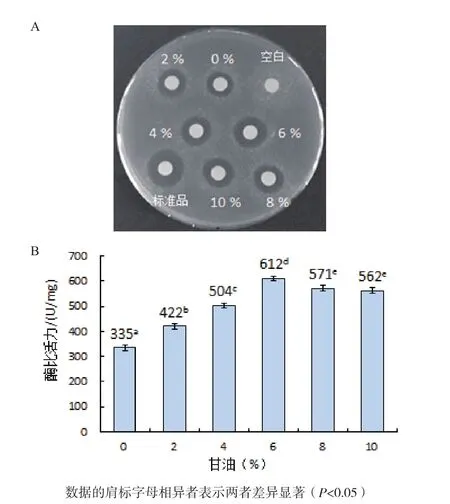
圖8 甘油濃度對人源溶菌酶復性的影響
如圖9-A所示,空白組無抑菌活性,當復性液中同時添加濃度比為1∶2的GSSG/GSH、4 mmol/L精氨酸和6%甘油時,復性后人源溶菌酶產生的抑菌圈明顯比未加復性物時人源溶菌酶產生的抑菌圈大,而且與標準品的抑菌圈大小接近。
從圖9-B可知,3種復性物均加時的最佳比活力值為1 170 U/mg,遠高于3種復性物均不加時人源溶菌酶335 U/mg的比活力值,但低于人溶菌酶標準品1 732 U/mg的比活力值。
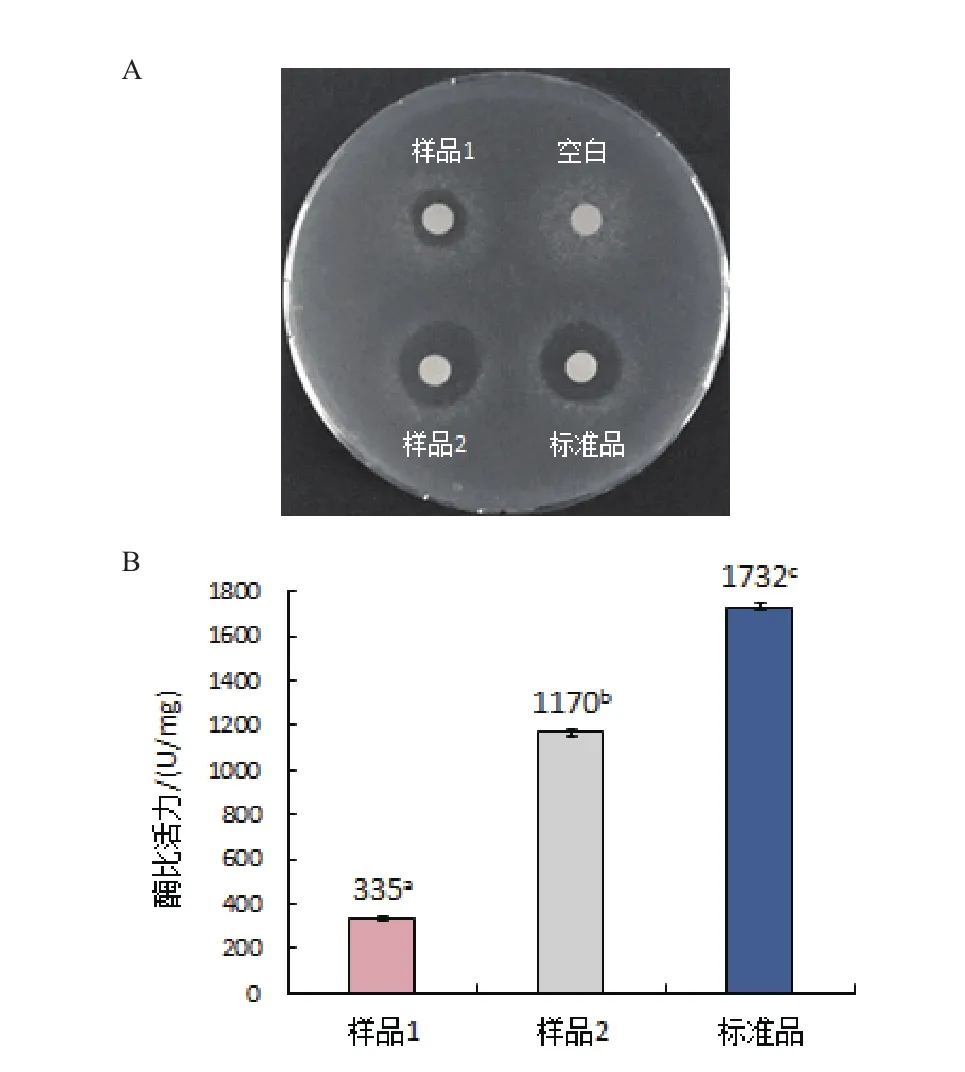
圖9 最佳濃度的復性物對人源溶菌酶復性的影響
3 討論
溶菌酶具有安全、無毒、無副作用等優良特性,目前已經被廣泛應用于食品添加劑、防腐劑、嬰幼兒奶粉配方以及保健品中,市場上對溶菌酶制劑的需求量與日俱增[31]。國內溶菌酶的主要來源是從雞蛋的蛋清和蛋殼中提取,國外則以動物和霉菌為原料進行生產[32]。然而雞源溶菌酶活性僅僅是人源溶菌酶活性的三分之一,同時有部分人群對溶菌酶制劑過敏,有研究表明過敏源來自于蛋清[33]。所以人源溶菌酶可能是其未來最好的替代品。
1986年,Jigami等[34]在人源溶菌酶前接上一段雞源溶菌酶信號肽,從啤酒酵母中分泌出了有活性的人源溶菌酶。1987年,Hayakawa[35]利用啤酒酵母成功表達出重組人源溶菌酶,但是因其以包涵體形式存在而不具有活性,而后在大腸桿菌中表達,又存在溶菌酶產量小和活性低的問題。2006年,Maga等[36]在山羊乳腺中成功表達人源溶菌酶成功抑制了引起乳腺炎和牛奶冷腐敗的細菌生長。李寧院士[37]團隊2011年在豬乳腺上得到人源溶菌酶表達,并獲得高產和穩定遺傳。人源溶菌酶已經在很多生物系統中成功表達,其中,真菌表達系統雖然表達水平高,但是目的蛋白易發生翻譯后修飾,如糖基化、磷酸化等修飾;植物和動物表達系統存在繁殖周期長、操作復雜等缺點,而且動物表達系統容易使溶菌酶產品污染致病菌。本研究成功將人源溶菌酶基因在大腸桿菌中表達,但是溶菌酶以包涵體的形式存在。眾所周知,包涵體蛋白利用的局限性在于缺乏有效的復性方法。本研究通過包涵體體外復性技術成功獲得了具有高活性的人源溶菌酶。在復性過程中,使用溫和的增溶過程保留蛋白質的部分二級結構,并尋找合適比例的GSSG/GSH氧化還原劑和甘油溶液,為促進人源溶菌酶正確二硫鍵的形成提供更佳的氧化還原環境和滲透壓,提高復性效率,這也是從包涵體中回收生物活性蛋白的關鍵[38]。
雖然,本研究成功實現人源蛋白質在大腸桿菌中表達并成功復性,但如果用于大批量生產,其復性率和酶活力還有待進一步提高。而且,IPTG誘導劑的價格昂貴,具有毒性,不適合批量生產,所以下一步可以從以下兩個方面改進。第一,選擇帶有溫控啟動子的表達載體,其成本低,安全無毒;第二,進一步研究蛋白質復性機制,尋找更加溫和的變性劑,減少蛋白質在復性過程中發生聚集。目前,開發易操作、新型高效且普適性好的蛋白質復性方法是生物工程下游純化技術的研究熱點,也是基因工程蛋白質產業化發展的需要[39]。
4 結論
優化人源溶菌酶編碼基因密碼子在大腸桿菌菌株BL21(DE3)中成功誘導表達,并利用包涵體復性體系在復性液中同時添加濃度比為1∶2的GSSG/GSH、4 mmol/L精氨酸和6%甘油時使用梯度透析法成功復性出人源溶菌酶,其比活力值為1 170 U/mg。

