伴糖尿病的新型冠狀病毒肺炎患者的臨床特征分析
梁 波, 蔡艷萍
新型冠狀病毒肺炎(corona virus disease 2019,COVID-19)傳染性強,傳播快。從目前獲得的臨床數據看,新型冠狀病毒引起被感染者肺部嚴重損傷,以終末支氣管和肺泡為主,其他重要臟器如心臟、腎臟、腸道均出現病理性改變,但非直接致死損傷[1]。普通型COVID-19患者好轉率高,重型和危重型患者肺部病變進展快,且多數患者存在并發癥,搶救難度大,病死率高[2]。多項研究表明,COVID-19患者合并其他疾病中,糖尿病和心血管疾病的比例最高[2-5]。目前中國成年人群糖尿病患病率為11.2%。糖尿病導致患者本身易患感染性疾病,血糖控制不佳能加重感染性疾病的病情和病程,同時機體感染也會影響血糖波動,加重糖尿病并發癥的發生、發展[6]。筆者回顧性分析2020年1—3月武漢市金銀潭醫院某綜合病區COVID-19患者的臨床資料,提高對伴糖尿病COVID-19患者的診治,為制訂進一步的防控和診療措施提供依據。
1 對象與方法
1.1對象 322例中,男性169例(52.48%),女性153例(47.52%),年齡(56.56±36.33)歲(24~93歲)。合并糖尿病41例(12.73%),合并高血壓病71例(22.05%),同時合并多個慢性病(糖尿病、心腦血管疾病、慢性腎病、慢性肺疾病、自身免疫病等)48例(14.9%)。
1.2方法 收集患者的基本信息,包括人口學數據、病史、并發癥、實驗室檢查結果、胸部CT掃描結果及治療措施。
1.2.1COVID-19診斷和分型標準 根據國家衛生健康委員會辦公廳、國家中醫藥管理局辦公室發布的《新型冠狀病毒肺炎診療方案(試行)第七版》的診斷和分型標準。發病日期被定義為癥狀被發現的那一天。病程定義為發病日期到核酸兩次檢測陰性、肺部CT明顯吸收。
1.2.1.1輕型 臨床癥狀輕微,影像學未見肺炎表現。
1.2.1.2普通型 具有發熱、呼吸道等癥狀,影像學有肺炎表現。
1.2.1.3重型 符合以下任何1條:出現氣促,呼吸頻率≥30 min-1,靜息狀態下氧飽和度≤93%,動脈血氧分壓/吸氧濃度≤300 mmHg(1 mmHg=133.3 Pa),肺部影像學顯示24~48 h內病灶明顯進展>50%。
1.2.1.4危重型 符合以下任何1條:出現呼吸衰竭且需要機械通氣,出現休克,合并其他器官功能衰竭需ICU監護治療。
1.2.2糖尿病診斷標準 空腹血糖≥7.0 mmol/L和(或)餐后2 h血糖≥11.1 mmol/L,排除其他應激性和繼發性高血糖狀態;或既往有明確的糖尿病病史。
1.2.3出院標準 發熱、呼吸道癥狀消失,肺部CT結果提示病變明顯吸收,核酸檢測兩次以上陰性。
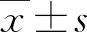
2 結 果
2.1病程 截止3月30日,普通型COVID-19患者出院199例,其中非糖尿病COVID-19患者的病程為(45.16±6.72)d(36~52 d),伴糖尿病的COVID-19患者的病程為(46.37±8.94)d(35~56 d),差別無統計學意義(P>0.05)。重型COVID-19患者出院80例,其中非糖尿病患者的病程為(52.67±5.23)d(46~58 d),伴糖尿病患者的病程為(58.42±8.54)d(47~68 d),差別有統計學意義(P<0.05)。
2.2炎癥程度
2.2.1病情程度分級 322例中,普通型COVID-19患者230例,其中非糖尿病208例(90.43%),伴糖尿病22例(9.57%);重型COVID-19患者92例,其中非糖尿病73例(79.35%),伴糖尿病19例(20.65%)。與普通型COVID-19患者比較,重型COVID-19患者合并糖尿病的比例較高,差別有統計學意義(P<0.05)。
2.2.2炎癥指標 由于住院情況不同,所有患者未能同時監測全部的炎癥指標,因此監測指標的總例數不同,其中監測白細胞322例,血沉238例,CRP 289例,鐵蛋白179例,IL-6 147例,具體見表1。
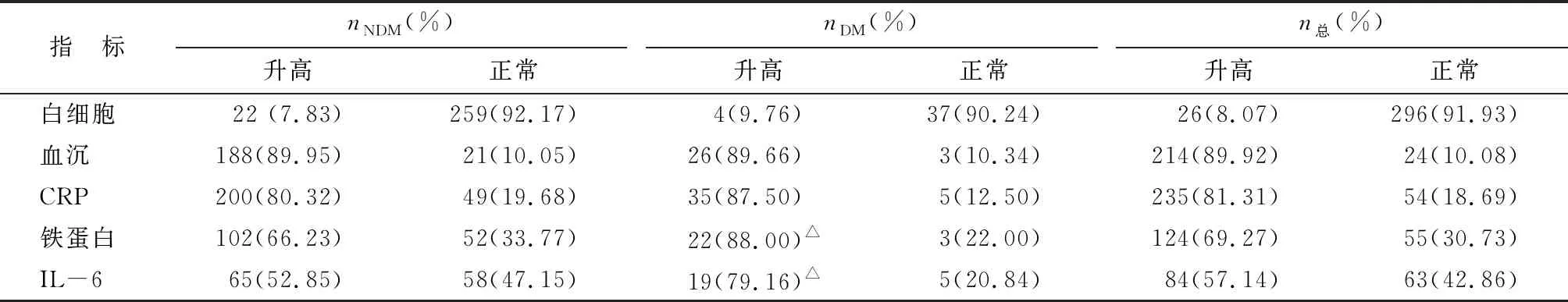
表1 COVID-19患者的炎癥指標
2.3血糖控制 住院期間患者飲食固定、規律,運動限制于病區散步及每周兩次在護師帶領下做操0.5 h,定時監測指尖血糖,規律服藥。糖尿病患者出院時空腹血糖為6~10 mmol/L,餐后2 h血糖為8~14 mmo/L。
2.4藥物治療
2.4.1抗病毒藥物 住院患者抗病毒方案不一,以一種西藥(阿比多爾、瑞德西韋、法匹拉韋、洛匹那韋利托那韋等)和一種中藥方(新型肺炎方、化濕敗毒方)聯合治療。1例患者(非糖尿病及高血壓病患者)應用法匹拉韋后出現白細胞減少,但未確定是否為法匹拉韋副作用。1例患者(高血壓病患者,無糖尿病)應用中藥方出現腹瀉,也未確定是否為中藥成分導致腹瀉。其余患者無明顯藥物不良反應。
2.4.2降糖藥物 普通型COVID-19糖尿病患者應用口服降糖藥物未出現低血糖、肝功能損害等明顯不良反應。重型COVID-19糖尿病患者應用皮下注射胰島素降糖處理。
2.4.3免疫治療 根據《新型冠狀病毒肺炎診療方案(試行)第七版》中推薦,針對潛在炎癥細胞因子風暴(cytokine release syndrome,CRS)的患者,采用IL-6受體拮抗劑托珠單抗進行免疫治療。7例應用托珠單抗防治CRS,3例出現白細胞下降,均為糖尿病患者。這3例均未出現繼發性感染,白細胞均在3 d內恢復到正常。停用升白細胞藥后,白細胞均維持在正常范圍內。所有應用托珠單抗的患者均好轉出院。
3 討 論
本研究納入的病例均為收治COVID-19定點醫院非ICU病區住院的中老年人患者。因此,雖然人群對COVID-19普遍易感,但年齡仍是病情嚴重程度和進展的重要因素之一。
最先發表在Lancet雜志上的關于41例COVID-19感染者(多數為最初感染者)的研究發現,32%的感染者合并其他疾病,位居前3位的分別為糖尿病20%,高血壓病15%,心血管疾病15%[3]。JAMA發表的138例COVID-19患者的回顧性研究顯示,64例合并1種或以上的基礎性疾病,其中14例(10.1%)合并糖尿病[2]。一項納入140例COVID-19患者的研究顯示,30.0%合并高血壓病,12.1%合并糖尿病[4]。另外一項納入99例COVID-19患者的回顧性研究顯示,合并心腦血管疾病患者占40%,合并糖尿病患者占12%[5]。本研究結果顯示,322例中,糖尿病患者占12.73%,與多數研究結果類似,主要原因:(1)我國糖尿病及心血管疾病尤其高血壓病患病人口多,基數大。(2)確診COVID-19的患者中,40歲以上人群占大多數,年輕患者多為無癥狀感染者或輕型患者,而40歲以上人群慢性病的患病率更高。但糖尿病患者的比例和普通人群的糖尿病患病率類似,且沒有大數據對糖尿病人群COVID-19的感染率與非糖尿病人群COVID-19的感染率進行比較,因此,尚不能肯定糖尿病患者是否更易感染新型冠狀病毒。
研究顯示,COVID-19死亡患者中,糖尿病患者占42.3%[7]。從本研究結果看,與普通型COVID-19比較,重型COVID-19患者合并糖尿病的比例較高,病程也較長。因此,相對于普通型COVID-19患者,糖尿病是影響重型患者病情轉歸的重要因素之一。
無論是否合并糖尿病,普通型COVID-19患者絕大多數僅有病毒性感染的肺部病變,白細胞升高的例數較少,提示合并細菌感染的二重感染情況較少。應用抗病毒藥物及中藥方治療后未發現不良反應增多或療效明顯減退。因此,糖尿病患者使用抗病毒藥物無需特殊調整。普通型COVID-19糖尿病患者的預后較好,病程與非糖尿病患者無統計學差別。
COVID-19糖尿病患者的血糖控制沒有達到理想控制水平,這是考慮到患者出院仍需要社區隔離觀察,因此,為防止院外藥物性低血糖的發生,適當放寬控制水平,且未影響COVID-19的轉歸。目前已有的研究未發現COVID-19會明顯破壞胰島分泌功能,因此,口服降糖藥物能夠控制2型糖尿病患者肺炎期間的血糖,且無明顯不良反應。但對于缺氧、重癥患者,仍應改為胰島素降糖治療,甚至應用皮下胰島素泵或靜脈胰島素泵治療以維持血糖穩定,也可避免口服降糖藥物帶來的不良反應,如乳酸酸中毒、肝功能損傷等。
與非糖尿病COVID-19患者比較,伴糖尿病COVID-19患者的炎癥指標血沉、CRP上升的比例無明顯差別,但鐵蛋白、IL-6上升的比例較非糖尿病COVID-19患者多。根據國家衛生健康委員會辦公廳、國家中醫藥管理局辦公室發布的《新型冠狀病毒肺炎診療方案(試行)第七版》意見,對于雙肺廣泛病變及重型患者且IL-6升高的患者,可以應用托珠單抗治療。此治療方案也是基于國內根據臨床COVID-19患者的診治經驗報告。IL-6是主要炎癥因子之一,能反映重癥患者的全身炎癥狀態。本研究發現,糖尿病患者的IL-6水平升高的比例較高,結合重癥患者伴糖尿病較多,應注意COVID-19患者伴糖尿病可能更易發生CRS,從而導致病情加重。
托珠單抗用于治療由嵌合抗原受體T細胞免疫療法(chimeric antigen receptor t-cell immunotherapy,CART)引起的CRS(年齡≥2歲)[6]。本研究發現,使用托珠單抗時,伴糖尿病的COVID-19患者易出現白細胞和中性粒細胞減少的不良反應,但并未出現繼發性感染,白細胞均在3 d內恢復到正常;停用升白細胞藥后,白細胞均維持正常范圍內。IL-6已被證明可誘導中性粒細胞從邊緣池向循環池移動,并可促進骨髓中性粒細胞釋放。托珠單抗是IL-6受體的單克隆抗體,可阻斷IL-6與受體結合,從而阻斷IL-6信號通路,使循環池中的中性粒細胞減少,增加中性粒細胞通過骨髓的運輸時間。因此,白細胞下降僅是一過性[8]。由于托珠單抗并不直接影響中性粒細胞吞噬功能,而是主要影響中性粒細胞分布,故托珠單抗所致中性粒細胞減少和感染的發生率之間無顯著的相關性。有研究顯示,糖尿病患者易出現中性粒細胞和淋巴細胞的比例失調,也會引起CD3+淋巴細胞下降,CD4+/CD8+淋巴細胞比例失衡,導致細胞免疫功能下降[9-10]。但糖尿病如何誘導托珠單抗的白細胞下降的副作用,目前機制不明,且由于納入觀察的例數較少,因此,糖尿病是否會出現誘導托珠單抗致白細胞下降的不良反應,需要進一步觀察研究。

