肝細胞癌切除術后影響手術部位感染的危險因素
王 明,李 明,鄭振江,李 川,蔣 利,楊家印,張 抒,文天夫△
1.成都市第三人民醫院普通外科,四川成都 610031;2.四川大學華西醫院肝臟外科,四川成都 610041
肝細胞癌(簡稱肝癌)是第五常見的惡性腫瘤,其致死率高居惡性腫瘤第3位[1]。絕大部分肝癌流行于發展中國家,以中國大陸為甚[2]。目前為止,肝癌切除術仍然是一種普及、有效的治療方式[3]。隨著手術器械的日益更新,手術技巧的飛速進步,以及圍術期管理的日趨完善,肝癌切除術后致死性并發癥發生率越來越低[4],但是術后感染,特別是手術部位感染,越來越受到臨床工作者的重視,因為這與患者術后康復時間及醫療費用息息相關[5]。目前,醫院感染監測部門都常規組建醫院感染監測專業小組,基于醫療記錄系統監測包括手術部位感染在內的術后感染并發癥。手術部位感染包括表淺切口感染、深部切口感染、器官/腔隙感染[6]。本研究的目的是根據肝癌切除術患者的圍術期臨床數據,明確手術部位感染的獨立危險因素,現報道如下。
1 資料與方法
1.1一般資料 選取2012年2月至2018年2月在四川大學華西醫院肝臟外科接受肝癌切除術后經病理檢查診斷為肝癌的1 655例患者作為研究對象,排除術前有任何感染、上腹部手術史、聯合臟器切除患者,共1 319例患者參與本研究,其中男1 039例,女280例,年齡17~78歲,平均55歲。術前患者肝臟儲備功能較好,Child-pugh A級1 243例,Child-pugh B級76例。伴隨肝硬化患者913例。有82例(6.2%)肝癌切除術后發生手術部位感染,包括表淺切口感染37例(2.8%),深部切口感染16例(1.2%),器官/腔隙感染29例(2.2%)。根據術后有無感染分為感染組(82例)和非感染組(1 237例)。收集包含術前、術中和術后的臨床數據,患者出院后至少隨訪3個月。首要分析手術部位感染,同時分析住院時間和術后30 d的并發癥情況,并比較不同范圍肝癌切除術對于手術部位感染的影響。
1.2手術及術后管理 手術采用常規右上腹肋緣下切口,肝臟惡性腫瘤切除術中常規切除膽囊,術中彩超引導下采用超聲吸引裝置、水刀等設備進行精細斷肝,所有大血管和膽道充分暴露后再離斷,對滲血或膽漏肝斷面使用血管滑線連續縫合加固肝斷面(圖1)。肝斷面處常規放置引流管1根。斷肝過程中視情況決定是否采取入肝血流阻斷方式控制肝斷面出血[7],收縮壓控制在90~100 mg Hg,中心靜脈壓控制在5~6 mm Hg,斷肝完畢后恢復基礎值。輸血與否由麻醉師術中根據具體情況決定,輸血指征為血紅蛋白水平下降至<7.0 g/L,或出現不可控制的大出血等危急情況。手術結束前使用溫熱蒸餾水沖洗手術創面;逐層縫合腹腔時,溫熱生理鹽水沖洗切口,使用薇喬抗菌縫線逐層縫合腹腔,關腹前更換外科手套。手術前30 min,靜脈滴注抗菌藥物,手術時間超過3 h,術中追加抗菌藥物。圍術期抗菌藥物預防性使用72 h。麻醉清醒后立即拔除術中安置的胃管,開始少量多次飲用清水,術后8 h口服10%葡萄糖水100 mL;術后8 h給予靜脈使用止痛藥物。術后第1天開始口服10%葡萄糖水80 mL,4次/天,乳果糖液15 mL,3次/天(如患者已排氣或排便,飲食過渡到流質或半流質飲食,停用10%葡萄糖水和乳果糖液);繼續靜脈給予止痛藥物;專職護理人員鼓勵并盡量督促患者下床活動;尿管于術后1 d拔除(有前列腺增生患者術前口服哈樂3 d);患者引流管于術后2 d或3 d經腹部B超檢查無異常、無出血、無膽漏后拔除;膽漏定義[8]:腹腔引流管術后連續3 d有膽汁引出或單次引流膽汁量≥100 mL/d,未安置腹腔引流者,術后出現腹膜刺激征,腹腔穿刺抽出膽汁或再次手術發現腹腔內有膽汁聚集。鼓勵并盡量督促患者咳嗽、咳痰及深呼吸;術后每天給予抗凝劑低分子肝素鈉注射液,每次0.5 mg。患者術后第1個月門診回訪,然后每3個月回訪。

圖1 精準肝癌切除術中肝斷面
1.3統計學處理 采用SPSS21.0統計軟件進行數據分析處理。計數資料以例數或百分率表示,不符合正態分布的計量資料以中位數(百分位數)表示;單變量分析后,在Cox比例風險模型的多元分析中,只使用了差異有統計學意義的變量。以P<0.05為差異有統計學意義。
2 結 果
2.1兩組患者臨床資料比較 見表1。兩組患者體質量指數、糖尿病、圍術期空腹血糖、清蛋白等臨床資料比較,差異均有統計學意義(P<0.05);兩組患者性別、年齡、總膽紅素、丙氨酸氨基轉移酶、天門冬氨酸氨基轉移酶、血小板、凝血酶原時間、肝功能分級、肝硬化、肝炎、甲胎蛋白、腫瘤數目、腫瘤大小、腫瘤破裂等臨床資料比較,差異均無統計學意義(P>0.05)。
2.2術后結果 兩組患者住院時間(P<0.05),圍術期死亡(P=0.021)有明顯差異(表2)。24例患者發生圍術期死亡,其中感染組3例,包括肝衰竭2例,敗血癥1例;非感染組21例,包括肝衰竭11例,腎衰竭4例,腦出血1例,肺部感染1例,肺栓塞3例,腹腔內出血1例。
2.3影響手術部位感染的危險因素 感染組和非感染組性別、年齡、腫瘤參數等方面比較,差異均無統計學意義(P>0.05)。圍術期空腹血糖>6.1 mmol/L,手術時間>280 min,術中出血量>800 mL,術后發生膽漏是影響肝癌切除術后發生手術部位感染的獨立危險因素(表3)。肝癌切除范圍明顯影響術后手術部位感染(P<0.05),以及器官/腔隙感染(P<0.05)(表4)。

表1 兩組患者臨床資料比較

續表1 兩組患者臨床資料比較

組別n肝炎(n)乙肝丙肝乙肝+丙肝無甲胎蛋白≥8ng/mL[n(%)]腫瘤數目(n)單個多個腫瘤大小(n)<5cm≥5cm腫瘤破裂(有/無,n/n)感染組827430561(74.4)671549332/80非感染組1237112351459890(71.9)98625172451329/1208P0.3720.2950.4780.3940.218
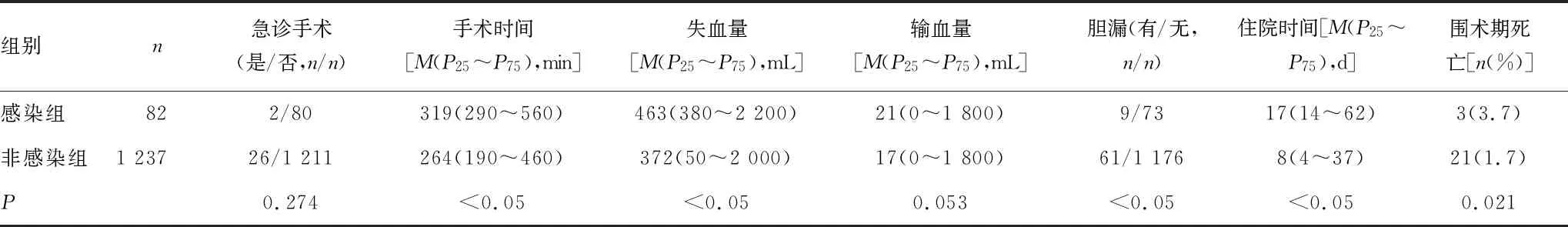
表2 兩組患者術中、術后變量比較

表3 影響手術部位感染的獨立危險因素

表4 肝癌切除范圍對手術部位感染率的影響[n%]
3 討 論
有研究表明,糖尿病是圍術期發生手術部位感染的獨立危險因素[9],但從本研究結果來看,確切地說是圍術期的血糖變化范圍對手術部位感染的發生率有明顯影響,高血糖顯然會導致手術部位感染。圍術期血糖控制一直是外科的研究熱點,尤其對于肝癌切除患者,因為術中會涉及非常復雜的第一、二肝門靜脈乃至下腔靜脈的阻斷、開放,這些操作會造成肝細胞缺血-再灌注損傷及許多炎癥因子釋放,這些因素將導致強烈的應激反應,造成圍術期血糖控制困難[10]。肝癌患者很多伴隨肝硬化,肝臟自身功能的調節障礙也會導致術后血糖異常,導致高血糖癥狀[11]。有研究表明,圍術期胰島素強化治療可有效控制血糖值[12]。肝癌切除患者圍術期最理想的血糖值是多少?一些研究者提出,圍術期需保持血糖控制在正常范圍內,即空腹血糖<6.1 mmol/L,但要注意發生低血糖[13]。
本研究發現,手術部位感染與手術時間長,術中出血量和術后膽漏相關。較長手術時間可能會影響全身抗菌藥物的濃度,導致手術部位發生感染;外科手術時間越長,就越有可能發生手術部位感染[14]。大量術中出血減少了自然殺傷細胞和細胞毒性淋巴細胞的數量[15],降低了術后患者的免疫力。肝癌切除術后膽漏的發生可能為細菌的生長和增殖提供了理想的環境,從而導致手術部位感染發生[16]。
肝癌切除術的范圍對手術部位感染有明顯影響。進行半肝切除、擴大半肝切除、中肝切除時,肝斷面非常大,這就意味著外科醫生需要更多的手術時間來進行肝實質離斷,當然較大創面會伴隨更多的失血。有研究表明,一些特殊的肝切除(中肝切除術、Ⅳ切除術、Ⅷ切除術)會導致較大的創面,暴露出較大的肝格利森纖維鞘,這將導致膽漏風險增高[17]。
近10年來,精細外科理念發展迅速[18],精細肝癌切除術可縮短手術時間,減少失血和降低膽漏發生,有利于減少術后手術部位感染發生率。
本研究不足之處是沒有比較分析兩組患者的治療費用,但有研究指出,發生手術部位感染患者的住院時間延長,這意味著醫療費用也增加[19]。ALFONSO等[20]進行了一項更進一步的研究顯示,發生手術部位感染的患者不僅住院治療費用增加,出院后治療費用同樣較高。
本研究有幾個局限性,數據沒有包含預防性使用抗菌藥物。有研究表明,在沒有術前感染的情況下,即使手術后沒有預防性使用抗菌藥物,也不會增加圍術期感染的風險[21]。作者已開始了1項前瞻性隨機對照試驗,以明確其可行性。
綜上所述,圍術期空腹血糖>6.1 mmol/L、手術時間>280 min、術中出血量>800 mL、術后膽漏、肝切除范圍是影響肝癌切除術后發生手術部位感染的獨立危險因素,糾正這些因素可降低手術部位感染的發生率,減少患者住院時間及圍術期病死率。

