小牛脾提取物注射液對人肺癌細胞增殖及放射敏感性的影響
顧宏韜,趙遠紅,高國青,李琪
(1.天津市中醫藥研究院附屬醫院 腫瘤科,天津 300120;2.天津市中醫藥大學第一附屬醫院 腫瘤科,天津 300073)
放射治療是臨床治療肺癌的主要手段之一,因存在較大的個體差異性,尤其是部分低分化癌對放射線敏感性較低[1],需要提高局部放射劑量以期獲得良好的控制率及預后,可能導致毒副反應加重,影響患者生活質量。尋找高效低毒的放射治療增敏劑一直是腫瘤領域的研究熱點。小牛脾提取物注射液(calf spleen extraction injection,CSEI)是提取出生24 h 內乳牛脾臟的一類無菌注射水溶液,主要成分為多肽與核糖[2]。趙巖玲等[3]學者證實,CSEI 可以降低晚期非小細胞肺癌患者血清腫瘤標志物水平,提高機體免疫力,進而延長患者帶瘤生存期。有學者提出,CSEI 可以降低乳腺癌、鼻咽癌等放射治療后出現皮膚損傷或口腔黏膜炎癥等不良反應的風險[4]。但其是否對放射線具有增敏作用,文獻研究報道較少。多數放射治療增敏劑的作用機制為改善腫瘤細胞乏氧狀態、誘導腫瘤細胞凋亡、調節細胞周期等[5]。我國一直十分重視放射增敏劑的研究,雖然已投入大量時間和精力,但是研發成果并不理想,因此尋找新的放射增敏劑對抗癌治療具有深遠意義。本文首先從細胞層面探討CSEI 對肺癌細胞放射治療增敏的可能;其次進一步從蛋白分子層面分析CSEI 放射治療增敏可能的作用機制,從而為尋找新的放射治療增敏劑及開發CSEI 新的臨床應用提供一定的理論支持,現報道如下。
1 材料與方法
1.1 材料
CSEI(吉林敖東洮南藥業股份有限公司,國藥準字H22026121,規格:2 ml/5 mg,多肽∶380μg 核糖),RPMI 1640培養基、D’Hank's 液及胎牛血清(法國Biowest公司),鏈-青(P/S)雙抗(美國Gibco公司),MTT(美國Sigma公司),彗星檢測試劑盒和Annexin V-FITC/PI雙染試劑盒(上海碧云天生物技術有限公司),Bcl-2 抗體、Bax 抗體及MDR1(美國Santa-Cruz公司),Survivin 抗體(美國Abcam公司),JEM-100CX Ⅱ型透射電鏡(日本電子公司)。FACS Canto Ⅱ流式細胞儀(美國BD公司)。
1.2 方法
人肺腺癌細胞系A549 購自中國科學院上海生命科學研究所細胞庫,細胞培養體系:10%胎牛血清,100 u/ml P/S雙抗,90% RPMI 1640培養液。調整細胞計數1×107個/ml,培養條件:37℃、5%二氧化碳CO2細胞培養箱。細胞毒性實驗分組:空白對照組和CSEI組(0.01、0.10、1.00、10.00及100.00 mg/ml)。細胞增殖實驗分組:待細胞貼壁后,分為空白對照組、放射線組(2、4、6、8及10 Gy)及放射線(2、4、6、8及10 Gy)+CSEI(1.0 mg/ml)組。彗星實驗和凋亡實驗分組:待細胞貼壁后,分為空白對照組、放射線組(5 Gy)及CSEI組(1.0 mg/ml)和放射線組(5 Gy)+CSEI(1.0 mg/ml)組。空白對照組細胞不接受任何特殊處理。放射條件:采用醫用6MeV X 射線,照射劑量為5 Gy,劑量率為200 cGy/min,源靶距為100 cm,照射視野為20 cm×20 cm。
1.3 MTT 法
將對數期生長的A549細胞按1×103個/孔單層接種至96 孔板中,分為空白對照組、CSEI(0.01、0.10、1.00、10.00及100.00 mg/ml)組,每組設置8個平行孔,培養22 ~24 h后,CSEI組細胞分別接受不同梯度CSEI;繼續培養48 h后,按照MTT 法檢測490 nm 波長處的光密度(optical density,OD)值。計算細胞增殖抑制率:增殖抑制率(%)=1-OD 值(受試孔)/ OD 值(對照孔)×100%;另外采用相同方法檢測CESI 對A549細胞放射線的增敏作用。將接種細胞分為空白對照組、放射線組(2、4、6、8及10 Gy)和放射線(2、4、6、8及10 Gy)+CSEI(1.0 mg/ml)組,每組設置8個平行孔,培養22 ~24 h后,放射線組+ CSEI組細胞加入1.0 mg/ml CSEI;2 h后,放射線組和放射線+CSEI組細胞分別接受不同梯度照射劑量,繼續培養48 h后,按照MTT 法檢測OD 值,計算細胞增殖抑制率和增敏比(sensitivity enhancement ratio,SER)。SER=放射線組D0/放射線+CSEI組D0。D0為細胞增殖活性下降50%時的放射劑量,即半數致死 劑量。
1.4 平板克隆實驗
將對數期生長的A549細胞按1×103個/孔單層接種至6 孔板中,待細胞貼壁后分為空白對照組、放射 線組(5 Gy)、CSEI組(1.0 mg/ml)和放射線(5 Gy)+ CSEI(1.0 mg/ml)組,處理方式同MTT 法測定。培養10 ~14 d后,加入4%多聚甲醛固定,吉姆薩染色,統計各組細胞集落(≥50個細胞)形成數。
1.5 中性彗星實驗檢測DNA雙鏈斷裂損傷
取對數期生長的A549細胞,分為空白對照組、放射線組(5 Gy)、CSEI組(1.0 mg/ml)和放射線組(5 Gy)+CSEI(1.0 mg/ml)組,處理方式同MTT 法。收集細胞,調整細胞濃度為1×107個/ml,采用彗星檢測試劑盒檢測DNA 修復。用溴化乙啶染色后,置于熒光顯微鏡下觀察細胞核拖尾情況,并采用CASP軟件進行分析。尾距越長,說明DNA雙鏈斷裂情況越嚴重。雙鏈斷裂程度(%)=受試組彗星拖尾長度/ 空白對照組彗星拖尾長度×100%。
1.6 流式細胞術檢測細胞凋亡
取對數期生長的A549細胞,分為空白對照組、放射線組(5 Gy)、CSEI(1.0 mg/ml)組和放射線組(5 Gy)+CSEI(1.0 mg/ml)組,處理方式同MTT法。每組分別收集2 管細胞,調整細胞濃度為1× 107個/ml,第1 管加入20μl RNase A 溶液,37℃水浴30 min,加入400μl PI 染色,上機檢測細胞周期變化;第2 管加入500μl Binding Buffer、5μl Annexin V-FITC,混勻,室溫避光孵育4 h,上機前20 min 加入5μl PI,上機檢測細胞凋亡情況。
1.7 Western blotting 檢測相關蛋白
收集空白對照組、放射線組(5 Gy)、CSEI組(1.0 mg/ml)和放射線(5 Gy)+CSEI(1.0 mg/ml)組,加入PMSF細胞裂解液,提取蛋白。采用BCA 蛋白測定試劑盒檢測蛋白濃度。加熱煮沸,使蛋白變性,10% SDS-PAGE 電泳分離,轉膜,脫脂牛奶密閉,分別加入Bcl-2 抗體(1 ∶500 稀釋)、Bax 抗體(1 ∶500稀釋)、Survivin 抗體(1 ∶1 000 稀釋)及MDR1 抗體(1 ∶1 000 稀釋),置于4℃搖床上過夜。采用TBST 反復沖洗,加入二抗(1 ∶5 000 稀釋)。ECL試劑顯影,拍照。
1.8 統計學方法
數據分析采用SPSS 17.0統計軟件和Graph Pad Prism7.0軟件。計量資料以均數±標準差(±s)表示,比較用獨立樣本t檢驗或單因素方差分析或析因設計的方差分析,進一步兩兩比較用SNK-q法,P<0.05為差異有統計學意義。
2 結果
2.1 CSEI 對A549細胞的毒性作用
MTT 法檢測顯示,不同濃度CSEI(0.01、0.10、1.00、10.00及100.00 mg/ml)處理后,細胞增殖活性受到抑制,分別為(0.56±0.43)%、(0.88±0.74)%、(1.25±0.85)%、(23.42±4.75)%及(44.89±9.82)%。0.01、0.10及1.00 mg/ml CSEI 對A549細胞增殖抑制作用基本一致,經單因素方差分析,差異無統計學意義(F=1.967,P=0.165)。1.00、10.00及100.00 mg/ml CSEI 對A549細胞增殖抑制率比較,經單因素方差分析,差異有統計學意義(F=95.455,P=0.000),且進一步兩兩比較,均差異有統計學意義(P<0.05)。1.0 mg/ml是CESI 無毒的最高劑量。見圖1。
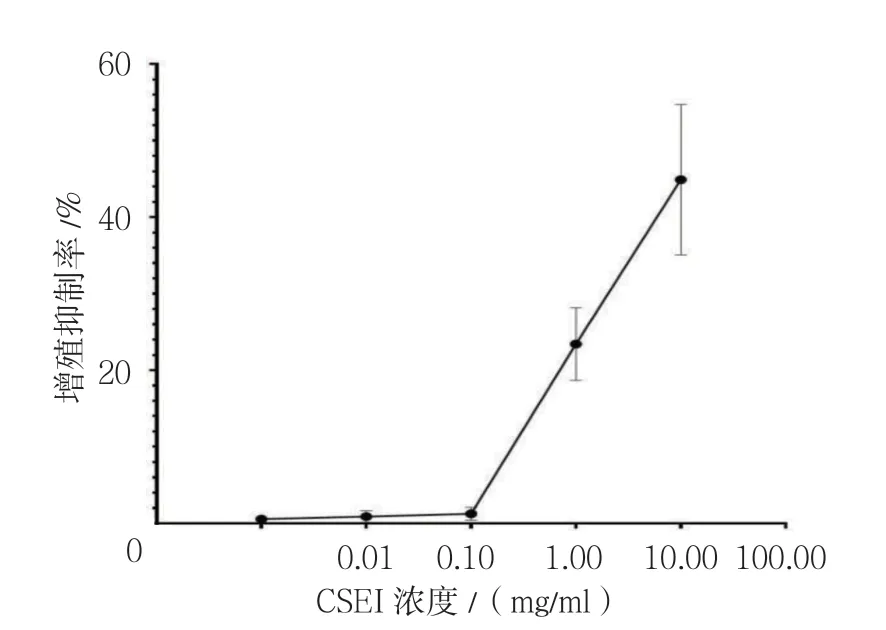
圖1 CESI 對A549細胞增殖的抑制作用(±s)
2.2 CSEI 對A549細胞照射后增殖活性的影響
MTT 法檢測顯示,不同放射劑量(2、4、6、8及10 Gy)照射后,細胞增殖活性受到抑制,D0為5.997 Gy。而不同放射組細胞給予CSEI(1.0 mg/ml)預處理后,各組細胞增殖抑制率比較,經析因設計的方差分析,處理因素CSEI的主效應比較,差異有統計學意義(F=136.124,P=0.000);處理因素放射線的主效應比較,差異有統計學意義(F=89.675,P=0.000)。兩者交互作用比較,差異無統計學意義(F=2.145,P=0.196)。因而無論是否進行CSEI處理,經不同放射劑量(2、4、6、8及10 Gy)照射后,細胞增殖活性均受到抑制;而給予CSEI(1.0 mg/ml)預處理后,能夠增強放射線對A549細胞增殖活性的抑制作用。放射線組D0為5.997 Gy,放射線+CSEI(1.0 mg/ml)組D0為4.216 Gy。SER 為(1.42±0.06)。見表1和圖2。
表1 兩組A549細胞經不同放射劑量照射后增殖抑制率的變化(±s)

表1 兩組A549細胞經不同放射劑量照射后增殖抑制率的變化(±s)
組別 2 Gy 4 Gy 6 Gy 8 Gy 10 Gy放射線組 11.43±2.57 16.38±3.79 50.74±5.93 69.35±6.47 73.62±6.58放射線+CSEI(1.0 mg/ml)組 24.85±3.16 43.24±4.41 69.53±6.28 82.92±7.63 86.45±7.98
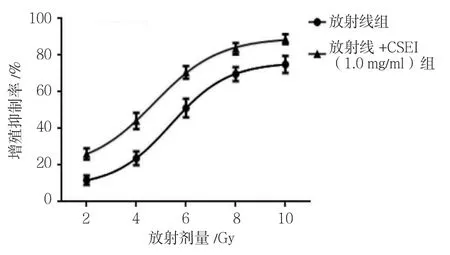
圖2 兩組A549細胞增殖率的變化趨勢(±s)
2.3 CSEI 對A549細胞照射后集落形成的影響
平板克隆試驗結果顯示,空白對照組、放射線組(5 Gy)、CSEI組(1.0 mg/ml)及放射線(5 Gy)+CSEI(1.0 mg/ml)組細胞集落形成率分別為(48.88±8.37)%、(26.63±5.46)%、(30.50±7.12)%及(12.38±2.64)%,經單因素方差分析,差異有統計學意義(F=45.897,P=0.000),放射線(5 Gy)+CSEI(1.0 mg/ml)組細胞集落形成率低于空白對照組、放射線組(5 Gy)及CSEI組(1.0 mg/ml)(P<0.05)。見圖3、4。
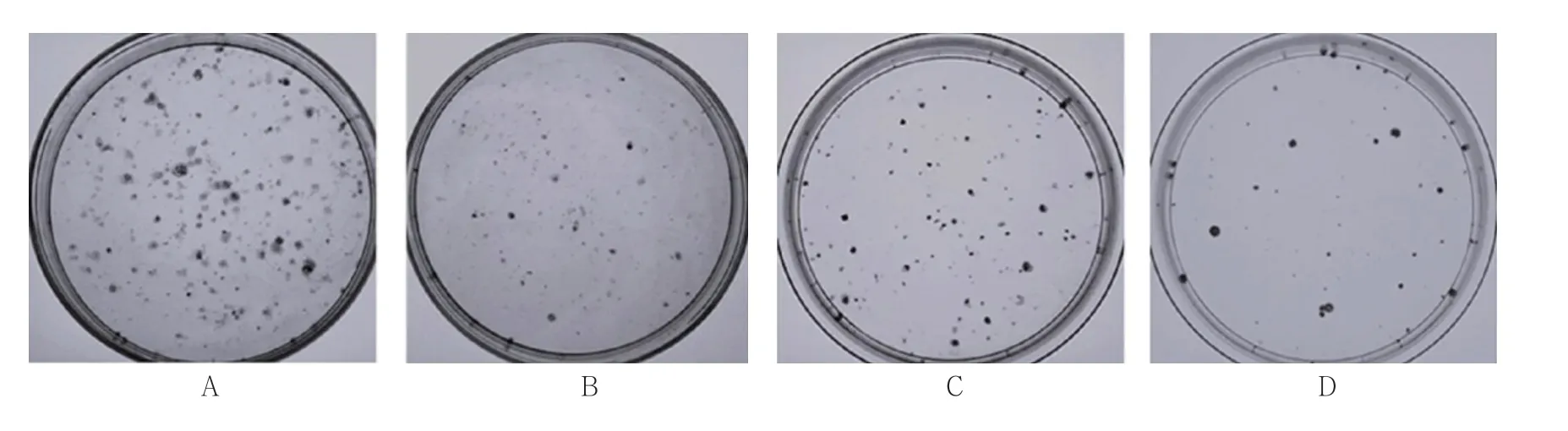
圖3 各組A549細胞克隆實驗細胞集落
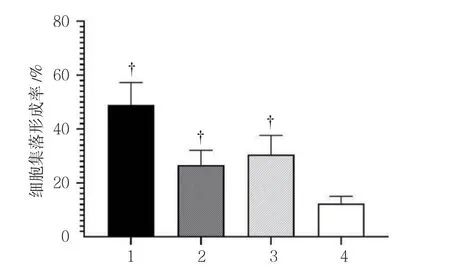
圖4 各組A549細胞集落形成率比較(±s)
2.4 CSEI 對A549細胞照射后DNA雙鏈斷裂損傷的影響
中性彗星實驗結果顯示,空白對照組、放射線組(5 Gy)、CSEI組(1.0 mg/ml)及放射線(5 Gy)+ CSEI(1.0 mg/ml)組細胞核拖尾細胞數、尾長及尾距,經單因素方差分析,差異有統計學意義(P<0.05),放射線(5 Gy)+CSEI(1.0 mg/ml)組細胞核拖尾細胞數、尾長、尾距多于其他組(P<0.05)。見表2和圖5。
2.5 CSEI 對A549細胞照射后凋亡活性的影響
流式細胞術結果顯示,空白對照組、放射線組(5 Gy)、CSEI組(1.0 mg/ml)、放射線(5 Gy)+CSEI(1.0 mg/ml)組細胞凋亡率分別為(4.85±1.32)%、(38.76±6.53)%、(28.70±5.43)%、(56.74±8.79)%,經單因素方差分析,差異有統計學意義(F=99.198,P=0.000);放射線(5 Gy)+CSEI(1.0 mg/ml)組細胞凋亡率高于其他組(P<0.05)。見圖6、7。
表2 各組A549細胞的拖尾細胞數、尾長、尾距比較(n =200,±s)
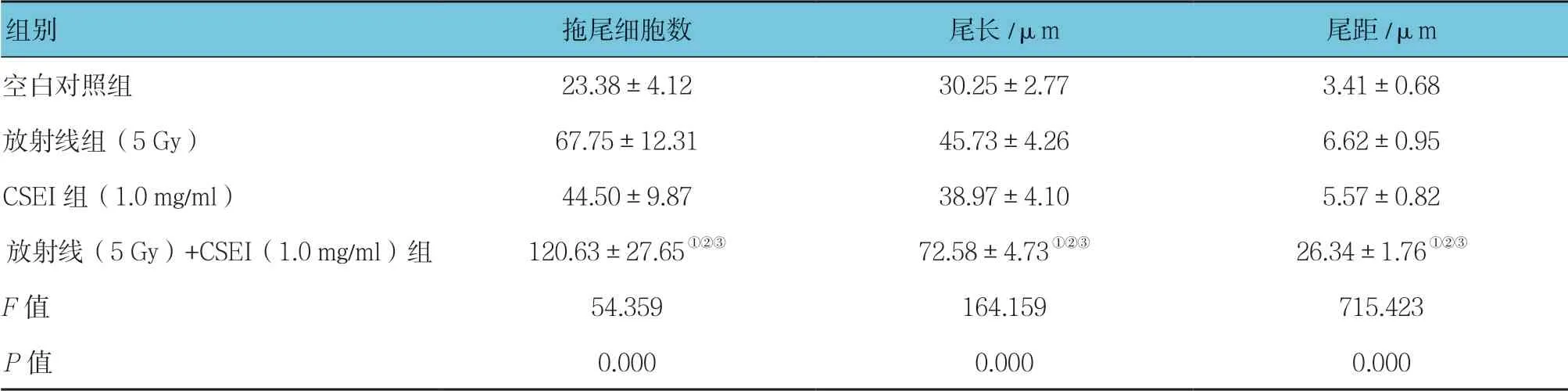
表2 各組A549細胞的拖尾細胞數、尾長、尾距比較(n =200,±s)
注:①與空白對照組比較,P <0.05;②與放射線組(5 Gy)比較,P <0.05;③與CSEI(1.0 mg/ml)組比較,P <0.05。
組別 拖尾細胞數 尾長/μm 尾距/μm空白對照組 23.38±4.12 30.25±2.77 3.41±0.68放射線組(5 Gy)67.75±12.31 45.73±4.26 6.62±0.95 CSEI組(1.0 mg/ml)44.50±9.87 38.97±4.10 5.57±0.82放射線(5 Gy)+CSEI(1.0 mg/ml)組 120.63±27.65①②③ 72.58±4.73①②③ 26.34±1.76①②③F 值 54.359 164.159 715.423 P 值 0.000 0.000 0.000

圖5 各組A549細胞的彗星圖像(×400)
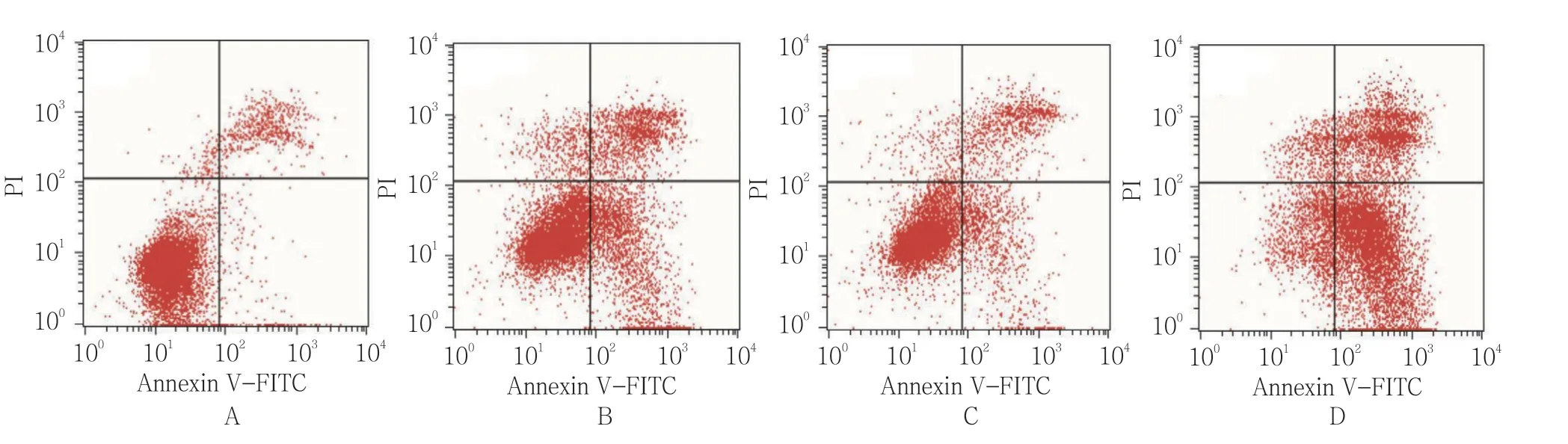
圖6 CSEI和放射線對A549細胞凋亡活性的影響
2.6 CSEI 對A549細胞照射后細胞周期的影響
流式細胞術結果顯示,空白對照組、放射線組(5 Gy)、CSEI組(1.0 mg/ml)及 放 射 線(5 Gy)+ CSEI(1.0 mg/ml)組G1期、G2/M期和S期 細 胞比例比較,經單因素方差分析,差異有統計學意義(P<0.05),與空白對照組比較,放射線(5 Gy)+ CSEI(1.0 mg/ml)組G1期 細 胞和S期 細 胞 減 少(P<0.05);而G2/M期 細 胞 增 多(P<0.05)。見表3。
2.7 CSEI和放射線對A549細胞Bcl-2、Bax、Survivin及MDR1 蛋白表達的影響
Western blotting 檢測結果顯示,空白對照組、放射線組(5 Gy)、CSEI組(1.0 mg/ml)及放射線(5 Gy)+CSEI(1.0 mg/ml)組 細 胞Bcl-2、Bax及Survivin 蛋白相對表達量比較,經單因素方差分析,差異有統計學意義(P<0.05),放射線(5 Gy)+CSEI(1.0 mg/ml)組細胞Bcl-2和Survivin 蛋白相對表達量低于其他組(P<0.05);而Bax 蛋白相對表達量高于其他組(P<0.05)。空白對照組、放射線組(5 Gy)、CSEI組(1.0 mg/ml)及放射線(5 Gy)+CSEI(1.0 mg/ml)組細胞MDR1 蛋白相對表達量比較,經單因素方差分析,差異無統計學意義(P>0.05)。見表4和圖8。
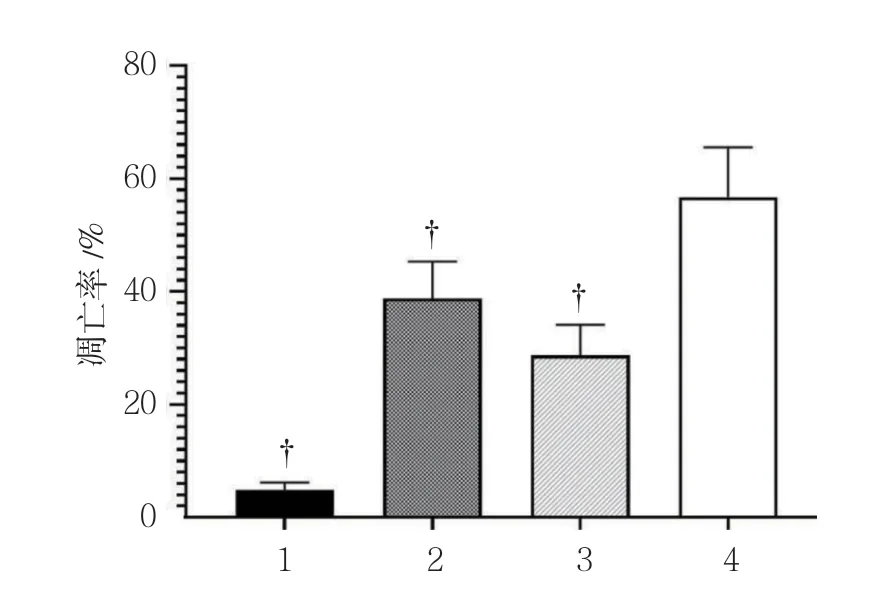
圖7 各組A549細胞凋亡率比較(±s)
表3 CESI和放射線對A549細胞周期的影響(±s)

表3 CESI和放射線對A549細胞周期的影響(±s)
注:①與空白對照組比較,P <0.05;②與放射線組(5 Gy)比較,P <0.05;③與CSEI組(1.0 mg/ml)比較,P <0.05。
組別 G1期 G2/M期 S期空白對照組 74.83±2.92 18.46±1.27 7.65±1.33放射線組(5 Gy)63.51±2.75 24.67±1.78 5.08±1.56 CSEI組(1.0 mg/ml)79.16±2.93 16.53±1.96 3.82±1.25放射線(5 Gy)+CSEI(1.0 mg/ml)組 65.49±3.16①②③32.69±1.84①②③1.84±0.59①②③F 值 53.168 141.286 30.987 P 值 0.000 0.000 0.000
表4 各組A549細胞Bcl-2、Bax 、Survivin及MDR1 蛋白相對表達量比較(±s)

表4 各組A549細胞Bcl-2、Bax 、Survivin及MDR1 蛋白相對表達量比較(±s)
注:①與空白對照組比較,P <0.05;②與放射線組(5 Gy)比較,P <0.05;③與CSEI組(1.0 mg/ml)比較,P <0.05。
組別 Bcl-2 Bax Survivin MDR1空白對照組 1.35±0.26 0.36±0.10 0.94±0.23 0.86±0.17放射線組(5 Gy)0.78±0.15 0.47±0.12 0.59±0.16 0.94±0.25 CSEI組(1.0 mg/ml)0.69±0.20 0.65±0.17 0.60±0.18 0.94±0.24放射線(5 Gy)+CSEI(1.0 mg/ml)組 0.42±0.13①②③ 0.84±0.20①②③ 0.32±0.11①②③ 0.98±0.21 F 值 33.308 15.211 16.783 0.420 P 值 0.000 0.000 0.000 0.740
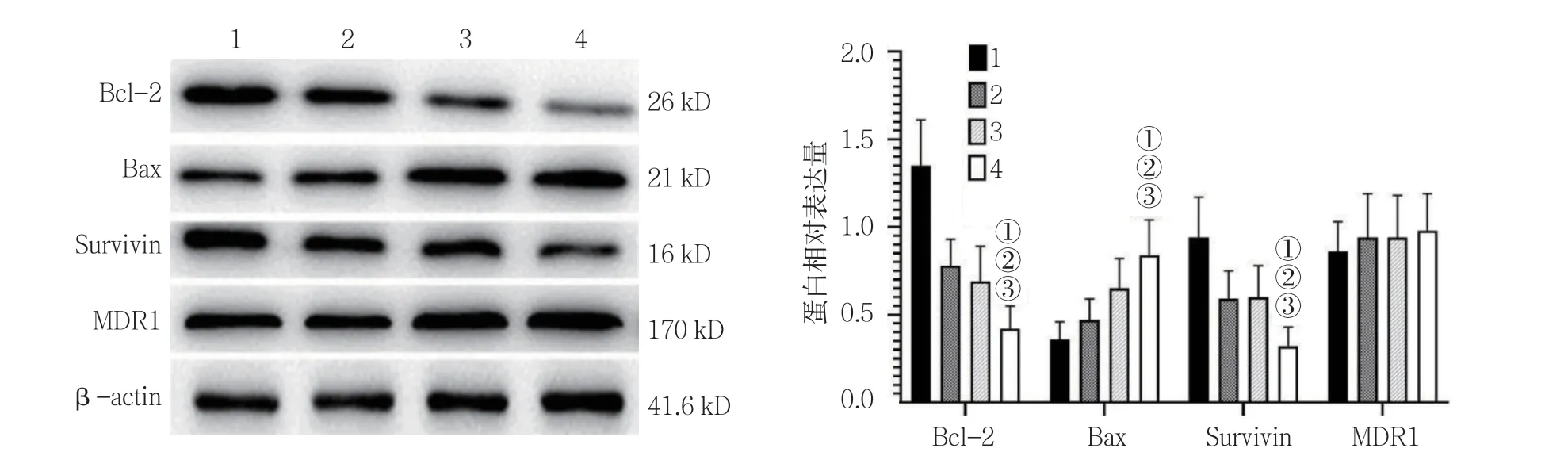
圖8 各組細胞Bcl-2、Bax、Survivin及MDR1 蛋白的表達(±s)
3 討論
放射治療是肺癌最常用的治療手段之一,基本原理是通過電離輻射誘導細胞核DNA 損傷,從而促進凋亡。多年臨床實踐證實,不同患者放射敏感性和耐受性差異較大,是影響患者預后,導致治療失敗的主要原因[6]。有學者提出放射治療增敏劑的概念,主要為硝基咪唑類化合物及其衍生物[7]。但是由于化學合成制劑本身具有嚴重的毒副反應,從而限制其在臨床的大力推廣。CSEI在臨床主要用于提高機體免疫力,同時可作為放射不良反應的輔助治療用藥。但是尚未有研究分析CSEI 可作為放射治療增敏劑的可能。
理想的放射治療增敏劑應該具有性質穩定、細胞毒性低、增敏作用可逆轉等特點[8]。本研究中,首先通過MTT 法確定CSEI 最高無毒劑量為1.0 mg/ml。因此,筆者在后續實驗中初步選定1.0 mg/ml 作為CSEI的用藥劑量。進一步采用MTT 法,在放射線照射前2 h 先給予1.0 mg/ml CSEI 預處理,證實1.0 mg/ml CSEI可增加不同照射劑量對A549細胞增殖的抑制作用,輻射增敏比為(1.42±0.06);另外,放射線(5 Gy)+ CSEI(1.0 mg/ml)組細胞集落形成率低于空白對照組、放射線組(5 Gy)及CSEI組(1.0 mg/ml),從而推斷1.0 mg/ml CSEI 對A549細胞具有放射增敏作用。
目前,關于放射增敏劑作用機制的研究主要集中在影響細胞周期、促進腫瘤細胞凋亡、靶向提高信號轉導通路的敏感性及增加放射線對腫瘤細胞的原發性損傷等方面[9]。錢鵬飛等[10]學者通過臨床研究證實,小牛脾提取物可提高晚期乳腺癌患者化學治療的療效,改善生活質量,減輕化學治療相關的骨髓抑制毒副反應,增強機體的免疫功能,對晚期腫瘤患者臨床化學治療有積極地推進作用。程惠華等[11]學者也證實,CSEI 對接受同步放射治療、化學治療的宮頸癌患者在保護骨髓和提高生活質量等方面具有很好的作用。但是目前關于CSEI對放射治療的增敏作用研究尚少。本研究中,關于CSEI 放射增敏機制的研究,首先通過中性彗星實驗結果證實,放射線(5 Gy)+CSEI(1.0 mg/ml)組細胞核拖尾細胞數、尾長及尾距較空白對照組、放射線組(5 Gy)及CSEI組(1.0 mg/ml)增加,說明1.0 mg/ml CSEI 增加A549細胞對放射線敏感性的機制可能與增加放射線誘導腫瘤細胞DNA 損傷有關。其次,通過流式細胞術檢測還發現,放射線(5 Gy)+CSEI(1.0 mg/ml)組細胞凋亡率高于空白對照組、放射線組(5 Gy)或CSEI組(1.0 mg/ml),從而推斷促進腫瘤細胞凋亡可能也是CSEI 放射治療的增敏作用機制之一。另外有研究顯示,處于不同細胞周期時相的細胞對放射線的敏感性不同,放射線主要是將細胞周期阻滯于M期和G1 末期,而對G0期細胞影響較小[12]。但是在本研究中,筆者發現CSEI組(1.0 mg/ml)G1期細胞增多,S期細胞數減少,說明CSEI 可特異性阻礙腫瘤細胞由G1/G0期向G2期和S期轉化,而且放射線(5 Gy)+CSEI(1.0 mg/ml)組G1期細胞和S期細胞減少,G2/M期細胞增多,說明CSEI 可能與放射治療產生協同作用,阻止腫瘤細胞向DNA 合成期(S期)轉化,從而提高放射治療的療效。
筆者還進一步從蛋白分子水平分析CSEI 對A549細胞放射治療增敏作用的主要機制。Bcl-2 家族蛋白和Survivin都屬于重要的細胞凋亡相關蛋白,Bcl-2屬于抗凋亡因子,主要通過調節細胞色素C的釋放來促進Bax或抑制Bcl-2 誘導細胞凋亡[13]。當抗凋亡基因Bcl-2表達上調時,Bcl-2與Bax 形成異源二聚體,從而抑制細胞凋亡[14]。而Survivin 也屬于凋亡抑制蛋白[15],在多數肺癌組織中呈高表達,是目前腫瘤治療最重要的分子靶標之一[16]。余江濤等[17]學者證實,Survivin和Bcl-2 蛋白在腫瘤組織中的表達呈正相關。沉默Survivin基因表達后,可誘導腫瘤細胞凋亡和Bcl-2 蛋白表達下調。本研究中,CSEI與放射線聯合作用,可抑制Bcl-2和Survivin 蛋白表達;同時上調Bax 蛋白表達水平。黎喜梅等[18]學者證實,放射治療可誘導腫瘤組織中MDR1 蛋白表達上調,從而降低腫瘤細胞對放射線的敏感性。本研究中,通過Western blotting 并未發現CSEI 對MDR1 蛋白表達的影響,但是并不能說明MDR1 蛋白分子未參與CSEI和放射線對腫瘤細胞增殖的抑制作用。
綜上所述,1.0 mg/ml CSEI 可增加人肺腺癌細胞系A549 對放射線的敏感性,其作用機制可能與影響腫瘤細胞周期、促進腫瘤細胞凋亡及細胞核DNA雙鏈損傷等有關。從而為CSEI 用于放射治療增敏提供一定的實驗依據,但是是否可以作為放射治療增敏劑用于臨床,尚需要更全面、更系統的實驗研究。

