苜蓿根腐病菌(Fusarium solani )的LAMP快速檢測方法
蘭成忠,阮宏春,甘 林,代玉立,盧學松
(福建省作物有害生物監測與治理重點實驗室/福建省農業科學院 植物保護研究所,福建 福州 350013)
苜蓿(Medicagosativa)是世界和我國最主要的優良豆科牧草之一,被譽為“牧草之王”。目前苜蓿栽培面積已占我國多年生牧草面積的30%以上,占全部牧草面積的25%[1]。根腐病是苜蓿生產上一種毀滅性的病害,常導致產量和品質大幅下降。隨著苜蓿新品種的不斷引進,栽培技術、水肥水平的不斷提高,苜蓿根腐病的發生也日趨嚴重,田間發病率一般達5%~7%,重病地達15%~21%,更嚴重的發病率達92%,嚴重影響了苜蓿的廣泛應用,給苜蓿生產構成了一定的威脅,成為限制苜蓿產業健康發展的主要因素之一[2-4]。
引起苜蓿根腐病的病原菌大致有以下幾種:苜蓿疫霉菌(Phytophthoramegasperma)、鐮刀菌屬真菌(Fusariumspp.)、立枯絲核菌(Rhizoctoniasolani)和腐霉屬卵菌(Pythoumspp.)等[4],其中茄鐮刀菌(Fusariumsolani)為優勢病原菌之一[5]。病原菌的準確鑒定與檢測是病害防控的基礎,研究人員通常依據病原菌所致的癥狀和菌物形態特征對苜蓿根腐病原菌進行鑒定和檢測[6-7],這種應用形態學方法進行鑒定不僅困難且耗時費力,不能滿足病害快速準確鑒定、診斷的需求。隨著分子生物學技術的發展,常規PCR技術被成功地應用于苜蓿根腐病菌的準確鑒定和快速檢測中[8]。PCR技術雖然提升了病原菌鑒定的準確性和檢測的快速性,但仍存在需要依賴精密的PCR儀、凝膠成像系統等貴重儀器設備和操作繁瑣等問題。因此,很有必要建立新的檢測技術以期實現對苜蓿根腐病菌的快速、簡便檢測。
環介導等溫擴增(Loop-mediated Isothermal Amplification, LAMP)技術是由日本榮研公司開發的一種簡便、快速、準確及廉價的核酸高效擴增技術,該技術可在60~65 ℃恒溫條件下,利用高活性的鏈置換DNA聚合酶(BstDNA polymerase)對目的DNA片段進行特異性擴增,在1 h內即可觀察結果[9]。LAMP技術具有特異性強、設備要求低、操作簡單、靈敏度高、反應時間短等優點,因而被廣泛應用于多種病原菌檢測中[10-12]。截至目前,關于苜蓿根腐病菌的LAMP檢測國內外均未見報道。本研究基于LAMP技術建立了苜蓿根腐病菌(F.solani)檢測體系,并對該體系的特異性、靈敏度及實際檢測應用進行了一系列的研究,以期為苜蓿根腐病的準確診斷和及時防治提供技術支持和理論依據。
1 材料與方法
1.1 供試菌株
供試菌株包括苜蓿根腐病菌(F.solani,茄鐮刀菌)及其近緣種、其它植物病原真菌和卵菌,菌株的名稱和來源等信息詳見表1。供試紫花苜蓿品種為阿爾岡金,由西北農林科技大學草業實驗室贈送。

表1 供試的病原菌菌株
1.2 菌株培養及DNA提取
將供試的鐮刀菌和其它真菌培養于PDA(馬鈴薯葡萄糖瓊脂培養基)平板上,于25 ℃黑暗培養7 d后刮取平板上的菌絲,經冷凍抽干研磨成菌絲粉,保存于-20 ℃備用。將供試疫霉菌培養于CA(胡蘿卜瓊脂培養基)平板中,于25 ℃黑暗培養5 d后,從菌落邊緣切取大小約為3 mm×3 mm的菌絲塊,轉移至胡蘿卜液體培養基中,于25 ℃、180 r/min、黑暗條件下培養7 d,用雙層紗布過濾收集菌絲,經冷凍抽干研磨成菌絲粉,保存于-20 ℃備用。
參照Murray和Thompson的方法[13],采用CTAB方法提取供試菌株基因組DNA,具體步驟如下:取少量菌絲粉于1.5 mL離心管中(菌絲粉剛蓋過半圓形底部為宜),加入900 μL 2%CTAB(十六烷基三甲基溴化銨)提取液(2% CTAB;100 mmol/L Tris-HCl, pH 8.0;20 mmol/L EDTA, pH8.0;1.4 mol/L NaCl)和90 μL SDS(十二烷基苯磺酸鈉)(CTAB和SDS需在60 ℃下預熱),使用振蕩器振蕩混勻,于60 ℃水浴1 h,使DNA釋放至緩沖液中,再以12000 r/min離心15 min;取上清液700 μL,加等體積酚、氯仿、異戊醇(25∶24∶1),輕輕振蕩混勻,以12000 r/min離心9 min;取上清液500 μL,加入等體積氯仿再抽提1次,以12000 r/min離心5 min;取上清液350 μL,加入1/10體積的3 mol/L NaAc和2倍體積的無水乙醇,在-20 ℃下沉淀30 min,以12000 r/min離心5 min;棄去上清液,加入700 μL冰的70%乙醇進行洗滌(稍離心;傾掉上清液),在超凈工作臺上晾干至無酒精味,加入30~60 μL TE溶液(10 mmol/L Tris-HCl,0.1 mmol/L EDTA, pH 8.0)進行溶解,得到DNA溶液,用紫外分光光度計檢測DNA的濃度,并稀釋至100 ng/μL待用。
1.3 引物設計與篩選
應用BioEdit軟件對苜蓿根腐病菌(F.solani)的TEF-1α基因序列(GenBank No: MN602077)和其它鐮刀菌(Fusariumspp.)的相應基因序列進行比對分析。選取F.solani種內不同來源菌株間序列高度保守,并與其它種鐮刀菌差異較大的區段,利用在線LAMP引物設計軟件Primer software Explorer V5(https://primerexplorer.jp/lampv5/index.html; Eiken Chemical Co., Japan)進行LAMP引物設計,所設計的多組引物經特異性和靈敏度試驗篩選,獲得1組對F.solani具有種的特異性且靈敏度高的LAMP引物,該引物在TEF-1α基因序列中的位點和序列見圖1和表2。該引物由上海生工生物工程技術有限公司合成,用ddH2O溶解后分裝,于-20 ℃保存備用。
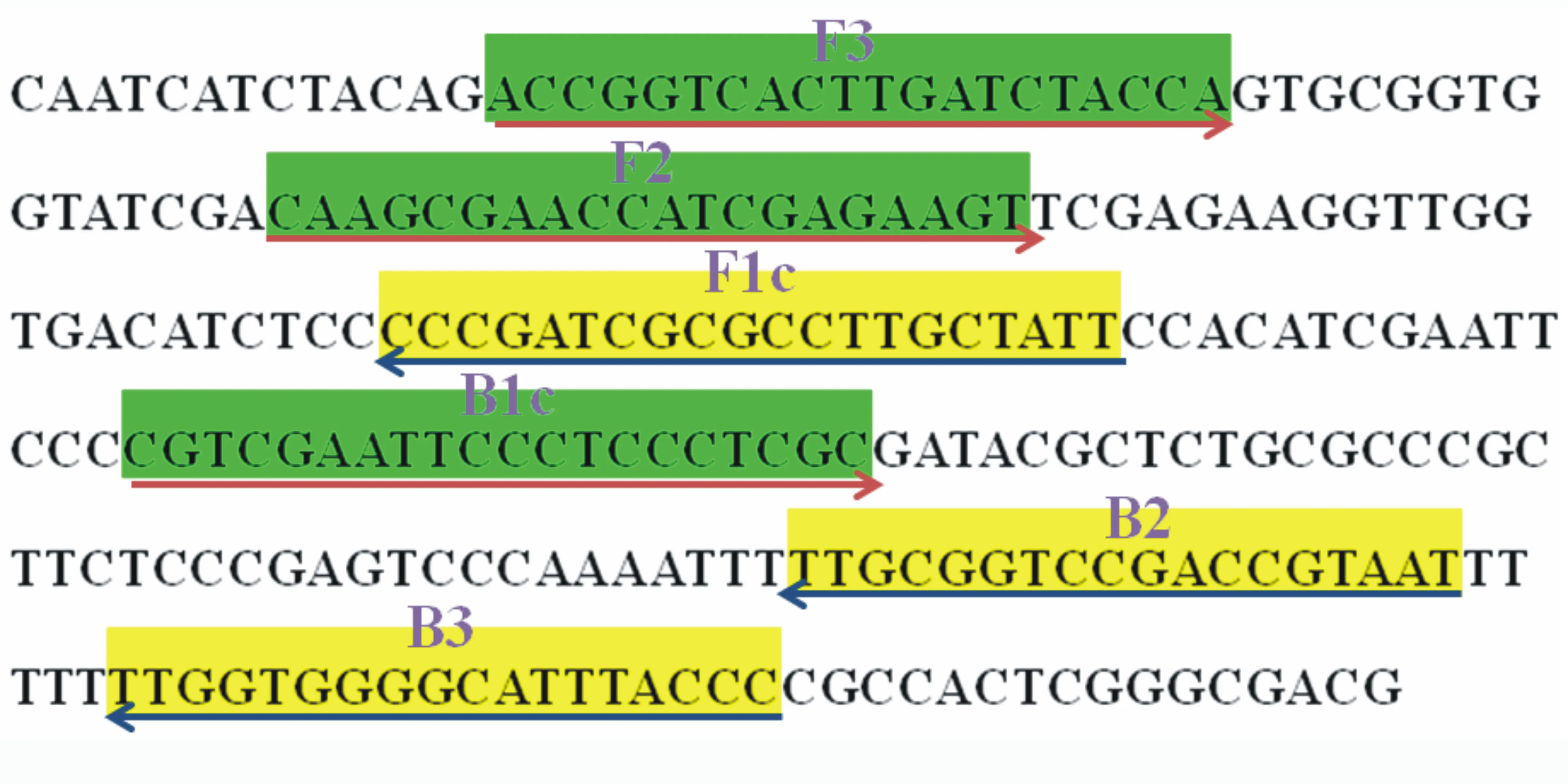
圖1 LAMP引物在TEF-1α序列中的位點
表2 用于FusariumsolaniLAMP檢測的引物

引物名稱序列(5′-3′)F35′-ACCGGTCACTTGATCTACCA-3′B35′-GGGTAAATGCCCCACCAA-3′FIP5′-AATAGCAAGGCGCGATCGGG-CAAGCGAACCATCGAGAAGT-3′BIP5′-CGTCGAATTCCCTCCCTCGC-ATTACGGTCGGACCGCAA-3′
1.4 LAMP反應體系
LAMP檢測反應體系為25 μL,包括5 μmol/L外引物F3和B3各1.0 μL、40 μmol/L內引物FIP和BIP各1.0 μL、LAMP反應混合液[40 mmol/L Tris-HCl、20 mmol/L (NH4)2SO4、20 mmol/L KCl、16 mmol/L MgSO4、1.6 mol/L甜菜堿(Betaine)、2.0 mmol/L dNTPs、0.2% Trion X-100]12.5 μL、8 UBst聚合酶1.0 μL、DNA模板1.0 μL,用滅菌超純水補足至25 μL;以熒光染料SYBR green Ⅰ為顯色指示劑,于反應前在PCR管內蓋上加入1.0 μL SYBR green Ⅰ,然后輕輕地蓋上PCR管蓋。LAMP反應條件:64 ℃溫育60 min;采用熒光染料目測觀察法判定反應結果,待LAMP反應結束后,瞬時離心PCR管,將染料與LAMP反應液混勻后觀察顏色變化,避免因開蓋檢測而導致的氣溶膠污染。若反應管中有目的DNA擴增,則反應液顏色呈現綠色,反之為橙色。實驗至少重復3 次。
1.5 LAMP檢測體系的特異性驗證
取2.0 μL不同地區來源的苜蓿根腐病菌(F.solani)DNA作為模板,進行LAMP反應,以ddH2O替代目標菌的DNA模板為陰性對照。同時分別取2.0 μL其它供試菌株的DNA為模板進行LAMP反應,以苜蓿根腐病菌(F.solani)DNA為陽性對照。以反應后溶液顏色的變化對LAMP的特異性進行評估。實驗至少重復3次。
1.6 LAMP檢測體系的靈敏度驗證
用ddH2O將已知濃度的苜蓿根腐病菌(F.solani)基因組DNA進行稀釋,配制成10倍數量級的系列濃度(1 ng/μL、100 pg/μL、10 pg/μL、1 pg/μL、100 fg/μL、10 fg/μL、1 fg/μL、100 ag/μL和10 ag/μL),備用;分別取2.0 μL不同濃度的DNA作為模板進行LAMP反應。根據反應后溶液顏色的變化對LAMP的靈敏度進行判斷。實驗至少重復3次。
1.7 人工接種發病組織中苜蓿根腐病菌(F. solani)的LAMP檢測
參照郭玉霞等[14]的方法將供試紫花苜蓿種子催芽后播種于裝有滅菌土壤的花盆(高9.0 cm,底徑7.5 cm,口徑11.0 cm)中,待苜蓿苗長至約5 cm高時,按辛寶寶等[15]的方法將供試苜蓿根腐病菌接種于苜蓿苗上。將已接種的苜蓿苗置于(28±3)℃溫室中,每天澆兩次水,保持土壤濕潤。7 d后,分別取接種發病和空白對照的苜蓿根部組織,按照DNA secure Plant Kit(Tiangen)說明書提取DNA,將其作為模板用于LAMP擴增。以從苜蓿根腐病菌(F.solani)純培養菌絲提取的基因組DNA作為陽性對照,以ddH2O作為陰性對照。反應結束后根據溶液顏色變化判定結果。
2 結果與分析
2.1 苜蓿根腐病菌(F. solani)LAMP檢測的特異性
LAMP對供試菌株的特異性驗證結果顯示,只有苜蓿根腐病菌(F.solani)反應管中溶液呈現綠色,其余鐮刀菌、真菌、卵菌和空白對照的反應液的顏色均保持不變,為橙色(圖2),表明所建立的LAMP能對F.solani的DNA進行擴增,而不能使其余菌株發生擴增反應,因此LAMP檢測體系可以將苜蓿根腐病菌與其它病原菌區分開來,具有種的特異性。

1~3:苜蓿根腐病菌。4~5:非苜蓿根腐病菌。6:空白對照。圖2 LAMP方法的特異性檢測結果
2.2 LAMP檢測的靈敏度
LAMP擴增靈敏度檢測結果表明,濃度為1 ng/μL、100 pg/μL、10 pg/μL、1 pg/μL、100 fg/μL、10 fg/μL的苜蓿根腐病菌基因組DNA顯色結果可觀察到綠色熒光,其余濃度及陰性對照顯色結果為橙色,說明所設計的苜蓿根腐病菌外引物F3/B3和內引物FIP/BIP通過了LAMP擴增,對苜蓿根腐病菌的檢測靈敏度可達10 fg/μL(圖3)。
2.3 人工接種發病苜蓿根部組織中F. solani的LAMP檢測
提取接種苜蓿根腐病菌7 d后發病的苜蓿根部組織DNA進行LAMP擴增,結果顯示,所有發病的苜蓿根部組織DNA均通過了LAMP擴增,顯色可觀察到綠色熒光;而空白對照的健康根部顯色結果為橙色(圖4)。表明所建立的LAMP檢測體系可用于苜蓿根腐病菌快速可靠的檢測和鑒定,同時還可直接用于苜蓿根腐病發病組織中病原菌的檢測。
3 結論與討論
根腐病是苜蓿生產上一種常見、易發和傳播迅速的重要土傳真菌病害[16]。因此,建立準確、快速、高效的檢測方法,對阻止根腐病病原菌的傳播蔓延具有重要意義,是有效防控該病的基礎。
本研究以TEF-1α為靶標,建立了一種基于顏色判定的可快速、準確和靈敏地檢測苜蓿根腐病菌(F.solani)的LAMP技術體系。TEF-1α基因作為鐮刀菌PCR分子鑒定中的種特異性鑒定靶標,已被國內研究人員廣泛地應用于鐮刀菌的鑒定和快速分子檢測中[17]。因此,以該基因為靶標序列設計鐮刀菌的種特異性引物,可保證引物的高度特異性和廣泛通用性。

1~9:分別為1 ng/μL、100 pg/μL、10 pg/μL、1 pg/μL、100 fg/μL、10 fg/μL、1 fg/μL、100 ag/μL、10 ag/μL。10:空白對照。
圖3 LAMP方法的靈敏度檢測結果

1:陽性對照。2:陰性對照。3、5、7:發病的根部組織。4、6、8:健康的根部組織。圖4 植物組織中根腐病菌的LAMP檢測結果
目前,檢測植物根腐病原鐮刀菌的主要步驟是從發病植物組織中分離菌株,利用傳統形態學特征結合某些保守基因序列對分離物進行鑒定[18];另外,還有許多研究人員利用一些看家基因序列在鐮刀菌不同種之間的保守性,針對鐮刀菌不同種看家基因的特有位點設計種特異性引物并建立PCR檢測體系[19-20]。這些方法雖然存在耗時長或需要特殊貴重儀器等缺點,但在鐮刀菌鑒定和檢測中得到了廣泛的應用。與上述鐮刀菌鑒定和檢測方法相比,本研究所建立的LAMP檢測方法具有如下優勢:高效快捷,整個擴增反應可于1 h內完成,并可通過顏色對結果進行可視化判斷;靈敏度高,對目標病原菌的檢測靈敏度可達10 fg/μL,是常規PCR檢測體系檢測靈敏度的1000倍;運行環境硬件條件低,不需要PCR儀、凝膠成像儀等貴重設備,僅用水浴鍋或加熱套等簡單恒溫加熱設備即可;適用范圍更廣,可對發病植物組織中的病原菌進行檢測,可以克服植物組織中一些化學物質對病原目標DNA擴增的抑制。本研究所建立的LAMP檢測方法可直接應用于田間苜蓿根腐病菌的快速檢測,適用于儀器設備簡單的科研單位和基層農技推廣部門使用,具有較廣闊的應用前景。

