基于發展學生學科核心素養的化學單元教學設計
陳寅 宋蕊
摘要: 新課程改革對傳統課堂提出了轉型要求,單元教學設計關注課時之間的關聯,改變偏重記憶零碎知識和符號的教學,為基于發展學生核心素養的課堂改革提供了路徑。以“晶體的結構與性質”為例開展化學單元結構化教學設計,穿插基于情景的探究式、啟發式、體驗式或互動式等教學活動,落實發展學生核心素養的課程目標。
關鍵詞: 化學學科核心素養; 化學單元教學設計; 宏觀辨識與微觀探析; 晶體的結構與性質
文章編號: 10056629(2020)01003106
中圖分類號: G633.8
文獻標識碼: B
在發展學生化學學科素養為化學課程目標的背景下,課堂是落實的主陣地,核心素養的培養目標對現有課堂提出了新的要求。化學學科核心素養的實施往往是跨課時的,甚至是跨學期、跨學年的。而現有課堂中,比較關注課時目標的落實,忽視了課時之間的相互關聯,缺乏對學科素養培養的頂層設計。單元教學設計是教師運用系統方法,架構各課時之間的教學關聯的過程性設計,其目的在于改變偏重記憶零碎知識和符號的教學,強調學生手腦并用獲得完整的知識和經驗,重視整個學習情境中的各部分關系[1]。
基于上述的背景與需求,本研究認為,單元教學設計對發展學生化學學科核心素養非常適宜,從以往忽視課時之間的聯系,轉向以學科核心素養為教學目標,開展以單元、主題、模塊為單位的結構化教學設計,穿插基于情景的探究式、啟發式、體驗式或互動式等教學活動,從而落實發展學生核心素養的課程目標。
1 單元教學設計概述
20世紀初,美國學者杜威主張實用主義的單元教學,并提出了關于單元教學的教學模式;20世紀60年代,布魯姆提出“掌握學習”教學理論,要求以單元為單位組織教學,通過教學目標控制整個單元內的教學活動,避免教學的模糊無序,提高了教學效率。20世紀20年代,“單元教學”從國外引入,并在國內經歷了較長時間的發展,在借鑒國外先進教育理念的同時,結合我國教育實際,探索適合我國的教學道路[2]。
單元教學設計是指形成單元主題并針對單元主題對教學目標、單元教學過程進行籌劃的過程性設計。單元教學設計強調教學目標全面性和教學內容及教學過程系統性設計,以提高課時教學效益,增進學生學科體系和學科觀念的整體構建。同時,單元教學設計強調從單元整體出發設計教學,突出教學目標、內容和過程的整體性、連續性和發展性。
2 單元教學設計流程
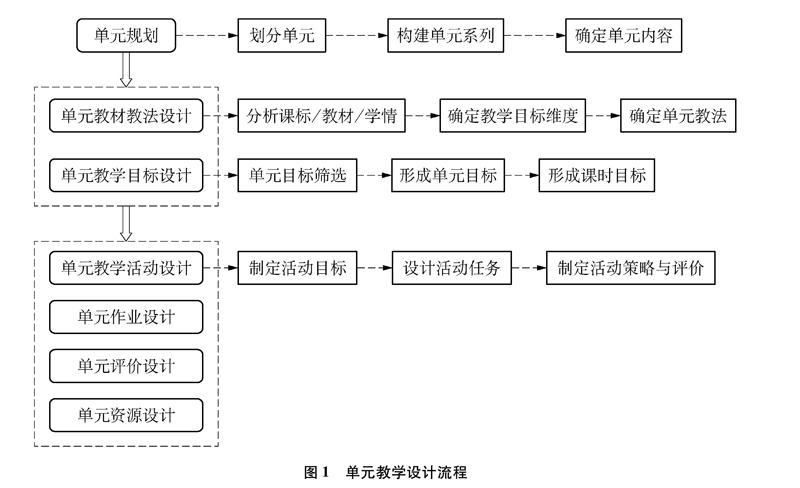
單元教學設計的關鍵環節一般包括三部分,分別為單元規劃、單元教材教法分析與目標設計、單元教學活動/作業/評價/資源設計,如圖1所示[3]。
2.1 單元規劃
單元規劃即通過分析課程標準、教材等,基于教學內容與學生的認知發展水平,對教學內容進行重新組織,形成具有特定主題的單元系列。其中化學學科的主題通常是能夠統攝一類化學知識的化學核心概念或化學學科思想與觀念。單元規劃需要具有整體性、有序性和可操作性。
2.2 單元教材教法設計
單元教材教法分析和設計是基于課程標準、教材、學情分析單元內容的地位與作用、所體現學科核心素養的載體、單元教學目標與重難點、單元學習的基本知識,從而為制定教學目標維度、設計教學活動、實施教學評價奠定基礎的教學實踐活動。
2.3 單元教學目標設計
化學單元教學目標是縱觀層面上的教學目標,起到聯結學科核心素養與微觀的課時目標的作用,是學科核心素養落地的重要橋梁。單元教學目標設計就是通過分析單元教學內容,確定各單元所承載的學科核心素養內容,再結合學生的認知發展水平,分析單元所體現的課程目標,最終根據單元承載的學科核心素養與課程目標,設計單元目標。
2.4 單元學習活動設計
學生的學科核心素養不能完全通過直接傳授的方式而獲得,需要在各種形式的學習活動過程中發展。而單元學習活動設計就是教師根據單元目標、單元內容特點和學生的認知發展水平,進行一系列以知識技能習得和過程方法體驗為特征的教學活動的設計,從而凸顯新課程改革基本思想與基本活動經驗的培養,并落實發展學生學科核心素養的目標。單元教學活動包括課時活動與跨課時活動。
2.5 單元作業設計
單元作業設計是指依據單元目標,系統規劃、整體設計一個單元各課時作業和單元末作業,也是整個單元教學設計的重要組成部分。
2.6 單元評價設計
單元評價是通過比較某些基準對學生完成單元的整體學習后的水平,包括知識與技能的掌握、情感價值觀的變化、學科核心素養水平、交流與合作能力等進行考查與評價。同時單元評價也可以檢核教師單元教學目標的達成程度。
2.7 單元資源設計
單元資源是指支持單元教學中的單元學習活動、單元作業和單元評價的物質資源條件,主要包括設備、場所、器材、信息、資料等。
3 “晶體的結構與性質”單元教學方案設計
本研究以“晶體的結構與性質”的單元教學方案設計過程為例,包括單元規劃與單元教材教法設計、單元教學目標與單元學習活動設計(暫不涉及單元作業、單元評價與單元資源設計),其中課時教學目標與課時教學活動的設計以“離子鍵”一課為例。具體設計方案如下:
3.1 單元規劃
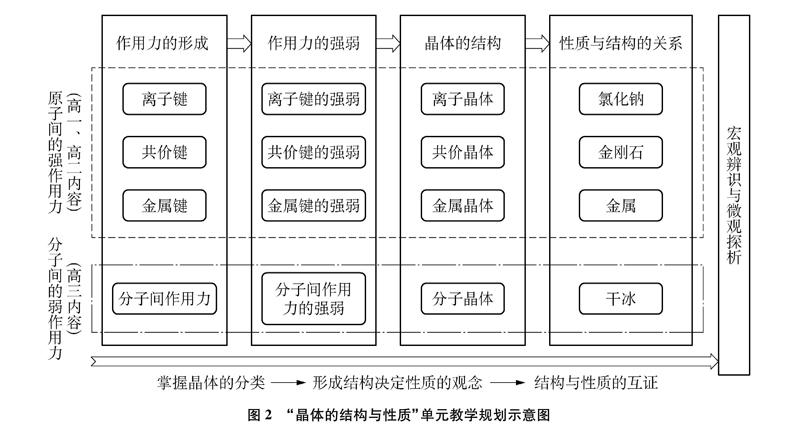
根據教學基本要求與教材分析,以滬科版《化學》高中一年級第一學期“探索原子構建物質的奧秘”章節(共計5課時)、高二第一學期“金屬鍵金屬晶體”內容(共計4課時)與高三拓展型課程中“分子晶體”的內容(共計1課時)等化學鍵和晶體結構的知識模塊共同組成一個教學單元。該單元的教學內容是發展“宏觀辨識與微觀探析”這一核心素養的重要知識載體,同時微粒變化觀的學習可以培育學生“變化觀念與平衡思想”的核心素養,并運用“證據推理與模型認知”的學科核心素養來描述和解釋化學現象。
本單元規劃思路如圖2所示,主要的教學目標為培養和發展學生“宏觀辨識與微觀探析”的學科核心素養,學生的學習目標水平逐步深化,從掌握晶體的分類,到形成結構決定性質的觀念,最終可以進行微觀結構與物質性質的互證[4]。根據該水平發展階段對單元教學內容進行梳理,各部分的教學設計遵循“作用力的形成→作用力的強弱→晶體的結構→性質與結構的關系”的思路,最終達成發展學生“宏觀辨識與微觀探析”等教學目標[5]。
3.2 單元教材教法設計
在“宏觀辨識與微觀探析”的目標導向下,旨在促進學生對宏觀數據、現象的感知,學會從微觀的視角認識物質性質的一般思路和方法,建立“宏觀微觀符號”的化學知識表征方式。分析學生的學情,學生對原子、分子、離子已經有了初步的概念,但是對化合物的微觀形成過程還比較模糊,同時本單元所涉及的化學知識均為較抽象的微觀概念,無法用直觀的觀察和實驗獲得具體的認識。宏觀上,需要通過引入模型引導學生從宏觀層面感受化學鍵的真實存在,微觀上,從原子的結構、電子的運動和變化、陰陽離子間的相互作用等層面,感受化學鍵的形成,將無形的化學鍵轉化為有形的認識,從而使學生更好地認識化學鍵的本質。
3.3 單元教學目標設計
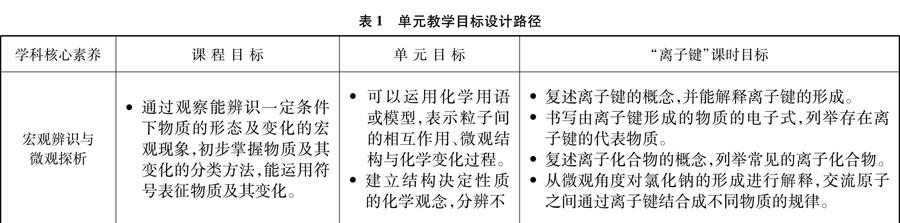
通過分析單元教學內容,確定本單元所承載的學科核心素養主要為“宏觀辨識與微觀探析”,同時也能培育學生的“變化觀念與平衡思想”和“證據推理與模型認知”等,結合學生的認知發展水平,確定所對應的課程目標,以“學科核心素養→課程目標→單元目標→課時目標”的解析路徑,形成各個課時目標,如表1所示[6,7]。
3.4 單元學習活動設計
該單元主要以課時活動為主,以“離子鍵”一課為例,依據教法設計與課時目標,設計了氯化鈉的形成、離子鍵強弱的判斷、離子晶體、氯化鈉的性質與結構的關系等4項活動任務,具體見課時教學案例與分析。
4 “晶體的結構與性質”單元課時教學案例與分析
依據單元規劃的線索,遵循單元教法、單元教學目標與單元學習活動的設計,以“離子鍵”一課為例進行“晶體的結構與性質”單元的課時教學案例設計。
4.1 環節1: 氯化鈉的形成
[教師設問]這是兩個金屬球,有什么方法可以增大兩球之間的吸引力?
[學生回答]利用電性作用,讓一個球帶正電,另一球帶負電,兩球吸引。
[教師]這是一臺手搖感應起電器,搖動以后可以產生異種電荷,通過導線讓一個球帶正電,另一球帶負電,觀察兩個球能否相互吸引。
[學生]認真觀察實驗,分析、思考發生的現象。
[教師設問]如果這兩個球分別代表的是原子,用什么方法可以增大兩個原子之間的吸引力?
[學生回答]可以利用電性作用,讓他們分別變成陰、陽離子,依靠異性相吸,產生靜電引力。
[教師設問]順著異性相吸的思路,在元素周期表的第3周期有我們熟悉的元素,在這一周期中最容易形成陽離子和陰離子的分別是哪兩種元素?
[學生回答]鈉易形成陽離子,氯易形成陰離子。
[活動1]請大家從原子結構的角度思考和討論NaCl是怎樣形成的。若需要可以觀看課桌上電腦里鈉與氯氣反應的實驗視頻。
[學生]觀看視頻,相互討論。
[教師]由于電子與電子、原子核與原子核都會產生同性相斥作用。當兩種離子接近到某一距離時,吸引和排斥作用達到了平衡,于是陰、陽離子之間就形成了穩定的離子鍵。由于陰、陽離子靠得比較緊密,我們也會用核間距表示兩個離子的間距。像NaCl這樣陰、陽離子間通過靜電作用所形成的化學鍵稱為離子鍵。化學上可用電子式來表示含有離子鍵的NaCl。
[學生]思考、領悟和分析。理解概念的內涵及關鍵點:“相反電荷”、“相互作用”。
[教師設問]在元素周期表中除了鈉和氯,還有哪些區域的元素可以形成像Na+這種典型的陽離子,或Cl-這種典型的陰離子?請同學們用化學式表示含有離子鍵的物質。
設計分析: 利用手搖感應起電器引導學生從宏觀層面感受靜電作用,從原子結構(微觀層面)入手分析離子鍵的形成過程及其本質,再從宏觀角度感受離子鍵的存在,不斷從宏觀和微觀兩個角度進一步認識離子鍵、運用化學符號表征離子鍵,培養學生“宏觀辨識與微觀探析”的核心素養。通過感受離子鍵的形成過程,培養了學生“變化觀念與平衡思想”的核心素養。
本環節以“原子結構”、“原子間的相互作用”作為前概念學習離子鍵的形成,通過宏觀現象讓學生感受離子鍵的存在,為共價鍵、金屬鍵等學習奠定基礎。
4.2 環節2: 判斷離子鍵的強弱
[教師提問]在同學們書寫的這些物質中,下面我們著重討論NaCl、 MgO這種AB型化合物中的離子鍵。請大家思考一個問題,怎樣判斷離子鍵的強弱?
[學生]看書、歸納、理解概念。
[活動2]根據式子F=KQ1Q2r2,如果Q1、 Q2是同種電荷的電量,那么F為斥力;如果Q1、 Q2是異種電荷的電量,那么F為引力。由于今天我們研究的是離子鍵,所以F的大小其實反映了離子鍵的強弱,那么離子鍵強弱會跟哪些因素有關?
[學生]Q可以表示離子所帶電荷的多少,由于陰、陽離子排列比較緊密,r可以表示兩個離子半徑之和或核間距。
[教師提問]NaCl、 MgO中誰的離子鍵更強?(提供O2-、 Na+、 Mg2+、 Cl-等離子半徑數據)
[學生回答]討論后回答是MgO。
設計分析: 本環節通過提供數據信息,幫助學生判斷陰、陽離子間的核間距,運用微粒作用理解離子鍵強弱的影響因素,建構判斷離子鍵強弱的方法模型,提升學生的“證據推理”意識和科學探究能力。同時引導學生養成重視課本資料信息的習慣,培養分析歸納的能力,提高學生“證據推理與模型認知”的化學學科核心素養。
本環節以“庫侖定律”作為前概念,引出作用力的強弱,通過對離子鍵作用力強弱的認識,使學生可以更好地理解其他類型化學鍵作用力的強弱。原子間的強作用力也為后續較弱的分子間作用力的學習起到了鋪墊作用。
4.3 環節3: 離子晶體
[活動3]現有一大一小兩個模型球,如果把離子近似地認為是球體,哪個表示Na+、哪個表示Cl-?根據靜電學理論,Na+和Cl-各自所帶的電荷為整個離子共有,所以它在各個方向上的靜電效應是等同的。而且只要離子附近空間條件允許,每一個離子就有可能吸引盡量多的帶相反電荷的離子。當然陽離子吸引幾個陰離子并不是隨意的,而是有一定規律的。請大家完成游戲,一個Na+周圍最多可以吸引幾個Cl-?
[學生]分組討論、游戲,并回答問題。
[教師]NaCl晶體是一大堆Na+和Cl-按一定排列方式相互吸引向三維空間無限延伸的巨型離子結構(視頻)。像NaCl這種含有離子鍵的化合物稱為離子化合物。離子化合物在室溫時以晶體形式存在,此時的晶體叫做離子晶體。我們怎樣研究這種“巨型”的離子晶體呢?科學家已從中取出一部分,這部分是一個三維結構,它從化學和幾何學上可以代表整個晶體。
[教師]請大家將模型從盒中取出,球體表示離子,棍子表示離子鍵。一維、二維重復行嗎?為什么是三維重復?這種三維結構的特點是什么?
[學生]討論,感悟。并回答是正方體,Na+位于棱上和中心,Cl-位于頂點和面上。
設計分析: 通過游戲讓學生更好地理解離子鍵、離子晶體概念的內涵與特征,從原子間作用力的角度對物質進行分類,建立晶體是有結構的觀念,也為共價晶體、金屬晶體、分子晶體結構的學習奠定基礎,理解微觀結構對宏觀性質的影響。
4.4 環節4: 氯化鈉的性質與結構的關系
[活動4]剛才研究的是Na+怎么跟Cl-結合成NaCl的。如果我們需要將Na+、 Cl-從晶體中取出,請問該怎么辦?斷開局部的NaCl都很費勁,哪怕一小塊食鹽晶體,也是很多個Na+和Cl-通過離子鍵相互結合的,那就需要很多的力拉開!斷開兩個陰、陽離子要用F大小的力,化學上怎么表示斷開無數個離子鍵的作用力呢?且離子晶體有不同的類型,有無方法可以比較離子晶體中離子鍵強弱呢?
[學生]研究模型,思考、領悟。
[教師]老師介紹一種工具。溫度0K時,將1mol離子化合物中的陰、陽離子,由互相遠離的氣態結合成離子晶體時放出的能量稱為晶格能。晶格能越大表示斷開離子間作用力所消耗的能量越多,離子鍵也越強。晶格能是具有化學特色的研究離子間作用力的工具,它跟庫侖定律得到的結果基本一致。大家從表格中的數據能夠得出什么結論?
[學生]由表中數據可見,當離子電荷相同,核間距越短,晶格能越大。所以晶格能的大小與離子晶體中離子電荷、離子間核間距等因素有關。
[教師]通過晶格能,我們可知離子晶體中存在較強的離子鍵,破壞它需要較高的能量。那么它會對離子晶體的性質產生什么影響呢?以氯化鈉為例,一般涉及以下性質: 密度和硬度較大,有較高的熔點和沸點;能溶于水,但不溶于非水溶劑;固體時不導電,熔融或溶于水后能導電。破解這些性質的奧秘掌握在大家的手里,我選了兩組問題和相關資料存放在筆記本電腦里,請大家閱讀并思考。回答時按以下三個步驟: 一敘述你們的問題,二展示你們用到的資料,三闡述你們的觀點。
問題1: 為何NaCl的密度和硬度較大,有較高的熔點和沸點?提供資料: ①表: 一些AB型離子晶體的晶格能、熔點、沸點和硬度;②視頻: 研磨食鹽晶體;③圖: 氯化鈉晶體。
問題2: 物質的宏觀表現往往跟其微觀層面的存在形態和運動方式有關。已知NaCl為固體時不導電,而熔融或溶于水后能導電。請你從微粒的存在形態和運動方式視角進行解釋。提供資料: ①圖: 氯化鈉晶體;②視頻: 熔融的氯化鈉導電;③視頻: 氯化鈉水溶液導電。
[學生]思考、討論、分析、歸納;師生共同討論。
[教師]NaCl是離子晶體的代表物。本課圍繞兩個字展開: 合、分。從“合”的角度體現的是離子鍵的形成和結構特點,“分”的視角更多展現的是性質與結構的關系。因此,本課體現了“結構決定性質,性質反映結構”這一重要的學科思想。
[學生]思考、領悟。
設計分析: 本環節以氯化鈉為例,推測離子晶體的結構與其性質的關系,引導學生從微觀層面正確理解離子晶體的宏觀性質,尋求宏觀與微觀之間的關系,建構“結構決定性質”的觀念,發展學生“宏觀辨識與微觀探析”的核心素養。同時,該環節幫助學生形成基于證據進行分析推理,解釋證據與結論之間關系,運用模型描述和解釋化學現象,建立解決復雜化學問題的思維框架,發展“證據推理與模型認知”的核心素養。
通過本課程可遷移到其他晶體結構與性質的學習,例如學生后續學習共價鍵、金屬鍵與分子間作用力等,可綜合分析不同作用力對物質宏觀性質的影響,從而根據微觀結構推斷物質性質,或根據物質性質推斷微觀結構。再如學生可綜合運用原子間作用力與分子間作用力的知識,通過石墨的性質推演石墨的結構信息,最終達成發展學生“宏觀辨識與微觀探析”核心素養的目標。
5 結語
化學學科核心素養是將知識與技能、過程與方法、情感態度價值觀“三維”融于一體后的整體表現,如何將抽象的化學學科核心素養轉化為具體的教學目標,單元教學設計為其提供了轉換的路徑。
化學學科核心素養較難通過直接傳授的方式獲得,需要在各種形式的教學活動中逐漸形成,本研究通過挖掘教學內容中的基本觀念和方法,以單元的整體視角,對教學活動進行整體的規劃,將核心素養融于教學活動之中。
鳴謝: 研究案例在實施中得到王祖浩、羅濱、葉佩玉、徐睿等專家的指導。
參考文獻:
[1]葉佩玉. 中學化學教學設計[M]. 上海: 上海教育出版社, 2016: 231~235.
[2]張芹芹. 小學語文單元教學問題與策略研究[D]. 北京: 首都師范大學碩士學位論文, 2013.
[3]上海市教育委員會教學研究室. 中學化學單元教學設計指南[M]. 北京: 人民教育出版社, 2018.
[4][6]楊玉琴, 倪娟. 學科核心素養視域下的教學目標: 科學研制與準確表達[J]. 化學教學, 2019,(3): 3~7.
[5]顧建辛. 關于化學核心素養培育的微觀思考——“宏觀辨識與微觀探析”素養培育中的目標與行為分析[J]. 化學教學, 2019,(1): 2~7.
[7]上海市教育委員會教學研究室. 高級中學上海市高中化學學科教學基本要求(試驗本)[M]. 上海: 華東師范大學出版社, 2017.

