微生物發酵對麥麩水溶性多酚含量、組成及抗氧化活性的影響研究
,*
(1.內蒙古農業大學動物科學學院,內蒙古呼和浩特 010018; 2.內蒙古自治區草食家畜飼料工程技術研究中心,內蒙古呼和浩特 010018)
植物多酚廣泛分布于植物的根、葉、皮、果實、果皮中,又稱鞣質、單寧,是一類具有多羥基化合物的次生代謝產物[1]。多酚的結構有著獨特的性質,能夠與蛋白質、多糖等相結合,并且可與金屬離子形成絡合物[2]。多酚一般分為游離酚、結合酚和束縛型多酚,其中游離酚和結合酚屬于可溶性酚類物質,而束縛型多酚屬于不可溶型酚類物質[3]。植物多酚具有清除自由基、抗過敏、抗誘變、降血脂等生理功能[4]。同時,多酚還具有很強的抗氧化活性,很多研究表明多酚的抗氧化活性與其含量、結構有著密切的關系[5-9]。
小麥麩皮是小麥加工成面粉的過程中產生的主要副產品[10],多糖和多酚是麥麩中最主要的生理活性物質,對機體的健康發揮著至關重要的作用。由于人們早期對于小麥麩皮的營養價值和功能作用認識不夠全面,直接將其用作飼料和一些產品原料[11],使得其價值得不到充分發揮,造成了這一資源的嚴重浪費。
小麥麩皮多酚大多存在于細胞壁,且以酯鍵或醚鍵的形式與糖相結合[12]。目前已經有越來越多關于從麩皮中提取多酚的研究,例如一些傳統的水提法,超聲波輔助法,微波輔助法、生物法等[13]。微生物發酵法提取多酚是目前的研究熱點。例如,胡博涵[3]通過微生物發酵的方法,將麥麩中的束縛型酚酸釋放,提高了麥麩的總酚含量和阿魏酸含量,并且提高了其抗氧化活性。周聰[14]通過微生物發酵得到紫麥麩皮總酚含量比未發酵提高了兩倍,并且提高了紫麥麩皮的抗氧化活性。由此可見,微生物發酵法處理麩皮,不僅可提高多酚含量和改變其組成,而且可增強其抗氧化活性,但相關研究主要集中在曲霉菌發酵麩皮提取多酚物質。利用枯草芽孢桿菌和釀酒酵母菌混合發酵提取麩皮多酚的研究尚未見報道。本研究選用枯草芽孢桿菌和釀酒酵母菌固態發酵提取麩皮多酚,分析發酵條件對多酚含量的影響,并對其水溶性多酚的組成和抗氧化活性進行研究,為麩皮的高附加值開發利用提供參考。
1 材料與方法
1.1 材料與儀器
菌種:釀酒酵母CGMCC2.119、枯草芽孢桿菌CGMCC1.892 內蒙古自治區草食家畜飼料工程技術研究中心保存;麩皮、豆粕粉、玉米粉 均購于市場;尿素、乙醇、麥芽汁液體培養基、營養肉湯培養基、沒食子酸、福林酚、無水碳酸鈉、1,1-二苯基-2-三硝基苯肼(DPPH)、FeSO4、H2O2、水楊酸、Na2HPO4、NaH2PO4、六氰合鐵酸鉀、三氯乙酸、FeCl3等 均為國產市售。
HVA-85型壓力蒸汽滅菌鍋、GXZ型智力光照培養箱 寧波東南儀器有限公司;SH2-82型旋轉氣浴恒溫振蕩器 金壇市岸頭中旺實驗儀器廠;ZHJH-C1214C型超凈工作臺、HH-2數顯恒溫水浴鍋 中國鄄城華魯電熱電器有限公司;TDL-5-A型臺式高速離心機 上海安亭科學儀器廠;Epoch2型微孔板分光光度計 美國伯騰儀器有限公司。
1.2 實驗方法
1.2.1 微生物發酵條件對麥麩水溶性多酚含量的影響 發酵菌種為釀酒酵母:枯草芽孢桿菌2∶1;實驗室成員前期研究發現,玉米粉和豆粕可以提高發酵麩皮中多糖含量[15],通過分析多酚含量發現也有明顯提高,故本試驗選擇發酵底物以麩皮為主(麩皮、玉米粉、豆粕粉各占80.46%、9.32%、10.22%),接種量為10%,將菌液與水以一定比例混合配制成濃度為108CFU/g的菌溶液,與發酵底物混合發酵。
1.2.1.1 發酵時間對麩皮多酚含量的影響 發酵時間設置為48、60、72、84、96 h,液料比(菌溶液∶發酵底物)為1∶1 (mL/g),發酵溫度37 ℃,發酵結束后產物于45 ℃烘干,備用。
1.2.1.2 發酵溫度對麩皮多酚含量的影響 發酵溫度設置為31、34、37、40 ℃,液料比為1∶1,發酵時間84 h,發酵結束后產物于45 ℃烘干,備用。
1.2.1.3 發酵液料比對麩皮多酚含量的影響 發酵液料比設置為1∶1.5、1∶1.2、1∶1、1∶0.8、1∶0.6,發酵時間為84 h,發酵溫度37 ℃,發酵結束后產物于45 ℃烘干,備用。
1.2.2 水溶性多酚的提取 將烘干的發酵麩皮和未發酵麩皮粉碎,以1∶16 (g/mL)的料水比,90 ℃恒溫水浴35 min,水提后的上清液放入烘箱70 ℃烘干,制得水提物。將水提物用60%乙醇以1∶55 (g/mL)的料液比進行多酚提取,50 ℃水浴2 h,離心取上清,冷凍干燥,制備出游離型多酚提取物。殘渣用1 mol/L的NaOH處理16 h,離心取上清,將pH調至中性,冷凍干燥,制備出結合型多酚提取物[16]。
1.2.3 多酚含量的測定 先配制1000 μg/mL沒食子酸標準液,然后用上述標準液制作濃度分別為:0、10、20、30、40、50 μg/mL的沒食子酸工作液。配制10%福林酚試劑與7.5%的Na2CO3。從不同濃度的沒食子酸工作液中取1 mL,加入5 mL 10%的福林酚試劑,搖勻反應3~8 min,加入4 mL 7.5%的Na2CO3搖勻室溫反應1 h,在765 nm處測定吸光度,繪制標準曲線。同樣方法測定樣品吸光值,計算多酚含量(mg/g)。

式中:c為用標準曲線計算得到的多酚濃度,mg/g;V為提取液體積,mL;D為稀釋倍數;m為發酵麩皮干粉的質量,g。
1.2.4 多酚組成測定 取冷凍樣品0.5 g,加液氮研磨,用8 mL 60%乙醇轉移到50 mL錐形瓶,100 Hz超聲波提取30 min。冷凍離心機10000 r/min、4 ℃離心10 min,取上清液,旋轉蒸發儀中35 ℃低壓蒸出乙醇,殘渣用20 mL超純水(Milli-Q超純水儀,18 MΩ·cm)轉移到50 mL錐形瓶中。用1 mol/L氫氧化鈉溶液調pH至7.0,加入乙酸乙酯20 mL,振蕩10 min,然后轉移到分液漏斗中分離,水相用20 mL乙酸乙酯萃取1次,合并酯相為中性酚。再用6 mol/L鹽酸溶液調水相pH至2.0,用20 mL乙酸乙酯萃取2次,合并酯相為酸性酚。將中性酚和酸性酚合并后35 ℃下濃縮至干,殘渣溶于60%甲醇中,在棕色容量瓶中定容至10 mL,用0.22 μm濾膜過濾,上樣檢測。
采用Diamonsil C18液相色譜柱(5 μm,4.6 mm×250 mm);柱溫30 ℃;流速設為1 mL/min;進樣量為10 μL;流動相為0.1 mol/L磷酸鹽緩沖液(A)與乙腈水溶液(82∶18,v/v);梯度洗脫程序為0 min,7% B;25 min,18% B;30 min,22% B;31 min,50% B;40 min,50% B。采用VWD測器檢測,檢測波長為245 nm。
與標準品保留時間比較確定色譜峰所屬的化合物種類,通過峰面積計算各種化合物含量,結果以干基表示(mg/kg)。
1.2.5 水溶性多酚抗氧化活性測定
1.2.5.1 還原力測定 將1.2.2中制備的樣品溶于水配制成0、0.5、1、2、4 mg/mL的溶液待測,將0.75 mL樣品與0.75 mL磷酸鹽緩沖液(200 mmol/L,pH=6.6)、0.75 mL 1%六氰合鐵酸鉀50 ℃反應20 min,加0.75 mL三氯乙酸終止反應,取1.5 mL加1.5 mL水和400 μL 0.1%的FeCl3室溫反應10 min,700 nm測定吸光度,吸光度越高,還原力越高。
1.2.5.2 DPPH自由基清除率測定 將1.2.2中制備的樣品溶于水配制成0、0.5、1、2、4 mg/mL的溶液待測,參照Musa[17]的方法,2 mL不同濃度樣品加2 mL DPPH溶液混勻30 min后517 nm處測定其吸光度。
計算公式:
式中:A0表示樣品與DPPH反應吸光度;A1表示樣品與95%乙醇反應吸光度;A2表示DPPH與水反應吸光度。
1.2.5.3 羥基自由基清除率測定 將1.2.2中制備的樣品溶于水配制成0、0.5、1、2、4 mg/mL的溶液待測,參考Rajauria等[18]的測定方法,0.5 mL樣品與0.5 mL FeSO4(9 mmol/L)、H2O2(8.8 mmol/L)室溫反應10 min,然后與0.5 mL水楊酸乙醇溶液(9.0 mmol/L)室溫反應30 min,510 nm處測定吸光度。
計算公式:
式中:A0表示蒸餾水代替樣品吸光度;A1表示樣品吸光度;A2表示蒸餾水代替FeSO4溶液吸光度。
1.3 數據統計分析
試驗數據采用SAS 9.2統計軟件進行了單因素方差分析,采用Origin 94-64軟件作圖。
2 結果與分析
2.1 沒食子酸標準曲線
沒食子酸標準曲線如圖1所示,方程為y=5.9249x+0.0554,R2=0.9996,在測定范圍內,線性關系良好,可用于多酚含量的測定。
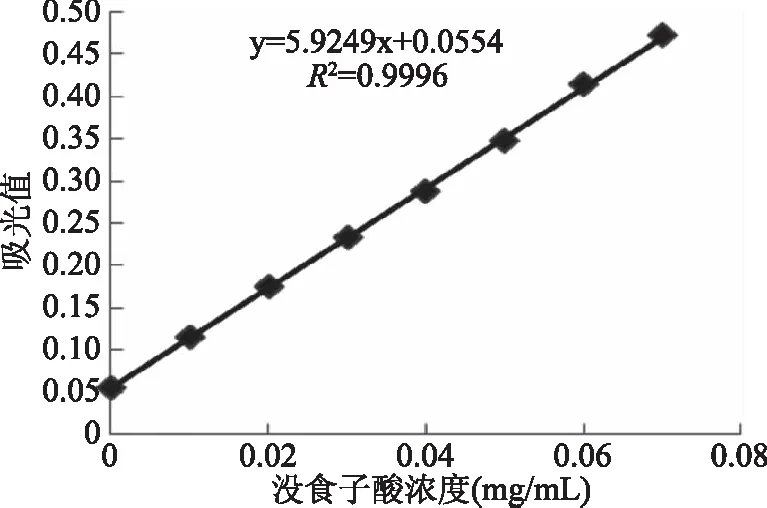
圖1 沒食子酸標準曲線Fig.1 Standard curve of gallic acid
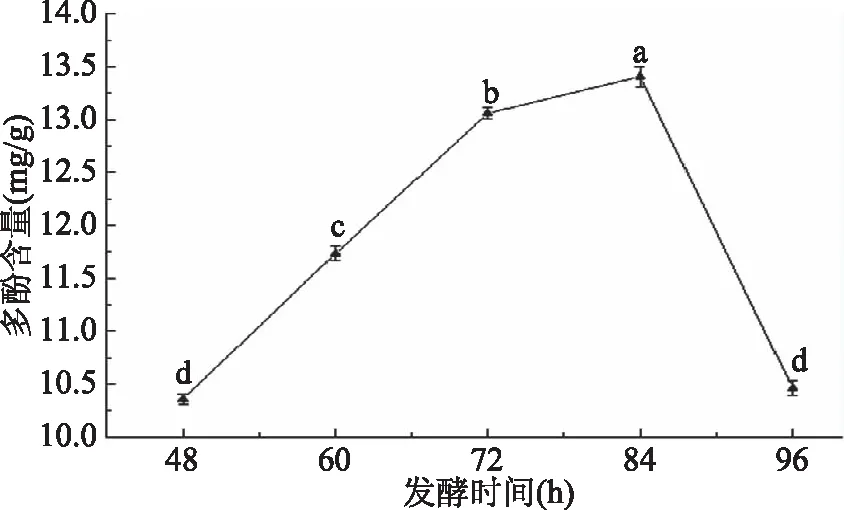
圖2 不同發酵時間水溶性麩皮多酚含量的變化Fig.2 Changes of polyphenol content in water-soluble bran under different fermentation time 注:小寫字母不同表示差異顯著(P<0.05),含有相同字母 表示差異不顯著(P>0.05);圖3~圖4,圖7~圖9同。
2.2 不同發酵條件對水溶性多酚含量的影響
2.2.1 不同發酵時間水溶性麩皮多酚含量的變化 圖2表示不同發酵時間對多酚含量的影響,由圖可以看出,在發酵48~84 h,多酚含量隨發酵時間的增加而提高,可能由于發酵時間過短,微生物生長不足,發酵不完全,隨著時間的增長微生物充分生長繁殖,在84 h多酚含量達到最大值,84 h之后多酚含量開始下降,可能是隨著發酵時間的增加,微生物生長進入了衰亡期,提取多酚的能力減弱[19],不再有酚類物質提出,反而隨著時間的增加,部分酚酸被降解[21],導致多酚含量下降。因此選用最佳發酵時間為84 h。
2.2.2 不同發酵溫度水溶性麩皮多酚含量的變化 微生物生長繁殖都有其適宜的溫度,隨著溫度的改變,其生長速率也會發生改變[20]。由圖3可以看出,隨著發酵溫度的升高,在31~37 ℃隨著發酵溫度的升高,多酚含量逐漸上升,在37 ℃多酚含量最高,可能溫度過低,微生物生長緩慢[20],使得酚類物質提取不充分。37~40 ℃隨著發酵溫度的升高,多酚含量逐漸下降。可能由于溫度過高,導致微生物生理代謝受到影響,酚類物質得率降低。因此,得到最佳發酵溫度為37 ℃。

圖3 不同發酵溫度水溶性麩皮多酚含量的變化Fig.3 Changes of polyphenol content in water-soluble bran under different fermentation temperature
2.2.3 不同液料比水溶性麩皮多酚含量的變化 由圖4可知,隨著液料比的增加,在1∶1.5~1∶1之間,多酚含量逐漸上升,可能由于水分過低使得微生物的生長得不到足夠的水分,使其生長受限,影響發酵效果,因此多酚含量較低。液料比在1∶1~1∶0.6時,多酚的含量下降,可能由于水分過高使得小麥麩皮結塊,降低麩皮透氣性[21],導致發酵效果不佳,多酚含量降低。因此最終選用液料比為1∶1作為發酵條件。

圖6 樣品HPLC色譜圖Fig.6 HPLC diagram of the sample 注:A:發酵結合酚;B:發酵游離酚;C:未發酵結合酚;D:未發酵游離酚。

圖4 不同液料比水溶性麩皮多酚含量的變化Fig.4 Changes of polyphenol content in water-soluble bran under different ratio of feed to liquid
根據單因素結果發酵麥麩,得到發酵后多酚含量為(13.41±0.10) mg/g,而未發酵麩皮多酚含量為(3.40±0.02) mg/g,表明發酵可以增加麩皮多酚的釋放。小麥麩皮中酚酸類物質大多以結合態的形式存在于細胞壁[22],微生物發酵使得細胞壁結構松散,從而使酚類物質得以釋放,多酚含量增加。隨著多酚含量的增加,麩皮多酚的組成成分有何變化尚需進一步分析。FC法常用于測定多酚含量,但由于FC試劑容易被一些糖、蛋白質、環狀有機物等還原,導致多酚含量明顯被高估[23]。因此為了準確測定多酚組成中單體酚的濃度,本試驗采用了高效液相色譜法進行測定。
2.3 發酵與未發酵麩皮水溶性多酚的主要組成分析
圖5為標品的HPLC色譜圖,圖6為樣品的HPLC色譜圖。

圖5 標準品HPLC圖譜Fig.5 HPLC spectrum of standard
由表1可看出,發酵麩皮中游離酚的主要組成成分有阿魏酸和香豆酸,且阿魏酸含量高于香豆酸。發酵麩皮中結合酚阿魏酸含量達到1160.6 mg/kg。未發酵麩皮中游離酚包括少量阿魏酸,香豆酸含量為14.78 mg/kg,結合酚含有941.49 mg/kg阿魏酸。與未發酵麩皮相比,發酵后的阿魏酸含量都明顯升高,而游離香豆酸含量降低,可能是發酵過程中一些香豆酸被降解成揮發性的酚類物質[24],從而導致發酵后香豆酸含量下降。因此,微生物發酵可以提高游離型和結合型阿魏酸含量,改變水溶性多酚的組成比例。Yin等[25]的報道采用泡盛曲霉、米曲霉和黑曲霉發酵小麥麩皮,發酵麩皮中阿魏酸含量分別達到(416.6±2.2)、(117.4±0.5)、(92.0±0.2) μg/g,較未發酵麩皮阿魏酸含量(27.5±0.5 μg/g)分別提高了1414.9%、326.9%、234.5%。同時,該研究發現采用高效液相色譜法測得的多酚含量遠低于FC法,如FC法測得黑曲霉發酵麩皮中多酚含量為10707.5 μg/g,而高效液相色譜法測得多酚含量為676.4 μg/g,其結果與本試驗相似。

表1 發酵與未發酵麩皮水溶性多酚的主要組成成分Table 1 The main components of water-soluble polyphenols in fermented and unfermented bran
2.4 抗氧化活性研究
2.4.1 發酵前后水溶性多酚的還原力變化 還原力表示了抗氧化物質的供電子能力,還原性越強,則說明樣品抗氧化能力越強[20],圖7顯示了不同濃度下發酵與未發酵麩皮中水溶性多酚的還原力,并以BHA作為陽性對照,由圖7可以看出,發酵與未發酵麩皮中水溶性多酚的還原力隨著樣品濃度的升高而逐漸增強,且無論是游離型多酚還是結合型多酚,發酵麩皮水溶性多酚的還原力均高于未發酵,且二者均低于對照組。杜小燕等[26]研究表明,發酵能夠將麥麩中的束縛型酚類物質釋放出來,從而引起抗氧化活性的變化。本試驗結果表明發酵后的總酚含量提高,并且發酵使得束縛型的阿魏酸釋放,因此還原力也有所提高。
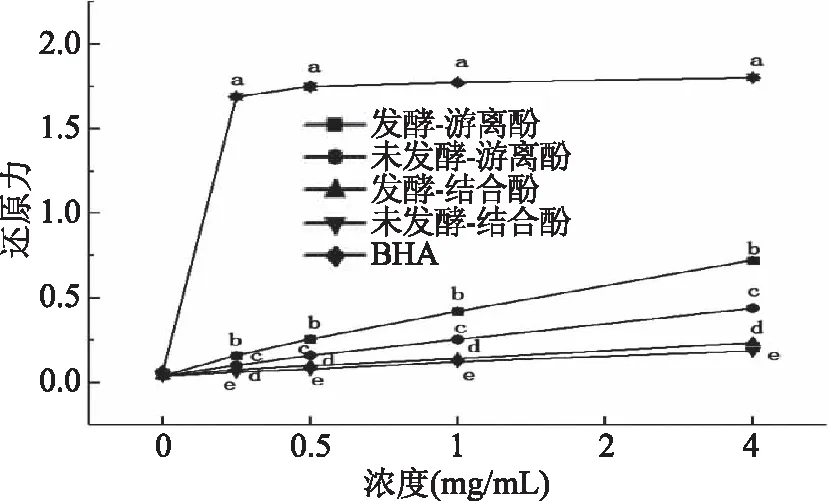
圖7 水溶性多酚提取物還原力Fig.7 Reducing power of water soluble polyphenol extract
2.4.2 發酵前后水溶性多酚提取物清除DPPH自由基的能力 圖8顯示了不同濃度下發酵與未發酵麩皮中水溶性多酚的DPPH自由基清除率,同時以BHA作為陽性對照,由圖8可知,隨著樣品濃度的升高,對DPPH自由基的清除率逐漸升高,兩者呈正相關[14],根據線性方程計算得到發酵麩皮游離酚、結合酚、未發酵麩皮游離酚、結合酚以及BHA的IC50分別為:(0.849±0.132)、(2.737±0.075)、(1.958±0.086)、(3.706±0.072)、(0.208±0.22) mg/mL,IC50值越小,其抗氧化能力越強[27],由此可知,發酵麩皮水溶性多酚對DPPH自由基的清除率明顯高于未發酵麩皮水溶性多酚,二者都低于對照組。可能由于發酵增加了麩皮多酚的釋放,從而提高其對DPPH自由基的清除能力。并且有研究表明小麥麩皮的抗氧化能力與發酵釋放的以阿魏酸為主的多酚類物質的增加有密切相關性[28],這與本研究的結果相一致。

圖8 水溶性多酚提取物清除DPPH自由基的能力Fig.8 The ability of water-soluble polyphenol extracts to scavenge DPPH free radicals
2.4.3 發酵前后水溶性多酚提取物清除羥基自由基能力 由圖9可知,發酵麩皮與未發酵麩皮中水溶性多酚以及對照組BHA對羥基自由基的清除率與其濃度都成線性關系,發酵麩皮游離酚、結合酚的IC50分別為(3.815±0.073)、(5.104±0.077) mg/mL,未發酵麩皮游離酚、結合酚的IC50分別是(2.572±0.073)、(3.495±0.074) mg/mL,BHA的IC50為(4.968±0.083) mg/mL,由此可見,未發酵樣品中水溶性多酚對羥基自由基的清除能力明顯高于發酵樣品,且二者都高于對照組,有研究表明,酚類物質的抗氧化活性與總酚的含量和酚類化合物的組成存在密切的關系[29],因此,本試驗所得結果可能是由于發酵與未發酵麩皮中多酚的組成不同導致其對羥基自由基發揮的作用不同。

圖9 水溶性多酚提取物清除羥基自由基的能力Fig.9 The ability of water-soluble polyphenol extracts to scavenge hydroxyl radicals
3 結論
枯草芽孢桿菌和釀酒酵母菌混合固態發酵可以提高麩皮多酚含量,在料液比為1∶1、發酵溫度37 ℃、發酵時間84 h條件下,水溶性麩皮多酚含量為(13.41±0.10) mg/g,較發酵前提高了294.41%(未發酵麥麩水溶性多酚含量為(3.40±0.02) mg/g)。由此可見,微生物發酵可以明顯提高水溶性麩皮多酚含量。
微生物發酵改變了水溶性多酚的組成比例,提高了游離型和結合型阿魏酸含量,且水溶性麩皮多酚主要以結合型阿魏酸形式存在。發酵后,麩皮多酚的還原力和DPPH自由基清除率均得到提高,而羥基自由基的清除率卻出現了下降,這可能與其組成有關,相關研究有待進一步探討。

