玉米大斑病菌StTOXE蛋白的原核表達及分析
張運峰
(唐山師范學院生命科學系,河北 唐山 063000)
【研究意義】植物病原真菌中TOXE蛋白作為轉錄因子在真菌寄主選擇性毒素的合成方面具有重要的作用,通過建立玉米大斑病菌StTOXE蛋白原核表達體系,為進一步開展StTOXE蛋白抗體制備、結構解析和StTOXE蛋白功能研究奠定基礎。【前人研究進展】玉米大斑病(Setosphaeriaturcica)是玉米上的重要葉部病害之一,在世界各地的玉米產區均有發生,流行的年份會造成高達50 %的玉米減產[1-3]。近年來,關于玉米大斑病菌的研究主要集中于對病原菌的Ras[4]、MAPK[1,5]、cAMP及Ca2+途徑等信號轉導途徑的結構及功能分析,尤其以對MAPK信號途徑的研究最為深入[6]。由于不同的信號轉導途徑之間存在著廣泛的交互調控(Cross Talk)[7],造成一個信號途徑產生變化時,其它信號途徑會產生補充效應。因此,利用這些基因作為靶位點防治玉米大斑病菌的技術面臨很大的挑戰。在中國玉米產區發現了超過15個玉米大斑病菌致病小種,包括0、1、3、N、12、13、1N、23、2N、3N、123、12N、13N、23N和123N[8]。玉米大斑病菌是否能夠對寄主玉米產生侵染并形成病害,主要取決于玉米Ht基因的類型[9]。例如:1號小種會使基因型為Ht1的玉米品種感病,而對于Ht2和Ht3、HtN等基因型的玉米植株不能形成侵染。許多植物病原真菌都是通過分泌真菌毒素侵染寄主植物并使植物產生病理反應[10],真菌毒素分為兩類,一類為非寄主選擇性毒素,具有廣泛的寄主侵染活性,一類為寄主選擇性毒素(Host-Selective Toxins,HSTs),它是由病原真菌分泌的一類低分子量次級代謝產物[11],這一類毒素僅會對特異基因型的植物產生病理反應,決定了病原真菌的寄主范圍和致病性[12]。Ahn Joong-Hoon等[10]首先在玉米圓斑病菌(Cochlioboluscarbonum)研究了HSTs毒素合成的機制,后相繼在Alternariajesenskae[13]、Burkholderiaglumae[14]等少數真菌中開展研究。研究發現HSTs合成需要Tox2基因簇,并發現基因簇中的ToxE基因起著重要作用,TOXE蛋白作為一種轉錄因子調控Tox2基因簇多個基因的協同表達,進而調控毒素的合成,ToxE基因突變以后,突變體的致病力會喪失[12]。目前,HSTs合成的機制在其它植物病原真菌中報道還較少。【本研究切入點】玉米大斑病菌侵染玉米過程中存在明顯的小種專化現象,推測玉米大斑病菌病菌也具有玉米圓斑病菌類似的寄主選擇性毒素合成機制,因此,開展玉米大斑病菌中StToxE基因和其蛋白的研究對證明和研究玉米大斑病菌寄主選擇性毒素合成機制具有重要作用。【擬解決的關鍵問題】本研究將克隆StToxE基因,構建StTOXE融合蛋白原核表達載體,并確定StTOXE融合蛋白最優表達條件及其可溶性特征。
1 材料與方法
1.1 材料
1.1.1 菌株與質粒 原核表達載體pET-28a(+)由河北農業大學真菌毒素實驗室惠贈。玉米大斑病菌野生型Wt01-23和大腸桿菌菌株BL21(DE3)由本實驗室構建和保存。
1.1.2 試劑 磁珠法 DNA 膠回收試劑盒、SanPrep 柱式質粒 DNA 小量抽提試劑盒、ECL化學發光檢測試劑盒和異丙基-β-D-硫代半乳糖苷(ITPG)等試劑均購自生工(上海)生物工程有限公司;TaqTMDNA 聚合酶、EcoR I和Hind III購自寶日醫生物技術(北京)有限公司;細菌蛋白提取試劑盒、Western Blot Marker(PR1800)和Pfu DNA Polymerase購自北京索萊寶科技有限公司。Anti-His Tag Antibody (Monoclonal, 9C11)一抗和Goat Anti-Mouse IgG(H+L)Secondary Antibody(HRP Conjugate)二抗均購自博士德生物工程有限公司(Boster Biological Technology co.ltd)。氯化鈉、蛋白胨和酵母提取物等試劑均為國產分析純試劑。
1.2 方法
1.2.1StToxE基因的克隆和凝膠回收 參照張運峰[15]的方法提取玉米大斑病菌Wt01-23的RNA,反轉成cDNA。以StToxE-F(5’-GCGAATTCATGGCCGATGTCAACGAG-3’)和StToxE-R(5’-GCAA GCTTGGGCACAGCCTAGATTTACATTC-3’)特異引物進行高保真PCR擴增。 PCR擴增體系為:Pfu DNA Polymerase 1.0 μl,10×Pfu buffer 2.5 μl,上下游引物各0.5 μl,cDNA 0.25 μl, 雙蒸水(ddH2O)補足至25 μl。PCR反應程序為:95 ℃預變性5 min;94 ℃變性10 s,55 ℃退火30 s, 72 ℃延伸3 min,30個循環;最后72 ℃延伸10 min。經1 %瓊脂糖凝膠電泳檢測,用磁珠法 DNA 膠回收試劑盒回收PCR產物。
1.2.2 玉米大斑病菌StToxE基因表達載體的構建和鑒定 將1.2.1回收獲得的PCR產物與載體pET28a(+)質粒分別用限制性內切酶HindIII和EcoR I進行37 ℃酶切過夜反應,用DNA回收試劑盒回收目的基因及載體片段,隨后將載體和PCR產物按1∶5進行連接反應后,將連接產物轉化DH5α感受態細胞,用StToxE基因特異引物進行篩選陽性克隆菌落。使用SanPrep 柱式質粒 DNA 小量抽提試劑盒提取重組質粒,并進行雙酶切鑒定,最后將驗證正確的質粒交生工(上海)生物工程股份有限公司測序。
1.2.3 ITPG最適誘導濃度摸索 將含有pET28a-StToxE質粒的BL21(DE3)菌株在LB培養基上劃線培養,挑取單菌落接入3 mL LB液體培養基中震蕩培養過夜,按照1∶100將菌液接種入50 mL LB液體培養基中37 ℃,200 r/min振蕩培養,待OD600≈0.8時,加入終濃度為0、0.2、0.4、0.6、0.8、1.0 mmol/L的IPTG,繼續振蕩培養4 h,離心收集菌體沉淀。
1.2.4 StTOXE蛋白的SDS-PAGE和Western Blot檢測 參考宋楊等[16]將收集菌體沉淀并用PBS(磷酸緩沖液pH7.4)懸浮,加入2×聚丙烯酰胺凝膠電泳(SDS-PAGE)上樣緩沖液,100 ℃煮沸10 min,冰浴5 min后4 ℃、12 000 r/min 離心10 min。使用12 %的SDS-PAGE凝膠對上清液進行電泳,考馬斯亮藍染色檢測蛋白表達。
將目的上清液進行SDS-PAGE電泳后,將蛋白轉移到PVDF膜上,然后進行Anti-His Tag Antibody (Monoclonal, 9C11)一抗孵育1.5 h,TBST洗滌5次,再進行Goat Anti-Mouse IgG(H+L) Secondary Antibody(HRP Conjugate)孵育1.5 h,經TBST洗膜后用ECL顯色,最后置于化學發光成像儀(上海嘉鵬科技有限公司,ZF-670)中檢測;另外,利用Image J軟件對不同ITPG濃度條件下StTOXE融合蛋白的Western blot檢測結果進行灰度分析,定量分析蛋白表達量的差異。
1.2.5 StTOXE蛋白的可溶性分析 將經過誘導培養的菌液12 000 r/min離心2 min,用PBS(pH 8.0)緩沖液洗滌2次后,沉淀用1 mL PBS緩沖液重懸。細胞超聲破碎儀功率為200 W,超聲3 s,冷卻5 s進行循環破碎40 min。裂解完成后4 ℃、10 000 r/min離心10 min,分別收集破碎后的上清和沉淀,SDS-PAGE電泳和Western Blot檢測分析重組蛋白的可溶性。
2 結果與分析
2.1 pET28a-StToxE原核表達載體的構建及其鑒定
以玉米大斑病菌的cDNA為模板、StToxE的特異引物進行PCR擴增,在1500 bp的位置擴增出一條的清晰、明亮、單一的條帶,與1470 bp理論值 的相同(圖1-A)。將StToxE基因與pET28a載體的連接產物轉化DH5α并獲得轉化子,以DH5α、DH5α-pET28a和DH5α-pET28a-StToxE菌體為模板進行的PCR篩選,在隨機挑取的菌落中均擴增出了1470 bp的條帶,而對照組DH5α、DH5α-pET28a均沒有擴增出條帶(圖1-B),證明隨機挑選的轉化菌落均為DH5α-pET28a-StToxE轉化子。提取DH5α-pET28a-StToxE轉化子質粒后,HindIII和EcoR I雙酶切鑒定,發現5400和1470 bp的2個條帶,分別與載體pET28a和StToxE基因大小相同。經過華大基因測序,堿基序列正確。

1~4:StToxE基因的擴增結果;5~11:DH5α-pET28a-StToxE;12:pET28a-StToxE重組質粒Hind III和EcoR I雙酶切;M:DL2000;M1:1Kb Marker
2.2 pET28-StToxE表達載體的誘導表達及Western Blot檢測
通過高溫煮沸裂解細菌菌體獲得的上清液進行SDS-PAGE電泳和考馬斯亮藍染色,發現條帶數目沒有明顯差異,但在72 kD區域條帶存在明顯加粗(圖2-A),初步確定StTOXE蛋白已經表達。由于表達蛋白攜帶His標簽,我們利用Western Blot試驗進一步檢測了StTOXE融合蛋白,結果發現BL21-pET28a上清液中未檢測到任何條帶,而BL21-pET28a-StToxE轉化子中檢測到72 kD的條帶(圖2B)。綜合考馬斯亮藍染色和Western Blot試驗結果進一步確定StTOXE蛋白在BL21細胞中表達,且StTOXE蛋白約為72 kD。
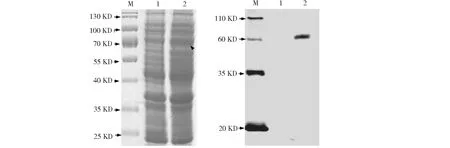
1:BL21-pET28a表達蛋白; 2: BL21-pET28a-StToxE表達蛋白
2.3 不同濃度ITPG對StTOXE融合蛋白表達的影響
BL23-pET28-StToxE轉化子在不同濃度ITPG誘導4 h后,Western Blot檢測結果發現隨著ITPG濃度的增加蛋白表達量逐漸增加,ITPG濃度在0.2 mmol/L時有明顯的條帶形成,0.4~0.6 mmol/L時達到最大;隨后雜交條帶逐漸變淺,表明融合蛋白表達量逐漸減少(圖3);灰度分析顯示:以0.2 mmol/L為對照,ITPG濃度達到0.4和0.6 mmol/L時顯著高于對照,表明蛋白表達量較高,而其它ITPG濃度條件下蛋白表達量均降低,ITPG濃度達到0.1 mmol/L,蛋白表達量顯著低于對照組(圖4)。
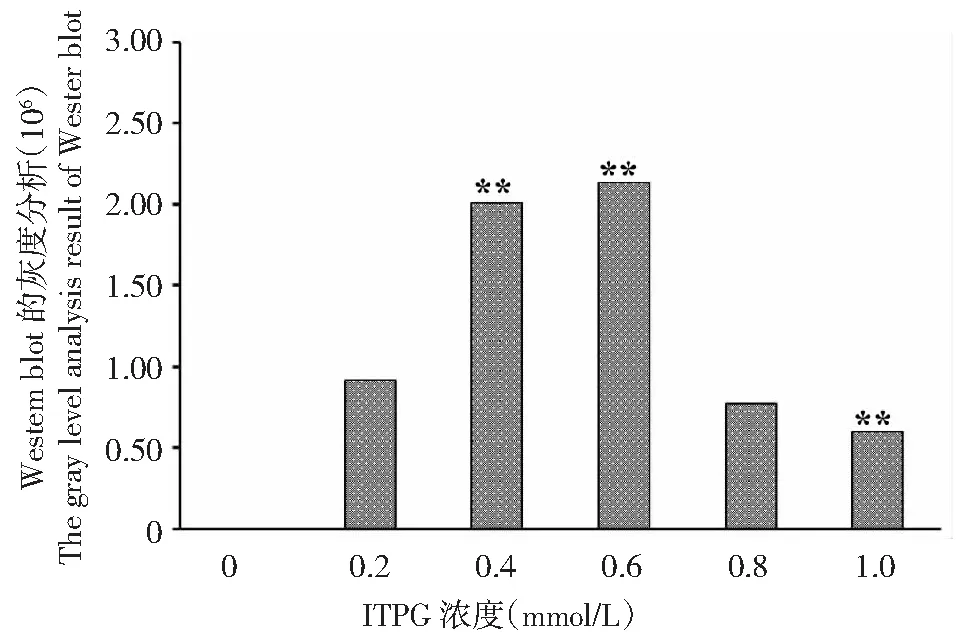
圖4 StTOXE融合蛋白Western blot的灰度分析結果Fig.4 Gray analysis results of StTOXE fusion protein Western blot
2.4 StTOXE表達蛋白的可溶性檢測
離心收集誘導表達后的含有pET28a-StToxE表達質粒的大腸桿菌BL21 (DE3),取上清及沉淀分別進行SDS-PAGE和考馬斯亮藍染色、Western blot檢測,結果顯示沉淀中在72 kD發現一條清晰條帶,在上清中沒有出現同等大小的條帶(圖3-A);Western blot結果也僅在72 kD位置檢測到一條清晰的條帶,而上清中為檢測出StTOXE蛋白(圖3-B)。因此,StTOXE融合蛋白僅存在于沉淀中,在上清中無明顯表達,表明重組蛋白以包涵體的形式存在,且重組蛋白單體為可溶性蛋白(圖5)。
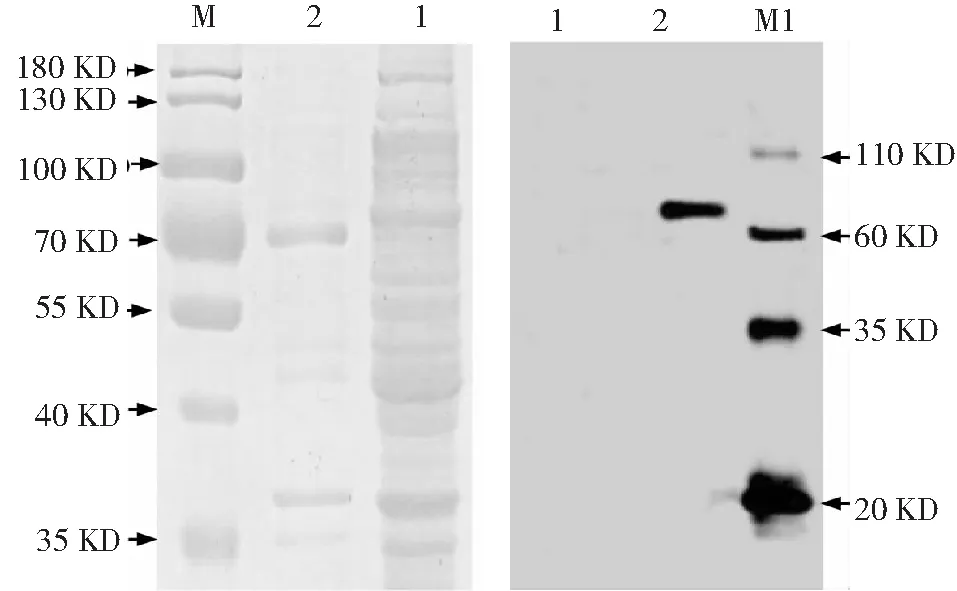
1:裂解上清;2:裂解沉淀;M:PageRulerTM prestained protein lader;M1:Western blot marker(PR1800)
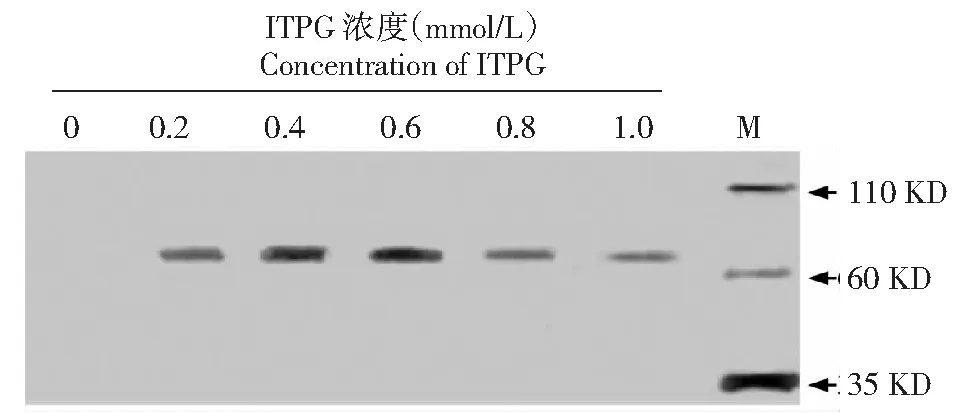
圖3 不同ITPG濃度條件下StTOXE融合蛋白的Western blot檢測(M:Western blot marker)Fig.3 Western blot detection of StTOXE fusion protein under different concentrations of ITPG
3 討 論
毒素是植物病原真菌重要的致病因子,也是植物病原真菌的研究熱點。董金皋等[17]的研究發現玉米大斑病菌可以產生致病毒素,且該毒素具有寄主專化性活性;張利輝等[18]在研究玉米大斑病菌2號小種毒素成份時指出玉米大斑病毒素中含有寄主選擇性毒素組份。本研究從玉米大斑病菌野生型菌種Wt01-23中克隆獲得了StToxE基因,構建了原核表達載體pET28a-StToxE,并在大腸桿菌BL21 (DE3)中進行了原核表達,通過分別收集破碎細胞的上清和沉淀,分析了表達蛋白的形式和可溶性。
由于構建的pET-28a (+)載體的StToxE無終止子,且StTOXE融合蛋白在N端和C端分別各含有1個His-Tag,在N端還有1個T7-Tag,結合前期利用生物信息學工具分析StToxE融合蛋白獲得數據(數據另行發表)理論分子量約為55 kD。通過對誘導表達蛋白SDS-PAGE和Western blot檢測結果顯示StTOXE融合蛋白的大小約為72 kD,比理論值大30.9 %。在前人研究結果中顯示表達蛋白分子量與預測值存在差異的情況并不少見[19-22],甚至有文獻報道SDS-PAGE檢測結果超過預測值的70 %~100 %[23-24],這個結果產生的原因His是堿性氨基酸帶有正電荷,而6個His的標簽所帶的正電荷就更多,從而降低了泳動速率,導致表觀分子質量變大;另外,具有結合DNA的活性的蛋白,也會進一步增加蛋白的分子質量[24],從而導致電泳結果和預測值有較大差異。
實驗結果發現在低濃度時StTOXE外源蛋白的表達量隨IPTG 濃度增加而逐漸升高,在IPTG 濃度為0.4~0.6 mmol/L時達到最大值,此后隨著IPTG 濃度的增加表達量反而下降,可能是因為高濃度的IPTG 會對細菌菌體的生長造成毒害作用,同時為了節約研究成本,選擇0.5 mmol/L為最適誘導濃度。另外,在37 ℃條件下,StTOXE融合蛋白全部以包涵體形式存在于宿主菌中。包涵體的形成是外源蛋白高效表達時的普遍現象[25],較高的溫度可以提高翻譯起始效率,增加蛋白表達量[26],但是外源蛋白表達過快時往往造成蛋白不能自發折疊卷曲生成有一定空間結構的蛋白質,從而形成包涵體,影響蛋白活性。減少包涵體的形成比率可以通過優化培養基、降低誘導溫度[27-28]、使用增溶標簽[29]、使用突變菌株[30]等方法,其中,降低誘導溫度是常用的增強蛋白可溶性[31]的有效方法,后期試驗中可開展通過降低誘導溫度增加StTOXE融合蛋白溶解性的研究。
4 結 論
本研究通過RT-PCR克隆了玉米大斑病菌StToxE基因;將StToxE基因插入PET28原核表達載體中成功構建了StTOXE融合蛋白表達載體pET28a-StToxE,并將表達載體轉化BL21菌株中獲得BL21-pET28a-StToxE轉化子;通過ITPG誘導、Western Blot檢測確認了StTOXE融合蛋白在BL21菌株中表達,并發現ITPG濃度為0.4~0.6 mmol/L時融合蛋白表達效率最高;當誘導溫度為37 ℃時StTOXE融合蛋白基本以包涵體形式存在細胞內,且融合蛋白單體為可溶性蛋白。

