抗腫瘤藥物奧莫替尼的合成
肖 珍, 周玲佳, 王秋秋, 朱五福
(江西科技師范大學 藥學院,江西 南昌 330013)
奧莫替尼(Olmutinib,1),化學名為N-[3-[(2-4-(4-甲基哌嗪-1-基)苯基)氨基]噻吩并[3,2-d]嘧啶-4-基]氧基]苯基]丙烯酰胺,是一種用于治療非小細胞肺癌(NSCLC)晚期或轉移性T790M突變的第三代表皮生長因子受體酪氨酸激酶抑制劑(EGFR TKI)[1-3]。該藥由韓美制藥開發,2016年5月獲得韓國食品藥品安全部(MFDS)的批準上市。1是一種不可逆激酶抑制劑,能與突變EGFR激酶結構域中的半胱氨酸殘基Cys797發生共價結合作用,其半衰期超過24 h,對癌細胞株H1975(EGFRL858R/T790M)及HCC827(EGFRExon19 del)具有較強的抑制作用(GI50分別為9.2 nM和10 nM),對攜帶野生型EGFR的NSCLC細胞H358幾乎無毒性(GI50為2225 nM)[4]。因1顯著的抗腫瘤療效,與其相關的研究受到了廣泛關注[5-15]。
目前,1因為部分副作用[16]和國際藥物競爭沖擊而未在其他國家上市。但對1的合成工藝進行優化有助于開發新的類似小分子抑制劑。因此,本文擬對1的合成方法進行改進。

Scheme 1
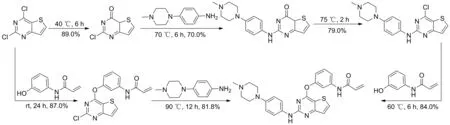
Scheme 2
文獻報道的1的合成路線主要有3條。韓美制藥報道的專利方法(Scheme 1)[17]:以3-氨基噻吩-2-羧酸甲酯為起始原料,經環合、氯代、親核取代反應得到關鍵中間體2-氯-4-(3-硝基苯氧基) 噻吩并[3,2-d]嘧啶,再與4-(4-甲基哌嗪-1-基)苯胺進行親核取代反應得到N-(4-(4-甲基哌嗪-1-基)苯基)-4-(3-硝基苯氧基)噻吩并[3,2-d]嘧啶-2-胺。該反應收率較低(42.0%),還原及丙烯酰化等步驟均需要使用柱層析法進行純化。此外,硝基還原采用的是鐵粉還原法,對環境污染較嚴重。整條路線總收率僅10%。另外兩條路線皆為韓美制藥對上述路線的優化。原創公司在專利[18]中報道(Scheme 2),將2,4-二氯噻吩并[3,2-d]嘧啶氧化成2-氯[3,2-d]嘧啶-4(3H)-酮后,與側鏈4-(4-甲基哌嗪-1-基)苯胺通過親核取代反應制得2-((4-(4-甲基哌嗪-1-基)苯基)氨基)噻吩并[3,2-d]嘧啶-4(3H)-酮,最后與N-(3-羥基苯基)丙烯酰胺反應得到1。該路線中對2,4-二氯噻吩并[3,2-d]嘧啶先氧化再氯代,過程較繁瑣。所用中間體N-(3-羥基苯基)丙烯酰胺的合成收率較低[19]。在另一條優化路線中[20]韓美制藥以2,4-二氯噻吩并[3,2-d]嘧啶與N-(3-羥基苯基)丙烯酰胺進行親核取代反應得到N-(3-((2-氯噻吩并[3,2-d]嘧啶-4基)氧基)苯基)丙烯酰胺,再與側鏈4-(4-甲基哌嗪-1-基)苯胺反應制得1。該路線的操作復雜,過程難以控制。
本文在文獻基礎上進行了優化,以3-氨基噻吩-2-羧酸甲酯(2)和尿素為起始原料制得噻吩并嘧啶母核,經氯代、親核取代反應得到中間體2-氯-4-(3-硝基苯氧基)噻吩并[3,2-d]嘧啶(5),再經還原、酰胺化,最后與側鏈4-(4-甲基哌嗪-1-基)苯胺通過親核取代反應制得1(Scheme 1),總收率25.7%,其結構經1H NMR和IR確證。
1 實驗部分
1.1 儀器與試劑
SGWX-4型熔點儀;ARX-400 MHz型核磁共振儀(DMSO-d6為溶劑,TMS為內標);Bruker TENSOR II 型傅里葉變換紅外光譜儀(KBr壓片)。
所用試劑均為分析純。
1.2 合成
(1) 噻吩并[3,2-d]嘧啶-2,4-二醇(3)的合成
將3-氨基噻吩-2-羧酸甲酯25.0 g(159.2 mmol)與脲48.0 g(792.1 mmol)加入500 mL燒瓶中,氮氣保護,加熱至120 ℃,攪拌下反應4 h。倒入1 L水中,冷卻至室溫,攪拌0.5 h,析出大量白色固體,抽濾,濾餅干燥得白色固體318.4 g,收率68.5%, m.p.138~140 ℃;1H NMRδ: 11.38(d,J=5.4 Hz, 2H), 8.04(d,J=5.2 Hz, 1H), 6.90(d,J=5.2 Hz, 1H); IRν: 3562, 1599, 1308, 1145 cm-1。
(2) 2,4-二氯噻吩并[3,2-d]嘧啶(4)的合成
將化合物318.0 g(107.0 mmol)溶解于三氯氧磷100 mL中,加入N,N-二甲基甲酰胺3 mL,攪拌下回流(120 ℃)反應3 h。反應完成之后,將反應混合物冷卻至室溫,緩緩加入到500 mL冰水中并劇烈攪拌,有固體析出。抽濾,濾餅用蒸餾水洗滌,真空干燥得淡灰色固體4 17.5 g,收率79.6%, m.p.121 ~129 ℃;1H NMRδ: 8.70(d,J=5.4 Hz, 1H), 7.74(d,J=5.4 Hz, 1H); IRν: 1592, 1460, 697 cm-1。
(3)5的合成
將化合物417.0 g(82.9 mmol)溶解于4-二氧六環100 mL中,依次加入間硝基苯酚12.0 g(86.3 mmol)和碳酸銫32.0 g(99.5 mmol),攪拌下反應4 h。倒入250 mL水中,攪拌10 min;抽濾,濾餅真空干燥得黃色固體525.2 g,收率98.7%, m.p.158.3~162.7 ℃;1H NMRδ: 8.51(d,J=5.4 Hz, 1H), 8.28(s, 1H), 8.16(d,J=8.2 Hz, 1H), 7.85(d,J=8.2 Hz, 1H), 7.74(t,J=8.2 Hz, 1H), 7.59(d,J=5.4 Hz, 1H); IRν: 3050, 1554, 1649, 1490, 1108, 673 cm-1。
(4) 3-[(2-氯吡啶并[3,2-d]嘧啶-4-基)氧基]苯胺(6)的合成
將化合物525.0 g(81.3 mmol)溶解于乙醇400 mL中,依次加入六水合氯化鐵22.0 g(81.5 mmol)和活性炭6.8 g(566.7 mmol),升溫至80 ℃,滴加水合肼40.6 g(812.0 mmol)的乙醇(100 mL)溶液,滴畢,攪拌下回流反應2 h。抽濾,濾餅用無水乙醇150 mL洗滌,收集洗液,減壓蒸除溶劑,殘余物加入飽和碳酸氫鈉溶液200 mL,劇烈攪拌,析出固體,抽濾,濾餅干燥得黃色固體619.8 g,收率87.5%, m.p.162~163 ℃;1H NMRδ: 8.53(d,J=5.4 Hz, 1H), 7.62(d,J=5.4 Hz, 1H), 7.11(t,J=8.0 Hz, 1H), 6.53(d,J=7.8 Hz, 1H), 6.47 ~6.41(t, 2H), 5.41(s, 2H); IRν: 3448, 3122, 1542, 1319, 1181, 743 cm-1。
(5)N-{3-[(2-氯噻吩并[3,2-d]嘧啶-4-基)氧基]苯基}丙烯酰胺(7)的合成
將化合物619.8 g(71.3 mmol)溶解于二氯甲烷400 mL中,加入NaHCO312.0 g(142.9 mmol),冰浴冷卻,攪拌10 min;緩慢滴加丙烯酰氯6.5 g(71.8 mmol)的二氯甲烷(10 mL)溶液,滴畢,攪拌下反應15 min。抽濾,濾餅依次用二氯甲烷和甲醇洗滌,減壓蒸除溶劑,殘余物用無水乙醇重結晶,抽濾,濾餅真空干燥得淡灰色固體721.2 g,收率89.6%, m.p.184~185 ℃;1H NMRδ: 10.41(s, 1H), 8.55(d,J=5.4 Hz, 1H), 7.79(s, 1H), 7.64(d,J=5.0 Hz, 1H), 7.54(d,J=8.0 Hz, 1H), 7.46(t,J=8.2 Hz, 1H), 7.10(d,J=7.0 Hz, 1H), 6.44(dd,J=16.8 Hz, 10.2 Hz, 1H), 6.27(d,J=17.2 Hz, 1H), 5.78(d,J=9.6 Hz, 1H); IRν: 3143, 1634, 1578, 1498, 1206, 695 cm-1。
(6)1的合成
將化合物721.0 g(63.3 mmol)溶解于異丙醇400 mL中,加入三氟乙酸7.3 g(64.0 mmol),升溫至100 ℃,攪拌0.5 h;緩慢滴加4-(4-甲基哌嗪-1-基)苯胺14.5 g(76.0 mmol)的異丙醇(50 mL)溶液,滴畢,攪拌下回流反應4.5 h。減壓蒸除溶劑,殘余物加水100 mL,用稀鹽酸調至pH 4,用二氯甲烷洗滌,無水硫酸鈉干燥,減壓回收二氯甲烷,殘余物加入飽和碳酸氫鈉溶液20 mL,抽濾,濾餅真空干燥得淡黃色固體118.8 g,收率60.9%, m.p. 211~212 ℃;1H NMRδ: 10.11(s, 2H), 8.55(d,J=5.2 Hz, 2H), 7.71(s, 2H), 7.64(t,J=6.4 Hz, 2H), 7.53~7.39(m, 5H), 7.04(d,J=7.0 Hz, 2H), 3.12~2.89(m, 4H), 2.38~2.29(m, 4H), 1.95(s, 3H);13C NMRδ: 174.8, 169.1, 169.3, 158.0, 149.0, 141.6, 138.2, 133.3, 131.9, 130.6, 127.9, 125.9(C2), 119.9(C2), 118.9, 117.5, 115.6(C2), 110.8, 109.0, 57.4(C2), 54.8(C2), 49.1; IRν: 3080, 1732, 1627, 1506, 1269, 1183 cm-1。
2 結果與討論
在韓美制藥的前期專利[17]路線中,合成化合物3的需要尿素6 eq.,且需先溶于N,N-二甲基甲酰胺中。反應溫度高達190 ℃,反應時間為12 h。在本路線中,惰性氣體保護下,直接機械攪拌原料和5 eq.尿素,反應溫度降低至120 ℃,反應時間縮短至4 h。合成化合物4時,將反應溫度從專利報道的200 ℃降至120 ℃;在化合物5的制備過程中,使用1,4-二氧六環替代N,N-二甲基甲酰胺作溶劑,碳酸銫用量降低至1.2 eq.。使用該路線合成時,產品收率較文獻方法提高21.6%。
與韓美制藥的后期專利相比,本路線詳細討論了中間體3和4的合成工藝,以及丙烯酰氯與相應中間體的反應。專利[18]采用將氯代基團先氧化后氯代的辦法,總收率較低。專利[20]在合成化合物7時,產率87.0%。本路線6與丙烯酰氯進行反應,產率略微提高至89.6%。在合成1的后處理過程中,專利方法涉及抽濾、調節酸堿度、萃取和減壓濃縮等一系列較繁瑣的過程。本實驗通過兩次調節酸堿度除去了雜質,簡化了后處理流程。
對抗腫瘤藥奧莫替尼(1)的合成工藝進行了優化。以3-氨基噻吩-2-羧酸甲酯和尿素為起始原料,經環合制得噻吩并嘧啶母核,再經氯代、親核取代、還原等反應合成1。與專利報道的以3-氨基噻吩-2-羧酸甲酯為起始原料的工藝路線相比,優化后的工藝路線具有后處理操作簡單,總收率較高(25.7%)等優點。

