木犀草素與白藜蘆醇聯合應用對人肝癌細胞凋亡的影響及機制
樂煒,王超,鄧波,章永
咸寧市中心醫院,湖北咸寧437000
肝癌發病率在癌癥中排名第六,致死率排名第三[1]。據報道,全球每年肝癌死亡患者超過70萬人,其中約50%發生在中國,嚴重危害了我國公民的身體健康[2]。手術切除和化療是臨床治療肝癌的主要手段,但由于肝癌局部復發轉移、耐藥性及化療藥物的不良反應嚴重影響了療效[3]。因此尋找安全有效的抗腫瘤藥物及治療方案是目前研究的重點。研究顯示,木犀草素(Lut)具有抗炎、抗氧化、心血管保護等作用[4~6],且Lut也是一種有效的腫瘤防治劑,對肝癌、乳腺癌和結腸癌均有顯著抑制作用[5,7]。白藜蘆醇(Res)是一種普遍存在于藜蘆、葡萄和花生等植物中的非黃酮類多酚化合物,具有心血管保護和改善代謝的作用[8,9],其通過作用于不同的信號通路,對前列腺癌、乳腺癌、肺癌等癌癥發揮抑制作用,具有較好的抗腫瘤活性[10]。Lut和Res對細胞內過度激活的核因子κB(NF-κB)均有抑制作用,但Lut和Res是否通過抑制NF-κB表達發揮抑制肝癌的作用,目前鮮見報道。2018年7月~2019年2月,本研究對此做了探討。
1 材料與方法
1.1 材料 人肝癌細胞(HepG2)、人正常肝細胞(LO2)分別購自北京協和細胞庫、中科院上海細胞庫。Res(溶于DMSO,母液濃度為50 mmol/L)購自美國Sigma公司;Lut(溶于DMSO,母液濃度為40 mmol/L) 購自美國MCE公司;索拉非尼購自美國Adooq公司;MTT和DAPI購自上海Beyotime公司;FBS和DMEM培養基購自美國Hyclone公司;DMSO購自美國Thermo公司;RT-PCR試劑盒購自日本TaKaRa公司;NF-κB、磷酸化NF-κB(p-NF-κB)、B細胞淋巴瘤/白血病-2基因(Bcl-2)、Bcl-2聯接X蛋白(Bax)、半胱氨酸蛋白酶3(Caspase-3)抗體購自美國Cell Signaling Technology公司;β-actin和GAPDH購自英國Abcam公司;ECL購自美國Pierce公司。
1.2 HepG2、LO2細胞培養 HepG2、LO2細胞培養于含10% FBS和雙抗的DMEM完全培養基中,培養條件為37 ℃、5% CO2的飽和濕度培養箱。根據細胞生長情況定時換液和傳代。
1.3 藥物處理 將生長狀態良好且處于對數生長期的HepG2、LO2細胞以1×105/mL接種于96孔板、24孔板、6孔板和T25細胞瓶中,待細胞生長融合至60%~80%,將培養基更換為含(終濃度0、5、10、20 μmol/L)Lut、(0、12.5、25、50 μmol/L)Res及5 μmol/L Lut+12.5 μmol/L Res、5 μmol/L Lut+25 μmol/L Res、5 μmol/L Lut+50 μmol/L Res、10 μmol/L Lut+12.5 μmol/L Res、10 μmol/L Lut+25 μmol/L Res、10 μmol/L Lut+50 μmol/L Res、20 μmol/L Lut+12.5 μmol/L Res、20 μmol/L Lut+25 μmol/L Res、20 μmol/L Lut+50 μmol/L Res、10 μmol/L索拉非尼的無血清DMEM培養基,繼續培養24 h。
1.4 細胞活力檢測 采用MTT實驗。藥物處理結束后,于96孔板中每孔加入濃度為5 mg/mL的MTT母液10 μL,37 ℃培養箱孵育4 h,酶標儀測定490 nm波長處的吸光度(OD)值,用空白孔校準。計算細胞相對存活率,細胞相對存活率=(實驗孔OD值-空白孔OD值)/(對照孔OD值-空白孔OD值)×100%。
1.5 細胞形態觀察 取對數生長期的HepG2、LO2細胞,以1×105/mL的接種于6孔板中,細胞生長融合80%時,分別給予20 μmol/L Lut、25 μmol/L Res、20 μmol/L Lut+25 μmol/L Res處理24 h。于倒置顯微鏡下觀察細胞的生長及形態變化。
1.6 細胞凋亡檢測 采用DAPI染色法。取對數生長期的HepG2、LO2細胞,以1×105/mL的接種于6孔板中,細胞生長至融合80%時,分別給予20 μmol/L Lut、25 μmol/L Res、20 μmol/L Lut+25 μmol/L Res處理24 h。藥物處理結束后,吸去培養基,PBS洗滌5 min×3次,4%多聚甲醛室溫固定15 mim,PBS洗滌5 min×3次,DAPI室溫染色5 min,PBS洗5 min×3次,洗滌結束后,Zeiss倒置熒光顯微鏡觀察細胞核形態變化。
1.7 NF-κB入核情況觀察 采用免疫熒光實驗。藥物處理結束后,吸去培養基,PBS洗滌5 min×3次,4%多聚甲醛室溫固定15 mim,PBS洗滌5 min ×3次,0.5% Triton X-100室溫透膜3~5 min,PBS洗5 min×3次,5%牛血清白蛋白(BSA)室溫封閉1 h,一抗4 ℃孵育過夜,PBS洗5 min ×3次,Alexa Fluor 594標記的熒光二抗室溫孵育1 h,PBS洗5 min×3次,DAPI室溫復染5 min,PBS洗5 min×3次,洗滌結束后,用眼科彎鑷輕輕將孔板內爬片取出,抗熒光淬滅劑和指甲油封固,OLYMPUS正置熒光顯微鏡拍照,觀察NF-κB的入核情況。
1.8 細胞內NF-κB及凋亡相關蛋白(Bcl-2、Bax、Caspase-3)表達檢測 采用Western blotting法。藥物處理結束后,收集細胞,RIPA強裂解液冰上裂解30 min,4 ℃ 12 000 r/min離心15 min,吸取上清液,BCA法測定樣本中蛋白含量。用10% SDS-聚丙烯酰胺凝膠電泳分離蛋白,將蛋白電轉移至硝酸纖維素膜上,5%BSA室溫封閉2 h,一抗4 ℃孵育過夜,TBST洗5 min×3次,辣根過氧化物酶標記二抗,室溫孵育2 h,TBST洗5 min×3次,用ECL顯色液顯色。用Image J進行半定量分析。蛋白相對表達量=目的蛋白電泳條帶灰度值/內參蛋白電泳條帶灰度值。
1.9 細胞內凋亡相關蛋白(Bcl-2、Bax、Caspase-3)mRNA表達檢測 采用qRT-PCR技術。藥物處理結束后,收集細胞,用TRIzol(Invitrogen公司,美國)提取細胞總RNA,NanoDrop 1000測定RNA濃度(A260/A280為1.8~2.0),逆轉錄參照TaKaRa RT-PCR說明書進行操作。RT-PCR引物序列由Invitrogen公司設計合成,NF-κB上游引物序列5′-CTGTCTTGTGGACAACGCAGTGGAATTTTAGG-3′,下游引物序列5′-CACTTATGGACAACTATGAGGTCTCTGG-3′;Bcl-2上游引物序列5′-CAGATGCCGGTTCAGGTACTCAGTC-3′,下游引物序列5′-CTCGTCGCTACCGTCGTGACTTGG-3′;Bax上游引物序列5′-CAGATGCCGGTTCAGGTACTCAGTC-3′,下游引物序列5′-AAGCTGAGCGAGTGTCTCCGGCG-3′;Caspase-3上游引物序列5′-GCATACTGTTTCAGCATGGCA-3′,下游引物序列5′-CAAACTTTTTCAGAGGGGATCG-3′;GAPDH上游引物序列5′-AGCCTTCTCCATGGTCGTGA-3′,下游引物序列5′-CGGAGTCAACGGATTTGGTC-3。使用SYBR Premix Ex Taq(TaKaRa)試劑盒進行RT-PCR反應,反應體系10 μL(cDNA 2 μL、引物3 μL、SYBR 5 μL),反應條件:95 ℃ 30 s預變性,95 ℃ 4 s、60 ℃ 30 s,循環40次。以GAPDH作為內參。目標基因相對表達量用2-ΔΔCt法計算。

2 結果
2.1 Lut、Res對HepG2、LO2細胞活力的影響 0、5、10、20 μmol/L Lut處理后HepG2細胞相對存活率分別為(100.00±4.05)%、(93.50±4.23)%、(88.33±4.84)%、(79.00±6.20)%,LO2細胞相對存活率分別為(100.00±4.94)%、(99.17±7.11)%、(97.17±3.13)%、(96.00±5.83)%;0、12.5、25、50 μmol/L Res處理后HepG2細胞相對存活率分別為(100.00±4.05)%、(93.17±6.18)%、(84.33±6.06)%、(73.83±4.88)%,LO2細胞相對存活率分別為(98.83±4.02)%、(96.67±3.88)%、(96.93±4.96)%;5 μmol/L Lut+12.5、25、50 μmol/L Res處理后HepG2細胞相對存活率分別為(80.33±5.50)%、(74.67±4.89)%、(66.83±5.56)%,LO2細胞相對存活率分別為(96.67±4.50)%、(95.46±4.73)%、(97.67±3.88)%;10 μmol/L+12.5、25、50 μmol/L Res處理后HepG2細胞相對存活率分別為(78.33±5.39)%、(68.17±7.22)%、(60.17±3.31)%,LO2細胞相對存活率分別為(96.83±4.54)%、(95.67± 4.37)%、(98.66±7.20)%;20 μmol/L Lut+12.5、25、50 μmol/L Res處理后HepG2細胞相對存活率分別為(75.17±5.00)%、(45.83±4.92)%、(47.17±6.31)%,LO2細胞相對存活率分別為(95.33±5.68)%、(95.31±4.73)%、(95.67±4.18)%。索拉非尼處理后HepG2、LO2細胞相對存活率分別為(49.33±6.12)%、(76.34±7.17)%。與未處理的細胞相比,分別經10、20 μmol/L Lut及25、50 μmol/L Res單獨處理后HepG2細胞相對存活率低(P均<0.05);Lut與Res聯合處理24 h后HepG2細胞相對存活率低(P均<0.05);20 μmol/L Lut+25 μmol/L Res處理后HepG2細胞相對存活率最低(P均<0.05)。各濃度Lut、Res及二者聯合處理24 h對LO2細胞相對存活率差異無統計學意義(P均>0.05);而索拉非尼處理24 h后LO2細胞相對存活率低(P<0.05)。
2.2 Lut、Res對HepG2、LO2細胞形態及凋亡的影響 未經藥物處理的HepG2細胞生長旺盛,細胞透亮,胞體肥厚,邊界清晰;而分別經20 μmol/L Lut、25 μmol/L Res、20 μmol/L Lut+25 μmol/L Res處理后,HepG2細胞逐漸固縮,膜局部破損,死亡細胞多。DAPI染色發現,藥物處理后,HepG2細胞核出現不同程度的核固縮和染色體片段化,經20 μmol/L Lut+25 μmol/L Res處理后的HepG2細胞變化更明顯。同時,藥物處理對LO2的細胞形態和DAPI染色后核形態均無明顯影響。
2.3 Lut、Res對HepG2細胞內NF-κB蛋白表達的影響 未經藥物處理及經Lut 20 μmol/L、Res 25 μmol/L、Lut 20 μmol/L+Res 25 μmol/L處理后HepG2細胞內NF-κB蛋白相對表達量分別為1.00±0.08、0.96±0.10、1.00±0.12、0.95±0.12;p-NF-κB蛋白相對表達量分別為1.00±0.06、0.74±0.04、0.63±0.05、0.36±0.08。藥物處理對HepG2細胞內NF-κB蛋白表達差異無統計學意義(P>0.05),但可下調細胞內p-NF-κB蛋白表達,經Lut 20 μmol/L+Res 25 μmol/L處理后HepG2細胞內p-NF-κB蛋白相對表達量最低(P均<0.05),HepG2細胞內NF-κB入核被明顯抑制。
2.4 Lut、Res對HepG2細胞內Bcl-2、Bax、Caspase-3表達的影響 與未經藥物處理的細胞相比,經藥物處理后HepG2細胞內Bax、Caspase-3表達上調,Bcl-2表達下調,經Lut 20 μmol/L+Res 25 μmol/L處理后HepG2細胞內Bax、Caspase-3表達最高,Bcl-2表達最低 (P均<0.05)。見表1。
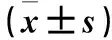
表1 Lut、Res對HepG2細胞內Bcl-2、Bax、Caspase-3相對表達量的影響
3 討論
近年來,藥物聯合治療肝癌成為研究熱點,一方面聯合用藥可降低給藥劑量,減少藥物的不良反應;另一方面又可對抗肝癌的耐藥性,發揮協同抗癌作用。研究發現,Lut和索拉非尼聯用可增加肝癌細胞對索拉非尼的敏感性,通過激活c-Jun氨基末端激酶,促進細胞凋亡,有效解決了臨床治療中肝癌對索拉非尼的耐藥性問題[11]。姜黃素與低劑量的塞來昔布聯用可通過抑制蛋白激酶B/NF-κB/前列腺素E2/活性氧信號通路,協同促進HepG2細胞凋亡,抑制細胞增殖,有效避免了塞來昔布單獨治療時因劑量較高引起的嚴重心血管不良反應[12]。除此之外,葫蘆素B與姜黃素聯用二者可在低劑量下實現安全、高效協同抑制人肝癌細胞BEL-7402/5-Fu的生長,這與抑制P-糖蛋白和多藥耐藥性,促進細胞凋亡有關[13]。因此,藥物聯用是治療肝癌的有效措施。
Lut和Res對細胞內過度激活的NF-κB均有抑制作用。Lut可抑制脂多糖誘導的小鼠單核巨噬細胞RAW246.7內NF-κB的激活,發揮抗炎作用[14];也可抑制腫瘤壞死因子α刺激的人肝癌細胞HepG2內NF-κB表達,抑制炎癥相關通路激活[15]。Res則可通過抑制人結腸癌細胞HCT-15和人非小細胞肺癌細胞A549中NF-κB的活性,發揮抗腫瘤的作用[16,17]。但Lut和Res是否通過抑制NF-κB發揮抑制肝癌的作用及聯用是否具有協同作用,目前鮮見研究報道。本研究發現,Lut和Res體外聯合使用較單獨使用對HepG2的生長具有更強的抑制作用,20 μmol/L Lut+25 μmol/L Res對HepG2生長的抑制作用最強。重要的是,Lut和Res單獨及聯合處理下,LO2細胞活力和形態均無顯著變化,說明Lut、Res可選擇性抑制肝癌細胞生長而對正常肝細胞的生長無影響。Lut與Res聯合使用具有低毒性、高藥效的特點。
NF-κB作為重要的核轉錄因子,激活后將從細胞質轉移到細胞核內。肝癌細胞內NF-κB被過度激活,因此可通過上調IκBα表達抑制NF-κB的激活,顯著減緩腫瘤的發展[18]。同時,化療藥物可通過激活腫瘤細胞內的NF-κB而使腫瘤細胞產生耐藥性[19]。研究發現,Lut和Res均可抑制腫瘤細胞內NF-κB的激活,具有一定的抗腫瘤活性,但單獨使用需要的劑量較大且藥效不佳[9,11,15,16]。p-NF-κB是NF-κB的活性形式,本研究發現,低劑量的Lut和Res聯用可顯著抑制HepG2內NF-κB的激活,誘導凋亡相關基因和蛋白的表達,發揮協同抗肝癌的作用。這種協同作用一方面可能與抑制腫瘤細胞的生長有關,另一方面可能與增加腫瘤細胞對藥物的敏感性有關。
綜上所述,體外低劑量Lut與Res聯用應用可協同抑制HepG2細胞的生長,且這種抑制作用強于陽性對照藥索拉非尼;同時其對LO2細胞生長無影響,安全性優于索拉非尼,具有良好的臨床應用價值。其作用機制可能與抑制HepG2細胞內NF-κB的激活,下調Bcl-2表達、上調Bax、Caspase-3表達有關。這為天然產物聯合用藥及靶向NF-κB抗肝癌的研究提供新思路。但本研究僅檢測了單一靶點(NF-κB),未考察其上游的調控蛋白,機制研究過于單一;本研究僅考察了聯合用藥體外抗肝癌的作用,考慮到藥物的體內吸收和代謝,其體內抗腫瘤活性需進一步研究。同時,LO2是一種轉化后的正常肝細胞,不具備正常肝細胞的所有特性,藥物的安全性需在原代肝細胞上進一步驗證。

