血清TLR4、MFG-E8及HMGB1對膿毒癥患者并發急性腎損傷的診斷價值
楊靜,何浩,譚波,趙珂,陳麗
川北醫學院附屬醫院,四川南充637000
膿毒癥是感染導致宿主反應失調的全身炎癥反應綜合征,機體炎癥反應失控可進展至膿毒性休克,最終導致多器官功能障礙。膿毒癥是急性腎損傷(AKI)最常見的病因[1],在膿毒癥患者中AKI的發生率為40%~50%[2]。膿毒癥患者發生AKI后,病死率可升高6~8倍[2,3],且遠期不良預后的風險升高[4]。尋找膿毒癥患者并發AKI相關的生物標志物,有助于評估疾病嚴重程度和預后。外周血Toll樣受體4(TLR4)及相關的炎癥因子在AKI的發病機制中發揮一定作用。乳脂球表皮生長因子8(MFG-E8)參與凋亡細胞的清除,其吞噬作用能夠預防死亡細胞可能造成的免疫損傷。高遷移率族蛋白B1(HMGB1)是真核細胞核內蛋白,其作為晚期炎癥介質,參與多種疾病的進展。本研究擬探討血清TLR4、MFG-E8及HMGB1對膿毒癥患者并發AKI的診斷價值,以期為該病的早期診斷及病情評估提供指導。
1 資料與方法
1.1 臨床資料 選擇2015年2月~2019年2月本院收治的膿毒癥患者130例,入選標準:①年齡>18歲,男女不限;②符合中國嚴重膿毒癥/膿毒性休克治療指南中的相關診斷[5];③自愿參與,并簽署知情同意書。排除標準:①入院時已進入慢性腎臟病5期或長期行腎臟替代治療;②由膿毒癥以外其他病因(腎小球腎炎、腎血管性疾病、腎小球壞死、泌尿系統梗阻、應用腎毒性藥物或造影劑或尿路梗阻)導致的AKI;③截肢術后;④腎移植術后。參考改善全球腎臟病預后組織(KDIGO)[6]標準,與基線血肌酐比較,48 h內血肌酐升高≥26.5 μmol/L或7 d內血肌酐升高≥基線值的1.5倍為AKI;48 h內血肌酐升高≥26.5 μmol/L或7 d內血肌酐升高為基線值的1.5~1.9倍定義為AKI Ⅰ期;7 d內血肌酐升高為基線值的2.0~2.9倍為AKI Ⅱ期;7 d內血肌酐升高≥基線值的3.0倍或血肌酐≥353.6 μmol/L或開始腎臟替代治療為AKI Ⅲ期。根據KGIDO標準將患者分為AKI組63例、非AKI組67例。AKI組男30例,女33例;年齡(54.61±13.73)歲;合并高血壓16例,糖尿病13例,貧血12例,高尿酸血癥15例;機械通氣31例,無機械通氣32例;使用血管活性藥物29例,未用血管活性藥物34例。非AKI組男34例,女33例;年齡(52.31±12.92)歲;合并高血壓15例,糖尿病14例,貧血11例,高尿酸血癥15例;機械通氣29例,無機械通氣38例;使用血管活性藥物25例,未用血管活性藥物42例。兩組臨床資料比較差異無統計學意義(P>0.05)。患者均簽署知情同意書;本研究獲得醫院倫理委員會批準。
1.2 血清LR4、MFG-E8及HMGB1檢測 收集患者治療前空腹外周靜脈血5 mL,經高速離心機3 000 r/min(有效離心半徑為10 cm),離心10 min后貯存于不含抗凝劑或防腐劑的試管,于-80 ℃冰箱保存以備用。采用ELISA法檢測TLR4、MFG-E8、HMGB1。TLR4、MFG-E8試劑盒購自美國R&D公司,HMGB1試劑盒購自武漢伊萊瑞特生物科技股份有限公司。根據試劑盒說明書操作步驟進行檢測。
1.3 相關指標收集及檢測方法 相關指標包括格拉斯哥昏迷(GCS)評分、基線急性生理功能和慢性健康狀況評分系統Ⅱ(APACHE II)評分、序貫器官衰竭(SOFA)評分、基線血肌酐、基線預估的腎小球濾過率(eGFR)、血紅蛋白、血小板、血清白蛋白、尿酸、乳酸、降鈣素原、C反應蛋白。GCS評分[7]包括睜眼反應、語言反應和肢體運動三部分,總分0~30分,分數越高表明昏迷程度越嚴重。APACHE Ⅱ評分[8]由急性生理學評分、年齡評分、慢性健康狀況評分三部分組成,總分0~71分,分數越高提示患者病情越重,死亡風險越高。SOFA評分[9]主要從各個系統分析危重患者器官功能障礙的嚴重程度,總分0~24分,分數越高提示合并器官功能障礙越嚴重。采用美國貝克曼庫爾特公司生產型號為COULTER LH 750/LH 755的BECKMANCOULTER-AC.T5diff儀器檢測血常規,用庫爾特全自動細胞分析儀(美國貝克曼公司)檢測肝腎功能,用便攜式乳酸鹽分析儀(德國Senslab公司)檢測乳酸,用BLA250型檢測儀(德國BERTHOLD公司)檢測降鈣素原,用P800全自動生化分析儀(RCHE公司)檢測C反應蛋白,按慢性腎臟病流行病協作研究(CKD-EPI)公式計算eGFR[10]。

2 結果
2.1 非AKI組與AKI組血清TLR4、MFG-E8及HMGB1水平比較 AKI組血清TLR4、HMGB1水平高于非AKI組,血清MFG-E8水平低于非AKI組(P均<0.05)。見表1。
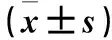
表1 非AKI組與AKI組血清TLR4、MFG-E8及HMGB1水平比較
2.2 非AKI組與AKI組相關指標比較 AKI組SOFA評分、基線血肌酐、基線eGFR、乳酸水平高于非AKI組,血清白蛋白水平低于非AKI組(P均<0.05)。兩組其他指標比較差異均無統計學意義(P均>0.05)。見表2。
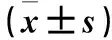
表2 非AKI組與AKI組相關指標比較
2.3 不同AKI分期患者TLR4、MFG-E8、HMGB1水平比較 AKI Ⅲ期的膿毒癥患者TLR4、HMGB1水平比較:AKI Ⅲ期>AKI Ⅱ期>AKI Ⅰ期;MFG-E8水平比較:AKI Ⅲ期 表3 不同AKI分期患者TLR4、MFG-E8、HMGB1水平比較 注:與AKI Ⅰ期相比,#P<0.05;與AKI Ⅱ期相比,*P<0.05。 2.4 膿毒癥患者并發AKI的危險因素 建立Logistic回歸模型,以膿毒癥患者的基線資料為樣本,以是否發生AKI作為因變量,賦值為1=AKI,0=非AKI。以前述單因素分析中P<0.05的指標/因素作為因變量,選取SOFA評分、基線血肌酐、基線eGFR、血清白蛋白水平、乳酸、TLR4、HMGB1、MFG-E8作為自變量,連續變量按照兩組總均值進行分段,轉化為兩分類變量,以提高統計效率使回歸結果清晰。回歸過程采用“進入法”以進行自變量的選擇和剔除,設定α剔除=0.10,α入選=0.05。回歸結果:TLR4、HMGB1、MFG-E8這3個變量被保留入回歸方程。TLR4、HMGB1水平升高是膿毒癥患者并發AKI的危險因素(OR均>1,P均<0.05),MFG-E8水平升高是膿毒癥患者并發AKI的保護因素(OR>1,P<0.05)。見表4。 表4 膿毒癥患者并發AKI的危險因素分析 2.5 TLR4、HMGB1、MFG-E8對膿毒癥患者并發AKI的診斷效能 TLR4、HMGB1及MFG-E8聯合檢測診斷膿毒血癥患者并發AKI的ROC曲線下面積大于三者單獨檢測(P均<0.05),見表5。 表5 TLR4、HMGB1、MFG-E8診斷膿毒癥并發AKI的ROC曲線分析 AKI是膿毒癥患者中最常見的并發癥,其發生率具有逐漸上升的趨勢。Rivers等[11]研究報道,在感染性休克患者中,近2/3患者并發AKI。另一項回顧性多中心研究[12]也發現,AKI在感染性休克的患者中的發生率高達64.4%。患者并發AKI可增加住院患者的病死率[13],且臨床預后不良,造成沉重的醫療負擔。膿毒癥并發AKI的病理生理學機制,可能由于膿毒癥患者血流動力學不穩定引起腎臟灌注不足導致腎小管壞死、炎癥因子激活以及細胞因子和趨化因子介導腎小管損傷、腎小管和間質細胞凋亡等[14]。本研究發現,膿毒癥并發AKI的發生率為48.5%,且合并AKI的膿毒癥患者基線SOFA評分、血肌酐、乳酸水平較高,但血清白蛋白、基線eGFR水平較低。由此可見,膿毒癥患者腎功能以及營養狀態較差,病情危重的患者更易并發AKI。目前膿毒癥相關的AKI無特效治療方案,且治療效果欠佳,尋找新的生物學標志物協助膿毒癥相關AKI的診斷以及評估其嚴重程度和潛在治療靶點顯得尤為重要。 膿毒癥是指由感染引起的全身炎癥反應綜合征,多種炎癥因子參與膿毒癥的發病機制,導致炎癥反應和炎癥損傷。Toll樣受體是參與非特異性免疫的一類重要蛋白質分子,也是連接非特異性免疫和特異性免疫的橋梁,可以識別抗原并激活機體免疫細胞應答。TLR4作為重要的受體家族成員,可識別革蘭陰性菌胞壁成分脂多糖的主要受體,參與炎癥反應。其通過阻斷TLR4信號轉導通路調節炎癥免疫反應,抑制炎癥介質的表達,能夠提高膿毒癥患者的生存率[15]。HMGB1是參與膿毒癥發病過程的一種晚期炎性介質,內毒素及多種炎性因子均可誘導HMGB1釋放介導炎性反應。既往有研究表明,HMGB1與膿毒癥的臨床表現、嚴重程度和預后轉歸具有一定的相關性。抑制HMGB1的表達能夠抑制膿毒癥的進展,降低患者病死率。且有研究表明,部分TLR是HMGB1的重要受體。HMGB1可能通過TLR信號通路調節炎癥介質和炎癥免疫反應,介導損傷。本研究發現,膿毒癥并發AKI的患者TLR4和HMGB1水平高于未并發AKI的膿毒癥患者,且AKI的分級越高,外周血TLR4和HMGB1水平越高,進一步分析膿毒癥并發AKI的危險因素得出,TLR4和HMGB1是膿毒癥患者并發AKI的獨立危險因素。郭皓等[16]研究發現,TLR4介導的炎癥反應參與了膿毒癥AKI的發生過程。而邱英等[17]則發現,HMGB1在膿毒癥相關AKI患者中水平明顯升高,有助于診斷膿毒癥并發AKI,并評估患者的預后。因此,膿毒癥患者TLR4、HMGB1水平升高應警惕并發AKI,TLR4和HMGB1水平可用于評估膿毒癥并發AKI的嚴重程度。 MFG-E8也稱為乳黏素,是最初在小鼠乳和乳腺上皮中發現的66 kD糖蛋白,其為抑制腸病原體結合和感染性的乳黏液蛋白相關防御重要組分,在組織動態平衡和炎癥預防上起重要作用。MFG-E8參與凋亡細胞的清除,其吞噬作用能夠預防死亡細胞可能造成的免疫損傷,維持機體免疫穩態,修復損傷組織,減輕炎癥反應。既往有研究表明,MFG-E8可通過脂多糖-CD14途徑影響膿毒癥的預后[18]。本研究結果顯示,膿毒癥并發AKI的患者中,MFG-E8水平低于未合并AKI的膿毒癥患者,且隨著AKI分級越高,MFG-E8水平越低。MFG-E8水平升高是膿毒癥并發AKI患者的保護因素,同樣可以用于評估膿毒癥并發AKI患者的嚴重程度及預后。 此外,本研究采用ROC曲線分析,TLR4、HMGB1和MFG-E8聯合檢測可以提高膿毒癥并發AKI的診斷特異度和敏感度,有助于膿毒癥并發AKI的早期診斷。本研究同時探討TLR4、HMGB1和MFG-E8水平與膿毒癥并發AKI病情嚴重程度的關系,對于膿毒癥并發AKI預后的評估和尋找潛在治療靶點具有重要意義。 綜上所述,膿毒癥并發AKI患者血清TLR4、HMGB1水平升高,而MFG-E8水平降低。TLR4、HMGB1、MFG-E8水平與AKI分級密切相關,可以用于評估膿毒癥并發AKI患者的嚴重程度以及早期診斷膿毒癥并發AKI。但本研究為單中心臨床研究,樣本量相對較少,需要大樣本多中心臨床研究進一步證實。此外,本研究缺乏在疾病進展過程中對血清TLR4、HMGB1、MFG-E8水平的監測,無法進一步評估AKI進展過程中TLR4、HMGB1、MFG-E8水平的變化。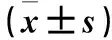


3 討論

