結直腸癌組織中miR-137、Notch1、DLL4表達變化及意義
曹冉華,呼群,張國建
內蒙古醫科大學附屬醫院,呼和浩特010050
2018年全球結直腸癌(CRC)新發病例110萬,居所有惡性腫瘤第3位;而死亡病例88萬,居所有惡性腫瘤第4位[1]。隨著我國飲食習慣的改變,CRC發病率和病死率逐漸上升,嚴重威脅人們身體健康[2]。因此有必要深入研究其發生發展機制。微小RNA(miR)是長度為18~25個核苷酸的內源性非編碼RNA,可調控多條細胞信號傳導通路,在慢性炎癥、腫瘤、免疫性疾病等疾病中均發揮重要作用[3,4]。miR-137位于人類染色體1p21.3,在非小細胞肺癌[5]、胰腺癌[6]等腫瘤組織中異常表達,可通過抑制MRGBP、SRC3等基因的表達,發揮腫瘤抑制作用。Notch信號通路進化上較為保守,該通路主要由Notch受體、Notch配體和DNA結合蛋白構成[7]。哺乳動物Notch受體包括Notch1~4四種,Notch配體包括Jagged1、Jagged2、Delta樣配體1(DLL1)、DLL3、DLL4。腫瘤發生發展過程中,常存在Notch信號通路過度活化,從而抑制腫瘤細胞分化、凋亡及促進血管生成等[8]。近年來有研究表明,腫瘤細胞表面Notch1、DLL4表達升高,DLL4-Notch1介導的信號傳導在腫瘤血管生成、浸潤及轉移中發揮重要調控作用[9]。但目前CRC組織中miR-137與Notch1、DLL4表達的關系研究較少。本研究通過觀察CRC組織中miR-137、Notch1及DLL4的表達,分析各指標表達的相關性,并探討其臨床意義。
1 資料與方法
1.1 臨床資料 選取2015年3月~2017年3月本院診治的CRC患者100例,男59例,女41例;年齡26~79(53.6±7.9)歲;腫瘤直徑≤3 cm者62例,>3 cm者38例;直腸癌35例,結腸癌65例;病理分級為高中分化71例,低分化29例;腫瘤分期Ⅰ期27例,Ⅱ期29例,Ⅲ期32例,Ⅳ期12例;淋巴結轉移22例,無淋巴結轉移78例;遠處轉移15例,無遠處轉移85例。納入標準:均經病理檢查確診為結直腸腺癌;均為初次診治,以往未接受過放化療、免疫治療;臨床資料完整,患者及家屬均簽署知情同意書。排除標準:合并炎性腸病、自身免疫性疾病等;合并其他惡性腫瘤;合并嚴重心肝肺腎等臟器功能不全。研究經本院倫理委員會審核批準通過。術中收集新鮮CRC組織及距腫瘤邊緣>3 cm的正常組織,置于凍存管內液氮罐速凍,轉運至實驗室于-80 ℃冰箱保存。
1.2 CRC組織及癌旁正常組織中miR-137表達檢測 采用熒光定量PCR法。取組織100 mg,用miRNA分離試劑盒(康朗生物有限公司)提取組織中總RNA和miRNA。紫外分光光度法鑒定RNA溶液的濃度及純度合格后,-80 ℃冰箱保存待測。以總RNA為模板,用TaqMan miRNA反轉錄試劑盒合成cDNA,實驗步驟嚴格按照試劑盒(新海基因檢測有限公司)說明書進行。miR-137特異性莖環正向引物序列:5′-TATTGCTTAAGAATACGCGTAG-3′,反向引物序列:5′-AACTCCAGCAGGACCATGTGAT-3′;內參U6上游引物序列:5′-ATTGGAACGATACAGAGAAGATT-3′,下游引物序列:3′-GGAACGCTTCACGAATTTG-5′。miR-137的總反應體系20 μL,熒光定量PCR反應條件:95 ℃預變性15 min,94 ℃變性15 s,58 ℃退火30 s,70 ℃延伸30 s,共40個循環,反應結束后PCR液-20 ℃冰箱保存。反應均在實時定量PCR儀(美國ABI公司,ABI7500)上完成,每個樣本重復檢測3次。用相對Ct值法進行數據分析。
1.3 CRC組織及癌旁正常組織中Notch、DLL4蛋白表達檢測 采用免疫組化SP法。制備羊抗人Notch、DLL4多克隆抗體(工作濃度為1∶500)和即用型二抗(工作濃度為1∶2 000)。DAB顯色,蘇木精復染,光鏡觀察。羊抗人Notch、DLL4多克隆抗體、SP試劑盒、DAB試劑盒均購自北京中杉公司。實驗步驟嚴格按照試劑盒說明書進行。陽性判斷采用二級計分法,即陽性細胞百分比<5%為0分,5%~25%為1分,>25%~50%為2分,>50%~75%為3分,>75%為4分;染色程度計分標準:淡黃色為1分,黃或深黃色為2分,褐色為3分。以上兩項評分相乘結果≥3判定為陽性。應用Image-pro Plus6.0軟件測量陽性染色區域的光密度值,每個標本隨機選取3個視野,取平均值作為目標蛋白的相對表達量。

2 結果
2.1 CRC組織與癌旁正常組織中miR-137、Notch1及DLL4蛋白表達比較 CRC組織與癌旁正常組織中miR-137相對表達量分別為0.79±0.24、3.61±0.69,CRC組織中miR-137相對表達量低于癌旁正常組織(t=38.601,P=0.000)。CRC組織與癌旁正常組織中Notch1蛋白陽性表達分別為47例(47%)、5例(5%),CRC組織中Notch1蛋白陽性表達率高于癌旁正常組織(χ2=45.842,P=0.000)。CRC組織與癌旁正常組織中DLL4蛋白陽性表達分別為81例(81%)、29例(29%),CRC組織中DLL4蛋白陽性表達率高于癌旁正常組織(χ2=50.731,P=0.000)。
2.2 CRC組織中miR-137、Notch1及DLL4表達與患者臨床病理特征的關系 CRC組織中miR-137表達與腫瘤分期有關(P<0.05),與CRC患者其他臨床病理特征無關(P均>0.05);Notch1、DLL4蛋白陽性表達與腫瘤分期、淋巴結轉移及遠處轉移有關(P均<0.05),與性別、年齡、腫瘤大小、腫瘤位置、組織分化程度無關(P均>0.05)。
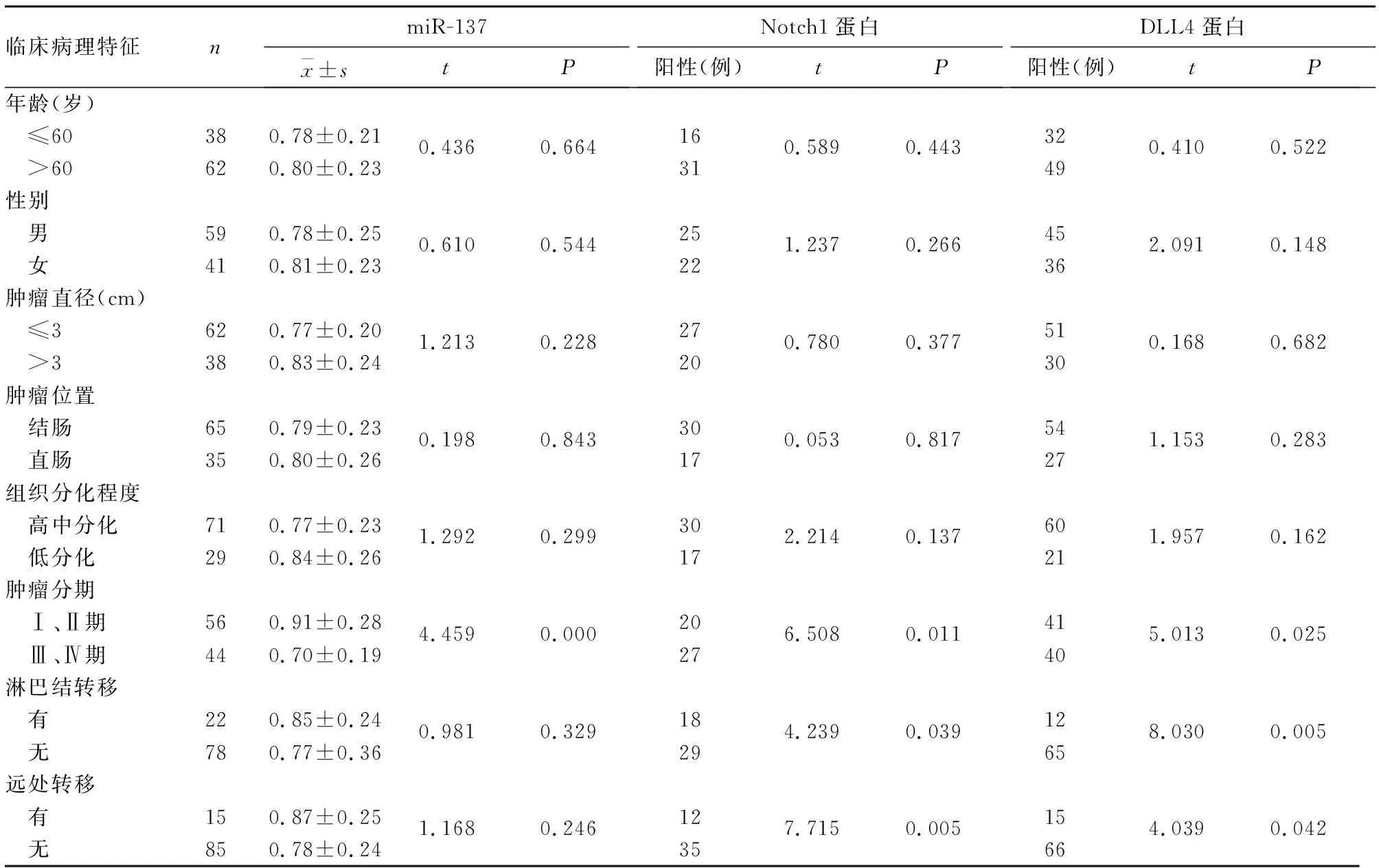
表1 CRC組織中miR-137、Notch1及DLL4表達與患者臨床病理特征的關系
2.3 CRC組織中miR-137與Notch1、DLL4蛋白表達的相關性 CRC組織中miR-137的相對表達量與Notch1、DLL4蛋白相對表達量均呈負相關(r分別為-0.654、-0.612,P均<0.05)。
3 討論
近年來隨著影像學技術、內鏡技術等診斷技術的發展,基于臨床分期分級等病理學特征對患者進行手術、放化療及分子靶向治療等,延長了患者的生存時間,5年生存率達60%[10]。但由于CRC腫瘤的異質性,相同分期的患者對相同治療方案的反應及預后各不相同,因此有必要深入研究CRC發生發展的分子機制。近年來研究表明,CRC中Notch信號通路的激活在腫瘤發生發展中起至關重要的作用,如在CRC細胞系中上調Notch1基因或其配體DLL4基因的表達后,可促進HES1等轉錄因子的表達,導致上皮間質轉化及干性相關蛋白的表達增加,促進腫瘤細胞增殖、浸潤和轉移,與CRC患者的不良預后相關[11]。miRNA是具有基因表達調控作用的非編碼RNA調控分子,研究表明,腫瘤組織中miR-137表達降低導致靶基因mRNA的穩定性增加,腫瘤細胞增殖能力增強,而過表達miR-137后促進腫瘤細胞的凋亡[6]。本研究癌組織中miR-137的相對表達量明顯低于癌旁正常組織,與以往研究報道一致[12]。目前其具體機制尚不清楚,可能是miR-137基因啟動子區域的CpG島的甲基化、泛素化等表觀遺傳學修飾后失活,導致miR-137表達降低[13]。本研究CRC組織中miR137的表達與腫瘤分期有關,Ⅲ~Ⅳ期癌組織miR-137表達明顯低于Ⅰ~Ⅱ期,表明miR-137參與CRC的發生發展。
本研究CRC組織中Notch1蛋白陽性表達率明顯高于癌旁組織,表明癌組織中Notch1蛋白表達增高,與以往研究[14]一致。其機制可能是腫瘤發生時某些miRNA,如miR-34a表達下降,其結合Notch1的mRNA的3′端非編碼區能力下降,導致Notch1蛋白表達升高,進而影響下游基因如纖連蛋白、波形蛋白等,促進腫瘤的惡性進展[15]。此外,Notch1表達與腫瘤分期、淋巴結轉移及遠處轉移有關,其原因可能是Notch1的過表達促進下游Twist、Snail等轉錄因子的表達,促進腫瘤細胞發生上皮間質轉化,導致腫瘤的浸潤轉移能力增強,腫瘤分期增高[16]。
人類DLL4基因位于15q14,可編碼由685個氨基酸構成的DLL4蛋白,其可表達于血管內皮細胞,亦可表達于腫瘤細胞表面,通過與Notch受體胞外域結合,活化下游信號。本研究癌組織中Notch1的配體DLL4蛋白表達較癌旁組織高,表明DLL4同樣參與CRC的發生發展過程。其表達升高的機制可能與DLL4的表達受miRNA的調控有關。有研究表明,miR-30a能負性調節DLL4 mRNA的表達,腫瘤發生時miR-30a表達下降,DLL4的表達增加,進而促進血管新生及腫瘤轉移[17]。此外,CRC組織中DLL4表達也與腫瘤分期、淋巴結轉移及遠處轉移有關,其原因可能是腫瘤組織中DLL4表達通過結合Notch1進而激活Notch信號通路,促進腫瘤的浸潤、淋巴及血行轉移;而在敲除DLL4后,Notch信號通路受到抑制,腫瘤的浸潤及轉移能力下降[18]。
本研究進一步分析CRC組織中miR137與Notch1、DLL4表達的相關性,結果均呈負相關。其機制可能是miR137可結合Notch1、DLL4的mRNA 3′UTR區,改變mRNA穩定性,進而負性調節Notch1、DLL4的表達[19]。
綜上所述,CRC組織中miR137表達下降,而Notch1、DLL4表達增加,三者共同參與CRC的發生發展,有可能成為CRC診斷、治療及預后評估的腫瘤標志物,但對于三者之間具體作用機制有待進一步研究。

