霍山石斛“九仙尊1號”一步法再生體系的建立
戴亞峰 王詩文 張恩亮 李誠
摘要?[目的]簡化霍山石斛離體再生方法。[方法]以霍山石斛“九仙尊1號”帶節莖段為外植體,研究不同基礎培養基、激素配比和添加物對九仙尊1號愈傷組織誘導的影響,并在愈傷組織的基礎上研究不同添加物和培養基對愈傷組織增殖和再生的影響。[結果]九仙尊1號一步法再生的最佳培養基為MS+1.0 mg/L KT+1.0 mg/L IBA+15 g香蕉泥+0.5 g活性炭+30 g/L蔗糖,愈傷組織誘導率為16.67%,增殖率為10.83%,再生率95%;最佳移栽基質為樹皮∶草炭1∶1,存活率為95.56%。[結論]九仙尊1號再生體系的建立為研究霍山石斛的分子機理提供了理論基礎和技術支持。
關鍵詞?九仙尊1號;一步法;植物組織培養;再生體系
中圖分類號?S?567.23文獻標識碼?A
文章編號?0517-6611(2020)01-0189-04
doi:10.3969/j.issn.0517-6611.2020.01.057
開放科學(資源服務)標識碼(OSID):
Development of One?step Regeneration System of Dendrobium huoshanse “Jiuxianzun 1”
DAI Ya?feng,WANG Shi?wen,ZHANG En?liang et al
(Jiuxianzun Huoshan Dendrobium Co.,Ltd.,Luan,Anhui 237012)
Abstract?[Objective] The research aimed to simplify the method of vitro regeneration of Dendrobium huoshanense.[Method]Stem segments of Dendrobium huoshanse“Jiuxianzun 1” were tested as explants to evaluate effects of types of basic medium,different combinations of exogenous hormones and additives for callus induction,based on the primary callus,effect of callus proliferation and regeneration under different basic medium and additives were investigated.[Result]The best medium for the one?step regeneration of Jiuxianzun 1 was MS+1.0 mg/L KT+1.0 mg/L IBA+15 g banana puree+0.5 g activated carbon+30 g/L sucrose.The callus induction rate was 16.67%,proliferation rate was 10.83% and regeneration rate was 95%; the best transplanting substrate was bark and peat mixed with 1∶1.The survival rate was 95.56%.[Conclusion]The establishment of the Jiuxianzun 1 regeneration system provides theoretical basis and technical support for studying the molecular mechanism of Dendrobium huoshanense.
Key words?Jiuxianzun 1;One?step method;Plant tissue culture;Regeneration system
霍山石斛(Dendrobium huoshanense)為蘭科(Orchidaceae)石斛屬(Dendrobium)多年生草本植物,原產于中國安徽霍山的道地藥材植物,具有促身心、延緩衰老的功效[1]。蘭科植物種子細小,通常無胚乳,難以萌發;與蘭科其他植物種子類似,霍山石斛種子細小如粉,植物組織培養是目前最有效的繁殖方式[2-4]。
我國學者徐云昌鳥等[5]于1984年首次報道通過植物組織培養的方式獲得霍山石斛試管苗,在此后幾十年的研究中,霍山石斛的組織培養技術日趨成熟。總結前人對于霍山石斛組織培養的研究中,溫云飛等[6]以種子為外植體誘導原球莖,進而誘導原球莖發芽、生長直至生根,建立霍山石斛無性繁殖體系,整個組培過程共使用了10種不同的培養基配方處理;譚云等[7]以假鱗莖上段、下段以及幼芽作為外植體誘導霍山石斛擬原球莖的發生,結果發現霍山石斛成熟植株較難脫分化,最適宜的外植體是假鱗莖下段;崔瑩瑩等[8]在2017年以霍山石斛帶節莖段為外植體誘導叢生芽,再增殖的方式成功實現了霍山石斛微體快繁。綜合前人的研究發現霍山石斛的組培快繁體系均較為復雜,步驟繁瑣,同時離體快繁亟需一種簡便的方法。
“九仙尊1號”是安徽六安九仙尊霍山石斛股份有限公司于2015年申報的霍山石斛優質品種,相比野生霍山石斛的藥用成分含量具有明顯優勢,目前關于其離體再生體系的研究鮮見報道。近些年來隨著分子生物學的發展,再生體系成為植物分子機理、基因編輯等的研究基礎[9]。該研究旨在構建霍山石斛的優良品種九仙尊1號再生體系,以期為后續研究九仙尊1號的分子機理以及利用轉基因的方式等研究霍山石斛藥用機理打下堅實的基礎。
1?材料與方法
1.1?試驗材料
選擇生長良好、長勢一致的霍山石斛九仙尊1號帶節莖段為試驗材料。所有材料均取自于九仙尊霍山石斛股份有限公司培養室的組培苗。
1.2?試驗方法
1.2.1?培養條件。
試驗所用培養基中蔗糖含量均為30 g/L,瓊脂為6 g/L,pH 為5.8~6.0,培養室溫度為(25±2)℃,暗培養20 d,之后光照強度2 000~3 000 lx,光照時間為12 h/d。
1.2.2?外植體處理。
選取霍山石斛九仙尊1號培養6~8個月的小苗莖段為外植體,莖段進行切割,將1 cm左右的莖段接入培養基。
1.2.3?一步法誘導霍山石斛九仙尊1號再生體系的建立。
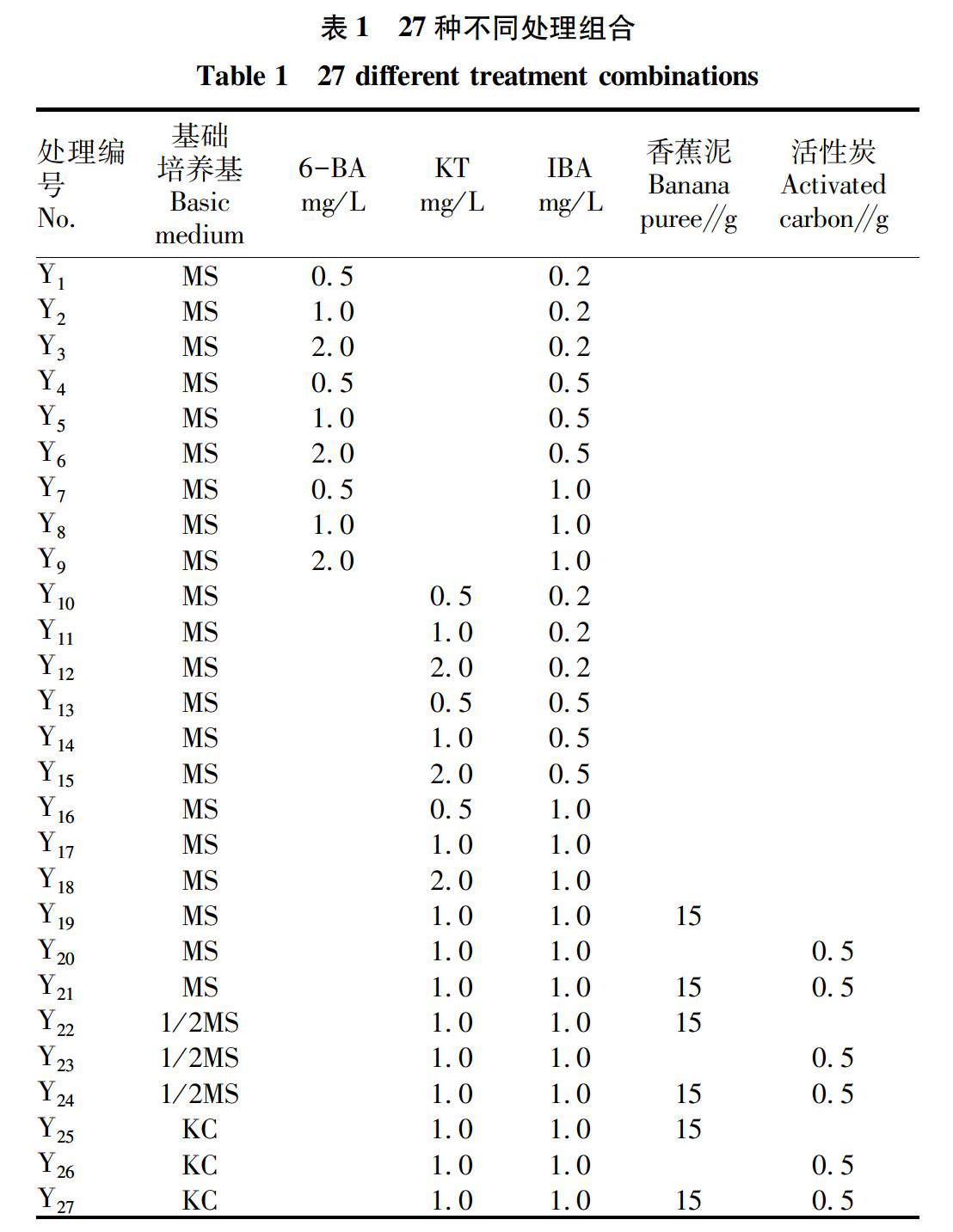
在試驗前期的基礎上為了簡化試驗流程,研究從愈傷組織培養到增殖再分化形成植株均采用同一種處理。研究以不同培養基(MS、1/2MS、KC)、不同外源激素組合(6-BA、KT、NAA)和不同添加物(香蕉泥、活性炭)為基礎,共27個處理(表1),其中Y1~Y18為不同樂源激素處理組合,Y19~Y27為不同添加物及培養基處理組合,每個處理接種30個外植體,每個處理重復3次。40 d繼代1次,180 d之后統計結果。
1.2.4?移栽馴化。
待組培苗生長至3~5 cm時,開蓋煉苗5 d,之后將植株移栽至樹皮與蛭石不同比例(R1 1∶0,R2 1∶1,R3 2∶1、R4 3∶1、R5 4∶1)混合的栽培基質中,保持基質濕潤,每天噴水3次,保持空氣濕潤,噴水量不宜過大。
1.3?數據處理與分析
愈傷組織誘導率=形成愈傷組織外植體數/接種外植體數×100%;增殖率=60 d后愈傷組織的顆粒數/接種的顆粒數×100%;再分化率=出芽的愈傷組織數/繼代的愈傷組織數×100%。所有的試驗數據均采用SPSS 19.0和Excel 2013進行處理分析。
2?結果與分析
2.1?不同激素處理對愈傷組織誘導的影響
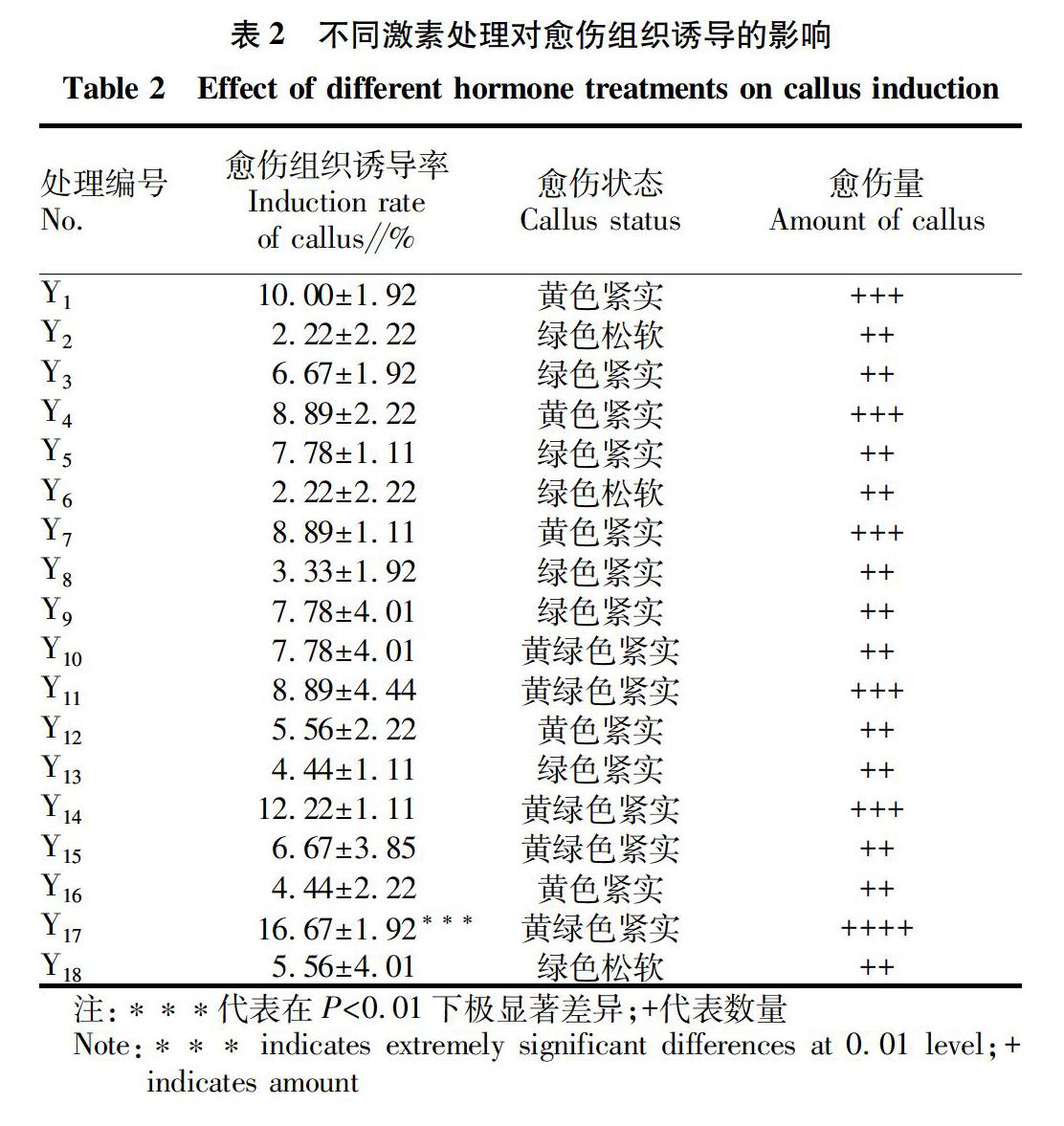
研究以正交試驗設計為基礎,由表2分析愈傷狀態和愈傷量KT相比較于6-BA,對九仙尊1號愈傷組織誘導具有更好的效果。Y1~Y9處理下的結果表明適宜的6-BA濃度為0.5 mg/L,隨著6-BA的提高,愈傷組織誘導率呈下降趨勢;在6-BA和IBA的組合中隨著生長素濃度的升高,莖段的愈傷組織誘導率也呈現下降的趨勢,最適宜的生長素濃度為0.2 mg/L。
Y10~Y18處理下的結果表明隨著KT濃度的升高,在濃度到達1.0 mg/L時愈傷組織誘導率達16.67%,當升至2.0 mg/L時,愈傷組織誘導率也隨之下降至5.56%,最適宜的KT濃度為1.0 mg/L;Y11、Y14和Y17的處理下隨著生長素濃度的提高,愈傷組織誘導率也隨之提高,表明最適宜的IBA濃度為1.0 mg/L。
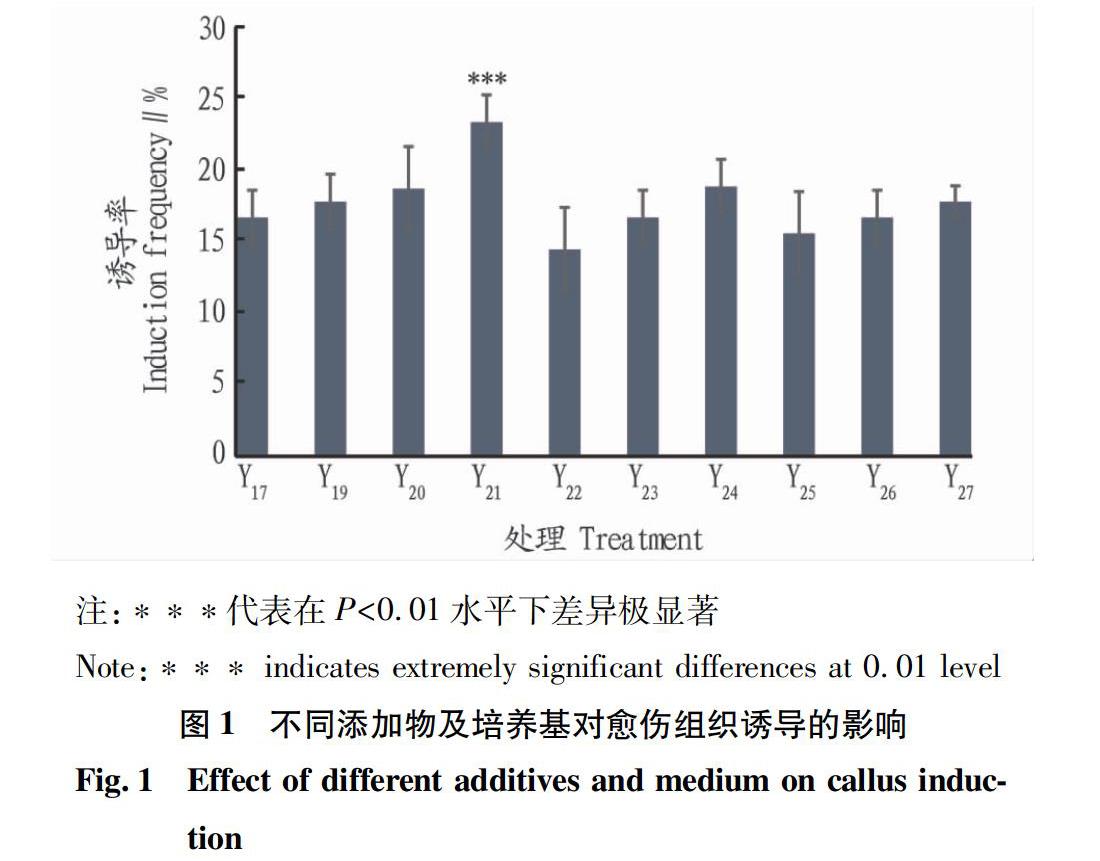
2.2?不同添加物及培養基對愈傷組織誘導的影響?從圖1可看出,在3種培養基中添加活性炭和香蕉泥都會提高愈傷組織誘導率,而同時添加活性炭和香蕉泥效果也會優于只添加一種組分。對比不同培養基處理,3種培養基的誘導效果分別為MS>1/2MS>KC培養基,因此對比Y17表明,愈傷組織誘導最適宜的培養基為Y21。
2.3?不同處理對愈傷組織增殖及再分化的影響
在愈傷組織的繼代培養過程中,九仙尊1號的愈傷組織出現邊增殖邊分化的過程(圖2),同時在同配方繼代培養后會直接發育成完整植株。
通過對照組Y17,分析Y19~Y27處理下的結果表明,不同培養基和添加物對愈傷組織的增殖在Y21的處理下愈傷組織增殖率達到最高,為10.83%,最低為Y23和Y27,均為8.83%,在0.01水平上并無顯著差異(圖3a),在Y23的處理下愈傷組織的再分化達到100%,而Y21的誘導條件下愈傷組織的再分化率為95%,在0.01水平下也無顯著差異(圖3b)。因此為簡化操作流程確定“一步法”最適誘導培養基為Y21即MS+1.0 mg/L KT+1.0 mg/L IBA+15 g香蕉泥+0.5 g活性炭+30 g/L蔗糖。
2.4?基質對組培苗移栽的影響
由圖4可知,在R4的處理下,移栽存活率最高達95.56%,R1單獨使用樹皮移栽效果最差,樹皮和蛭石混合使用時,效果均優于單獨使用樹皮。因此移栽組培苗最適的栽培基質為樹皮∶蛭石3∶1。
3?結論與討論
我國有76種石斛,其中近50種石斛被用藥,尤其是霍山石斛,還具有很高的商業價值[10],但霍山石斛野生資源面臨著過度采伐等問題。自1902年德國植物學家Gottlieb Haberlandt 首次提出了離體細胞培養的概念以來,100多年來植物組織培養的大量研究表明植物激素的種類、濃度和比例是影響植物形成愈傷組織到再生的最關鍵因素,通常細胞分裂素類激素是用來促進芽分化,生長素類激素促進生根[11-12]。該研究中6-BA和IBA配合使用時在濃度分別為0.5和0.2 mg/L時效果最好,同比KT和IBA配合使用時則在濃度分別為1.0和1.0 mg/L時效果最好,對比楊靜等[13]研究霍山石斛的擬原球莖時采用0.5 mg/L 6-BA+0.1 mg/L NAA誘導擬原球莖,分化培養采用2.0 mg/L 6-BA+1.5 mg/L NAA + 0.03 mg/L TDZ, 該研究結果發現新的配方可以一步再生。不同植物對植物激素的敏感度不一樣,歐洲百合對于TDZ較為敏感,簸箕對于6-BA敏感[14-15],該研究結果顯示九仙尊1號對于KT的敏感度較高,效果也優于6-BA。
KC培養基在大量研究中是極為適合蘭科的基礎培養基[16]。該研究結果表明MS是最適合九仙尊1號的基礎培養基,在前人大量的研究中霍山石斛的最適合培養基是MS和1/2MS,該研究的結果也與前人吻合[17]。香蕉泥和活性炭已經在多種植物中被證實對植物組培具有顯著的促進作用[18-19],該研究中單獨添加活性炭和香蕉泥效果并不顯著,但同時添加香蕉泥和活性炭對愈傷組織誘導率有顯著提升,在后續的組培中會適量添加香蕉泥和活性炭。
在實際生產中用一種培養基即可完成再生體系的建立可稱作“一步法”,一步法的優勢在于能夠降低工作量、提高效率,有利于規模化生產[20]。該研究結果顯示霍山石斛九仙尊1號可用在培養基MS+1.0 mg/L KT+1.0 mg/L IBA+15 g香蕉泥+0.5 g活性炭+30 g/L蔗糖上一步完成愈傷組織誘導、增殖、再生的過程,前人關于霍山石斛組培快繁的步驟通常需要更換不同的培養基組分[13,17],石斛屬植物也是很少一步法完成[21-22]。因此該研究的結果大大降低了霍山石斛快繁的工作量,提高了效率,同時為后期利用轉基因研究霍山石斛藥用分子機理以及基因編輯等方式奠定了重要基礎。
參考文獻
[1] WANG H,CHEN N F,ZHENG J Y,et al.Isolation and characterization of eleven polymorphic microsatellite loci for the valuable medicinal plant Dendrobium huoshanense and cross?species amplification[J].International journal of molecular sciences,2012,13(12):16779-16784.
[2] 郎楷永,陳心啟,羅毅波,等.中國植物志:第17卷[M].北京:科學出版社,1999:1.
[3] SOETOPO L,PURNAMANINGSIH S L.In vitro propagation of dendrobium and phalaenopsis through tissue culture for conservation[J].Agrivita:Journal of agricultural science,2012,34(2): 115-126.
[4] VELLUPILLAI M,SWARUP S,GOH C J .Histological and protein changes during early stages of seed germination in the orchid,Dendrobium crumenatum[J].Journal of pomology and horticultural science,1997,72(6):941-948.
[5] 徐云昌鳥,于力文.霍山石斛種子試管苗的培養[J].植物生理學通訊,1984,20(4):35-36.
[6] 溫云飛,魯潤龍,謝子立.霍山石斛的快速繁殖和花芽誘導[J].植物生理學通訊,1999,35(4):296-297.
[7] 譚云,葉慶生,劉偉.霍山石斛(Dendrobidium huoshanness)的組織培養[J].植物學通報,2005,22(1):58-62.
[8] 崔瑩瑩,鄭福山,陳昆,等.霍山石斛微體快繁技術研究[J].西部林業科學,2017,46(6):51-55.
[9] IWASE A,HARASHIMA H,IKEUCHI M,et al.WIND1 promotes shoot regeneration through transcriptional activation of ENHANCER OF SHOOT REGENERATION1 in Arabidopsis[J].The plant cell,2016,29(1):54-69.
[10] JIN Q,JIAO C Y,SUN S W,et al.Metabolic analysis of medicinal Dendrobium officinale and Dendrobium huoshanense during different growth years[J].PLoS One,2016,11(1):1-17.
[11] 陳陸琴.五種木本植物的組織培養及其生理生化研究[D].大連:遼寧師范大學,2005.
[12] YE S W,CAI C Y,REN H B,et al.An efficient plant regeneration and transformation system of ma bamboo (Dendrocalamus latiflorus Munro) started from young shoot as explant[J].Frontiers in plant science,2017,8:1-12.
[13] 楊靜,何芳,王紀,等.霍山石斛擬原球莖生長及植株再生過程中微觀結構與元素的變化[J].西南林業大學學報,2016,36(6):1-7.
[14] 張旭紅,王頔,梁振旭,等.歐洲百合愈傷組織誘導及植株再生體系的建立[J].植物學報,2018,53(6):840-847.
[15] 孫永蓮.簸箕柳組織培養體系建立及遺傳轉化體系初探[D].南京:南京林業大學,2017.
[16] 周利利.蝴蝶蘭組培快繁體系的建立[D].杭州:浙江農林大學,2017.
[17] 翟月婷.霍山石斛試管叢生芽及原球莖繼代增殖措施的研究[D].合肥:安徽農業大學,2010.
[18] 董燕婧,李博,程波翔,等.不同添加物對鐵皮石斛組培幼苗生長的影響[J].江蘇農業科學,2017,45(6):135-137.
[19] 王瑋瑋,汪國蓮,孫玉東,等.不同濃度激素、活性炭對紅顏草莓莖尖組培的影響[J].江蘇農業科學,2015,43(8):46-48.
[20] 任杰,丁增成,劉祚軍,等.“一步法”誘導三角紫葉酢漿草再生體系的形成[J].中國農學通報,2009,25(3):60-62.
[21] BHATTACHARYYA P,KUMARIA S,DIENGDOH R,et al.Genetic stability and phytochemical analysis of the in vitro regenerated plants of Dendrobium nobile Lindl.,an endangered medicinal orchid[J].Meta gene,2014,2:489-504.
[22] KUI L,CHEN H T,ZHANG W X,et al.Building a genetic manipulation tool box for orchid biology: Identification of constitutive promoters and application of CRISPR/Cas9 in the orchid,Dendrobium officinale[J].Frontiers in plant science,2017,7:1-13.

