表面活性劑與離子液體對β-葡萄糖苷酶的協同影響
劉航,楊威,鞠鑫,姚雪梅,扶教龍,李良智
(蘇州科技大學化學生物與材料工程學院,江蘇蘇州215009)
隨著社會經濟的發(fā)展,能源與環(huán)境問題日益突出,化石燃料作為不可再生資源日益減少[1]。將豐富廉價的生物質資源轉化成生物燃料或生物基化學品等已成為國內外研究的熱點。眾所周知,我國是農業(yè)大國,每年產生大量的農業(yè)纖維廢棄物[2]。由于木質纖維素本身有較高的結晶度,且分子間和分子內有大量氫鍵的存在,通常需經有效的預處理后再進行水解轉化[3]。目前,離子液體作為一種“綠色、可設計”的溶劑,已經廣泛用于纖維廢棄物的預處理[4]。為簡化工藝,國內外研究者對離子液體中纖維素的原位酶解更加關注。β-葡萄糖苷酶能夠直接將纖維二糖水解為兩分子葡萄糖,是纖維素酶解的關鍵限速步驟[5]。然而,離子液體往往導致β-葡萄糖苷酶完全或者部分地失活[6]。因此探索提高離子液體中β-葡萄糖苷酶活性的方法對解決能源與環(huán)境問題,實現能源的可持續(xù)發(fā)展具有重大意義。
2002年,Swatloski 等[7]首次發(fā)現離子液體1-丁基-3-甲基咪唑氯化鹽([BMIM]Cl)可有效溶解纖維素,隨后用離子液體預處理纖維素的研究大量開展。2008年,Kamiya等[8]報道了將纖維素、離子液體及纖維素酶進行“一鍋法”處理的原位酶解技術,纖維素的酶解轉化率在24h內可達到70%。由于“一鍋法”的工藝相對簡單,已經成為研究的熱點。然而,纖維素酶在離子液體中易失活,其中β-葡萄糖苷酶作為水解纖維二糖的關鍵酶在離子液體中的失活受到了關注,如Goswami 等[9]發(fā)現β-葡萄糖苷酶在0.9mol/L 離子液體1-乙基-3-甲基咪唑氯鹽([C2C1im]Cl)中損失了30%的活性。另一方面,由于β-葡萄糖苷酶在纖維素酶多組分中的重要性,近年來國內外研究人員對提高β-葡萄糖苷酶在原位酶解體系中的活性開展了多方面研究。例如,研究發(fā)現添加2mmol/L Zn2+可以提高β-葡萄糖苷酶92%的活性[10]。此外,由于表面活性劑能使酶在反應體系中均勻分散、促進酶與底物的結合、降低底物的表面張力及增強高分子聚合物纖維素的親水性,添加表面活性劑成為提高纖維素酶活性的常用手段。如通過添加非離子型表面活性劑PEG6000孵育72h,β-葡萄糖苷酶的活性提高超過2 倍[11];添加離子型表面活性劑SDS 使纖維素酶糖化[BMIM]Cl 預處理后的稻草秸桿的效率提高18.76%[12-13]。但是,目前關于上述方法在離子液體體系中對β-葡萄糖苷酶及纖維二糖水解過程的影響報道較少,更缺乏該過程的機理性研究。
本文作者課題組前期已經初步研究了類芽胞桿菌sp.LLZ1 纖維素酶在離子液體[EMIM]DEP 存在時的失活規(guī)律[14]。本文研究首先比較了在離子液體[EMIM]DEP、表面活性劑及二者共同存在的環(huán)境下類芽孢桿菌sp.LLZ1β-葡萄糖苷酶活性的變化規(guī)律。隨后通過動力學參數測定、熒光光譜、圓二色譜和差示掃描量熱(DSC)等方法對[EMIM]DEP和表面活性劑影響β-葡萄糖苷酶活性的具體機制進行了解析。最后,在離子液體和表面活性劑同時存在的條件下研究了以纖維二糖作為底物的原位酶解進程。
1 實驗材料和方法
1.1 材料
1.1.1 菌株
類芽孢桿菌sp.LLZ1(Paenibacillussp. LLZ1)篩選自蘇州市上方山國家森林公園,接種于固體斜面培養(yǎng)基,于4℃冰箱保存。
1.1.2 試劑
[EMIM]DEP 購于上海成捷化學有限公司;對硝基苯基-β-D-吡喃葡萄糖苷(pNPG)購于上海生工生物工程有限公司;鼠李糖脂購于西安博聯特化工有限公司;纖維二糖購于上海源葉生物技術有限公司;其他試劑購于國藥集團化學試劑有限公司。
1.1.3 主要儀器
F-4500 型熒光光度計購于日本日立公司;Chirascan-plus 圓二色譜儀購自英國應用光物理公司;DSC2010 差示掃描量熱儀購自美國TA 儀器;Tecan Infinite F50 酶標儀購于上海帝肯貿易有限公司;SBA-40C 生物傳感分析儀購于山東省科學院生物研究所。
1.2 培養(yǎng)基
斜 面 培 養(yǎng) 基:K2HPO40.5g/L, MgSO4·7H2O 0.5g/L,CMC-Na 10.0g/L,剛果紅0.4g/L,蛋白胨2.0g/L,酵母浸粉1.0g/L,瓊脂15.0g/L,pH=7.0。
產酶培養(yǎng)基:Na2HPO43.0g/L,NH4NO30.8g/L,MgSO4·7H2O 0.5g/L,CaCl20.5g/L,MCC 5.0g/L,蛋白胨1.0g/L,酵母浸粉1.0g/L,pH=7.0。
1.3 培養(yǎng)方法
從斜面培養(yǎng)基中挑取菌株接種于250mL 的產酶培養(yǎng)基中,以30℃、200r/min 培養(yǎng)7 天。產酶培養(yǎng)基置于4℃離心機中以6000g 離心15min 并使用0.22μm微孔濾膜過濾培養(yǎng)液,得到酶液。
1.4 分析方法
1.4.1β-葡萄糖苷酶活性分析
用0.1mol/L、pH=6.0乙酸緩沖液配制的5mmol/LpNPG 作為底物,置于40℃水浴中預熱15min,加入0.5mL的酶液,40℃反應1h,向反應體系中加入2mL、1mol/L 的碳酸鈉溶液終止反應。在410nm處測定對硝基苯酚的生成量。在相同條件下測定對硝基苯酚的標準曲線。以蒸餾水代替酶液作為空白對照。β-葡萄糖苷酶活力定義為每分鐘產生1μmol對硝基苯酚所需要的酶量。
分析表面活性劑和離子液體對β-葡萄糖苷酶活性的影響:向酶活測定體系中加入表面活性劑使表面活性劑終濃度為質量分數0.1%,加入[EMIM]DEP 使[EMIM]DEP 終濃度為質量分數5%。不添加表面活性劑和離子液體為對照組。
1.4.2 動力學曲線和動力學參數
動力學曲線和動力學參數使用濃度為0.1~20mmol/L的pNPG作為底物進行測定。反應體系包括0.5mL 的酶液、0.5mL 的底物和乙酸緩沖液配制的表面活性劑,使表面活性劑終濃度為質量分數0.1%,[EMIM]DEP 終濃度為質量分數5%。40℃孵育15min 后,采用pNPG 法檢測對硝基苯酚的生成量。使用Lineweaver-Burk雙倒數法[式(1)]計算得到米氏常數(Km)和酶促反應最大速度(Vmax),初始反應速率(V0)以反應前15min 的平均速率計算。[S]為底物濃度。

1.4.3 圓二色譜
利用圓二色譜儀測定表面活性劑對β-葡萄糖苷酶二級結構的影響。分別配制表面活性劑溶液,通過向其中加入酶液使表面活性劑的終濃度為質量分數0.1%,40℃水浴1h。圓二色譜儀采用波長為190~250nm 的掃描范圍,檢測池為10mm,掃描3次。在室溫下測量,圖譜經過儀器本底消除和溶劑空白差減,利用軟件對β-葡萄糖苷酶的二級結構含量進行分析。
1.4.4 熒光光譜
分別配制表面活性劑溶液,通過向其中加入酶液使表面活性劑的終濃度為質量分數0.1%,[EMIM]DEP 終濃度為質量分數5%,40℃水浴1h,利用熒光光度計測定其熒光光譜,激發(fā)波長為280nm,激發(fā)狹縫為15nm,發(fā)射狹縫為15nm,響應時間為0.1s,室溫下掃描范圍為300~420nm。
1.4.5 差示掃描量熱法
β-葡萄糖苷酶和表面活性劑與[EMIM]DEP 的結合使用DSC2010 差示掃描量熱儀進行測定,熱分析圖記錄溫度從40~90℃,掃描速率為15℃/h。β-葡萄糖苷酶的蛋白濃度為0.2g/L,表面活性劑終濃度為質量分數0.1%,[EMIM]DEP 終濃度為質量分數5%。對量熱數據進行分析得到平均展開焓(ΔH)和中點溫度(Tm)。
1.4.6 纖維二糖的原位酶解
使用1g/L 的纖維二糖作為底物,向其中加入酶液,在0.1mol/L、pH=6.0的乙酸緩沖液中進行纖維二糖的水解,并向混合物中加入優(yōu)化濃度后的[EMIM]DEP 和鼠李糖脂,β-葡萄糖苷酶的蛋白濃度為0.2g/L。40℃、50r/min 水浴搖床震蕩,0、60min、120min、180min和240min收集樣品,使用SBA-40C 生物傳感分析儀測定產物葡萄糖的生成量。
2 結果與討論
2.1 離子液體中添加表面活性劑對β-葡萄糖苷酶活性的影響

圖1 添加表面活性劑和[EMIM]DEP對β-葡萄糖苷酶活性的影響
首先考察了鼠李糖脂等幾種表面活性劑對類芽孢桿菌sp.LLZ1β-葡萄糖苷酶活性的影響,結果如圖1所示。在未添加離子液體的條件下,分別添加0.1%鼠李糖脂、Span20、PEG4000、Tween80 可使β-葡萄糖苷酶的相對活性提高了11.95%、9.27%、10.07%和10.21%,而添加Triton X-100和SDS使酶活降低了3.31%和21.08%。添加5%[EMIM]DEP 使β-葡萄糖苷酶的相對活性增強了12.00%,進一步分別添加0.1%鼠李糖脂和Span20增強了21.85%和12.07%,而PEG4000 和Tween80 加入僅僅增加了8.57%和5.25%。添加Triton X-100 和SDS 的β-葡萄糖苷酶相對活性降低了4.59%和10.63%。結果顯示加入5%[EMIM]DEP和0.1%鼠李糖脂的β-葡萄糖苷酶活性相較于其他實驗組最高為121.08%。鼠李糖脂是生物表面活性劑,能顯著降低水的表面張力,使底物更容易被利用。Chang 等[15]使用1-烯丙基-3-甲基咪唑氯鹽([AMIM]Cl)和鼠李糖脂預處理的稻草秸稈轉化為還原糖的效率為36.21%,遠遠高于對照組的轉化率16.16%。 Span20、PEG4000、Tween80 和Triton X-100 屬于非離子表面活性劑,其本身不帶電荷,在水溶液中不會產生靜電斥力,能夠能降低溶液的表面張力,對酶與底物的結合影響較弱[16]。SDS 是陰離子表面活性劑,使底物表面的負電荷增多,增加底物與酶之間的靜電斥力,降低了酶與底物的結合能力,從而降低了酶活[17]。當[EMIM]DEP與SDS共同作用時,β-葡萄糖苷酶活性相比于SDS單一作用時增強,這可能是因為[EMIM]DEP能減弱SDS分子極性頭部上所帶的電荷對周圍分子的作用范圍,從而減弱靜電斥力。
2.2 離子液體中添加表面活性劑對β-葡萄糖苷酶動力學參數的影響
由于在離子液體的存在下只有添加鼠李糖脂和Span20 對β-葡萄糖苷酶的活性有增強作用,進一步測定酶的動力學參數可能發(fā)現該結果的解釋。如圖2 和表1 所示,對照組β-葡萄糖苷酶的Km值為3.79mmol/L,添加0.1%Tween80、PEG4000、Span20和鼠李糖脂的β-葡萄糖苷酶Km值分別為3.36mmol/L、2.93mmol/L、2.29mmol/L 和1.84mmol/L,降低了11.35%、22.69%、39.58%和51.45%。米氏常數Km值反映了酶與底物親和力的大小,Km值越大,酶與底物的親和力越小。由此可知,在實驗組中,加入表面活性劑使β-葡萄糖苷酶和底物pNPG的親和力變大,與底物更緊密的結合也有助于增強蛋白質在離子液體中的穩(wěn)定性。
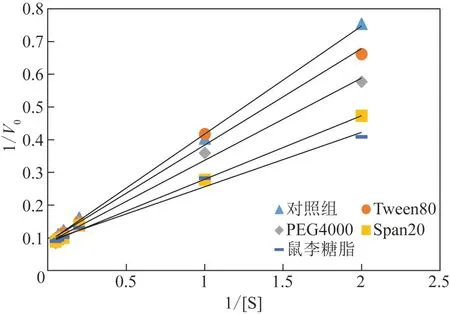
圖2 表面活性劑存在下β-葡萄糖苷酶的動力學曲線

表1 表面活性劑存在下β-葡萄糖苷酶的動力學方程和動力學參數
離子液體[EMIM]DEP 協同表面活性劑對β-葡萄糖苷酶影響的動力學參數如圖3和表2所示。離子液體環(huán)境中,β-葡萄糖苷酶的Km值為2.21mmol/L,比對照組減小了41.69%。在5%[EMIM]DEP 體系中分別加入0.1%Span20 和鼠李糖脂的Km值分別為1.77mmol/L 和1.68mmol/L。相對于對照組降低了53.30%和55.67%。由此可知,無論是離子液體還是離子液體與表面活性劑復配都能增加β-葡萄糖苷酶與底物的親和力。在本實驗中,離子液體體系中添加0.1%鼠李糖脂使β-葡萄糖苷酶的Km值減小最多,這與第2.1 節(jié)中5%[EMIM]DEP 協同0.1%鼠李糖脂對β-葡萄糖苷酶的活性增強最多這一實驗結果一致。這可能是因為特定的表面活性劑改變了β-葡萄糖苷酶的活性位點,使酶與底物更容易結合,同時減少了酶在底物上的無效吸附。

圖3 表面活性劑和[EMIM]DEP存在下β-葡萄糖苷酶的動力學曲線
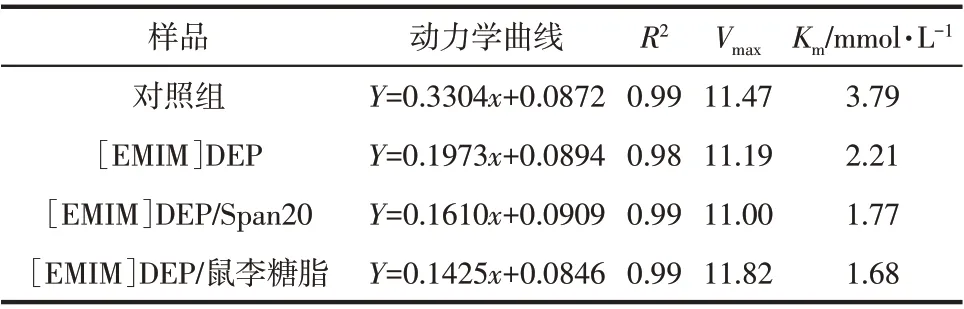
表2 表面活性劑和[EMIM]DEP存在下β-葡萄糖苷酶的動力學方程和動力學參數
2.3 加入表面活性劑對β-葡萄糖苷酶二級結構的影響
使用圓二色譜分析表面活性劑對β-葡萄糖苷酶二級結構的改變。結果如圖4所示,α-螺旋的兩個標志條帶可以在208nm和225nm處觀察到[18]。使用0.1%鼠李糖脂、Span20、PEG4000、Tween80和Triton X-100處理后β-葡萄糖苷酶的圓二色譜條帶強度略有變化。使用SDS處理后該條帶強度明顯降低。表3中對β-葡萄糖苷酶二級結構的進一步計算也證實了這一結果。經0.1%鼠李糖脂、Span20、PEG4000 和Tween80 處理后,β-葡萄糖苷酶的α-螺旋分別增加了1.00%、0.78%、0.72%和0.80%。添加Triton X-100對α-螺旋沒有明顯的影響。添加SDS導致α-螺旋急劇減少了5.72%,同時β-折疊增加了20.09%,結果清楚地表明SDS 處理使β-葡萄糖苷酶結構的無序性增加,致使酶活受到抑制。由于離子液體[EMIM]DEP的咪唑環(huán)在210nm處有強烈的紫外吸收,對圓二色譜的測定有極強的干擾,本研究嘗試使用透析的方法將[EMIM]DEP 從溶液中透析出來,但是經過實驗檢測,質量分數為50%以內的[EMIM]DEP 對β-葡萄糖苷酶是可逆抑制,而在本實驗中[EMIM]DEP 質量分數為5%,所以無法通過檢測酶活的方法確定透析是否可以徹底除去酶中的[EMIM]DEP,因此離子液體存在下的圓二色譜檢測未能進行。
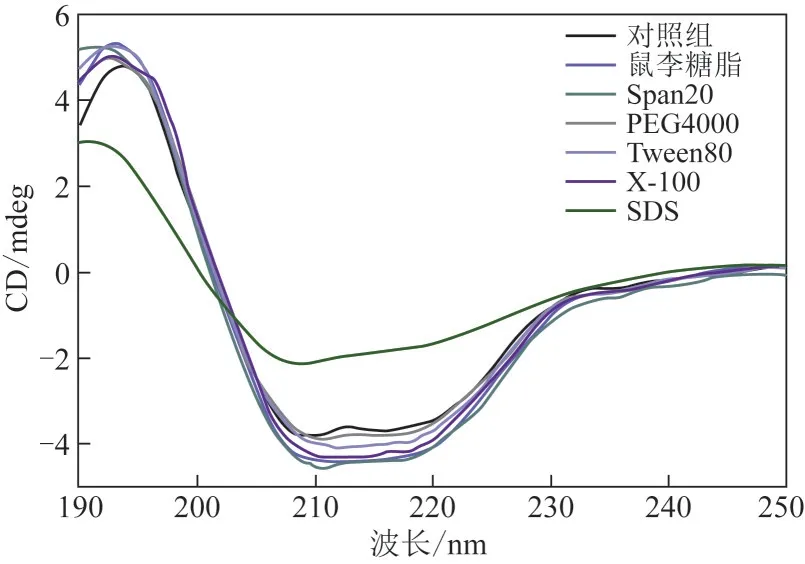
圖4 表面活性劑存在下β-葡萄糖苷酶的CD圖譜
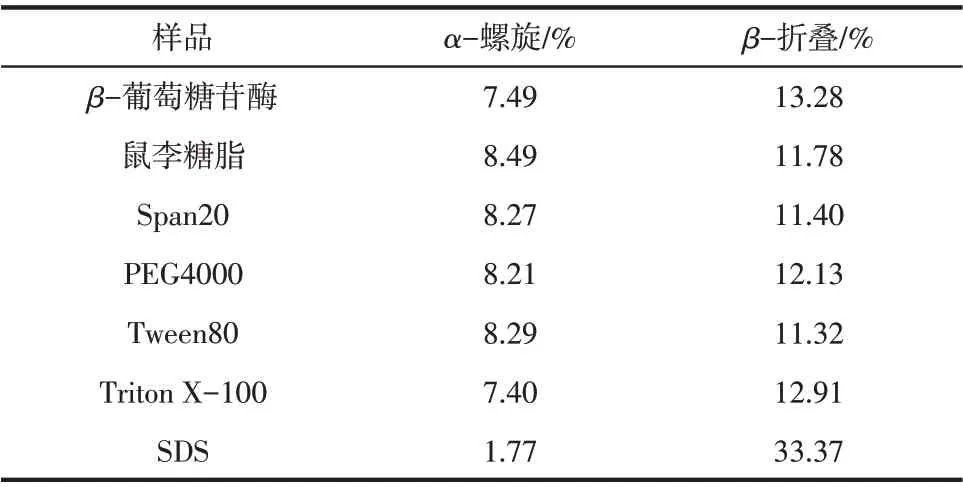
表3 表面活性劑存在下β-葡萄糖苷酶的二級結構
2.4 加入表面活性劑對β-葡萄糖苷酶芳香族氨基酸側鏈的影響
在280nm 的波長下對β-葡萄糖苷酶進行熒光激發(fā),獲得了反映其內部的色氨酸、酪氨酸變化的光譜圖[19]。如圖5(a)所示,在不同表面活性劑的影響下,β-葡萄糖苷酶的最大發(fā)射波長不同。β-葡萄糖苷酶-蒸餾水體系中β-葡萄糖苷酶的最大發(fā)射波長在352nm處,β-葡萄糖苷酶-鼠李糖脂的最大發(fā)射波長為363nm,發(fā)生了紅移;β-葡萄糖苷酶-Span20、β-葡萄糖苷酶-PEG4000、β-葡萄糖苷酶-Tween80 的最大發(fā)射波長分別為354nm、351nm 和351nm,變化不大;而β-葡萄糖苷酶-SDS 的最大發(fā)射波長在336nm處,發(fā)生了藍移;由于Triton X-100 會對熒光光譜產生干擾,無法準確得到Triton X-100 處理后β-葡萄糖苷酶的最大發(fā)射波長。加入離子液體后如圖5(b)所示,β-葡萄糖苷酶-[EMIM]DEP 和β-葡萄糖苷酶-[EMIM]DEP-鼠李糖脂的最大發(fā)射波長分別為363nm和366nm,β-葡萄糖苷酶-[EMIM]DEP-SDS 的最大發(fā)射波長為349nm,與上述結果趨勢一致。
Span20、PEG4000 和Tween80 是非離子表面活性劑,在溶液中不產生靜電斥力,只改變疏水相互作用,對酶的構象改變微小,因此熒光峰的位置變化很小。SDS是陰離子表面活性劑,使β-葡萄糖苷酶中發(fā)色基團色氨酸和酪氨酸的疏水性增強,所處的微環(huán)境發(fā)生變化,改變了β-葡萄糖苷酶的二級結構,從而降低了β-葡萄糖苷酶的活性[20]。β-葡萄糖苷酶在5%[EMIM]DEP和0.1%鼠李糖脂的作用下向長波長方向移動較大的距離,是因為酶蛋白內部的色氨酸殘基逐漸暴露,酶的構象發(fā)生了一定的變化。
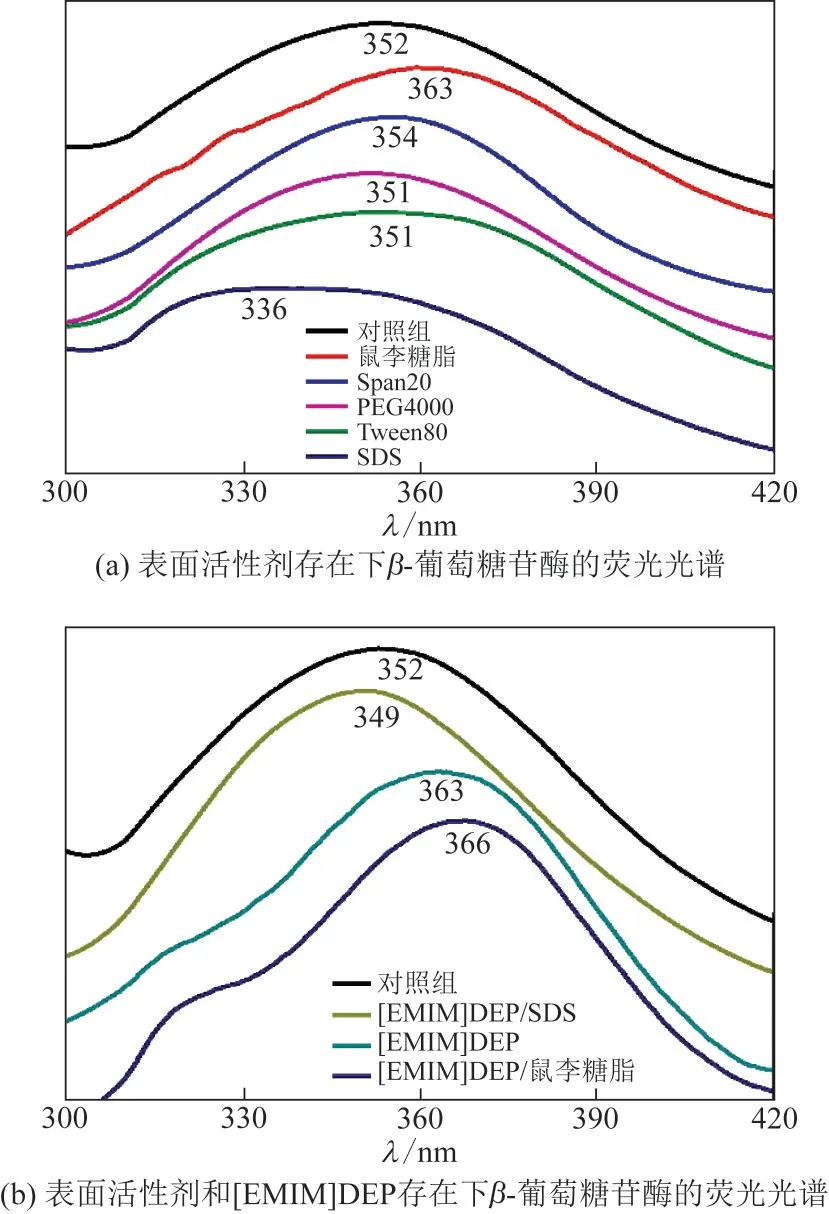
圖5 熒光光譜圖
2.5 加入鼠李糖脂和[EMIM]DEP 對β-葡萄糖苷酶熱穩(wěn)定性的影響
DSC可以用于確定酶蛋白的平衡熱力學穩(wěn)定性和折疊機制。根據第2.1 節(jié)和第2.2 節(jié)可知,5%[EMIM]DEP 協同0.1%鼠李糖脂作用對β-葡萄糖苷酶的活性增強效果最為明顯,且最大程度增加底物和酶的親和力,因此本研究對5%[EMIM]DEP 協同0.1%鼠李糖脂處理后的β-葡萄糖苷酶進行了DSC分析,結果如圖6所示。吸熱峰表明β-葡萄糖苷酶在中點溫度60.7℃時熱誘導展開,平均展開焓為393.1J/g。添加5%[EMIM]DEP 和0.1%鼠李糖脂改變了這種吸熱轉變,中點溫度Tm增加至61.4℃,平均展開焓ΔH增加至395.5J/g。一般來說,蛋白質分子的Tm值是一個確定的參數,可以指示蛋白的穩(wěn)定性強弱等特性。研究表明,生物表面活性劑能影響蛋白質的解鏈,且蛋白質與表面活性劑的相互作用通常是由于靜電作用[21]。該結果證明了當體系中添加了鼠李糖脂后,酶蛋白的解鏈能量增加,因此解鏈溫度升高。結合前述實驗結果,可以推測添加的鼠李糖脂與酶分子間的結合確實改變了蛋白質的空間構象。
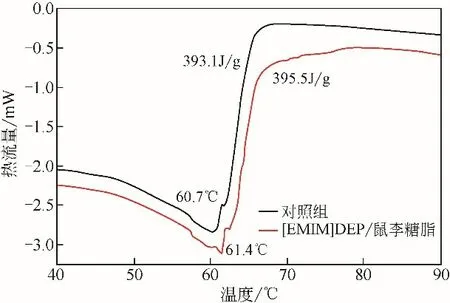
圖6 鼠李糖脂和[EMIM]DEP存在下β-葡萄糖苷酶的熱分析圖
2.6 纖維二糖原位酶解的時間進程
纖維二糖的積累會對內切葡聚糖酶和外切葡聚糖酶產生反饋抑制,繼而降低纖維素酶降解纖維素的效率。強化β-葡萄糖苷酶對纖維二糖的水解可以有效地緩解這種抑制[22]。因此,提高β-葡萄糖苷酶活性可以提高纖維素酶促水解的效率。由上述實驗可知,5%[EMIM]DEP協同0.1%鼠李糖脂提高β-葡萄糖苷酶的效果最好,因此選取5%[EMIM]DEP和0.1%鼠李糖脂進行纖維二糖的酶解。結果如圖7所示,在最初的60min,對照組的轉化率為45.67%,而添加5%[EMIM]DEP和0.1%鼠李糖脂的轉化率為58.33%,提高了12.66%。當水解時間為180min 時,對照組的轉化率為72.23%,添加5%[EMIM]DEP 和0.1%鼠李糖脂的轉化率為94.26%,相對于對照組提高了21.93%。在240min 時的水解率相對于180min 的水解率幾乎沒有提高,這可能是因為β-葡萄糖苷酶水解纖維二糖生成產物葡萄糖會對β-葡萄糖苷酶活性產生反饋抑制[23]。
3 結論
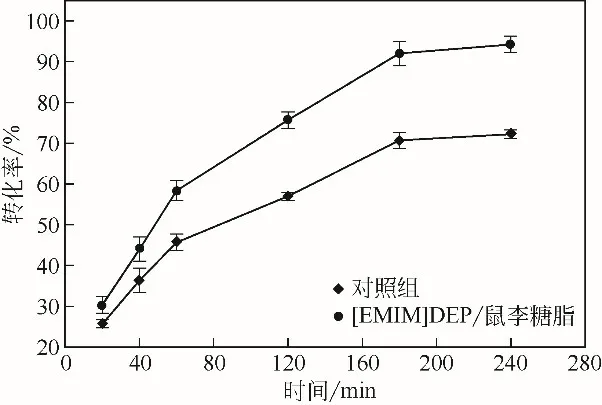
圖7 纖維二糖原位酶解的時間進程
本文考察了表面活性劑和離子液體[EMIM]DEP對類芽孢桿菌sp.LLZ1β-葡萄糖苷酶活性的影響。研究結果表明, 0.1% 鼠李糖脂、 Span20、PEG4000、Tween80 和5%[EMIM]DEP 能增強β-葡萄糖苷酶的活性;用5%[EMIM]DEP協同0.1%表面活性劑處理β-葡萄糖苷酶,鼠李糖脂和Span20 均能增強β-葡萄糖苷酶的相對活性。其中,5%[EMIM]DEP 和0.1%鼠李糖脂使β-葡萄糖苷酶的相對活性增加了21.85%。圓二色譜表明經表面活性劑處理后β-葡萄糖苷酶的二級結構發(fā)生了改變;熒光光譜顯示添加表面活性劑和[EMIM]DEP 使β-葡萄糖苷酶的最大發(fā)射波長發(fā)生紅移或藍移;DSC表明5%[EMIM]DEP和0.1%鼠李糖脂協同作用提高了β-葡萄糖苷酶的中點溫度和平均展開焓。最后在0.1%鼠李糖脂和5%[EMIM]DEP環(huán)境中進行纖維二糖的酶促水解,葡萄糖的生成量增加了21.93%。本研究有效地增強β-葡萄糖苷酶在[EMIM]DEP 中的活性,從而提高原位酶解的效率,研究可為廢棄生物質的資源化利用提供理論基礎和技術支撐。

