孜然精油對微凍貯藏羊肉肌原纖維蛋白結構和功能特性的影響
魯小川,張伊儂,潘成磊,康夢瑤,李懿璇,尚永彪,2,3*
1(西南大學 食品科學學院,重慶,400716) 2(農業部農產品貯藏保鮮質量安全評估實驗室(重慶),重慶,400716)3(重慶市特色食品工程技術研究中心,重慶,400716)
肌肉中的蛋白質分為可溶于濃鹽溶液的蛋白質、可溶于水或稀鹽溶液的蛋白質和不溶于濃鹽溶液的蛋白質。其中含量最多的是鹽溶性蛋白中的肌原纖維蛋白(myofibrillar protein,MP),其與肌肉的交聯、流變和凝膠等性質密切相關[1]。肉制品在貯藏過程中通常伴隨著蛋白質的氧化,這不僅會降低肌肉的營養價值,還會對蛋白質的功能性質產生影響,降低肉的加工品質。
延緩肉制品氧化的方法主要有低溫、氣調、添加生物化學制劑等。微凍保鮮屬于低溫保鮮方法中的一種,其原理是通過低溫來抑制微生物的生長繁殖及酶的活力,延緩肌肉蛋白的氧化[2]。相比于冷藏,微凍能更好地延長產品的保鮮期[3]。此外,通過添加化學抗氧化劑和生物抗氧化劑來延緩蛋白質氧化也是目前的研究熱點,但化學抗氧化劑有潛在的安全性問題。天然抗氧化劑多為植物提取物,其毒性遠遠低于化學抗氧化劑,具有廣闊的應用前景。
孜然是一種安全的天然香辛料,人們已經對其有效成分的提取[4]、鑒定[5]、抗氧化活性[6]等方面開展了一些研究,但對其在肉制品的加工與保鮮中的應用還鮮見報道。本文以新鮮羊肉為原料,以人工合成抗氧化劑BHT和天然抗氧化劑TP為參照,從羊肉MP結構和功能性質兩方面入手,考察不同濃度孜然精油在微凍貯藏過程中的抗氧化效果,探討其抗氧化的機理,以期為羊肉的貯藏保鮮以及孜然資源的深度開發提供理論基礎和應用依據。
1 材料與方法
1.1 材料與試劑
新鮮羊后腿肉,購于重慶市石柱縣千野羊行,宰殺后用洗凈的刀具將后腿肉取下,置于潔凈的塑料袋中,用放有冰袋的保溫箱(0~4 ℃)在6 h內運回實驗室冷藏;孜然精油(食用級,超臨界CO2萃取,深綠色油狀澄明液體,純度為100%,其中枯茗醛類≥50%),廣州晶晶生物科技有限公司;茶多酚(食用級,純度為99%,其中黃烷醇類≥60%),西安康之樂生物技術有限公司;BHT(分析純),成都市科龍化工試劑廠;其他試劑均為分析純。
1.2 儀器與設備
Avanti J-10高速冷凍離心機,美國貝克曼庫爾特公司;XHF-D內切式勻漿機,寧波新芝生物科技股份有限公司;MCR302 流變儀,奧地利安東帕公司;DXR2拉曼光譜儀,美國Thermo Fisher Scientific;SYNERGYH1MG全波長酶標儀,美國基因公司。
1.3 方法
1.3.1 試樣處理
用消毒過的砧板和刀具在無菌操作臺上將羊肉分割成40 g(約5 cm×4 cm×2 cm)左右肉塊,蒸餾水洗凈后分別在8、12、16 mg/mL孜然精油,2 mg/mL TP、0.15 mg/mL BHT溶液中浸泡30 min,空白對照用體積分數80%乙醇溶液浸泡,瀝干后置于聚酯托盤內,用PE膜包裝后于-3 ℃貯藏備用。
1.3.2 羊肉凍結點的測定
凍結肌肉時,溫度隨時間的變化曲線叫做該肌肉的凍結曲線。將數顯溫度計的探針插入重約250 g的羊肉中心位置,肉塊放在-30℃的冰柜中,每隔20 s記錄溫度變化。平臺期時的溫度即為羊肉的凍結點。
1.3.3 MP的提取及濃度的測定
參照WU等[7]的方法并修改。試樣于4 ℃解凍后絞碎,稱取一定量碎肉于離心管中,加入5倍體積磷酸鹽緩沖液(內含0.1 mol/L NaCl、1 mmol/L EGTA,pH 7.0),高速勻漿60 s,紗布過濾去掉結締組織,濾液離心(7 500 r/min, 15min, 4 ℃)后去掉上清液,所得沉淀重復上述操作3次,再用5倍體積0.1 mol/L NaCl勻漿離心3次,沉淀即為MP,4 ℃保存,并在48 h內用完。用雙縮脲法測MP濃度,牛血清蛋白為標準蛋白。
1.3.4 MP分子結構指標的測定
1.3.4.1 羰基含量的測定
參照OLIVER等[8]的方法測定。
1.3.4.2 總巰基含量的測定
參照劉琴等[9]的方法并修改。取1 mL 5 mg/mL的MP溶液加入9 mL 0.2 mol/L的Tris-HCl緩沖液A(內含0.6 mol/L NaCl、10 mmol/L EDTA、質量分數2% SDS、8 mol/L尿素,pH 6.8)中,混勻后取4 mL加入0.4 mL 0.01 mol/L Tris-HCl緩沖液C(內含質量分數0.1% DTNB,pH 8.0),40 ℃保溫30 min,在412 nm處測定吸光度,空白用磷酸鹽緩沖液代替。MP的總巰基含量按公式(1)計算。
(1)
式中:A,吸光度;B,樣品蛋白濃度,mg/mL;C,吸光度系數,為13 600 mol/(cm·L);D,稀釋倍數,為11。
1.3.4.3 活性巰基含量的測定
參照1.3.4.2用0.2 mol/L Tris-HCl緩沖液B(內含0.6 mol/L NaCl、10 mmol/L EDTA、2%SDS,pH 6.8)替代緩沖液A,40 ℃保溫30 min,在412 nm處測定吸光度,空白用磷酸鹽緩沖液代替。MP的活性巰基含量按公式(1)計算。
1.3.4.4 MP表面疏水性的測定
參照CHELH等[10]的方法并修改。取1 mL 5 mg/mL的MP溶液加入200 μL溴酚藍溶液(1 mg/mL)中,室溫振蕩10 min,使之混勻,離心(7 500 r/min,12 min,4 ℃)后取上清液稀釋10倍,于595 nm處測定吸光度,空白用磷酸鹽緩沖液代替。MP表面疏水性按公式(2)計算:
(2)
式中:A0,空白對照組的吸光度值;A1,MP溶液的吸光度值。
1.3.4.5 拉曼光譜的分析
羊肉MP冷凍干燥后用DXR2拉曼光譜儀測定,設定參數為:激發波長785 nm,分辨率6 cm-1,掃面范圍100~3 300 cm-1。
1.3.5 MP功能特性指標的測定
1.3.5.1 MP溶解度的測定
參照AGYARE等[11]的方法并修改。用磷酸緩沖液(含0.6 mol/L NaCl,pH 6.25)配制MP質量濃度為2.5 mg/mL。將配好的MP溶液于4 ℃靜置1 h,冷凍離心(5 000 r/min, 4 ℃,15 min)后取上清液,用雙縮脲法測定其濃度,記為C1,空白用磷酸緩沖液代替。按公式(3)計算MP的溶解度。

(3)
式中:ρ1,離心后上清液中MP質量濃度,g/L;2.5,離心前混合液中MP的質量濃度,g/L。
1.3.5.2 乳化性質的測定
采用濁度法測定MP的乳化性[12]。
1.3.5.3 流變性質的測定
參照WU等[13]的方法并修改。配制MP質量濃度為40 mg/mL,用MCR302流變儀測定其流變學特征,上樣后需用硅油密封。參數設置為:夾具40 mm,頻率1 Hz,應變8 mg/mL,平行板間距1 mm,升溫掃描范圍20~80 ℃,升溫速率2 ℃/min,80 ℃保持3 min,最后以5 ℃/min將溫度降至20 ℃。
1.3.6 數據處理
每個實驗重復3次,每次做3個平行樣,用Excel處理數據,SPSS Statistics 20.0軟件進行單因素方差分析,Origin 8.5繪圖,結果以平均值±標準差(X±SD)形式表示。
2 結果與分析
2.1 新鮮羊肉的凍結曲線
從圖1可以看出,整個過程沒有出現明顯過冷點,平臺區出現在-1.3~-1.2 ℃左右,根據微凍貯藏的定義將-3 ℃作為羊肉微凍貯藏溫度進行研究。
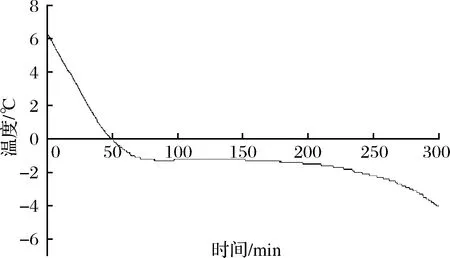
圖1 羊肉的凍結曲線Fig.1 Freezing curve of mutton
2.2 孜然精油對微凍羊肉MP結構的影響
2.2.1 羰基含量的變化
經不同處理后的羊肉在微凍貯藏過程中MP羰基含量的變化情況如圖2所示。
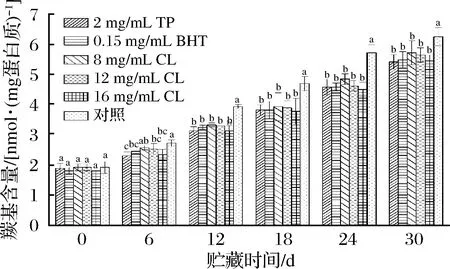
圖2 微凍貯藏羊肉MP羰基含量的變化Fig.2 Changes of carbonyl content in MP of mutton duringsuperchilling storage
從圖2可以看出,隨著貯藏時間的延長,處理組和空白對照組羊肉MP的羰基含量均呈現出逐漸上升趨勢,這可能是因為氨基酸側鏈受到羥基自由基(·OH)的攻擊氧化。TP組、BHT組、8 mg/mL CL組、12 mg/mL CL組、16 mg/mL CL組和空白對照組的初始羰基含量分別為1.89、1.82、1.93、1.93、1.82、1.93 nmol/mg蛋白質,貯藏24 d后,對照組的羰基含量達到了5.72 nmol/mg蛋白質,而TP組、BHT組、8 mg/mL CL組、12 mg/mL CL組、16 mg/mL CL組貯藏30 d后羰基含量分別為5.42、5.49、5.72、5.64、5.45 nmol/mg蛋白質,均不高于貯藏24 d時的對照組,表明處理組能顯著抑制羊肉MP羰基的生成(P<0.05)。
蛋白質發生氧化后一個最顯著的變化就是羰基的形成,因此常用其衡量蛋白質的氧化程度。蛋白質自身結構中并不含天然的羰基,其主要是通過直接氧化氨基酸側鏈、與還原糖發生非酶糖化反應、與非蛋白糖基化合物結合和多肽鏈的氧化斷裂等途徑產生的[14]。從圖2可以看出,處理組試樣在貯藏過程中羰基含量增加速率較為緩慢,這表明孜然精油和茶多酚、BHT一樣,都可以抑制MP的氧化,且16 mg/mL的孜然精油和茶多酚對羊肉MP的抑制效果最好,其次是BHT,12和8 mg/mL孜然精油不如前三者,但差異不顯著(P>0.05)。
2.2.2 巰基含量的變化
經不同處理后的羊肉在微凍貯藏過程中總巰基含量與活性巰基含量的變化情況如圖3所示。
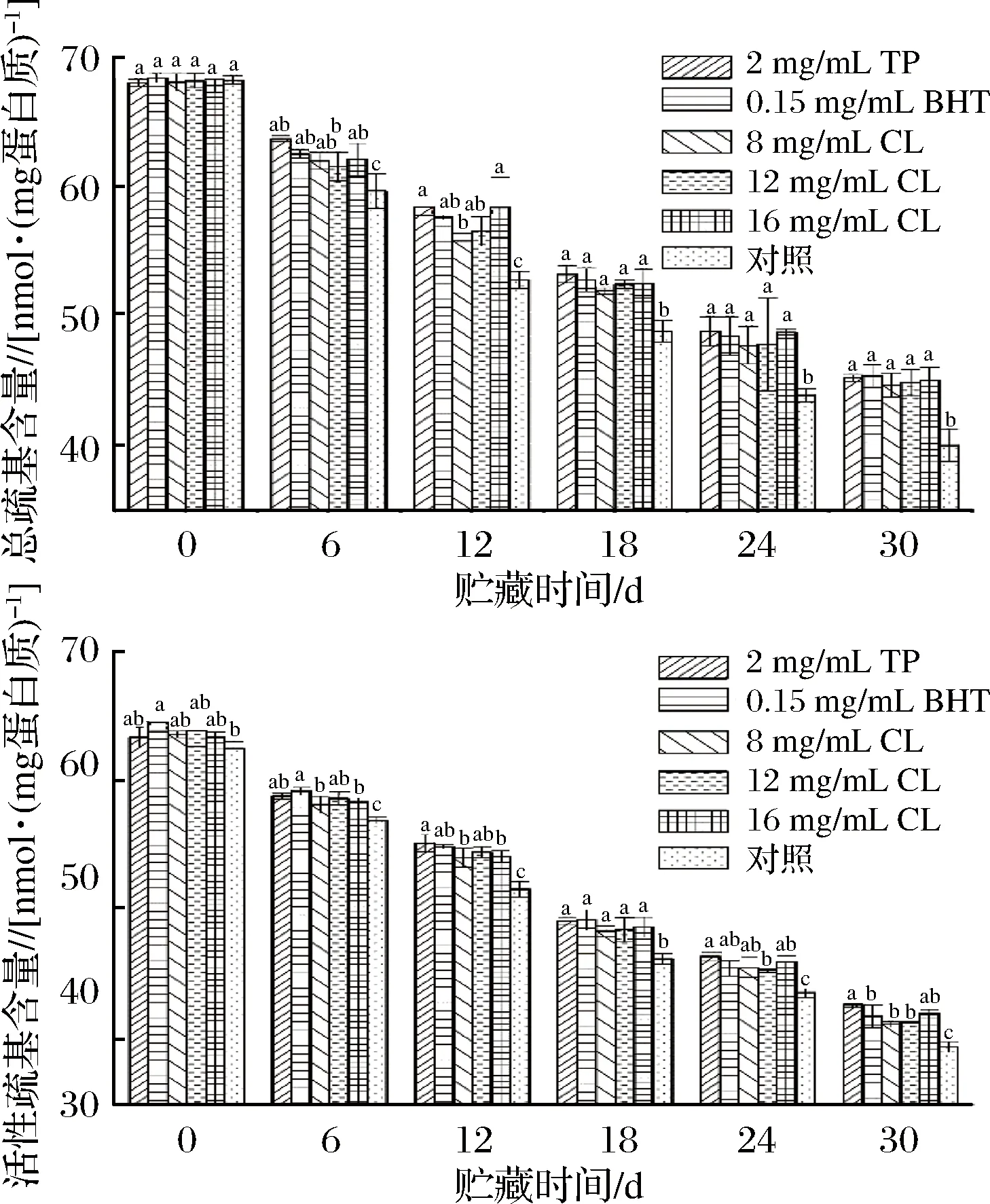
圖3 微凍貯藏羊肉MP巰基含量的變化Fig.3 Changes of sulfhydryl content in MP of muttonduring superchilling storage
從圖3可以看出,隨著貯藏時間的延長,處理組和空白對照組羊肉總巰基含量與活性巰基含量均呈現出逐漸下降的趨勢,這可能是由于巰基被氧化導致的。0 d時,TP組、BHT組、8 mg/mL CL組、12 mg/mL CL組、16 mg/mL CL組和空白對照組的總巰基含量分別為68.10、68.48、68.16、68.27、67.89、68.32 nmol/mg蛋白質,空白對照組在貯藏24 d時總巰基含量為43.89 nmol/mg蛋白質,TP組、BHT組、8 mg/mL CL組、12 mg/mL CL組、16 mg/mL CL組在貯藏了30 d后的值分別為45.24、45.40、44.70、44.86、45.08 nmol/mg蛋白質,均高于24 d時的空白對照組,活性巰基含量呈現類似的規律,這表明處理組顯著抑制了巰基含量的下降(P<0.05)。
巰基(—SH)是MP中很活潑的功能基團,其含量變化能反映MP空間結構的穩定性。羊肉在微凍貯藏過程中常伴隨著MP的變性,其結構會發生一定程度變化,從而導致巰基暴露,被氧化成為分子內或分子間的二硫鍵(—S—S—)[15]。對比各組發現處理組相較于空白對照組能顯著減緩羊肉MP總巰基含量和活性巰基含量的下降速率(P<0.05),同時孜然精油(12、16 mg/mL)能較好抑制MP總巰基含量的下降,其效果與茶多酚、BHT處理組相當,優于8 mg/mL孜然精油處理組。茶多酚對活性巰基含量的抑制效果最佳,但與16 mg/mL孜然精油處理組差異不顯著(P>0.05),與8、12 mg/mL孜然精油處理相比差異顯著(P<0.05)。這表明孜然精油對羊肉MP巰基的抑制作用在一定范圍內與濃度呈正相關。由于巰基含量的減少主要由MP的氧化引起,從這一點來看,孜然精油在抑制羊肉MP氧化方面可與茶多酚相當。
2.2.3 表面疏水性的變化
經不同處理后的羊肉在微凍貯藏過程中表面疏水性的變化情況如圖4所示。

圖4 微凍貯藏羊肉MP表面疏水性含量的變化Fig.4 Changes of surface hydrophobicity in MP of muttonduring superchilling storage
從圖4可以看出,隨著貯藏時間的延長,處理組和空白對照組羊肉MP的表面疏水性均呈現逐漸升高的趨勢,且空白對照組相較于處理組而言上升速率更快(P<0.05)。空白對照組在貯藏24、30 d時羊肉MP與溴酚藍結合量分別為96.24、115.13 μg,而TP組、BHT組、8 mg/mL CL組、12 mg/mL CL組、16 mg/mL CL組經過30 d貯藏后羊肉MP與溴酚藍結合量分別達到92.06、96.46、96.46、95.92、90.99、91.74 μg,尤其12 mg/mL CL組和16 mg/mL CL組比空白對照組24 d時的值還低,這表明了處理組能延緩微凍貯藏羊肉MP的氧化速率,并且12 mg/mL和16 mg/mL的孜然精油的抑制效果優于茶多酚和BHT。
蛋白質的表面疏水性是指蛋白質分子與水分子間相互排斥的物理性質,是常用的衡量表面疏水性氨基酸的含有率和蛋白質變形程度的指標。蛋白質氧化會引起埋藏在蛋白質天然結構里的疏水性氨基酸殘基暴露,導致其分子間產生聚集和交聯,使其表面疏水作用增強。從圖4可以看出,所有組羊肉MP的表面疏水性均隨著貯藏時間的延長逐漸上升,LI等[16]研究肌球蛋白和閆春子[17]研究超高壓對草魚的保鮮作用時也發現了類似結果。
2.2.4 拉曼光譜分析
蛋白質的空間結構通常是指其二、三、四級結構,其中二級結構是其復雜空間構象的基礎,通常包括α-螺旋、β-折疊等規則結構和γ-轉角、無規則卷曲等不規則結構,主要通過氫鍵連接,范德華力、二硫鍵等作用力也有部分貢獻[18],這些結構對蛋白質的功能特性起決定作用[19]。目前常用拉曼光譜、紅外光譜、核磁共振技術等方法研究蛋白質的空間結構,其中拉曼光譜對分子振動非常靈敏,不僅可以通過酰胺鍵和C—C骨架振動譜帶獲得主鏈與側鏈的構象來推測蛋白質的二級結構,還可以通過部分氨基酸功能基團的伸縮來推測蛋白質三級結構的變化,是研究蛋白質結構最常用的手段之一。
經不同處理后的羊肉在微凍貯藏前MP的拉曼圖譜如圖5所示。

圖5 微凍貯藏羊肉MP初期拉曼光譜圖Fig.5 Changes in Raman spectra of MP of mutton duringsuperchilling storage of sulfhydryl content in MP of mutton

通常用酪氨酸等氨基酸側鏈來判斷蛋白質的三級結構,酪氨酸殘基在830和850 cm-1附近形成的費米共振雙峰與該基團所處的微環境有關,I850/I830(強度比)是反應酪氨酸殘基狀態(“包埋”或“暴露”)的有效探針,當I850/I830值大于1.0時,表明酪氨酸殘基暴露在蛋白質表面,可作為氫鍵供體或受體與溶劑水分子相互作用,當I850/I830值介于0.7~1.0之間,表明酪氨酸殘基包埋在蛋白質分子內部疏水環境中,可作為氧鍵供體[25-26]]。表1展示了羊肉微凍貯藏過程中I850/I830的變化情況,貯藏初期TP組、BHT組、8 mg/mL CL組、12 mg/mL CL組、16 mg/mL CL組和空白對照組的比值分別為1.07、1.06、1.06、1.05、1.06和1.06,表明酪氨酸殘基在MP表面是暴露的,處于極性環境中。隨著微凍時間的延長,I850/I830呈現減小的趨勢,至貯藏終點時分別到了0.91、0.89、0.88、0.90、0.90、0.87。表明隨著貯藏時間的延長,MP發生了變性,分子間疏水作用增強使蛋白質發生凝集沉淀,導致部分表面裸露的酪氨酸殘基又被包埋在蛋白質網絡里。LEELAPONGWATTANA等[27]研究黑線鱈肌動球蛋白時也發現了類似結果。

圖6 微凍貯藏過程中羊肉MP拉曼光譜圖Fig.6 Changes in Raman spectra of MP of mutton during superchilling storage of sulfhydryl content in MP of mutton注:圖中A、B、C分別表示貯藏0、18、30 d的拉曼圖譜
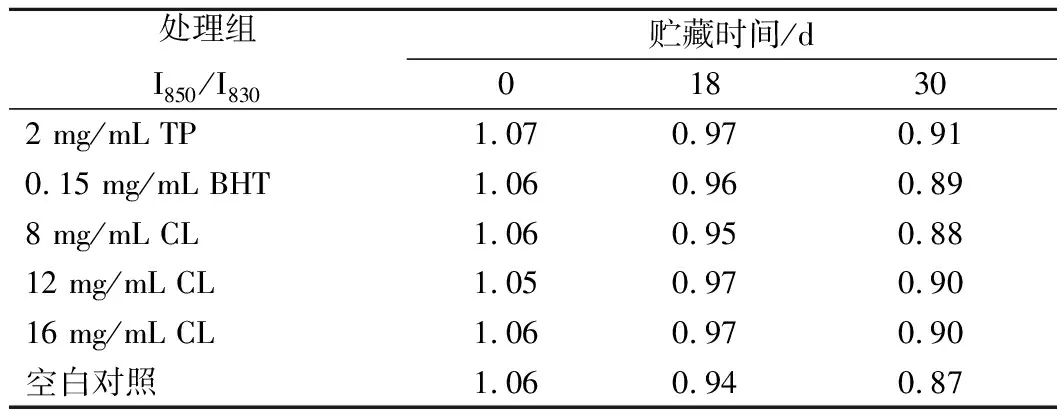
表1 微凍貯藏過程中羊肉MP I850/I830強度的變化Table 1 Effect on tyrosine doublet ratio I850/I830 of MPof mutton during superchilling storage
2.3 孜然精油對微凍羊肉MP功能性質的影響
2.3.1 溶解度的變化
不同處理的羊肉在微凍貯藏過程中溶解度的變化情況如圖7所示,隨著貯藏時間的延長,處理組和空白對照組羊肉溶解度均呈現逐漸下降的趨勢,且處理組相較于空白對照組能顯著減緩羊肉MP溶解度的下降速率(P<0.05)。最初TP組、BHT組、8 mg/mL CL組、12 mg/mL CL組、16 mg/mL CL組和空白對照組羊肉MP的溶解度分別為61.22%、61.64%、59.94%、61.22%、62.49%、61.22%,貯藏30 d后,分別下降了2.29、2.23、2.35、2.33、2.41和2.94倍。
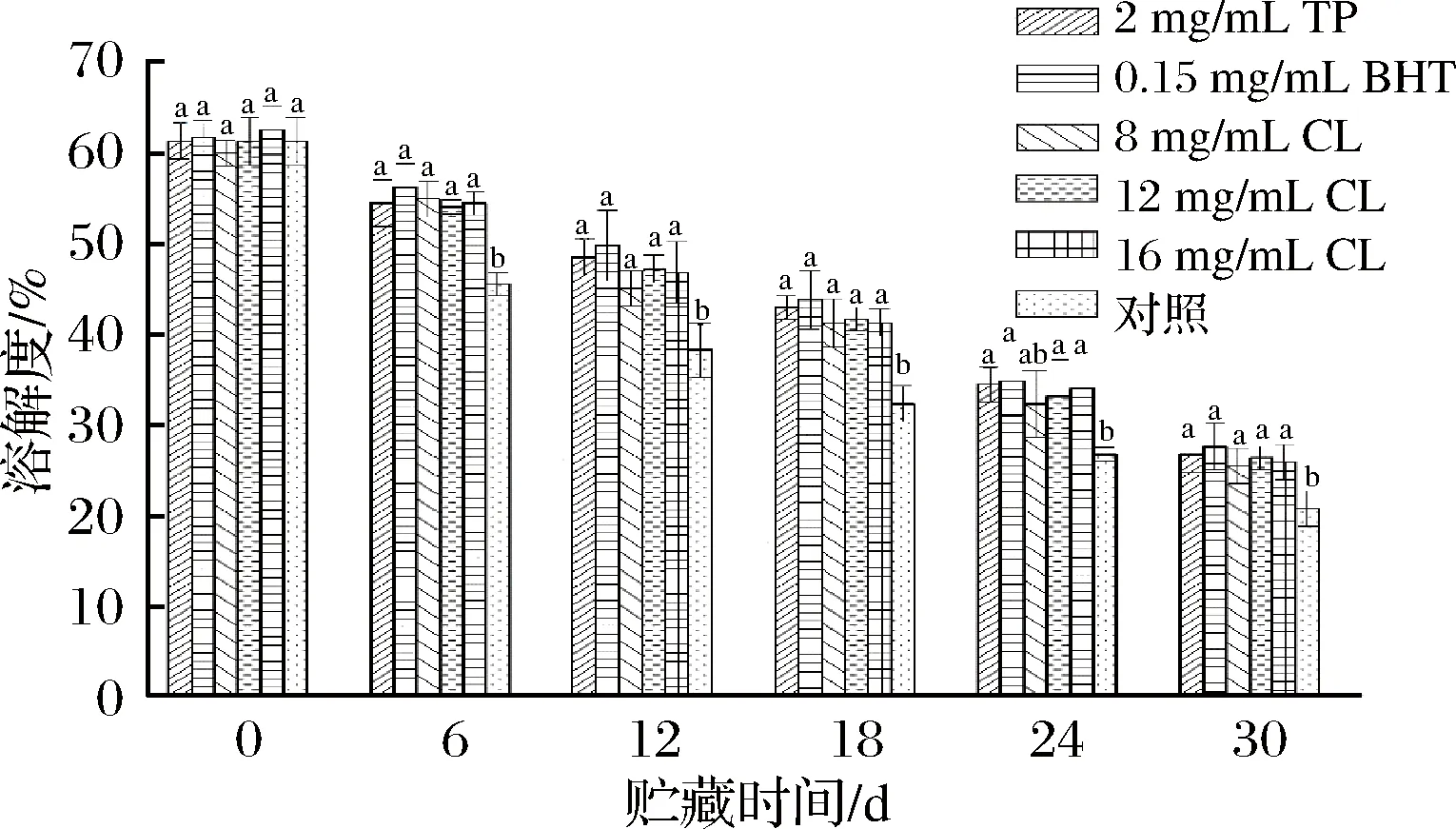
圖7 微凍貯藏羊肉MP溶解度含量的變化Fig.7 Changes of solubility in MP of mutton duringsuperchilling storage
蛋白質的溶解性是其基本物理性質之一,能直接反映蛋白質變性和聚集的情況[28]。從圖7可以看出,羊肉微凍貯藏期間各組溶解度都有不同程度地降低,這可能是由于貯藏過程中MP變性和微環境的變化導致了不溶性的大分子量的蛋白質聚集體的形成,導致蛋白質溶解性降低;蛋白質的結構變化會使其疏水基團暴露,而疏水性相互作用會使MP發生凝聚,也使其溶解度降低[29]。圖7顯示,BHT組溶解度下降程度最小,TP組、12 mg/mL CL組和16 mg/mL CL組溶解度下降程度接近,表明孜然精油(12、16 mg/mL)能較好延緩MP的變性和聚集,在抑制微凍貯藏羊肉MP氧化方面和茶多酚相當,較BHT稍微差,但差異不顯著(P>0.05)。
2.3.2 乳化性的變化
不同處理的羊肉在微凍貯藏過程中乳化活性和乳化穩定性的變化情況見圖8,隨著貯藏時間的延長,TP、BHT、CL處理組和空白對照組羊肉乳化活性和乳化穩定性均呈現出逐漸下降的趨勢,且處理組相較于空白對照組能顯著減緩羊肉MP乳化活性和乳化穩定性的下降速率。起初TP組、BHT組、8 mg/mL CL組、12 mg/mL CL組、16 mg/mL CL組、空白對照組的乳化活性和乳化穩定性分別為29.77、29.86、28.88、29.08、28.35、28.77和82.02%、81.62%、80.20%、80.20%、82.20%、81.32%,至貯藏終期分別為13.55、13.24、12.95、13.95、13.74、11.65和59.35%、58.99%、58.82%、60.00%、60.49%、55.75%。這可能是因為在微凍貯藏過程中,羊肉MP發生氧化變性,引起肌球蛋白交聯程度的增加,導致蛋白質表面吸附脂肪顆粒的能力減弱,宏觀表現為蛋白質乳化活性和乳化穩定性下降[30]。這與李學鵬等[31]研究大黃魚凍藏過程中MP的乳化活性和乳化穩定性結果相似。
從圖8看出羊肉在微凍貯藏0~18 d內乳化性質的下降速率比18~30 d更快,這可能是因為貯藏前期羊肉體內冰晶的生長對其肌肉的機械損傷程度更大,導致蛋白質變性速率更快。分析發現乳化活性在貯藏期內下降17.12 m2/g,乳化穩定性在貯藏期內下降了25.57%,而TP組和16 mg/mL CL組下降幅度分別為16.21、14.6 m2/g和22.28%、22.36%,均顯著低于空白對照組,這可能是由于處理組在一定程度上延緩了羊肉MP的變性程度,從而表現為處理組乳化性質優于空白對照組,其中16 mg/mL的孜然精油處理組效果最好。
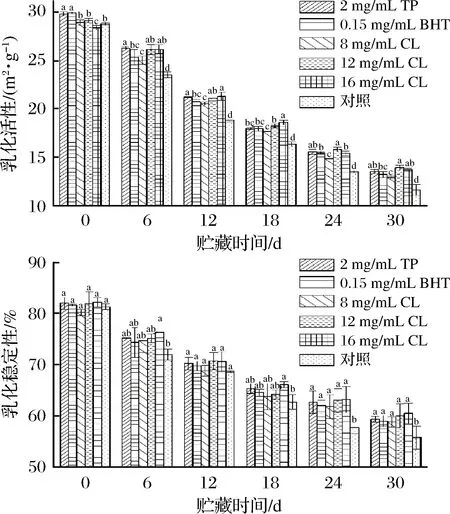
圖8 微凍貯藏羊肉MP乳化性質的變化Fig.8 Changes of emulsifying in MP of mutton undersuperchilling storage
2.3.3 流變分析
從流變學角度來說,MP凝膠是一種彈性特征的物質,隨溫度和時間的改變而改變。彈性模量(G′)表示MP彈性凝膠三維結構的形成速率,用于表征蛋白質結構的凝聚、折疊和打開情況[32]。經不同處理后的羊肉在微凍貯藏過程中G′的變化情況如圖9所示。
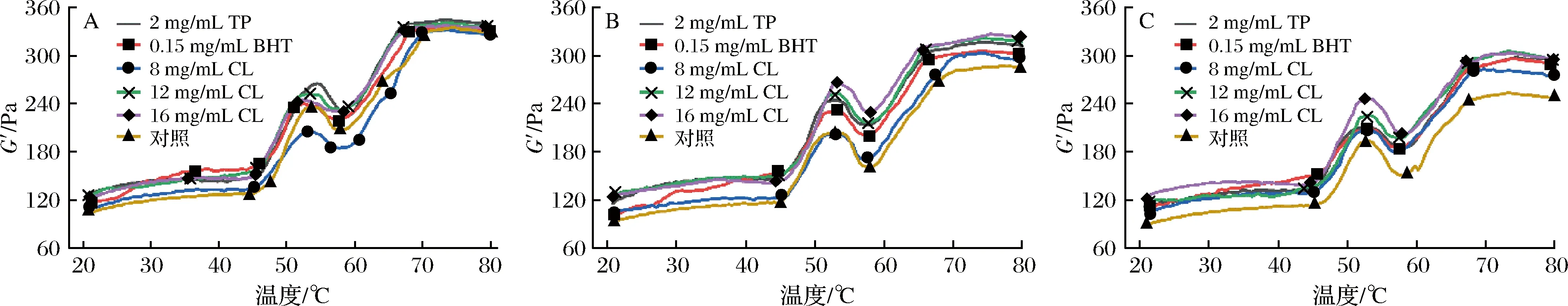
圖9 微凍貯藏羊肉MP彈性模量的變化Fig.9 Changes of elastic modulus in MP of mutton under superchilling storage注:圖中A、B、C分別表示貯藏時間0、18和30 d的彈性模量變化。
從圖9可以看出,羊肉MP的G′隨溫度的升高變化趨勢基本一致,分為上升-下降-上升3個階段。在第一階段,羊肉MP的G′表現為先緩慢上升后迅速升高,在54 ℃左右達到第1個峰值,這是因為此時肌球蛋白頭部的α-螺旋開始打開,頭部發生交聯,開始形成較弱的三維網狀結構[33]。之后G′開始下降,通常認為這是由于加熱過程中氫鍵發生斷裂,蛋白質變性引起的,其三維網狀結構被破壞;此外,肌球蛋白尾部解螺旋使蛋白質流動性增加,蛋白質在內源蛋白酶的作用下發生水解也可能引起G′下降[34]。最后G′再次上升直至平穩,這是因為蛋白質隨著溫度的升高繼續變性,更多的肌球蛋白分子螺旋結構被展開,在二硫化合物共價結合和疏水相互作用的共同作用下發生交聯,最終形成了穩定、不可逆的三維網狀結構[35-36]。
0 d時TP組、BHT組、8 mg/mL CL組、12 mg/mL CL組、16 mg/mL CL組和空白對照組羊肉MP的最大G′分別為344.97、335.99、331.94、340.49、337.26和334.93 Pa,至貯藏終點分別下降了13.69%、11.99%、15.32%、10.34%、10.17%和24.43%,各組試樣的最大G′均隨著冷藏時間的延長逐漸下降,流變學性質的總體變化趨勢與張斌斌等[37]的研究相似。但對照組的G′下降幅度最大,16 mg/mL CL處理組下降幅度最小,12 mg/mL CL和16 mg/mL CL處理組下降幅度均低于TP和BHT處理組。流變學分析結果也表明,孜然精油能顯著延緩微凍貯藏過程中肌原纖維蛋白凝膠特性的變化,且效果優于TP和BHT。
3 結論
隨著貯藏時間的延長,羊肉MP會發生一定程度的氧化,蛋白質二級結構遭到一定程度的破壞。添加抗氧化劑能延緩MP結構的變化,且孜然精油處理液濃度達到12 mg/mL及以上時,其使用效果與適宜濃度的TP和BHT溶液相當。微凍貯藏過程中,羊肉MP的水合性、界面特性以及凝膠性能不斷減弱,抗氧化處理能顯著延緩MP功能特性的變化,且孜然精油質量濃度達到12 mg/mL及以上時,其效果優于適宜濃度的TP和BHT溶液。
孜然精油在羊肉微凍貯藏過程中能顯著發揮其抗氧化作用,延緩MP的結構和功能特性變化,其以孜然精油進行浸泡處理的適宜質量濃度為12 mg/mL。

