葡萄潰瘍病菌外泌蛋白LtGH61A的致病力及基因表達模式
彭軍波,李興紅,張瑋,周瑩,黃金寶,燕繼曄
葡萄潰瘍病菌外泌蛋白LtGH61A的致病力及基因表達模式
彭軍波,李興紅,張瑋,周瑩,黃金寶,燕繼曄
(北京市農林科學院植物保護環境保護研究所/北方果樹病蟲害綠色防控北京市重點實驗室,北京 100097)
【目的】由葡萄座腔菌屬()真菌引起的潰瘍病是葡萄生產上的重要病害之一,在國內多個葡萄產區發生,嚴重威脅葡萄的產量及品質。本研究對葡萄潰瘍病菌()中一個假定外泌蛋白LtGH61A進行功能分析,為進一步解析葡萄潰瘍病菌的致病機理及病害防控提供理論依據。【方法】通過SignalP 4.0預測LtGH61A蛋白的信號肽;氨基酸序列同源比對結合基因功能注釋,預測LtGH61A蛋白的功能;通過酵母互補試驗分析LtGH61A蛋白的外泌特性;采用實時熒光定量PCR(qRT-PCR)分析在病原菌營養菌絲及侵染寄主不同階段的表達量;借助RNA干涉(RNAi)對進行表達抑制;通過葡萄枝干離體接種試驗,分析LtGH61A蛋白對葡萄潰瘍病菌致病力的影響。通過比較菌落直徑,分析LtGH61A蛋白對葡萄潰瘍病菌菌絲生長速率的影響。【結果】信號肽預測表明LtGH61A蛋白N端具有一個長度為18個氨基酸的信號肽;基因功能注釋推定的編碼產物屬于糖苷水解酶61(GH61)家族,能酶解纖維素類物質;互補蔗糖酶外泌缺陷型酵母YTK12結果表明,LtGH61A蛋白的信號肽具有外泌活性,能夠引導酵母YTK12蔗糖酶的外泌;與營養菌絲階段相比,的表達量在病原菌侵染階段顯著升高,并且在接種后48 h高達營養菌絲階段的19倍;通過RNAi試驗及qRT-PCR驗證,獲得了2個表達量明顯降低的陽性轉化子,分別命名為RNAi-LtGH61A1和RNAi-LtGH61A2;葡萄枝干離體接種試驗結果顯示,與野生型CSS-01s相比,RNAi-LtGH61A1和RNAi-LtGH61A2轉化子在葡萄枝干形成的病斑長度顯著變短,約為野生型CSS-01s的55%,表明LtGH61A影響葡萄潰瘍病菌的致病力;菌落直徑比較顯示,與野生型CSS-01s相比,RNAi-LtGH61A1和RNAi-LtGH61A2轉化子的菌落直徑變小,約為野生型85%,表明LtGH61A影響葡萄潰瘍病菌的菌絲生長速率。【結論】LtGH61A影響葡萄潰瘍病菌的致病力及生長速率;LtGH61A蛋白能夠分泌至胞外;在病原菌侵染階段的表達量顯著升高,推測其通過發揮自身酶活功能,破壞寄主植物組織,從而促進病原菌的侵染。
葡萄潰瘍病菌;外泌蛋白;致病力;表達模式;實時熒光定量PCR; RNA干涉
0 引言
【研究意義】葡萄是世界范圍內四大水果之一,據聯合國糧食及農業組織的統計數據顯示,2017年世界葡萄總產量約7 428萬噸,我國葡萄的總產量約1 316萬噸,占世界葡萄總產量的18%(http://www.fao.org/ statistics/zh/)。由葡萄座腔菌屬()真菌引起的葡萄潰瘍病是我國乃至世界葡萄產區的重要病害之一。近年來,該病害在我國多個葡萄產區流行,并且有逐年加重的趨勢,危害嚴重時,產量損失高達80%,甚至絕產[1-2]。世界范圍內,已有超過12個國家報道了葡萄潰瘍病的發生及危害,包括中國、意大利、美國、法國、西班牙及澳大利亞等葡萄產量大國[2]。目前生產上針對該病害并無高效的防控措施,主要采用改善環境條件、葡萄種植管理及殺菌劑相結合的綜合防控措施[2]。因此,探究葡萄潰瘍病菌致病關鍵因子的作用機理,對于全面解析葡萄潰瘍病的發生機理,促進我國葡萄產業的發展,建立都市型現代農業具有重要意義。【前人研究進展】據統計,世界范圍內已報道的造成葡萄潰瘍病的病原菌多達20種[3],其中在國內已鑒定到的葡萄潰瘍病菌有6種,包括可可毛色二孢()[4]、色二孢屬真菌[5]、葡萄座腔菌()[2]、小新殼梭孢()[3]、[6]和[7],其中可可毛色二孢是致病力最強的優勢種。由可可毛色二孢引起的葡萄潰瘍病于1972年首次在埃及報道[8],在國內由筆者研究室的科研人員首次報道[4]。關于葡萄潰瘍病的研究主要集中在病原菌的分離鑒定、生物學特性及癥狀描述[2-15],殺菌劑防治效果、抗性風險評估及作用機理的解析[16-17]、生防菌的作用機制[18]、組學分析[19-21]、病菌外泌毒素的鑒定及致病力分析[22-25]等方面,有關致病基因作用機理的報道較少。糖苷水解酶是一類在真菌中被廣泛研究報道的化合物,這些酶類在工業生物能源的再生、自然界多糖類物質的代謝及病原菌的侵染致病中發揮了不同的作用[26-27]。目前,碳水化合物活性酶(CAZy)數據庫(http://www.cazy.org)含有超330個家族,近340 000個碳水化合物活性酶的序列信息[28],這些水解酶能以纖維素、木質素或幾丁質等不同碳水化合物為底物,發揮活性功能。如嗜熱子囊菌()產生的糖苷水解酶61(GH61)家族蛋白TaGH61A能夠以微晶纖維素為底物,發揮酶解活性[27];里氏木霉()能夠產生2種纖維素水解酶(Cel6A和Cel7A)及至少5種內切葡聚糖酶(Cel5A、Cel7B、Cel12A、Cel45A和Cel61A),并且這些酶可以相互協同作用,水解纖維素[29-30];白曲霉()編碼的GH61家族的內切葡聚糖酶AkCel61及截斷體rAkCel61ΔCBM對海帶多糖及可溶性羧甲基纖維素具有一定的水解能力,但對微晶纖維素、阿拉伯木聚糖和果膠等多糖沒有水解能力[31]。水稻白葉枯病菌(Xanthomonasoryzaepv.oryzae)分泌的木聚糖酶XynB能夠增強病原菌對水稻的致病力[32]。【本研究切入點】盡管碳水化合物活性酶的酶解活性及功能的多樣性在不同真菌中被廣泛報道,但是這些酶類在葡萄潰瘍病菌中的作用機理并不清楚。筆者研究室在前期工作中完成了葡萄潰瘍病菌3個種可可毛色二孢、葡萄座腔菌及小新殼梭孢的全基因組測序、數據拼接及基因功能注釋[21]。在致病力最強的優勢種可可毛色二孢預測的12 902個蛋白編碼基因中,有820個基因的編碼產物為碳水化合物活性酶類,其中198個是可可毛色二孢特有的,但是關于這些碳水化合物活性酶的功能未見報道。以可可毛色二孢中一個碳水化合物活性酶為研究對象,氨基酸序列同源性及系統進化樹分析表明該蛋白酶屬于糖苷水解酶61(GH61)家族,命名為LtGH61A,但是關于該蛋白的外泌特性、生物學功能及其在病原菌侵染寄主不同階段的基因表達模式并不清晰。【擬解決的關鍵問題】采用RNAi及病原菌接種研究LtGH61A對可可毛色二孢致病力的影響;通過酵母互補試驗分析LtGH61A蛋白的信號肽活性;通過實時熒光定量PCR(qRT-PCR)比較在營養菌絲及病原菌侵染各階段的表達量差異。明確LtGH61A蛋白的外泌特性及其在可可毛色二孢致病中的作用,為后續深入解析LtGH61A蛋白的作用機理打下基礎。
1 材料與方法
試驗于2018年11月至2019年6月在北京市農林科學院植物保護環境保護研究所進行。
1.1 材料
供試菌株及植物:可可毛色二孢野生型(WT)菌株CSS-01s由筆者實驗室保存,酵母菌株YTK12由中國農業大學孫文獻老師饋贈,大腸桿菌感受態細胞Trans1-T1購自北京全式金生物技術有限公司。病原菌接種試驗所用葡萄品種為‘夏黑’,順義香逸葡萄園。真菌轉化子置于滅菌的1.5 mL Eppendorf管中,保存于4℃冰箱,質粒載體保存于-20℃冰箱。
供試藥劑及儀器:各種限制性內切酶及T4 DNA連接酶,New England Biolabs公司;高保真聚合酶,北京擎科新業生物技術有限公司;氨芐青霉素、硫酸腺嘌呤,北京索萊寶科技有限公司;葡萄糖,國藥集團化學試劑有限公司;抗霉素A,Abcam公司,英國;聚乙二醇3350及棉子糖,Sigma-aldrich公司,美國;Trizon試劑,Invitrogen,美國;植物RNA快速提取試劑盒,北京艾德萊生物科技有限公司;反轉錄試劑盒,北京全式金生物技術有限公司;2×RealStar Green Fast Mixture with ROX II,北京康潤誠業生物科技有限公司;酵母提取物、蛋白胨、不含氨基酸的酵母氮源、瓊脂,Becton, Dickinson and Company,美國;YeastmakerTMYeast Transformation System 2試劑盒、tryptophan dropout supplement,Clonthch,日本;Applied Biosystems 7500儀器,ABI公司,美國;冷凍高速離心機,HiKOKI,日本。
培養基:60% PEG3350(120 g聚乙二醇3350溶解于ddH2O,定容至120 mL);YPDA培養基(1%酵母提取物、2%蛋白胨、2%葡萄糖、0.003%硫酸腺嘌呤,固體培養基按比例加2%瓊脂);CMD-W(0.67%不含氨基酸的酵母氮源、0.075% tryptophan dropout supplement、2%蔗糖、0.1%葡萄糖和2%瓊脂);YPRAA培養基(1%酵母提取物、2%蛋白胨、2%棉子糖、2 μg·mL-1抗霉素A、2%瓊脂)。
1.2 方法
1.2.1 葡萄枝干的離體接種 選取一年生葡萄感病品種‘夏黑’,在葡萄莖稈上用直徑4 mm的打孔器劃取大小一致的傷口,然后在生長2 d的可可毛色二孢菌落邊緣,用直徑4 mm的打孔器打取直徑一致的菌餅,并將其接種至葡萄傷口處,25℃、光照和黑暗各12 h交替保濕培養。3 d后觀察發病情況,測量統計病斑長度。
1.2.2 葡萄枝干RNA的提取及cDNA的反轉錄 通過離體接種的方法,將可可毛色二孢菌塊接種至葡萄枝干傷口處,然后分別在接種病菌后24、48、72 h,截取葡萄枝干的發病部位,-80℃液氮速凍。采用植物RNA快速提取試劑盒提取RNA,然后反轉錄為cDNA。獲得的cDNA模板用于后續的基因克隆及表達量分析。
1.2.3 可可毛色二孢原生質體的制備 將可可毛色二孢CSS-01s接種至CM固體平板上,生長約24 h;將菌絲轉移至液體CM培養基中,28℃、160 r/min搖培24 h;將搖培好的菌絲置于50 mL離心管中,4 000 r/min離心5 min,收集沉淀的菌絲;稱量菌絲的質量,按照每克菌絲加入2 mL 2%的蝸牛酶及2%崩潰酶的比例,加入適量的裂解酶,28℃、160 r/min酶解4 h;然后用內置4層濾紙的漏斗過濾酶解完的菌絲,并用0.7 mol·L-1的氯化鈉洗脫,4℃、4 000 r/min離心15 min,收集原生質體;收集原生質體沉淀,用5 mL STC溶液懸浮洗滌,4℃、4 000 r/min離心15 min;加入適量的STC溶液,懸浮原生質體,并將其終濃度調整為約1×107個/mL,制備的原生質體用于轉化試驗。
1.2.4 可可毛色二孢原生質體的轉化 將準備好的可可毛色二孢原生質體及RNAi質粒混勻于50 mL離心管中,放置在冰上,10 min;往混合物中滴加2 mL PEG3350溶液,至于冰上15 min;然后加入30 mL STC溶液,上下顛倒混勻,4℃、4 000 r/min離心15 min;離心得到的原生質體沉淀采用LR培養基懸浮,置于28℃培養箱培養;培養約12 h后,轉入培養皿,每皿加入約12 mL 固體LR培養基混勻,待其凝固后,上面鋪一層10 mL的水瓊脂培養基(含1 100 μg·mL-1新霉素);28℃培養2 d左右,將出現的初始轉化體轉至CM培養基(含1 100 μg·mL-1新霉素)上,連續篩選3次,然后將對新霉素抗性穩定的轉化子置于1.5 mL Eppendorf管中,4℃保存。
1.2.5RNAi轉化子的驗證及其在病原菌侵染不同階段表達量的檢測 根據可可毛色二孢和內參基因的cDNA序列,設計qRT-PCR的引物(表1)。20 μL PCR反應體系:1 μL cDNA、0.4 μL終濃度為0.2 μmol·L-1基因特異性引物、10 μL 2×RealStar Green Fast Mixture(with ROX II),補水至總體系為20 μL。PCR反應程序采用兩步法:預變性95℃ 2 min;變性95℃ 15 s,退火延伸60℃ 30 s,40個循環。得到的CT值取平均值,根據2-ΔΔCT值計算不同侵染階段基因的相對表達量。
1.2.6融合載體的構建及酵母轉化 YTK12是一個蔗糖酶外泌缺陷型酵母,該酵母已被廣泛用于分析鑒定分泌蛋白的信號肽[33-34]。通過Signal IP 4.0預測LtGh61A蛋白N端包含一個長度為18個氨基酸的信號肽序列LtGh61ASP,將編碼LtGh61ASP的核酸序列連接至缺失信號肽序列的蔗糖酶編碼基因序列上游,構建融合表達載體。采用YeastmakerTMYeast Transformation System 2試劑盒,將、陽性對照載體及陰性對照載體分別轉入酵母YTK12菌株中,在CMD-W培養基上生長3 d左右,篩選轉化子。將在CMD-W平板上長出的轉化子劃線至YPRAA平板上,通過觀察酵母轉化子在YPRAA平板上的生長狀況,檢測LtGH61A蛋白的信號肽序列是否具有外泌特性。同時,將轉化子劃線至CMD-W及YPDA平板上,用作試驗對照。
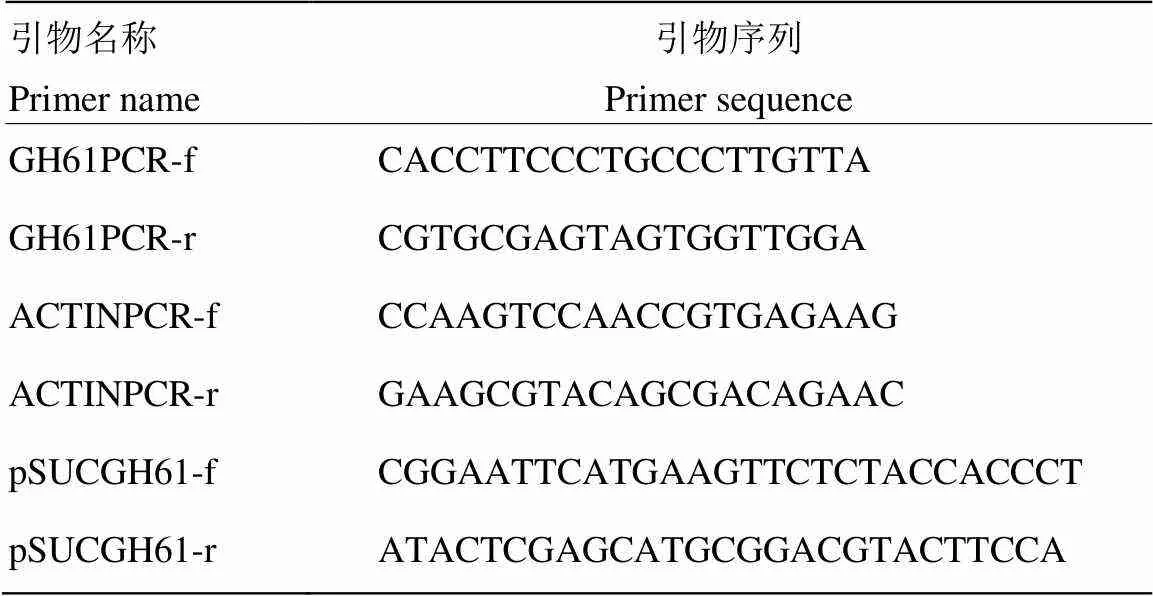
表1 本試驗所用引物
1.3 數據分析
試驗數據利用Excel 2013進行差異顯著性分析,圖片應用Excel 2013及Adobe Photoshop CS5軟件制作。
2 結果
2.1 LtGH61A蛋白信號肽的鑒定
將與陽性對照載體及陰性對照載體分別轉入酵母YTK12菌株后,獲得的轉化子在YPARR培養基上劃線,3 d后的生長結果顯示表達和陽性對照的酵母均能夠在YPARR培養基上生長,這表明LtGH61A蛋白的信號肽和大豆疫霉()外泌蛋白Avr1b的信號肽均能夠引起酵母YTK12蔗糖酶的外泌,進而分解YPRAA培養基中的棉子糖,從而獲得自身生長需要的碳源。與此同時,陰性對照的表達產物不能分泌至胞外,因此不能利用YPRAA培養基中的碳源。此外,酵母轉化子在YPDA及CMD-W培養基上的生長作為對照(圖1)。
2.2 LtGH61A RNAi轉化子的驗證
將測序正確的RNAi載體轉入可可毛色二孢的原生質體,長出的轉化子經3輪連續的抗性篩選后,選擇2株抗性遺傳穩定的轉化子,分別命名為RNAi-LtGh61A1和RNAi-LtGH61A2,用于檢測表達量。qRT-PCR結果顯示,與野生型相比,轉化子RNAi-LtGH61A1和RNAi-LtGH61A2中的表達量顯著降低,說明在這2株轉化子中的表達得到抑制(圖2)。
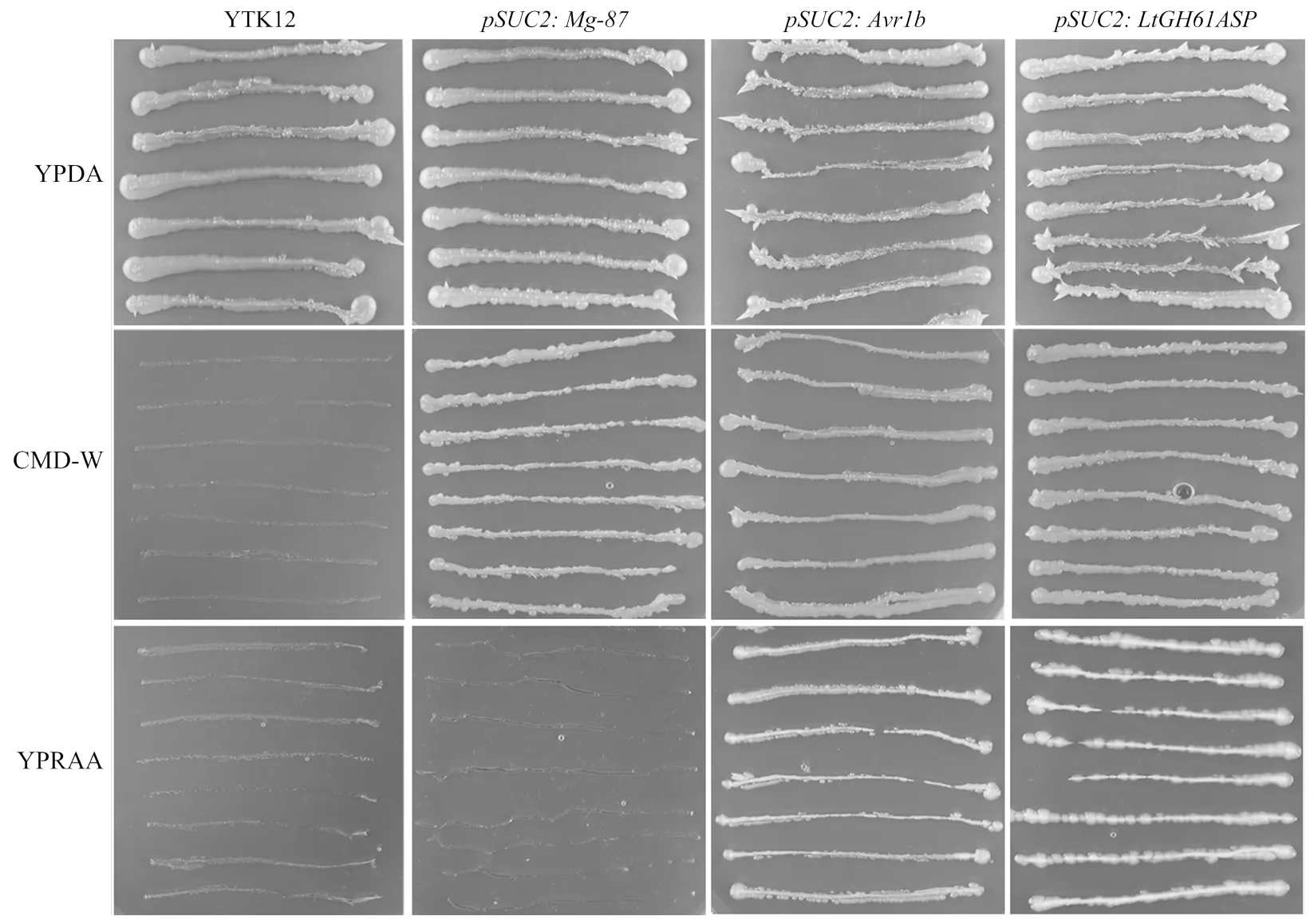
圖1 不同酵母轉化子在不同培養基上的生長情況
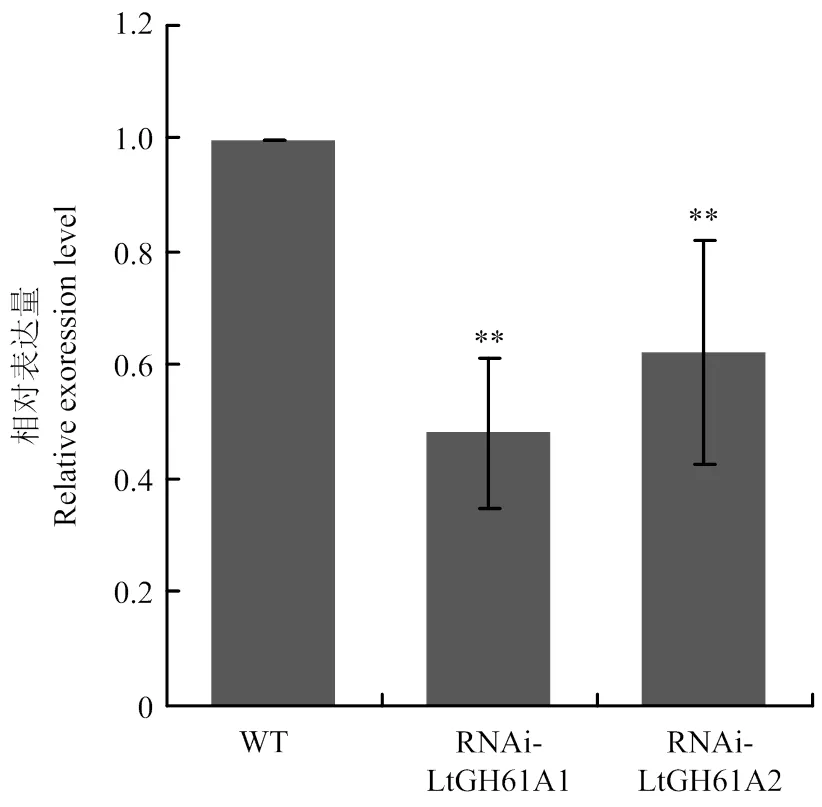
**:P<0.01
2.3 LtGH61A對可可毛色二孢生長及致病力的影響
為了觀察對可可毛色二孢生長速率的影響,將直徑為4 mm的野生型CSS-01s,RNAi轉化子RNAi-LtGH61A1和RNAi-LtGH61A2分別點接至CM培養基平板中央,生長2 d后拍照,比較野生型和RNAi轉化子菌絲生長速率的差異。測量結果表明,與野生型CSS-01s相比,RNAi轉化子RNAi-LtGH61A1和RNAi-LtGH61A2的菌絲生長速率明顯降低,菌落直徑為野生型的85%左右(圖3-A、3-B)。
為了分析對可可毛色二孢菌致病力的影響,將野生型CSS-01s,RNAi轉化子RNAi-LtGH61A1和RNAi-LtGH61A2分別接種葡萄枝干,比較野生型和RNAi轉化子在葡萄枝干上引起的病斑長度差異。結果表明,與野生型CSS-01s相比,RNAi轉化子RNAi-LtGH61A1和RNAi-LtGH61A2侵染葡萄枝干形成病斑的長度顯著變短,約為野生型的55%(圖3-C、3-D),對葡萄枝干的致病力明顯減弱,進一步證實影響可可毛色二孢的致病力。
2.4 LtGH61A在病原菌侵染寄主不同階段的表達量
為了明確在病原菌營養菌絲及侵染過程中的表達模式,通過qRT-PCR檢測在不同階段的表達量。結果表明,與營養菌絲階段相比,在病原菌侵染階段的表達量明顯升高(圖4)。說明LtGH61A作為一個重要的致病因子,在病菌侵染致病階段發揮了更加重要的作用。
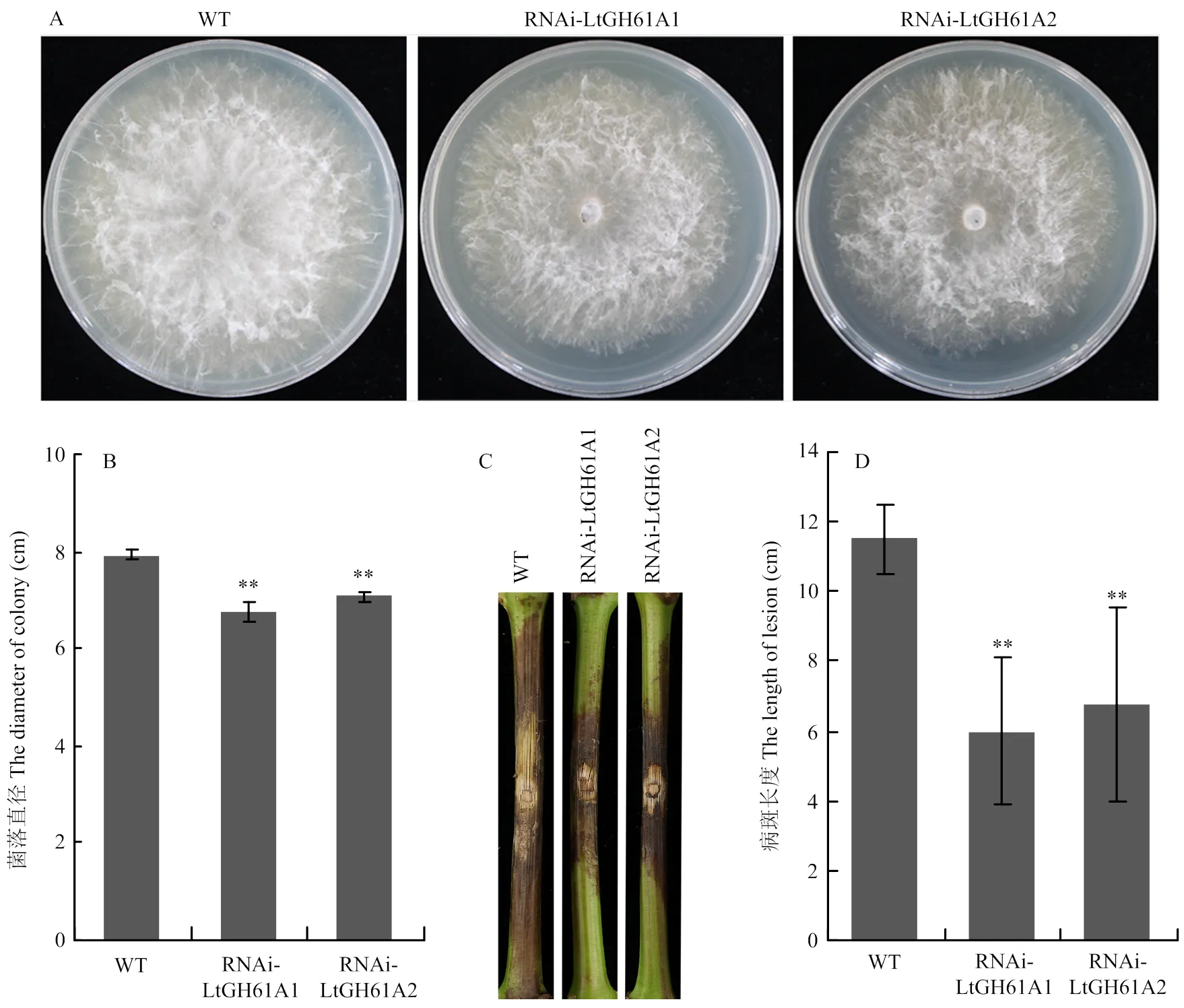
A:菌落形態The colony morphology;B:菌落直徑比較 Statistical analysis of the colony diameter;C:在葡萄枝干上形成的病斑The lesion on grape shoot;D:病斑長度統計Statistical analysis of the lesion length。**:P<0.01
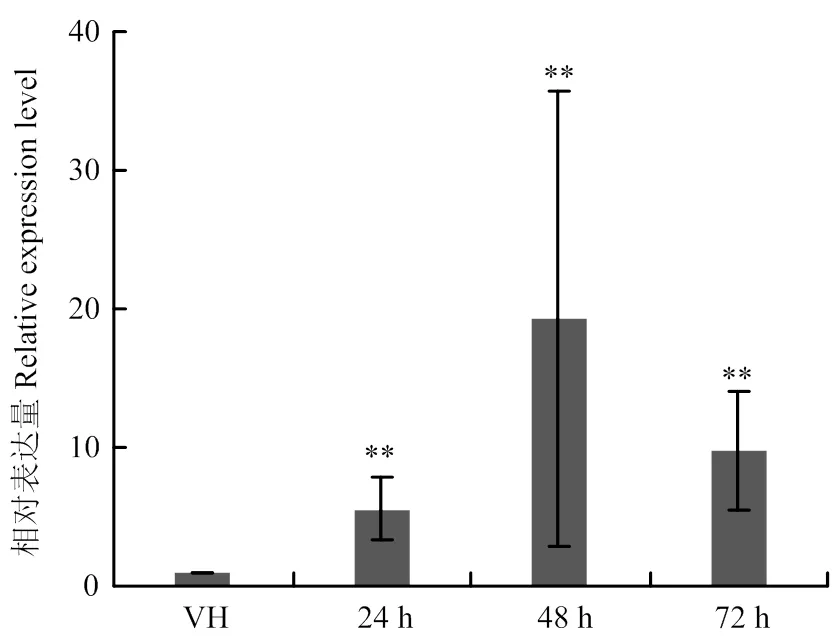
VH:營養菌絲vegetative hyphae;24—72 h:接種后24、48、72 h 24, 48 and 72 h after inoculation。**:P<0.01
3 討論
葡萄潰瘍病菌作為重要的木本植物病原真菌,近年來由于其危害的嚴重性及侵染寄主的廣泛性,該病原菌日漸受到人們的關注,但是目前該病原菌的致病機制并不清晰。筆者研究室先后在國內率先分離鑒定了6個種的葡萄潰瘍病菌,完成了其中3個種可可毛色二孢、葡萄座腔菌及小新殼梭孢的全基因組及轉錄組測序及數據拼接,并分析預測了優勢種可可毛色二孢中近800個碳水化合物活性酶,包括糖苷水解酶GHS、糖基轉移酶GTS、糖水化合物酯酶類CES、碳水化合物結合模塊CBMS和輔助模塊酶類AAS等,其中大量的碳水化合物活性酶編碼基因在病原菌侵染階段上調表達,但是其作用機制仍不清晰[21]。本研究以其中一個碳水化合物活性酶LtGH61A為研究對象,RNAi結合病原菌接種結果表明,的下調表達導致可可毛色二孢的致病力明顯減弱,這與前期超表達該基因能增強可可毛色二孢的致病力這一結果一致[21];此外,的下調表達導致可可毛色二孢的菌絲生長速率減慢(圖3-A、3-B),由此說明LtGH61A是可可毛色二孢菌無性發育及侵染致病的重要影響因子,這為后續深入解析LtGH61A作用的分子機理打下了基礎。
LtGH61A蛋白包括231個氨基酸,經SignalP 4.0預測其N端包含一個長度為18個氨基酸的信號肽,酵母YTK12是一個蔗糖酶外泌缺陷型酵母,該體系已被廣泛應用于稻曲病菌()[34]、葡萄霜霉菌()[35]、條銹病菌()[36]、大豆疫霉[37]等病原菌外泌蛋白信號肽的鑒定。本研究應用該酵母體系,發現LtGH61A蛋白的信號肽同樣能夠引導酵母蔗糖酶的外泌,導致酵母互補轉化子能夠在以棉子糖為碳源的培養基YPRAA上生長,這表明YTK12酵母體系同樣能夠應用于葡萄潰瘍病菌外泌蛋白信號肽的鑒定。
與Pfam數據庫比對顯示,LtGH61A具有一個Glyco_hydro_61結構域,屬于糖苷水解酶61(GH61)家族,能夠以纖維素為底物發揮其酶活功能。關于GH61家族蛋白酶的功能在不同真菌中已有研究報道,如嗜熱子囊菌產生的糖苷水解酶TaGH61A能夠以微晶纖維素為底物,發揮酶解活性[27]。白曲霉編碼的內切葡聚糖酶AkCel61對海帶多糖及可溶性羧甲基纖維素具有一定的水解能力,但是對微晶纖維素、阿拉伯木聚糖和果膠等多糖沒有水解能力[31]。這些結果表明不同真菌中產生的GH61家族的糖苷水解酶可能對纖維素類底物具有一定的水解能力,但是對具體的纖維素種類具有一定的選擇性。遺憾的是,筆者在試圖探究LtGH61A蛋白酶活功能時,未能純化出LtGH61A蛋白,以分析LtGH61A蛋白酶解能力及底物。此外,木本植物組織中含有大量的纖維素類物質,結合LtGH61A推定的酶解活性及在病原菌侵染過程中顯著高表達的特性,推測葡萄潰瘍病菌在侵染致病過程中,LtGH61A蛋白被病原菌分泌至胞外,以寄主植物中的組織成分為酶解底物,發揮其酶活功能,以促進自身更好地侵染寄主植物。但是LtGH61A作為一個致病因子,其對可可毛色二孢侵染致病的影響與其酶解活性是否關聯也需要進一步分析驗證。
4 結論
葡萄潰瘍病菌LtGH61A蛋白屬于糖苷水解酶61家族,具有外泌特性,其N端具有一個信號肽,能夠引導酵母蔗糖酶的外泌。LtGH61A是葡萄潰瘍病菌一個重要的致病影響因子,在病原菌侵染階段表達量升高,并且在侵染后48 h達到高峰。
致謝:中國農業大學孫文獻老師饋贈了酵母菌株YTK12及pSUC2載體,在此表示感謝!
[1] 張瑋, 李興紅, 郭飛飛, 劉梅, 黃金寶, 燕繼曄. 兩種葡萄潰瘍病菌雙重PCR檢測方法的建立與應用. 植物保護學報, 2017, 44(4): 636-642.
Zhang W, Li X H, Guo F F, Liu M, Huang J B, Yan J Y. Establishment and application of duplex PCR assay for grape canker pathogensand., 2017, 44(4): 636-642. (in Chinese)
[2] Yan J Y, Xie Y, Yao S W, Wang Z Y, Li X H. Characterization of, the causal agent of grapevine canker in China., 2012, 41(4): 351-357.
[3] Yan J Y, Xie Y, Zhang W, Wang Y, Liu J K, Hyde K D, Seem R C, Zhang G Z, Wang Z Y, Yao S W, Bai X J, Dissanayake A J, Peng Y L, Li X H. Species of Botryosphaeriaceae involved in grapevine dieback in China., 2013, 61(1): 221-236.
[4] Yan J Y, Li X H, Kong F F, Wang Z Y, Gong L Z, He H P. Occurrence of grapevine trunk disease caused byin China., 2011, 95(2): 219.
[5] Yan J Y, Peng Y L, Xie Y, Li X H, Yao S W, Tang M L, Wang Z Y. First report of grapevine trunk disease caused byin China., 2011, 95(5): 616.
[6] Dissanayake A J, Zhang W, Liu M, Chukeatirote E, Yan J Y, Li X H, Hyde K D.causes pedicel and peduncle discolouration of grapes in China., 2015, 10: 21.
[7] Dissanayake A J, Zhang W, Li X H, Zhou Y, Chethana T, Chukeatirote E, Hyde K D, Yan J Y, Zhang G Z, Zhao W S. First report ofassociated with grapevine dieback in China., 2015, 54(2): 414-419.
[8] Elgoorani M A, Elmeleigi M A. Dieback of grapevine byPat. in Egypt., 1972, 11(3): 210-211.
[9] Phillips A J L.and other fungi associated with excoriose and dieback of grapevines in Portugal., 1998, 146(7): 327-332.
[10] Larignon P, Fulchic R, Cere L, Dubos B. Observation on black dead arm in French vineyards., 2001, 40(Suppl.): S336-S342.
[11] Phillips A J L. Botryosphaeria species associated with diseases of grapevines in Portugal., 2002, 41(1): 3-18.
[12] Taylor A, Hardy G E, Wood P, Burgess T. Identification and pathogenicity ofspecies associated with grapevine decline in Western Australia., 2005, 34(2): 187-195.
[13] Urbez-Torres J R. The status of Botryosphaeriaceae species infecting grapevines., 2011, 50(Suppl.): S5-S45.
[14] Van Niekerk J M, Fourie P H, Halleen F, Crous P W.Botryosphaeria spp. as grapevine trunk pathogens., 2006, 45(Suppl.): S43-S54.
[15] úrbez-Torres J R, Leavitt G M, Guerrero J C, Guevara J, Gubler W D. Identification and pathogenicity ofand, the causal agents of bot canker disease of grapevines in Mexico., 2008, 92(4): 519-529.
[16] Fan K, Wang J, Fu L, Zhang G F, Wu H B, Feng C, Qu J L. Baseline sensitivity and control efficacy of pyraclostrobin againstisolates in China., 2019, 103(7): 1458-1463.
[17] Pan J L, Hao X, Yao H W, Ge k k, MA L, MA W. Matrine inhibits mycelia growth ofby affecting membrane permeability., 2019, 30(3): 1105-1113.
[18] Trotel-Aziz P, Abou-Mansour E, Courteaux B, Rabenoelina F, Clément C, Fontaine F, Aziz A.PTA-271 counteractsdieback in grapevine, triggering immune responses and detoxification of fungal phytotoxins., 2019, 10: 25.
[19] Cobos R, Barreiro C, Mateos R M, Coque J J R. Cytoplasmic- and extracellular-proteome analysis of: a phytopathogenic fungus involved in grapevine decline., 2010, 8: 46.
[20] Paolinelli-Alfonso M, Villalobos-Escobedo J M, Rolshausen P, Herrera-Estrella A, Galindo-Sánchez C, López-Hernández J F, Hernandez-Martinez R.Global transcriptional analysis suggestspathogenicity factors involved in modulation of grapevine defensive response., 2016, 17: 615.
[21] Yan J Y, Zhao W S, Chen Z, Xing Q K, Zhang W, Chethana K W T, Xue M F, Xu J P, Phillips A J L, Wang Y, Liu J H, Liu M, Zhou Y, Jayawardena R S, Manawasinghe I S, Huang J B, Qiao GH, Fu C Y, Guo F F, Dissanayake A J, Peng Y L, Hyde K D, Li X H. Comparative genome and transcriptome analyses reveal adaptations to opportunistic infections in woody plant degrading pathogens of Botryosphaeriaceae., 2018, 25(1): 87-102.
[22] Martos S, Andolfi A, Luque J, Mugnai L, Surico G, Evidente A. Production of phytotoxic metabolites by five species of Botryosphaeriaceae causing decline on grapevines, with special interest in the speciesand., 2008, 121(4): 451-461.
[23] Evidente A, Punzo B, Andolfi A, CIMMINO A, MELCK D, LUQUE J. Lipophilic phytotoxins produced by, a grapevine canker agent., 2010, 49(1): 74-79.
[24] Andolfi A, Mugnai L, Luque J, Surico G, Cimmino A, Evidente A. Phytotoxins produced by fungi associated with grapevine trunk diseases., 2011, 3(12): 1569-1605.
[25] Abou-Mansour E, Débieux J L, Ramírez-Suero M, Bénard-Gellon M, Magnin-Robert M, Spagnolo A, Chong J, Farine S, Bertsch C, L'Haridon F, Serrano M, Fontaine F, Rego C, Larignon P.Phytotoxic metabolites from, a pathogen ofdieback of grapevine., 2015, 115: 207-215.
[26] Vaaje-Kolstad G, Horn S J, Van Aalten D M F, Synstad B, Eijsink V G H. The non-catalytic chitin-binding protein CBP21 fromis essential for chitin degradation., 2005, 280(31): 28492-28497.
[27] Langston J A, Shaghasi T, Abbate E, Xu F, Vlasenko E, Sweeney M D. Oxidoreductive cellulose depolymerization by the enzymes cellobiose dehydrogenase and glycoside hydrolase 61., 2011, 77(19): 7007-7015.
[28] Lombard V, Golaconda Ramulu H, Drula E, Coutinho P M, Henrissat B.The carbohydrate-active enzymes database (CAZy) in 2013., 2014, 42(Database issue): D490-D495.
[29] Karkehabadi S, Hansson H, Kim S, Piens K, Mitchinson C, Sandgren M. The first structure of a glycoside hydrolase family 61 member, Cel61B from, at 1.6 ? resolution., 2008, 383(1): 144-154.
[30] Salinas A, Vega M, Lienqueo M E, Garcia A, Carmona R, Salazar O. Cloning of novel cellulases from cellulolytic fungi: heterologous expression of a family 5 glycoside hydrolase fromin., 2011, 49(6/7): 485-491.
[31] Koseki T, Mese Y, Fushinobu S, Masaki K, Fujii T, Ito K, Shiono Y, Murayama T, Iefuji H. Biochemical characterization of a glycoside hydrolase family 61 endoglucanase from., 2008, 77(6): 1279-1285.
[32] Rajeshwari R, Jha G, Sonti R V. Role of an-expressed xylanase ofpvin promoting virulence on rice., 2005, 18(8): 830-837.
[33] Jacobs K A, Collins-Racie L A, Colbert M, Duckett M, Golden-Fleet M, Kelleher K, Kriz R, LaVallie E R, Merberg D, Spaulding V, Stover J, Williamson M J, McCoy J M. A genetic selection for isolating cDNAs encoding secreted proteins., 1997, 198(1/2): 289-296.
[34] Fang A, Han Y Q, Zhang N, Zhang M, Liu L J, Li S, Lu F, Sun W X. Identification and characterization of plant cell death- inducing secreted proteins from., 2016, 29(5): 405-416.
[35] 孔祥久, 石潔, 孔繁芳, 王忠躍, 張昊. 葡萄霜霉菌候選效應子RXLR5信號肽的鑒定. 植物保護, 2016, 42(1): 40-44.
Kong X J, Shi J, Kong F F, Wang Z Y, Zhang H. Identification of the signal peptide of candidate effector protein RXLR5 from, 2016, 42(1): 40-44. (in Chinese)
[36] Gu B, Kale S D, Wang Q H, Wang D H, Pan Q N, Cao H, Meng Y L, Kang Z S, Tyler B M, Shan W X. Rust secreted protein Ps87 is conserved in diverse fungal pathogens and contains a RXLR-like motif sufficient for translocation into plant cells., 2011, 6(11): e27217.
[37] Dou D, Kale S D, Wang X, Jiang R H, Bruce N A, Arredondo F D, Zhang X, Tyler B M. RXLR-mediated entry ofeffectorinto soybean cells does not require pathogen-encoded machinery., 2008, 20(7): 1930-1947.
pathogenicity and gene expression pattern of the exocrine protein LtGH61A of grape canker fungus
Peng JunBo, Li XingHong, Zhang Wei, Zhou Ying,HUANG JinBao, Yan JiYe
(Institute of Plant and Environment Protection, Beijing Academy of Agriculture and Forestry Sciences/Beijing Key Laboratory of Environmental Friendly Management of Diseases and Pests of North China Fruits, Beijing 100097)
【Objective】Grape canker disease, caused bygenus fungi, occurs in a wide range of grape-producing areas in China and seriously threatens the yield and quality of grape. The objective of this study is to analyze the function of a hypothetical exocrine protein, LtGH61A, in grape canker fungus, and to lay a foundation for in-depth analysis of the pathogenic mechanism and disease control of grape canker fungus.【Method】The signal peptide of LtGH61A protein was predicted by SignalP 4.0. The function of LtGH61A protein was predicted by the homologous comparison and functional annotation. The exocrine characteristic of LtGH61A protein was analyzed by yeast complementary experiment. The quantitative real-time PCR (qRT-PCR) was used to analyze the expression ofin vegetative hyphae and different infection processes. The expression ofwas inhibited through RNA interference (RNAi). The effect of LtGH61A protein on the pathogenicity ofwas analyzed byinoculation test of grape shoots. The effect of LtGH61A protein on the hyphal growth rate ofwas analyzed by comparing the colony diameter.【Result】Amino acid sequence analysis predicts that the N-terminal of the LtGH61A protein contains a signal peptide with a length of 18 amino acids. The gene function annotation suggests that LtGH61A belongs to glycoside hydrolase family 61 (GH61) and can degrade cellulose as a substrate. Yeast complementary experiments showed that the signal peptide of LtGH61A protein could guide the secretion of invertase of yeast YTK12. Compared with the vegetative hyphae, the expression ofwas increased significantly at the infectious stages, and the mRNA accumulation ofat 48 h post inoculation was 19 times of that in the vegetative hyphae. Moreover, RNAi lines were constructed forand two lines RNAi-LtGH61A1 and RNAi-LtGH61A2 were confirmed by qRT-PCR. The results ofinoculation test of wild-type and RNAi transformants on wounded grape shoots showed that the lesion length caused by both RNAi-LtGH61A1 and RNAi-LtGH61A2 was significantly shorter than that of wild type (WT) CSS-01s, which was about 55% of WT, indicating that LtGH61A affected the pathogenicity of. The colony diameter comparison showed that compared with WT, the colony diameter of RNAi-LtGH61A1 and RNAi-LtGH61A2 transformants became smaller, about 85% of WT, indicating that LtGH61A affected the hyphal growth rate of.【Conclusion】LtGH61A affects the pathogenicity and hyphal growth of grape canker pathogen. LtGH61A protein can be secreted outside the cell. The expression level ofduring infectious stages is significantly increased, suggesting that LtGH61A can destroy the host plant tissue by exerting its own enzyme activity function, thus promoting pathogen infection.
grape canker fungus; exocrine protein; pathogenicity; expression pattern; qRT-PCR; RNA interference (RNAi)
2019-06-24;
2019-07-18
北京市青年拔尖個人項目(2016000021223ZK29)、北京市農林科學院院儲備項目(KJCX20170412)
彭軍波,E-mail:pjb169961@163.com。通信作者燕繼曄,E-mail:jiyeyan@vip.163.com
(責任編輯 岳梅)

