柴芩承氣湯通過(guò)抑制TLR4/NF-κB p65通路減輕小鼠重癥急性胰腺炎并發(fā)肝損傷
黨 琳,宋 亮,張曉芹,許小凡,張 紅,
(陜西中醫(yī)藥大學(xué) 1. 基礎(chǔ)醫(yī)學(xué)院、2. 醫(yī)學(xué)科研實(shí)驗(yàn)中心,陜西 咸陽(yáng) 712046)
重癥急性胰腺炎(severe acute pancreatitis,SAP)往往伴有多器官損傷[1-2],其中,肝損傷是SAP病情發(fā)展過(guò)程中較早出現(xiàn)的胰外損傷之一,其損傷程度直接影響SAP的病情進(jìn)展和預(yù)后,是患者并發(fā)多器官功能障礙后死亡的主要原因[2]。柴芩承氣湯(chaiqinchengqi decoction,CQCQD)可視為大柴胡湯與大承氣湯的合方或衍生方,是近年來(lái)臨床治療急性胰腺炎的有效方藥之一[3]。課題組前期實(shí)驗(yàn)觀察到CQCQD對(duì)于大鼠SAP并發(fā)的肝損傷同樣具有明顯的保護(hù)作用,這可能與抑制肝組織氧化應(yīng)激,減少單核巨噬細(xì)胞活化,降低白細(xì)胞介素6(interleukin 6,IL-6)和單核細(xì)胞趨化蛋白1等炎性因子的表達(dá)有關(guān)[4]。然而,柴芩承氣湯抑制肝內(nèi)炎性因子表達(dá)的分子通路尚不明確。已有研究表明,SAP發(fā)生后,肝臟內(nèi)Toll樣受體4(Toll-like receptor 4,TLR4)能夠特異性識(shí)別細(xì)胞外抗原識(shí)別信號(hào),并將刺激信號(hào)轉(zhuǎn)導(dǎo)入細(xì)胞內(nèi),活化核因子κB(nuclear factor κB,NF-κB)。作為調(diào)控多種細(xì)胞因子產(chǎn)生的重要轉(zhuǎn)錄因子,NF-κB可介導(dǎo)多種炎性因子的合成和釋放,進(jìn)而參與SAP病程中肝功能障礙的形成[5-6]。
為了明確CQCQD在不同動(dòng)物種屬中的治療效果,以及CQCQD是否通過(guò)抑制TLR4/NF-κB通路活化來(lái)發(fā)揮其肝內(nèi)抗炎作用,本實(shí)驗(yàn)通過(guò)給予SAP小鼠CQCQD灌胃治療,觀察其對(duì)SAP并發(fā)肝損傷的保護(hù)作用,以及對(duì)TLR4/NF-κB p65通路活性的影響,進(jìn)一步探討CQCQD治療SAP肝損傷的作用機(jī)制。
1 材料
1.1 藥物CQCQD(購(gòu)自陜西中醫(yī)藥大學(xué)附屬醫(yī)院):柴胡10 g、黃芩10 g、丹參10 g、川芎10 g、梔子10 g、枳實(shí)10 g、厚樸10 g、生大黃15 g(后下)、芒硝10 g(烊化),生藥量共95 g,前7味藥加水400 mL浸泡1 h,煎沸后文火繼續(xù)煎煮20 min,再加入生大黃煎5 min,然后加水300 mL煎煮第2次,最后將湯液濃縮至95 mL,加入芒硝烊化,形成CQCQD濃縮液(生藥量濃度為1 kg·L-1),分裝后置4 ℃保存?zhèn)溆肹4]。
1.2 試劑L-精氨酸(L-Arg,Sigma);血清淀粉酶、脂肪酶、丙氨酸氨基轉(zhuǎn)移酶(ALT)、天冬氨酸氨基轉(zhuǎn)移酶(AST)檢測(cè)試劑盒,均購(gòu)自南京建成生物;IL-6 ELISA試劑盒(上海橋杜生物);血清內(nèi)毒素檢測(cè)試劑盒(GenScript);抗TLR4抗體(博奧森);抗IL-6抗體(Santa Cruz);抗p-NF-κB p65抗體(Cell Signaling);抗GAPDH抗體(博士德);RNA提取試劑盒、反轉(zhuǎn)錄試劑盒、實(shí)時(shí)定量PCR試劑盒(TaKaRa)。
1.3 儀器正置數(shù)碼顯微鏡(德國(guó)Zeiss A1);酶標(biāo)儀(美國(guó)Bio-Tek ELX808IU);蛋白質(zhì)電泳及轉(zhuǎn)膜系統(tǒng)(美國(guó)Bio-Rad);PCR儀(美國(guó)ABI 7500)。
2 方法
2.1 實(shí)驗(yàn)動(dòng)物分組與造模36只昆明小鼠,6~8周齡,體質(zhì)量(25~30) g,購(gòu)自空軍軍醫(yī)大學(xué)動(dòng)物實(shí)驗(yàn)中心,許可證書(shū)0001249。小鼠在室溫(20~24) ℃環(huán)境飼養(yǎng),造模前12 h禁食,不禁水,隨機(jī)分為3組:對(duì)照組(Control)、重癥急性胰腺炎模型組(SAP)和CQCQD治療組(SAP+CQCQD),每組12只。模型組和治療組小鼠給予20% L-Arg(3.3 g·kg-1,2次,間隔1 h)腹腔注射,建立SAP模型[7]。20% L-Arg第2次注射后30 min,治療組小鼠給予柴芩承氣湯濃縮液灌胃(19 g·kg-1·d-1,按成人體質(zhì)量60 kg計(jì)算,等效劑量為成人用量的12.33倍)[8],每日分2次給藥,連續(xù)給藥3 d。模型組小鼠給予同等劑量生理鹽水灌胃。
2.2 取材與檢測(cè)指標(biāo)第1次L-Arg腹腔注射后72 h麻醉小鼠,下腔靜脈取全血,分離血清。取胰腺(稱重)及肝臟組織,部分組織固定于中性甲醛溶液,用于組織病理學(xué)檢測(cè)。部分組織低溫保存于-80 ℃冰箱,用于Western blot及PCR檢測(cè)。
2.2.1胰腺濕重比 胰腺濕重比=胰腺重量(g)/體質(zhì)量(g)。
2.2.2組織病理學(xué)檢測(cè) 取胰腺及肝臟組織,常規(guī)石蠟切片(2 μm),HE染色后觀察組織病理學(xué)改變。
2.2.3生物化學(xué)指標(biāo)檢測(cè) 檢測(cè)血清淀粉酶、脂肪酶、ALT、AST活性,以及血清IL-6水平、血清內(nèi)毒素含量,均按照試劑盒說(shuō)明書(shū)進(jìn)行操作。
2.2.4免疫組化檢測(cè)肝臟組織TLR4、p-NF-κB p65表達(dá)變化 取肝臟組織,常規(guī)石蠟切片。脫蠟,再水,檸檬酸緩沖液高溫抗原修復(fù)15 min,3% H2O2室溫孵育15 min(避光),5%血清室溫封閉1 h,分別加入抗TLR4抗體(1 ∶500)、抗p-NF-κB p65抗體(1 ∶200)4 ℃過(guò)夜,二抗室溫孵育1 h,SABC室溫反應(yīng)30 min,DAB顯色,蘇木精復(fù)染,脫水、透明后封片。
2.2.5Western blot檢測(cè)肝臟組織TLR4、p-NF-κB p65表達(dá)變化 提取肝臟組織總蛋白。SDS-PAGE電泳分離蛋白,轉(zhuǎn)膜,5%牛奶或BSA室溫封閉1 h,分別加入抗TLR4、p-NF-κB p65、NF-κB p65抗體(1 ∶1 000),以及抗GAPDH抗體(1 ∶500),4 ℃過(guò)夜,二抗室溫孵育1 h,ECL化學(xué)發(fā)光法顯影。
2.2.6實(shí)時(shí)熒光定量PCR檢測(cè)肝組織IL-6、腫瘤壞死因子α(tumor necrosis factor α, TNF-α)、巨噬細(xì)胞炎性蛋白1α(macrophage inflammatory protein 1α, MIP-1α)mRNA表達(dá)變化 提取肝臟組織總RNA,反轉(zhuǎn)錄成cDNA,以cDNA為模板進(jìn)行擴(kuò)增,檢測(cè)mRNA表達(dá)量(cyclophilin為內(nèi)參基因)。引物序列如下:IL-6 正義鏈5′-GAAGTAGGGAAGGCCGTGG-3′,反義鏈5′-CTCTGCAAGAGACTTCCATCCAGT-3′。TNF-α正義鏈5′-CATCTTCTCAAAATTCGAGTGACAA-3′,反義鏈5′-TGGGAGTAGACAAGGTACAACCC-3′。MIP-1α正義鏈5′-TGCCCTTGCTGTTCTTCTCT-3′,反義鏈5′-TTCTTGGACCCAGGTCTCTTT-3′。cyclophilin 正義鏈5′-ATGGTCAACCCCACCGTG-3′,反義鏈5′-TTCTGCTGTCTTTGGAACTTTGTC-3′。
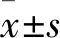
3 結(jié)果
3.1 胰腺濕重比改變與Control組比較,SAP組小鼠的胰腺濕重比明顯升高,CQCQD治療能夠降低SAP小鼠的胰腺濕重比,變化程度約25%。提示SAP炎癥早期胰腺水腫明顯,CQCQD干預(yù)降低了SAP小鼠的胰腺水腫程度。見(jiàn)Fig 1。

Fig 1 Relative pancreatic weight of mice during SAP decreased by CQCQD treatment n=12)
3.2 胰腺、肝臟組織病理學(xué)改變?nèi)鏔ig 2所示,Control組小鼠胰腺細(xì)胞結(jié)構(gòu)清晰,未見(jiàn)炎性細(xì)胞浸潤(rùn)。SAP組小鼠胰腺組織明顯水腫,細(xì)胞結(jié)構(gòu)模糊不清,可見(jiàn)大片凝固性壞死,間質(zhì)內(nèi)有大量炎性細(xì)胞浸潤(rùn)及出血。CQCQD治療后,胰腺組織水腫程度減輕,片狀壞死區(qū)域減少。腺泡細(xì)胞輕度腫脹,仍可見(jiàn)不完整的腺泡結(jié)構(gòu),中性及巨噬細(xì)胞細(xì)胞浸潤(rùn)減少。Control組小鼠肝小葉結(jié)構(gòu)清晰,肝細(xì)胞形態(tài)大小一致。無(wú)胞質(zhì)空泡形成,無(wú)出血、壞死及炎性細(xì)胞浸潤(rùn)。SAP組小鼠出現(xiàn)肝細(xì)胞水腫,邊界模糊,胞質(zhì)空泡形成及炎性細(xì)胞浸潤(rùn),且部分肝細(xì)胞壞死,肝臟毛細(xì)血管明顯充血。給予CQCQD之后,肝組織水腫、壞死及炎性細(xì)胞浸潤(rùn)較SAP組小鼠均有不同程度的減輕。
3.3 血清淀粉酶、脂肪酶、ALT、AST含量改變Tab 1結(jié)果顯示,與Control組比較,無(wú)論是反映胰腺功能的血清淀粉酶和脂肪酶含量,還是反映肝臟功能的血清ALT和AST含量,在SAP組小鼠中均出現(xiàn)明顯升高,提示L-Arg注射誘發(fā)小鼠胰腺及肝臟功能受損,而CQCQD干預(yù)則能夠不同程度地降低上述血清生化指標(biāo)在SAP小鼠中的活性。
3.4 血清內(nèi)毒素含量改變SAP組小鼠血清內(nèi)毒素含量較Control組小鼠明顯增加,CQCQD干預(yù)則能夠減少SAP小鼠血清內(nèi)毒素含量(Fig 3)。

Fig 2 Pancreatic and liver injury of mice during SAP alleviated by CQCQD treatment (HE×100)

Fig 3 Endotoxin in serum of mice during SAP reduced by CQCQD treatment n=12)
3.5 肝組織TLR4表達(dá)改變免疫組化顯示,Control組小鼠肝組織內(nèi)TLR4無(wú)表達(dá),誘發(fā)SAP后,肝組織內(nèi)TLR4的表達(dá)明顯增強(qiáng),其主要分布于受損的肝組織區(qū)域,肝細(xì)胞和炎癥細(xì)胞均可見(jiàn)TLR4表達(dá)。CQCQD干預(yù)則可降低肝組織內(nèi)TLR4的表達(dá),鏡下僅可見(jiàn)少數(shù)陽(yáng)性染色的細(xì)胞。Western blot結(jié)果顯示,類似于免疫組化的TLR4表達(dá)變化(Fig 4)。
3.6 肝組織p-NF-κB p65表達(dá)改變Fig 5的免疫組化顯示,Control組小鼠肝組織內(nèi)未見(jiàn)p-NF-κB p65陽(yáng)性細(xì)胞,SAP組小鼠肝組織內(nèi)p-NF-κB p65表達(dá)則明顯增加,陽(yáng)染細(xì)胞數(shù)明顯增多,且胞核與胞質(zhì)內(nèi)均可見(jiàn)其表達(dá)。CQCQD干預(yù)能夠明顯減少肝組織內(nèi)p-NF-κB p65陽(yáng)性細(xì)胞數(shù)。Western blot結(jié)果顯示類似的p-NF-κB p65表達(dá)變化。
3.7 血清IL-6含量和肝組織IL-6、TNF-α、MIP-1α mRNA表達(dá)改變與Control組比較,SAP組炎性因子表達(dá)明顯增加,表現(xiàn)為血清IL-6含量,肝組織內(nèi)IL-6、TNF-α、MIP-1α mRNA水平均明顯升高。CQCQD干預(yù)則能夠降低血清IL-6,以及肝組織內(nèi)IL-6、TNF-α、MIP-1α mRNA水平(Fig 6)。
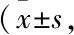
Tab 1 Enzymes in serum of mice during SAP decreased by CQCQD treatment n=12)

Fig 4 Expression of TLR4 in liver of mice with SAP inhibited by CQCQD treatment n=3)
4 討論
中醫(yī)將急性胰腺炎納入“胰癉”“脾心痛”“腹痛”“結(jié)胸”等范疇,認(rèn)為該病乃氣機(jī)郁滯、中焦宣泄不利、腑氣不通所致。根據(jù)“六腑以通為用”的中醫(yī)理論,采用通里攻下治療急性胰腺炎已取得共識(shí)。柴芩承氣湯是通里攻下法代表方藥之一[3],方中柴胡疏肝解郁退熱、黃芩清熱燥濕解毒、枳實(shí)破氣消積散痞、厚樸燥濕下氣除滿、大黃瀉下攻積、涼血解毒,芒硝潤(rùn)燥軟堅(jiān)、瀉下通便。諸藥同用具有清熱解毒、活血化瘀、通里攻下的功效。臨床實(shí)驗(yàn)表明[9],早期應(yīng)用CQCQD能夠減輕急性胰腺炎病人的臨床癥狀,降低器官損傷程度,縮短入院治療時(shí)間。動(dòng)物實(shí)驗(yàn)也發(fā)現(xiàn),CQCQD不僅能夠減輕SAP發(fā)生時(shí)胰腺的損傷,而且對(duì)并發(fā)的肺臟[10]及肝臟[4]損傷也具有不同程度的保護(hù)作用。

Fig 5 Expression of p-NF-κB p65 in liver of mice with SAP inhibited by CQCQD treatment n=3)
課題組前期采用逆行膽管注射去氧膽酸鈉復(fù)制大鼠SAP模型,發(fā)現(xiàn)CQCQD干預(yù)可以緩解SAP并發(fā)的肝損傷,其機(jī)制與抑制肝組織內(nèi)氧化應(yīng)激,降低肝組織炎性因子的水平有關(guān)[4]。為了排除造模方法和動(dòng)物種屬的依賴效應(yīng),本實(shí)驗(yàn)選用L-Arg腹腔注射誘發(fā)小鼠的SAP模型,該方法操作簡(jiǎn)單,L-Arg的用量與SAP的胰腺損傷呈正相關(guān),易于控制SAP的病變程度,模型穩(wěn)定[11]。此外,去氧膽酸鈉造模法所致模型動(dòng)物12 h死亡率較高,多選擇在造模后4 h或者8 h處死動(dòng)物,由于造模時(shí)間短、僅能給予1~2次CQCQD治療。相比之下,L-Arg造模法在72 h處死動(dòng)物,允許持續(xù)進(jìn)行CQCQD的干預(yù),更有利于觀察中藥湯劑的治療效果。

Fig 6 Cytokines and chemokines of mice during SAP reduced
本研究結(jié)果顯示:模型組小鼠血清淀粉酶、脂肪酶、ALT和AST水平明顯升高,胰腺與肝臟均出現(xiàn)不同程度的損傷。進(jìn)一步檢測(cè)炎性因子水平,發(fā)現(xiàn)小鼠血清內(nèi)IL-6明顯升高,肝組織內(nèi)IL-6、TNF-α、MIP-1α mRNA的水平也明顯高于對(duì)照組。柴芩承氣湯干預(yù)后,小鼠胰腺和肝組織損傷明顯緩解,表現(xiàn)為肝組織淤血水腫及肝細(xì)胞壞死程度的減輕,血清ALT、AST水平的降低,以及肝臟內(nèi)炎性因子表達(dá)的減少。
我們的研究還發(fā)現(xiàn),模型組小鼠血清內(nèi)毒素含量明顯升高。已有研究認(rèn)為[5],SAP時(shí)易并發(fā)腸道功能紊亂、導(dǎo)致腸腔細(xì)菌增殖、腸黏膜屏障功能障礙、腸道細(xì)菌和內(nèi)毒素易位、經(jīng)腸腔吸收入血。作為腸道回流的首個(gè)臟器,肝臟遭受大量?jī)?nèi)毒素侵襲,將直接刺激肝組織中TLR4的表達(dá)。作為一種模式識(shí)別受體,TLR4廣泛分布于包括肝細(xì)胞在內(nèi)的多種細(xì)胞,是革蘭陰性菌脂多糖胞內(nèi)信號(hào)轉(zhuǎn)導(dǎo)的主要受體,二者結(jié)合后,可活化細(xì)胞內(nèi)NF-κB信號(hào)通路,進(jìn)而誘導(dǎo)包括TNF-α、IL-6等炎性因子的合成和釋放,引起組織的炎癥反應(yīng)[12]。已有研究發(fā)現(xiàn)[13],SAP發(fā)生時(shí),肝組織內(nèi)TLR4蛋白表達(dá)明顯上調(diào),NF-κB活性增加,且與肝損傷程度呈正相關(guān);抑制TLR4的表達(dá)則能夠減輕SAP動(dòng)物的胰腺和肝組織損傷,提高生存率。因此,TLR4/NF-κB通路的活化已經(jīng)被認(rèn)為是調(diào)控SAP并發(fā)肝功能障礙的一個(gè)重要環(huán)節(jié)[14]。本研究發(fā)現(xiàn),SAP組小鼠肝組織內(nèi)TLR4蛋白表達(dá)明顯上調(diào),其主要分布于受損的肝組織區(qū)域,而且肝細(xì)胞和炎癥細(xì)胞均可見(jiàn)TLR4表達(dá)。此外,p-NF-κB p65在SAP組小鼠肝組織中的表達(dá)明顯升高,而非磷酸化NF-κB p65的表達(dá)無(wú)明顯改變,說(shuō)明NF-κB通路被激活。CQCQD干預(yù)后可見(jiàn)血清內(nèi)毒素含量降低,肝臟內(nèi)TLR4表達(dá)明顯下降,NF-κB的活化程度受到抑制,肝臟內(nèi)炎性因子IL-6、TNF-α、MIP-1α水平也明顯下調(diào)。已有的臨床實(shí)驗(yàn)顯示,CQCQD可促進(jìn)腸蠕動(dòng)以改善腸道運(yùn)動(dòng)功能,因此認(rèn)為CQCQD可能通過(guò)排除胃腸積滯,減輕腸道內(nèi)毒素易位[15],抑制TLR4/NF-κB通路活化及其下游炎癥因子的釋放,進(jìn)而發(fā)揮防治SAP并發(fā)肝損傷的作用。

