定癇丸對風痰閉阻型耐藥性癲癇患者血清炎癥因子-鐵代謝途徑的影響
陳延,郭珍立*,陳云,張雪意
(1.湖北省中西醫結合醫院神經內科,湖北 武漢 430015;2.湖北中醫藥大學,湖北 武漢 430065)
癲癇是一種由多種病因引起的慢性腦部疾病,其特征在于腦神經元過度放電引起的反復性、發作性和短暫性的中樞神經系統功能失常[1]。據WHO統計,全球約有5 000萬癲癇患者[2]。盡管有許多的抗癲癇藥物治療,仍有30%的癲癇患者控制欠佳,稱為耐藥性癲癇(Drug-resistant Epilepsy,DRE)[1]。因此,開辟新的治療途徑或藥物是目前耐藥性癲癇亟待解決的問題。
最新研究發現,免疫炎癥在中樞神經系統的自我平衡調節及癲癇發作進程中起到重要作用[3-4]。癲癇發作自身可產生免疫炎癥應答,產生的炎癥因子可導致皮層細胞興奮性增高、細胞損傷、突觸重塑,從而影響癲癇發作[5]。此外,慢性炎性刺激可導致十二指腸鐵吸收減少,并且鐵被巨噬細胞轉移儲存,導致巨噬細胞內含鐵血黃素沉積,從而降低鐵生物利用度,減少活性氧自由基[6]。炎癥因子TNF-α、IL-1β、IL-6、IL-10可促進鐵蛋白的轉錄和翻譯及細胞內鐵儲存,鐵蛋白表達上調,刺激巨噬細胞對鐵的攝入,減少轉鐵蛋白、血清鐵蛋白,導致細胞合成中鐵利用障礙[7]。因此,炎癥反應因子-鐵代謝-癲癇具有內在聯系。
定癇丸源于明代王肯堂的《醫學心悟》,具有熄風滌痰、清心開竅的作用,是臨床治療癲癇的常用方劑,但對于其作用機制尚不清楚[8]。本研究從耐藥性癲癇血液中慢性炎癥指標(炎癥因子及鐵代謝)的變化入手,為揭示耐藥性癲癇的發病機制及中醫藥干預途徑提供理論依據。
1 資料與方法
1.1 一般資料
收集2016年8月1日—2019年4月30日湖北省中西醫結合醫院神經內科難治性癲癇患者中64例,隨機分為兩組,觀察組32例,男12例,女20例;年齡30~84歲,平均(58.2±25.6)歲;病程5~12年,平均(8.4±3.2)年,其中部分發作19例,全面性發作13例。對照組32例,男16例,女16例;年齡24~80歲,平均(60.0±26.9)歲;病程5~13年,平均(8.8±3.9)年,其中部分發作20例,全面性發作12例。一般資料比較差異無統計學意義,具有可比性(P>0.05)。本研究經湖北省中西醫結合醫院倫理委員會批準,倫理編號:(2016)倫審[科]第(003)號。
1.2 診斷標準
耐藥性癲癇定義根據國際抗癲癇聯盟(ILAE)標準[9],耐藥性癲癇定義:兩種或以上抗癲癇藥物治療方案失敗(不論是單藥治療還是多種藥物的組合,并且每種方案都是患者能夠耐受的,根據患者發作情況正確的選擇合適的治療方案)。中醫風痰閉阻癥癲癇診斷標準[10],主癥:猝然撲倒、強痙拘攣;次癥:喉中痰鳴、口吐白沫;舌脈象:舌質淡紅,舌苔白膩,脈滑細。
1.3 納入標準
①符合耐藥性癲癇的中西醫診斷標準;②年齡≥18歲;③72 h無癲癇發作;④排除糖尿病、自身免疫性疾病、感染等明確與炎癥因子相關的疾病;⑤患者或家屬的知情同意。
1.4 排除標準
凡有下述標準之一者,即予排除。①不符合上述診斷標準和納入標準者;②合并有心血管、肝、腎和造血系統等嚴重原發性疾病;③妊娠期或哺乳期婦女。
1.5 病例的剔除、脫落和中止試驗標準
①入選后發現不符合診斷標準者;②癥狀惡化,必須采取緊急措施者;③出現嚴重的藥物副作用或不良反應;④不能堅持治療者、自動提出退出試驗者或失訪者;⑤加用其他同類中藥或中成藥者。
1.6 治療方法
對入組的耐藥性癲癇患者隨機分為兩組,對照組采用丙戊酸鈉緩釋片(賽諾菲安萬特,國藥準字H20010595,前期調整至口服維持量每次200~400 mg,每日1~2次)聯合拉莫三嗪(葛蘭素史克,國藥準字H20110023,前期調整至口服維持量每次100~200 mg,每日1~2次)治療,試驗組在對照組抗癲癇藥物基礎上,同時口服定癇丸(由我院中藥配方室提供)。中藥定癇丸組成:川貝母6 g,炒僵蠶3 g,陳皮4 g,膽南星3 g,丹參12 g,燈芯草3 g,茯苓6 g,茯神6 g,天麻6 g,琥珀6 g,姜半夏6 g,全蝎3 g,石菖蒲3 g,生姜9 g,麥冬12 g,生曬參3 g,甘草3 g,朱砂2 g。制法:將燈芯草、甘草兩味加水煎煮2次,合并煎出液,濃縮至密度1.2 g/mL,煎煮濃縮液備用;其余十六味藥進行干燥后粉碎成細粉后備用;用濃縮液進行泛丸;干燥后每丸重約0.1 g。用法:每日2次,一次6 g(約1瓶蓋)。
1.7 觀察指標
1.7.1 療效標準
以癲癇患者入組前3個月平均發作次數為基線,統計治療后3個月、6個月癲癇平均發作次數進行比較,治療效果以發作頻率減少率統計:治療前后月發作頻率之差與治療前月發作頻率的百分比。①控制:觀察期內未發作;②顯效:發作頻率減少75%以上;③有效:發作頻率減少50%~75%;④無效:發作頻率、程度、發作癥狀、腦電圖均無好轉或惡化[11]。總有效率為無發作、顯效、有效之和的百分比。
1.7.2 炎癥因子及鐵代謝指標檢測
每人晨起空腹按要求共抽血三管:用肝素鈉抗凝真空管分別抽血9 mL,另一個立即離心機3 000 rpm離心10 min,血漿迅速保存于-80℃,使用Elisa方法測定IL-1β、IL-6、TNF-α、IL-10的濃度;用肝素抗凝和促凝真空管分別抽血9 mL,在抽血后2 h內測定血清鐵、總鐵結合力、鐵蛋白。試劑盒購于上海英駿生物技術有限公司,根據說明書進行測定。
1.8 統計學方法
2 結果
2.1 癲癇發作頻次和持續時間比較
治療前兩組癲癇發作頻次和持續時間比較,無明顯差異(P均>0.05);觀察組經西藥聯合中藥治療后3個月、6個月與治療前3個月相比,癲癇發作頻次明顯減少(P<0.05),持續時間亦明顯縮短(P<0.05),治療后6個月與治療后3個月相比,癲癇發作頻次進一步減少(P<0.05),持續時間亦進一步縮短(P<0.05);對照組單純調整西藥治療3個月后可部分減少癲癇發作頻次及縮短發作持續時間,但與治療前比較無明顯差異(P均>0.05),而在治療后6個月與治療前3個月相比,癲癇發作頻次出現明顯減少(P<0.05),持續時間明顯縮短(P<0.05)。見表1。
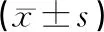
表1 治療前后癲癇發作頻次和持續時間比較
注:與同組治療前3個月比較,*P<0.05;與對照組相同治療時間比較,ΔP<0.05;與同組治療后3個月比較,#P<0.05
2.2 臨床療效比較
治療后3個月,觀察組經中西醫結合治療,總有效率為34.3%,而對照組西藥治療后3個月總有效率為15.6%,觀察組與對照組比較具有顯著差異(P<0.05);治療后6個月,觀察組總有效率為53.1%,對照組總有效率為25.0%,兩組具有顯著差異(P<0.05)。見表2。

表2 治療后臨床療效比較 (例)
注:與對照組相同治療時間比較,*P<0.05
2.3 血清炎癥因子比較
觀察組與對照組治療前IL-1β、IL-6、TNF-α、IL-10水平無明顯差異(P>0.05);觀察組治療后3個月血清IL-1β、IL-6和TNF-α水平均下降(P<0.05),IL-10水平治療后有所下降,但差異無統計學意義(P>0.05);對照組血清炎癥因子IL-1β、IL-6、TNF-α、IL-10水平治療后3個月無明顯改變(P>0.05);治療6個月后,觀察組血清IL-1β水平進一步下降,與治療后3個月相比具有明顯差異(P<0.05),IL-6、IL-10和TNF-α水平較治療后3個月有所下降,但無明顯差異(P<0.05);對照組治療后6個月,可見血清IL-1β水平較治療前明顯下降(P<0.05),而IL-6和TNF-α水平較治療前明顯升高(P<0.05),IL-10水平有所下降,但不具有明顯差異(P>0.05)。見表3。

表3 治療前后血清炎癥因子水平比較
注:與同組治療前比較,*P<0.05,**P<0.01;與對照組相同治療時間比較,ΔP<0.05;與同組治療后3個月比較,#P<0.05
2.4 血清鐵代謝指標比較
治療前兩種血清鐵代謝指標(血清鐵、總鐵結合力、鐵蛋白)水平無明顯差異;觀察治療3個月后血清鐵含量明顯升高(P<0.05),總鐵結合力和鐵蛋白出現明顯下降(P<0.05);治療后6個月與治療后3個月相比,血清鐵含量進一步升高(P<0.05),總鐵結合力和鐵蛋白進一步下降(P<0.05),與對照組相比具有明顯差異(P<0.05)。對照組治療后3個月,血清鐵、鐵蛋白、總鐵結合力未見明顯改變,治療后6個月血清鐵和鐵蛋白含量明顯較治療前升高(P<0.05),總鐵結合力未見明顯改變(P>0.05)。見表4。
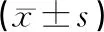
表4 兩組治療前后鐵代謝水平比較
注:與同組治療前比較,*P<0.05;**P<0.01;與對照組相同治療時間比較,ΔP<0.05;ΔΔP<0.01;與同組治療后3個月比較,#P<0.05
3 討論
癲癇屬于祖國醫學“ 癇病”范疇,歷代醫家多從風痰瘀熱等進行論治,而痰飲是其主要病機,既可以是發病誘因,也可能成為病理產物,因此,熄風滌痰是治療癲癇重要的治法[12-14]。本研究從臨床常用的熄風滌痰方劑定癇丸入手,對風痰閉阻型難治型癲癇進行研究發現,定癇丸聯合抗癲癇西藥可以有效減少癲癇發作次數及持續時間,6個月總有效率達到53.1%優于3個月的34.4%,提示了中西醫聯合治療難治性癲癇可提高臨床療效。
本研究發現,耐藥性癲癇患者單純西藥治療后3個月后,血清炎癥因子及鐵代謝指標未見明顯改變,但治療6個月后可見IL-1β較治療前明顯下降,IL-6、TNF-α較治療前明顯升高,IL-10未見明顯改變,提示了不同炎癥因子在藥物治療耐藥性癲癇中存在差異;血清鐵和鐵蛋白含量明顯較治療前升高,總鐵結合力未見明顯改變,提示鐵代謝在西藥治療6個月后輕度下降。抗癲癇西藥聯合定癇丸治療后3個月、6個月,IL-1β、IL-6、TNF-α水平均出現了明顯下降,而IL-10未見明顯改變,提示定癇丸聯合西藥可有效降低炎癥因子水平;血清鐵含量明顯升高,總鐵結合力和鐵蛋白出現明顯下降,提示定癇丸具有促進鐵代謝的作用。
癲癇炎癥因子的改變與抗癲癇藥物治療有關[4],IL-1β是評價耐藥癲癇炎癥反應最常見的因子之一[15]。IL-1β是一種強有力的細胞炎癥因子,在外周組織中,IL-1β主要由血液單核細胞和組織巨噬細胞產生,外周IL-1β可通過初級傳入神經元對大腦產生影響,可以從血液通過室周器和脈絡膜叢擴散到大腦[16]。TNF-α和IL-6也是參與癲癇的發生、發展過程的重要炎癥因子[4]。因此,對IL-1β、TNF-α和IL-6水平的抑制,提示定癇丸可能通過抑制炎癥因子發揮抗癲癇的作用。此外,鐵代謝也與癲癇密切相關,有meta分析證實鐵缺乏很大程度上增加了癲癇發作的風險,OR1.79(95%CI 1.03~3.09)[17];最新研究發現鐵代謝具有調節炎癥因子的作用,脆弱擬桿菌促進細胞內鐵濃度的顯著增加,減少鐵轉運蛋白水平,而這一作用抑制了沙門氏菌誘導的IL-6和IL-1β產生[18]。因此,定癇丸調節鐵代謝-炎癥因子途徑的改變,可能與腸道菌群有密切關系,有待進一步研究。
“腸道菌群”與中醫“脾”的功能類似,中醫藥健脾化痰可能具有調節腸道菌群的作用。難治性癲癇患者長期服用抗癲癇西藥,對脾胃運化功能有損。定癇丸源于明代王肯堂的《醫學心悟》,方中川貝母、膽南星苦涼性降,清熱化痰,其中川貝母功擅開郁散結,膽南星兼具熄風解痙;姜半夏、陳皮、茯苓取二陳湯之義,溫燥化痰、理氣和中;全蝎、炒僵蠶、天麻平肝熄風止痙;石菖蒲、茯神祛痰開竅、寧心安神;丹參、麥冬偏涼清心,琥珀、朱砂鎮心安神;生曬參大補元氣、養心安神;燈心草清熱利濕安神;甘草調和諸藥。方中半夏、陳皮、茯苓相合,具有健脾調節腸道菌群的作用[19];半夏可抑制烏頭的抗炎活性,且隨著半夏用藥量的增加,抑制作用逐漸增強,且血清中炎癥介質IL-1,TNF-α含量逐漸減少,毛細血管通透性降低[20];天麻素可通過降低癲癇大鼠海馬p38MAPK 蛋白的表達,抑制部分炎癥細胞因子IL-1β、IL-2、IL-6 和TNF-α 的分泌,從而影響炎癥信號通路[21]。
綜上所述,定癇丸聯合抗癲癇西藥治療難治性癲癇,可以明顯提高臨床療效,抑制炎性反應,調節鐵代謝,從而干預癲癇的發生發作,值得臨床推廣應用。但本研究納入病例數較少,未進行遠期隨訪,其機制尚不十分明確,有待進一步研究。

