一氧化氮對弱光脅迫下苗期及坐果初期辣椒生長和抗性相關指標的影響
李 莉,田士林,*,姜 俊,宋 麗
(1.黃淮學院 生物與食品工程學院,河南 駐馬店 463000; 2.駐馬店市農業科學院 園藝研究所,河南 駐馬店 463000)
在植物生長過程中,逆境脅迫是植物生長經常要面臨的問題,輕微的脅迫植物可以通過自身的調控來緩解逆境帶來的不利影響,通常植物通過啟動抗氧化酶(SOD、POD、CAT)來抵御和清除活性氧,維持膜的穩定性[1];當逆境脅迫超出植物自我調節能力時,植物體活性氧代謝失調從而導致自由基積累,并進一步導致細胞膜結構損傷[1]。
光照不足是近年來設施園藝中常見的逆境脅迫。在弱光條件下,植物光合作用降低,葉綠素含量出現異常,這一現象常常與谷氨酰-tRNA還原酶基因(HEMA1)、葉綠素酸酯a氧化酶基因(CAO)、牻牛兒基牻牛兒焦磷酸基因(GGPP2)的失調密不可分[2]。GGPS2、CAO和HEMA1基因是調控植物進行光合作用的關鍵基因,GGPS基因表達水平的高低不僅會影響植物光合器官中類胡蘿卜素的合成,而且會影響類異戊二烯途徑中葉綠素等物質的合成[2];CAO基因是催化脫植基葉綠素a形成葉綠素b的唯一基因,在弱光脅迫下通過調控葉綠素b含量使植物更好地適應弱光環境[3];HEMA1基因是代謝和環境調控的關鍵酶基因,該基因受光誘導,在光合組織中表達[3]。弱光環境下,上述3個基因的變化可以反映植物對弱光環境的適應能力[2-3],基因表達的變化會導致葉綠素的合成受阻,最終影響蔬菜的產量和品質[4]。
近年來,隨著溫室大棚的廣泛應用,蔬菜瓜果實現了周年供應。受價格規律的影響,反季節蔬菜生產呈逐年上升的趨勢,然而,光照不足在大棚生產中最為常見[5]。辣椒屬于中光性植物,光照不足容易引起品質降低[5]。因此,尋找一個簡單、快速、經濟的栽培措施,用于緩解弱光對辣椒苗期生長所造成的不利影響至為重要。一氧化氮(nitric oxide,NO)既是一個氣態自由基也是一個多功能細胞信號傳導效應器,在不同的生理過程中扮演著重要的作用[6]。研究表明,NO參與調控植物的抗病、氣孔關閉、非生物逆境脅迫、鐵離子平衡以及生長發育等方面[7]。硝普鈉(sodium nitroprusside,SNP)是外源NO的直接供體,利用SNP作為NO的發生器在植物逆境調控方面已經得到廣泛應用[8-9]。有研究表明,適當濃度的SNP能有效緩解逆境對多種植物生長造成的傷害[8-12]。付娟娟等[13]選用冷季型草坪草高羊茅為材料,通過研究不同遮陰強度和不同遮陰時間對高羊茅的膜透性及抗氧化酶活性的影響,結果表明,外源NO可以顯著提高遮陰脅迫下高羊茅葉片的葉綠素含量,降低質膜相對透性的增加,減少膜質過氧化產物MDA含量的升高,促進脯氨酸的積累,提高超氧化物歧化酶(SOD)、過氧化物酶(POD)和過氧化氫酶(CAT)的活性。外源NO能否減輕弱光環境對辣椒植株造成的傷害尚未見相關報道。本研究擬設置不同程度的遮陰處理(輕度遮陰LS、中度遮陰MS、重度遮陰SS)模擬弱光環境條件,采用SNP作為NO的供體,探討外源NO對遮陰辣椒苗期抗氧化系統的影響,為辣椒耐弱光遺傳資源的篩選及設施栽培提供參考。
1 材料與方法
1.1 材料
試驗材料為光強敏型辣椒材料WM-1,為早熟品種,果實朝天簇生,株高30~40 cm,果實初期乳白,成熟后淺紅,微辣。每簇結5~6個果,果長4~5 cm,果徑1 cm左右,單果質量3~4 g,坐果力強。種子由河南省辣椒核心種質資源創制及分子育種創新團隊提供。
1.2 方法
1.2.1 試驗布置
試驗于黃淮學院智能溫室內進行。當辣椒長出3~4片真葉時,移栽于花盆(20 cm×14 cm),盆土成分為泥炭、沙子和珍珠巖(體積比1∶1∶1),每盆1株,按照隨機區組設計布置。2周后,選出70株相同苗齡、相同高度、相同莖粗、相同葉片數、相同健康程度的辣椒苗為試材。其中,對照(CK)10株、輕度遮陰(LS)20株、中度遮陰(MS)20株、重度遮陰(SS)20株。每3 d澆一次霍格蘭營養液,每盆每次澆200 mL。
1.2.2 遮陰處理
智能溫室內采用黑色透氣遮陽網進行遮陰,設置對照(CK)和3種遮陰處理(輕度遮陰、中度遮陰、重度遮陰)。對照(CK)光強,1 000 μmol·m-2·s-1;輕度遮陰(LS)光強,600 μmol·m-2·s-1;中度遮陰(MS)光強,300 μmol·m-2·s-1;重度遮陰(SS)光強,100 μmol·m-2·s-1。生長溫度:白天28 ℃/夜晚20 ℃,光照時間:白天10 h/夜晚14 h。
1.2.3 SNP配制及噴施
2000年11月,美國國會在水資源發展法中通過了大沼澤地綜合修復計劃。這是美國有史以來最大的環境修復工程,共有60個單項,計劃30年完成。該計劃的主要目標:一是增加自然生態的空間面積,改善棲息環境及其相應功能,增加原生態動植物種群的數量和多樣性;二是增加區內工農業及城鎮供水量,降低洪水災害。修復計劃有四項主要措施:
SNP購自Sigma公司,使用前30 min用蒸餾水配成0.1 mmol·L-1SNP工作液[9],置于4 ℃冰箱保存備用。每天下午18:00進行噴施,用SNP溶液分別對輕度遮陰、中度遮陰、重度遮陰辣椒植株進行均勻噴施,每隔30 min噴施一次,連續噴施3次,分別對3組噴施過SNP溶液的遮陰植株進行掛牌,標記為LS+SNP(輕度遮陰+SNP)、MS+SNP(中度遮陰+SNP)、SS+SNP(重度遮陰+SNP)。
1.2.4 樣品采集
從SNP噴施后的第5天開始,分別采集不同處理組辣椒葉片,帶回實驗室進行相關指標測定。每5 d進行一次采樣,至第15天采樣結束。
1.2.5 相關指標測定
SOD、POD、CAT活性的測定分別采用氮藍四唑(NBT)法、分光光度法和紫外吸收法[3];葉綠素a、葉綠素b、葉綠素a+b含量的測定采用葉綠素含量測定儀(SPAD502);葉面積的測定采用數格子法:沿著葉子的形狀將其畫下來,畫在透明的坐標紙上,然后數格子。計算格子時,葉片邊緣凡超過半格的計算為1,不足半格則不計數,根據數出的格子數就是葉片的面積數。以上所有指標均重復測定3次,其結果以平均值±標準誤表示。
1.2.6 半定量RT-PCR
采用Trizol法提取辣椒葉片總RNA,用微量紫外分光光度計(ND-1000,美國)測定純度及定量(D260/D280、D260/D230),-80 ℃保存。采用cDNA一鏈合成試劑盒(上海生工),對純化后的RNA進行反轉錄,合成cDNA一鏈,-20 ℃保存備用。按照半定量RT-PCR的要求,重復3次。根據辣椒基因組中GGPS2、CAO和HEMA1基因相對應的CDS序列和Ubi3基因序列,設計半定量RT-PCR引物(表1)。
表1 引物序列
Table1Primer sequences used for qPCR

基因Gene 序列號Accession number引物名稱Primer name引物序列Sequence(5′→3′)GGPS2Capana04g000412GGPS2-FGGPS2-RTTGAAGCAGCACAGACGGCGAGAAGGGAATAACGCAOCapana00g004119CAO-FCAO-RGCCACGAGACAAGGAACAGAGTCGGGGATTGATAGTHEMA1Capana04g000804HEMA1-FHEMA1-RAGTTCTGGTGGAAATGTGACTGGATACTAAGCCCAATGACUbi3AY486137.1Ubi3-FUbi3-RGTTGTCTCTCGTCTACCTTGTCAGAATAACACGAACCCCAC
Ubi3用作內參基因,F為正向引物,R為反向引物。
Ubi3 was used as internal control (reference gene); F, Forward primer; R, Reverse primer.
以PCR擴增出的條帶清晰可見為原則對模板濃度進行調整,將反轉錄得到的cDNA一鏈適當稀釋至50 ng·mL-1,作為半定量RT-PCR模板。PCR擴增體系為15 μL:上游引物和下游引物(10 mmol·L-1)各0.5 μL,5×Buffer(含Mg2+)1.5 μL,dNTP(2.5 mmol·L-1)0.3 μL,Taq酶0.12 μL,模板cDNA 1.5 μL,ddH2O至10.58 μL。反應條件為:94 ℃預變性5 min;94 ℃變性30 s,退火30 s,溫度分別為48 ℃(HEMA1、CAO的引物)、47℃(GGPS2、Ubi3的引物),72 ℃延伸1 min,26~28個循環;72 ℃延伸10 min;4 ℃終止反應。取10 μL PCR產物分別點樣至1%瓊脂糖凝膠樣品孔中,在1×TAE電泳緩沖液中檢測PCR產物,全自動凝膠成像分析儀(上海培清JS-680C)照相分析電泳結果。
采用SAS (SAS Institute, version 8.2)對數據進行處理,采用SigmaPlot10.0軟件進行作圖分析。
2 結果與分析
2.1 SNP對弱光脅迫下辣椒植株生長狀況的影響
由表2可以看出,隨著遮陰加重,辣椒結果能力減弱、分枝降低、葉片稀而少;經SNP處理后,植株的株高、莖粗、葉面積比遮陰植株顯著增加;在輕度遮陰條件下,SNP可以提高果實的質量。值得提出的是:經SNP處理過的中度遮陰(MS)和重度遮陰(SS)植株,植株的分枝數明顯增加。
表2SNP對遮陰處理下辣椒生長指標的影響
Table2Effect of SNP on pepper growth indicators under weak light stress
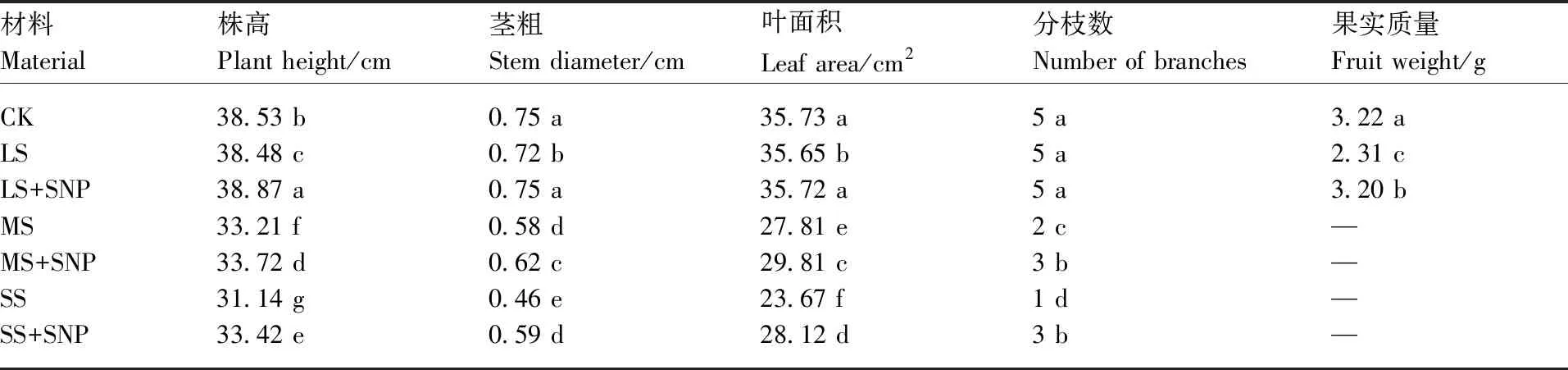
材料Material株高Plant height/cm莖粗Stem diameter/cm葉面積Leaf area/cm2分枝數Number of branches 果實質量Fruit weight/gCKLSLS+SNPMSMS+SNPSSSS+SNP38.53 b38.48 c38.87 a33.21 f33.72 d31.14 g33.42 e0.75 a0.72 b0.75 a0.58 d0.62 c0.46 e0.59 d35.73 a35.65 b35.72 a27.81 e29.81 c23.67 f28.12 d5 a5 a5 a2 c3 b1 d3 b3.22 a2.31 c3.20 b————
CK,對照株,正常光照;LS,輕度遮陰;MS,中度遮陰;SS,重度遮陰;LS+SNP,對輕度遮陰植株采用SNP處理;MS+SNP,對中度遮陰植株采用SNP處理;SS+SNP,對重度遮陰植株采用SNP處理。同列數據后無相同字母的表示處理間差異顯著(P<0.05)。 “—”為未檢測到。
CK, The control (unshaded plants); LS, Light shaded treatment; MS, Moderate shaded treatment; SS, Severe shaded treatment; LS+SNP, SNP treatment on the light shaded plants; MS+SNP, SNP treatment on the moderate shaded plants; SS+SNP, SNP treatment on the severe shaded plants. Data marked without the same letters in the same column indicated significant difference atP<0.05. "—", undetected.
2.2 SNP對不同弱光脅迫下辣椒幼苗SOD、POD和CAT活性的影響
從圖1-A中可以看出,處理第5、10、15天時,正常光照植株的SOD活性未發生明顯變化;不同程度遮陰處理后,辣椒植株SOD活性增加;與單獨遮陰處理相比,SNP處理后,遮陰植株葉片中的SOD活性普遍增加。說明SNP的施用提高了遮陰環境下辣椒植株的SOD活性,提高了弱光環境條件下辣椒的抗氧化能力。
從圖1-B中可以看出,遮陰處理后,取樣檢測結果表明,第5天、第10天、第15天對于正常光照植株來說,POD活性未發生明顯的變化;不同程度遮陰處理的辣椒植株POD活性增加;與單純遮陰辣椒植株相比,采用SNP處理遮陰的辣椒植株,葉片的POD活性普遍增加。因此,SNP的施用提高了辣椒植株中POD活性,增強了弱光環境條件下辣椒的抗逆性。
從圖1-C中可以看出,遮陰處理后,取樣檢測結果表明,第5天,輕度遮陰未發生明顯變化,中度遮陰和重度遮陰經SNP處理后效果明顯;第10天,無論是輕度遮陰、中度遮陰還是重度遮陰經SNP處理后CAT活性明顯增加;第15天,除重度遮陰脅迫經SNP處理后有輕微提高外,SNP處理15天時對遮陰植株CAT活性的提高已經沒有影響,說明SNP處理有一定的時間效應。因此,SNP的噴施提高了辣椒CAT活性,一定時期內提高了弱光環境條件下辣椒的抗逆性。
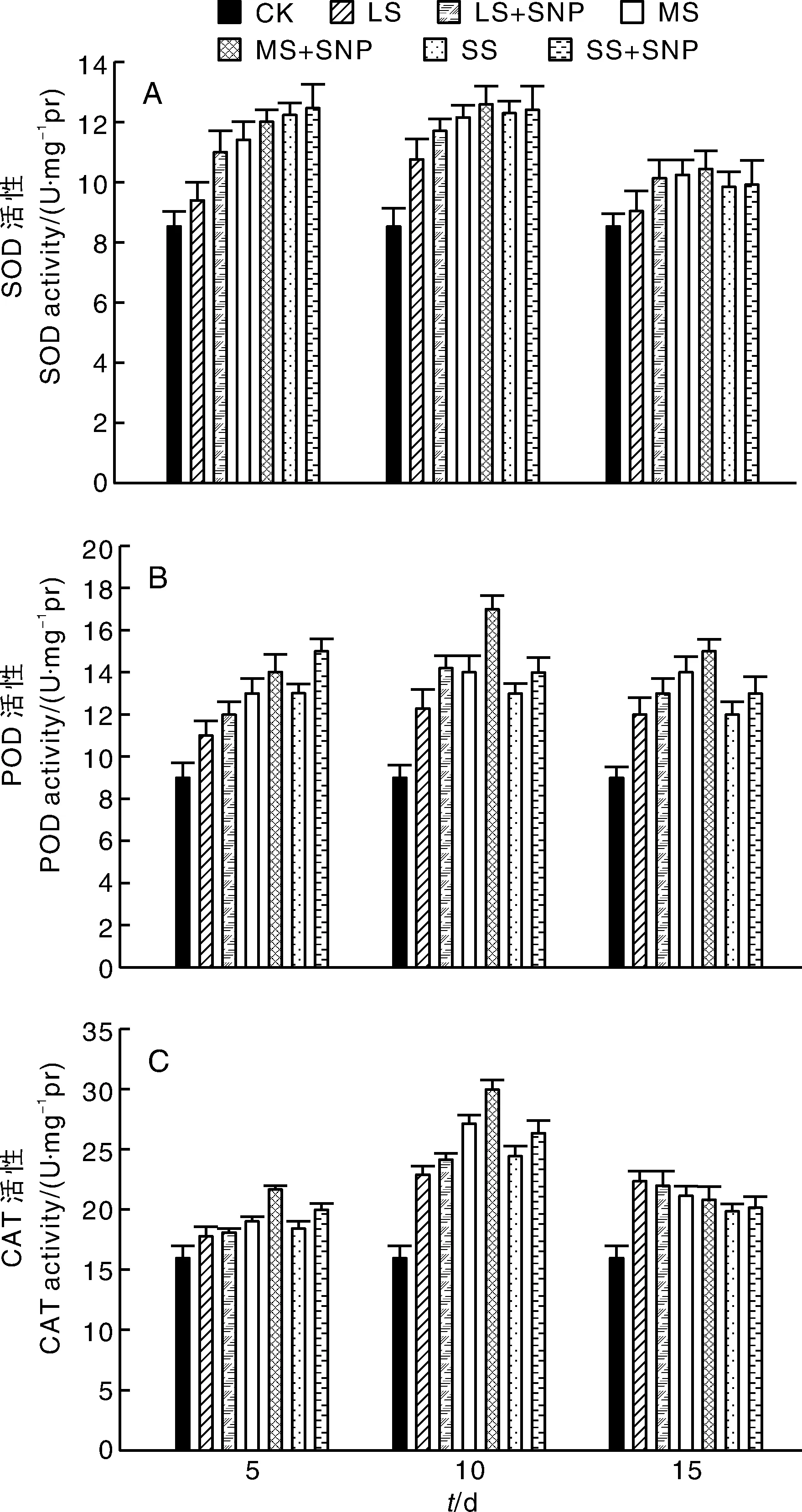
圖1 SNP對不同弱光脅迫下辣椒幼苗SOD、POD和CAT活性的影響Fig.1 Effect of SNP on SOD, POD and CAT activity of pepper seedlings under different weak light stress
2.3 SNP對不同弱光脅迫下辣椒幼苗葉片葉綠素含量的影響
從圖2-A可以看出:第5天、第10天、第15天,相對于未噴施SNP辣椒植株來說,噴施SNP后辣椒葉片中的葉綠素a的SPAD值均表現為不同程度的提高,其中第15天SNP處理過的輕度遮陰植株葉綠素a的SPAD值與輕度遮陰植株差異顯著。因此,SNP的施用可以增強弱光脅迫下辣椒植株的抗逆能力。
從圖2-B可以看出:第5天、第10天,噴施SNP后辣椒葉片中的葉綠素b的SPAD值與未噴施SNP的遮陰植株相比均表現為不同程度的提高;噴施SNP后的第15天,辣椒葉片中的葉綠素b的SPAD值差異不顯著。
由圖2-C得知,第5天,SNP處理過的輕度遮陰和中度遮陰植株葉片中的葉綠素a+b的SPAD值略有提高,SNP處理過的重度遮陰植株葉片中的葉綠素a+b的SPAD值有不同程度的降低;第10天,SNP處理過的輕度遮陰和中度遮陰植株葉片中的葉綠素a+b的SPAD值略有提高,SNP處理過的重度遮陰植株葉片中的葉綠素a+b的SPAD值無顯著差異;第15天,SNP處理過的輕度遮陰、中度遮陰和重度遮陰植株葉片中的葉綠素a+b的SPAD值均有提高,但只有SNP處理過的輕度遮陰和中度遮陰葉綠素a+b值差異顯著;SNP提高了輕度遮陰和重度遮陰辣椒葉片中葉綠素a+b的SPAD值,對重度遮陰效果不明顯。
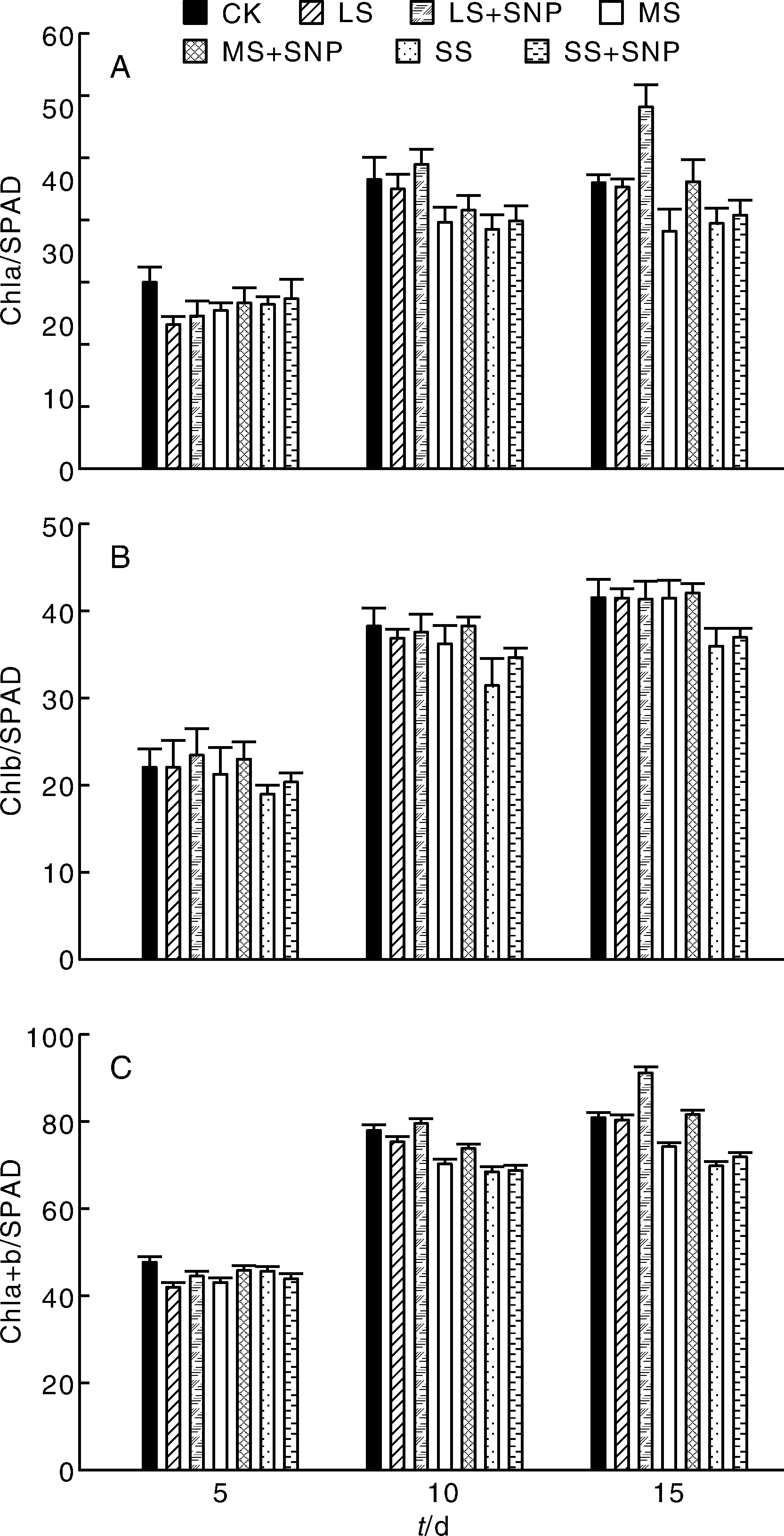
圖2 SNP對不同弱光脅迫下的辣椒幼苗葉綠素含量的影響Fig.2 Effect of SNP on chlorophyll content in pepper leaves under different weak light stress
2.4 SNP對葉綠素合成相關基因表達水平的影響
取不同處理的辣椒葉片1 μL總RNA,1%瓊脂糖凝膠電泳后,28S RNA和18S RNA條帶清晰,完整性較好,無明顯降解(圖3-A)。紫外分光光度計測得所提RNA的D260/D280值約為2.0,表明總RNA提取質量較好,符合進一步RT-PCR的要求;確定適宜的循環次數是保證實驗結果準確性的關鍵因素之一,本試驗以Ubi3為內參基因[14],在25~30個循環數內來探索內參基因和葉綠素酶基因的指數期,根據PCR電泳擴增結果(圖3-B),確定了內參Ubi3基因在28個循環時達到指數期,參試的3個葉綠素酶基因HEMA1、CAO、GGPS2對應的指數期分別為26、28和27個循環,分別以上述循環數進行RT-PCR擴增;從圖3-C中可以看出,弱光脅迫后,與對照(CK)相比,植株葉片中的GGPS2基因、CAO基因和HEMA1基因表達水平增強,而噴施過SNP的辣椒植株3個基因的表達水平更強。由此可知,SNP處理促進了GGPS2基因、CAO基因和HEMA1基因的表達,增強了辣椒的耐弱光性。
3 討論
低溫弱光等環境因子是反季節設施蔬菜生產主要因素。在逆境脅迫下,植物形態特征變化可以直接反映植物的受傷害狀況,是評價植物抗逆性強弱的最直接指標[4]。本研究中,遮陰導致辣椒植株葉片少、分枝差、植株生長勢弱;采用SNP處理后,處理組植株(MS+SNP和SS+SNP)長勢明顯好于遮陰組植株(MS和SS)。因此,對于反季節大棚辣椒,可以通過噴施SNP來緩解弱光對辣椒植株生長的影響。
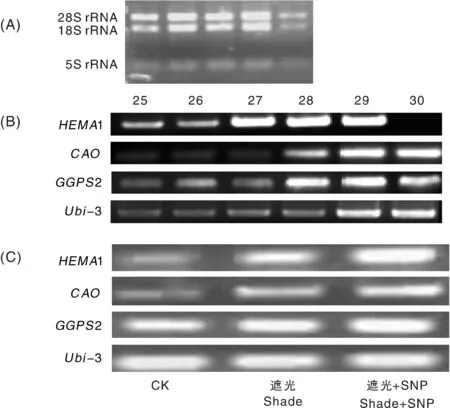
A,RNA質量;B,RT-PCR最佳循環數;C,相關基因表達水平。A, The quality of RNA; B, The optimal number of cycles for RT-PCR; C, The level of expression of related genes.圖3 HEMA1、CAO和GGPS2的表達水平的變化Fig.3 Changes in the expression levels of genes HEMA1, CAO and GGPS2
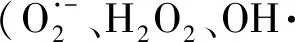
總之,在遮陰情況下,SNP能夠提高辣椒植株SOD、POD、CAT活性,增強了植株的耐弱光性;葉綠素a含量和葉綠素b含量的增加,提高了弱光環境下辣椒光合能力;同時,SNP處理也在一定程度上提高了葉綠素合成相關基因的表達水平。這些結論表明:NO有利于弱光環境下辣椒抗性的提高和光合能力的恢復,對于弱光環境下辣椒的生產提供參考。

