溶膠凝膠法制備Cu-Mn雙金屬復合氧化物及其催化降解甲苯
豆寶娟,趙慧琦,趙晨晨,閆寧娜,郝慶蘭
(天津科技大學化工與材料學院,天津 300457)
大氣中的揮發性有機污染物(volatile organic compounds,VOCs)不僅嚴重危害人體健康[1],而且還是空氣中光化學煙霧和細顆粒物(PM2.5)的前驅物質,嚴重污染生態環境.隨著我國工業的快速發展,VOCs 的排放量逐年增加.近年來,我國在《中華人民共和國環境保護法》和《中華人民共和國大氣污染防治法》等法規中新增了對VOCs 排放的限制[2]. 甲苯作為VOCs 工業排放的典型物質,排放企業眾多,排放量居高不下,造成嚴重污染.催化氧化法作為末端處理VOCs 的有效方法之一[3],具有起燃溫度低、凈化效率高、無二次污染等優點[4].
過渡金屬成本低,毒性小,可替代貴金屬作為催化氧化VOCs 的催化劑[5-6].利用過渡金屬Cu-Mn 間的相互作用,制備Cu-Mn 雙金屬復合氧化物催化劑,有利于提高催化劑降解VOCs 的活性[7-9].添加儲氧釋氧能力高的和熱穩定性強的可改善過渡金屬復合氧化物的活性和穩定性.Tang 等[11]和Lu 等[7]制備的MnCeOx和Cu-Mn-Ce 復合氧化物催化劑完全降解甲苯的溫度分別為245 ℃和220 ℃.對比發現:多金屬復合有利于減少副產物的產生;Cu 比Mn 更易進入CeO2晶格中形成固溶體.
采用生物基材料替代化學造孔劑(草酸(OA)或乙二醇(EG))也可制備復合氧化物催化劑[11-12].細菌纖維素(BC)作為一種新型的生物質原料,具有多孔性、親水性和較大的比表面積[13].Yang 等[14]用細菌纖維素作模板劑合成的La2CuO4納米晶體催化劑在甲烷重整實驗中呈現出優異的催化活性.但采用BC作為溶膠凝膠法的造孔劑制備復合氧化物催化劑還鮮有文獻報道.本文采用溶膠凝膠法以水凝膠的形式制備了Cu-Mn 雙主金屬Ce-Zr 雙助劑催化劑,在固定床反應器上評價了催化劑活性,探究生物造孔劑(BC)和化學造孔劑(OA、EG)對Cu-Mn 雙金屬催化劑降解甲苯活性的影響.
1 實 驗
1.1 催化劑制備
按照n(Cu)∶n(Mn)=1∶1、n(Ce)∶n(Zr)=3∶1、n(Cu+Mn)∶n(Ce+Zr)=1∶1 的比例將硝酸銅、硝酸鈰、硝酸鋯和醋酸錳溶解于100 mL 去離子水中.在攪拌狀態下將15 g 造孔劑(BC、OA 或EG)在50 ℃下加入到上述溶液中,維持攪拌并且加熱到80 ℃至形成凝膠.將上述凝膠在室溫下老化48 h,在105 ℃下干燥12 h,在550 ℃馬弗爐中于空氣氣氛下焙燒2 h,即得催化劑Cu0.25Mn0.25Ce0.375Zr0.125Ox,其催化劑中CuO 的質量分數為20%,MnO2的質量分數為17%.以BC、OA 或EG 為造孔劑制備的3 種組成相同的Cu-Mn 雙主金屬催化劑在下文中分別用CM-BC、CM-OA 和CM-EG 進行表示.
1.2 催化劑表征
1.2.1 低溫N2物理吸脫附
催化劑織構性質采用Autosorb-iQ-MP 型全自動比表面積與孔徑分析儀測定.先將樣品在300 ℃下真空脫氣4 h,再將樣品在液氮中冷卻至-196 ℃,然后進行低溫N2吸脫附實驗.通過BET 方法計算催化劑比表面積,采用BJH 方法計算孔徑分布曲線.
1.2.2 X 射線衍射(XRD)分析
X 射線衍射由DX-2700 型X 射線衍射儀測定,Cu 靶作為衍射源(λ=0.154 1 nm),X 射線管電壓為40 kV、電流為30 mA,掃描步長0.06°,角度范圍為5°~85°,掃描速率為2°/min.
1.2.3 拉曼光譜(Raman)分析
采用激光共聚焦顯微拉曼光譜儀對催化劑進行分析.該設備配備488 nm 激光器,高速光柵尺反饋平臺(HSES)為100 nm 步長,行程范圍為112 mm×76 mm,光譜范圍為10~9 000 cm-1,光譜分辨率為1 cm-1,通光效率大于30%.
1.2.4 程序升溫還原(H2-TPR)
催化劑的程序升溫還原(H2-TPR)使用PCA-140型化學吸附儀進行測定,TCD 檢測.將100 mg 催化劑填充在U 形石英管中,先用載氣(Ar 氣)對催化劑進行預處理,然后在程序升溫下用流量為50 mL/min的5%H2/Ar 混合氣對催化劑進行還原,升溫速率為10 ℃/min.
1.3 催化劑評價
以甲苯為VOCs 目標污染物,在固定床反應器內對催化劑進行評價,催化劑評價裝置示意圖[13,15]如圖1 所示.該反應裝置主要由VOCs 飽和蒸氣發生器系統、混氣系統、固定床反應器和尾氣在線檢測系統 組成.

圖1 催化劑評價實驗裝置示意圖 Fig. 1 Schema of apparatus for catalyst evaluation
將甲苯液體加入飽和蒸氣發生器中,通過控制水浴溫度保證甲苯氣體的穩定產生.調節空氣流量和夾帶氣路流量控制甲苯進氣濃度維持在225 mg/m3,空速為24 000 h-1.將0.8 g(20~30 目)催化劑裝填于固定床反應器的中部,然后將混合后的氣體通入反應器中進行反應.反應后的尾氣用GC 2014 型氣相色譜儀(日本島津)在線檢測,TCD 檢測器檢測CO2濃度,FID 檢測器檢測甲苯的濃度.
1.4 催化劑的活性與選擇性計算
催化劑的活性用甲苯的轉化率表示,計算公式見式(1).

式中:x 為甲苯的轉化率;ρin、ρout分別為反應器中甲苯的進口、出口質量濃度,mg/m3.
催化劑的CO2選擇性根據式(2)計算.

式中:Sc為CO2的選擇性;ρ1為尾氣中CO2的質量濃度,mg/m3;n 為甲苯中的碳原子數.
2 結果與討論
2.1 催化劑表征
2.1.1 催化劑的織構性質
3 種催化劑的N2物理吸脫附等溫曲線和孔徑分布如圖2 所示,表1 列出了催化劑的比表面積、平均孔容和平均孔徑.
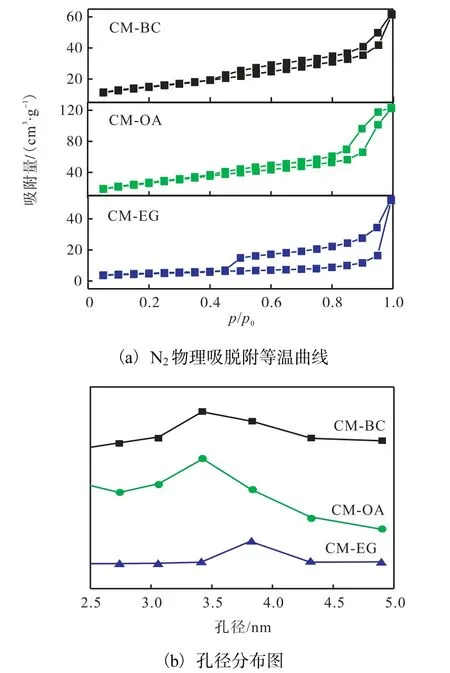
圖2 不同催化劑的N2物理吸脫附等溫曲線和孔徑分布圖Fig. 2 N2 physical adsorption/desorption isotherm curves and pore size distribution of different catalysts
由圖2(a)可知:3 種催化劑均為典型的Ⅳ型等溫吸脫附曲線,在相對壓力p/p0=0.45 處出現拐點,呈現出介孔毛細凝聚,對應的孔道直徑在介孔[16]范圍內;當相對壓力p/p0>0.45 時,吸附和脫附曲線分離,表現出了H4 型回滯環,表明均勻粒子間堆積孔的存在[17].由圖2(b)可知:3 種催化劑的孔徑呈單峰分布,孔徑主要集中在2.5~5 nm.由表1 給出的催化劑的比表面積可知,用OA 為造孔劑制備得到的催化劑的比表面積最大,達到了128.0 m2/g.
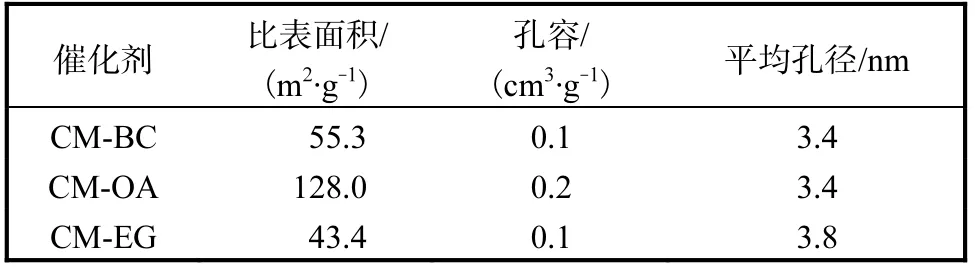
表1 不同催化劑的織構性質 Tab. 1 Texture properties of different catalysts
2.1.2 催化劑的晶體結構
3 種催化劑以及CuO 和CeO2的XRD 譜圖如圖3 所示.
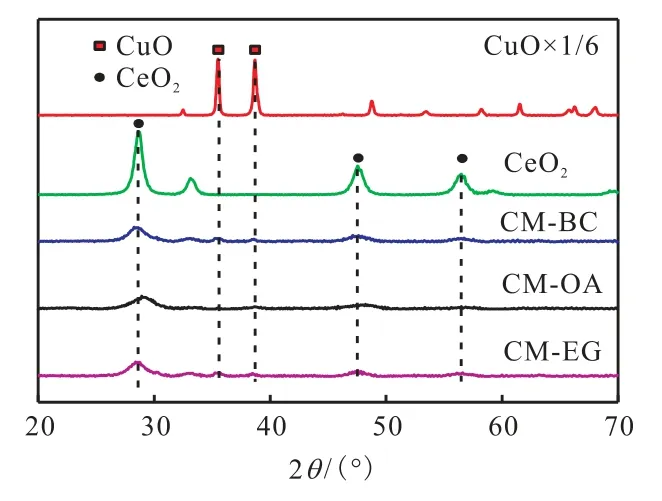
圖3 不同催化劑的XRD譜圖 Fig. 3 XRD patterns of different catalysts
由圖3 可知:所有催化劑在35.5°和38.7°處均出現了極微弱的CuO 特征衍射峰,表明CuO 在催化劑表面有很輕微的團聚現象發生.未檢測到MnO2的特征衍射峰,說明Mn 高度分散在了催化劑的表面.在28.5°、47.5°、56.3°處出現的衍射峰歸屬于CeO2的衍射峰[6],說明催化劑均保持了CeO2螢石結構;但與純CeO2衍射峰相比,3 種催化劑的CeO2衍射峰均變寬變弱,并同時向高角度偏移;這是由CeO2晶格參數減小所致[15],CeO2晶格中的Ce4+(0.097 nm)被半徑小的 Cu2+(0.072 nm)、Mn4+(0.056 nm)以及 Zr4+(0.084 nm)所取代[7],從而導致CeO2晶格扭曲現象發生,這有利于Cu-Mn-O-Ce-Zr 固溶體的形成,進而使催化劑產生更多的氧空位[18].氧空位可以提高催化劑吸附氧分子的能力,進而促進催化劑催化氧化甲苯活性的提高[13].
2.1.3 催化劑表面的氧物種和氧空位濃度
不同催化劑的拉曼光譜圖和氧空位濃度圖如圖4 所示.
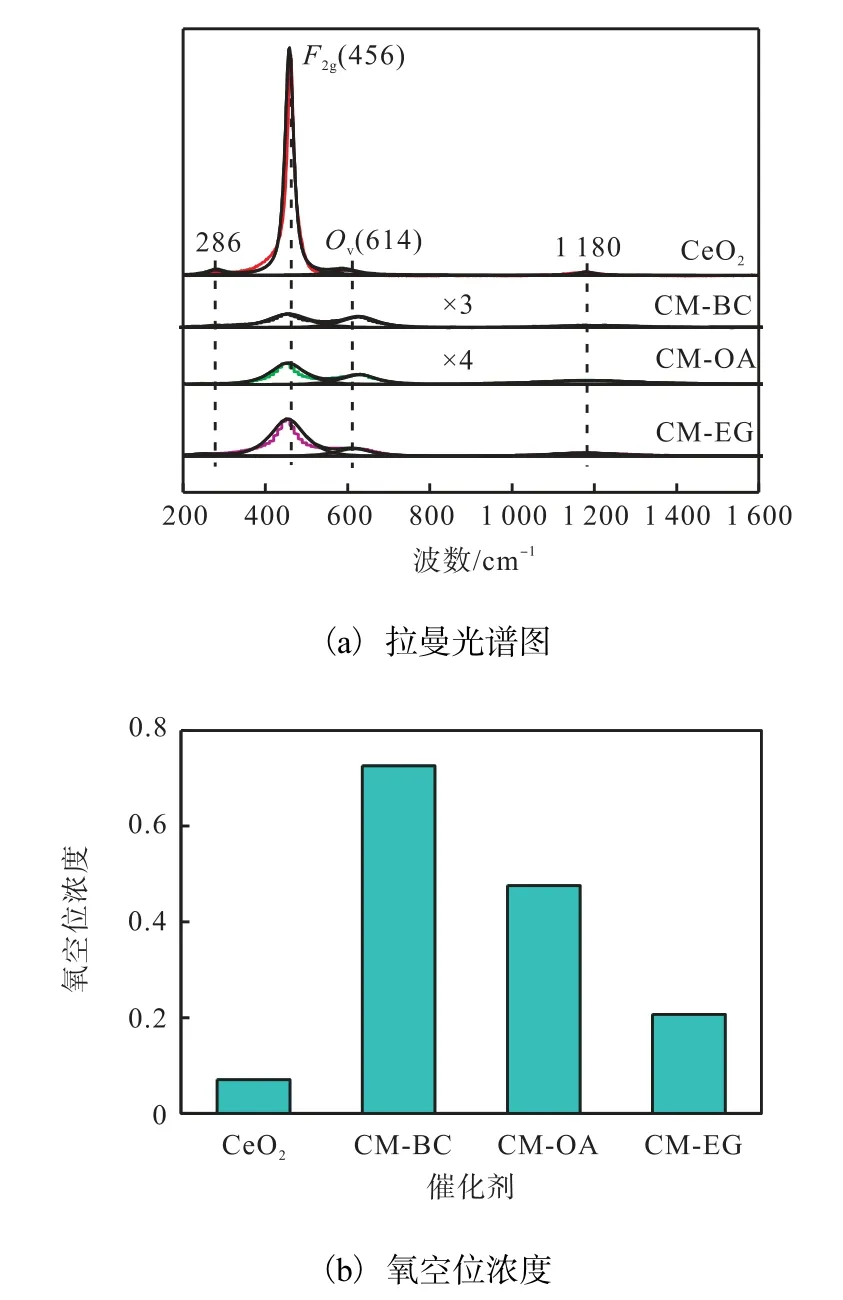
圖4 不同催化劑的拉曼光譜圖和氧空位濃度 Fig. 4 Raman spectra and oxygen vacancy concentration of different catalysts
由圖4(a)可看出:CeO2在456 cm-1處有一個強的Raman 峰,這是由Ce-O 振動單元的對稱拉伸所引起的[13].而3 個催化劑在456 cm-1處的Raman 峰明顯變弱且向低波數偏移,可能是由催化劑中CeO2晶胞參數減小造成的,這與催化劑的XRD 表征結果相一致.此外,催化劑中氧空位的存在也可以引起456 cm-1處Raman 峰的變化[13].
催化劑的氧空位濃度可通過氧空位Ov振動峰的峰面積和F2g振動峰的峰面積之比(Ov/F2g)得到[15]. 由圖4(b)的氧空位濃度圖可知:3 個催化劑的氧空位濃度明顯高于CeO2的氧空位濃度,CM-BC 催化劑的氧空位濃度最高,達到了0.726.這表明CuO、MnO2和ZrO2進入CeO2晶格中可以產生更多的氧空位;造孔劑對催化劑的氧空位濃度有影響,與化學造孔劑相比,以BC 為造孔劑制備的催化劑有利于氧空位的產生,具體原因還在進一步研究中.氧空位有利于晶格氧的遷移,從而有利于提高催化劑的活性.
2.1.4 催化劑的還原性
不同催化劑的H2-TPR 譜圖如圖5 所示.從圖5中可看出,催化劑的耗氫峰均可以擬合為α、β、γ 和δ 4 個峰,其對應的耗氫量見表2.
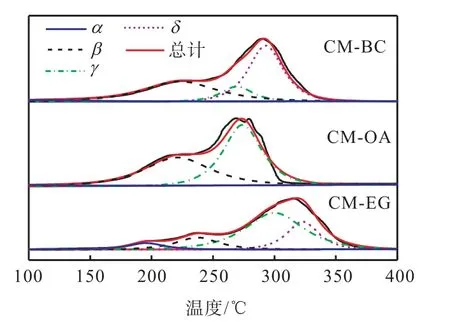
圖5 不同催化劑H2-TPR譜圖 Fig. 5 H2-TPR spectra of different catalysts
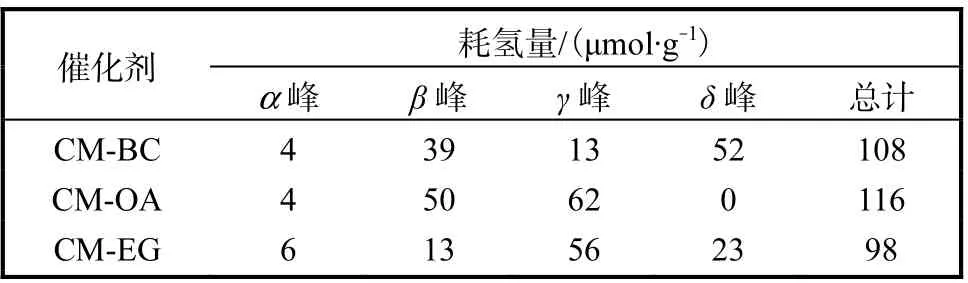
表2 不同催化劑的H2消耗量 Tab. 2 H2 consumption of different catalysts
150~200 ℃的α 峰對應于與CeO2有強烈的相互作用的表面CuO 的還原峰[13];200~250 ℃的β 峰應歸屬于高度分散的CuO 的還原峰[16];250~300 ℃的γ 峰對應于體相CuO 的還原峰[3];高于300 ℃的δ 峰對應于Mn 氧化物的還原峰,可歸因于Cu-Mn 固溶體的形成[19].催化劑H2-TPR 譜圖中出現的β 峰和γ峰與前述XRD 的表征結果相一致.當催化劑降解VOCs 的溫度低于250 ℃時,α 峰和β 峰的還原溫度和相應的耗氫量對催化劑活性影響較大.
由圖5 還可知:造孔劑對催化劑的還原性能有影響,CM-BC 和CM-OA 的α 峰和β 峰的還原溫度明顯低于CM-EG 催化劑的還原峰,且其對應的耗氫量也較高.3 種催化劑的還原溫度均比純CuO[16]和MnOx要低[17],這是由于CuO 和CeO2之間存在強的協同作用,提高了催化劑表面的活性氧物種的流動性,有利于Cu2+/Cu+和Ce3+/Ce4+之間的氧化還原循環,從而提高了催化劑的還原性[13].
2.2 催化劑活性評價
3種催化劑降解甲苯的活性評價和CO2選擇性如圖6 所示.由圖6(a)可知:催化劑的甲苯轉化率隨溫度的升高而增加,CO2選擇性隨甲苯轉化率同步升高,說明本研究制備的催化劑在降解甲苯時無副產物產生.但造孔劑的種類對催化劑的活性有顯著的影響,采用BC 制備的CM-BC 催化劑具有最好的催化活性,T90(甲苯轉化率達到90%時對應的溫度)為227 ℃,其完全降解甲苯的T100為240 ℃;而采用化學造孔劑OA 和EG 制備的CM-OA 和CM-EG 催化劑的T100分別為250 ℃和270 ℃.
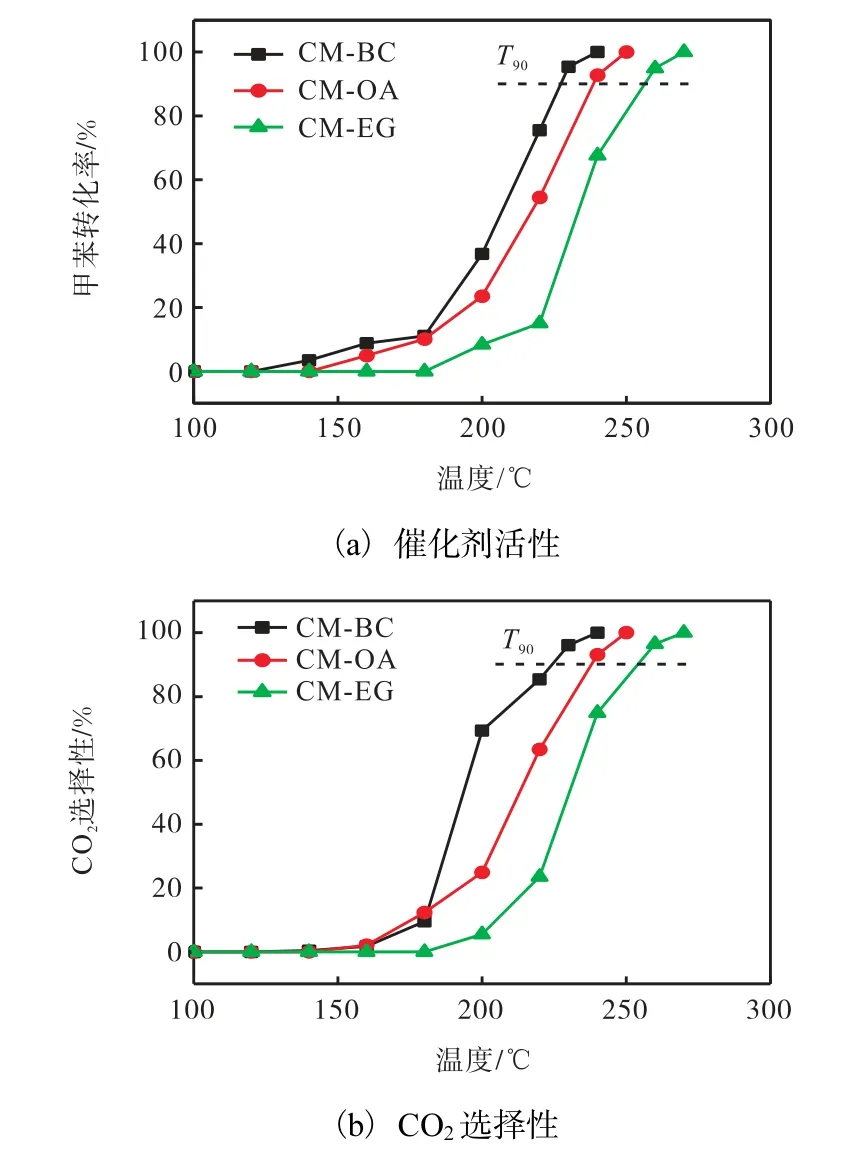
圖6 不同催化劑活性及CO2選擇性 Fig. 6 Catalytic activity and CO2 selectivity of different catalysts
結合前述的表征結果可知:較高的氧空位濃度和較強的還原性是影響催化劑活性的主要因素.CMBC 和CM-OA 催化劑的α 峰和β 峰還原溫度較低、耗氫量較高,所以其催化活性比CM-EG 要高;但當催化劑的還原性差別不明顯時,氧空位濃度對催化劑活性的影響更為重要,CM-BC 的氧空位濃度為0.726,明顯高于CM-OA 的0.476,所以CM-BC 完全降解甲苯的T100比CM-OA 低10 ℃.
3 結 語
采用溶膠凝膠法制備的Cu-Mn 雙主金屬Ce-Zr雙助劑Cu0.25Mn0.25Ce0.375Zr0.125Ox催化劑均具有介孔結構,Cu-Mn 雙金屬與CeO2的協同作用,使得催化劑能在較低的溫度下還原,催化劑中CeO2晶格扭曲現象的發生,有利于Cu-Mn-O-Ce-Zr 固溶體的形成,使催化劑在降解甲苯過程中均表現出較好的催化活性和CO2選擇性.采用生物造孔劑BC 制備的CMBC 催化劑在240 ℃就可完全降解甲苯,其活性明顯高于化學造孔劑(OA 和EG)制備的CM-OA 和CMEG 催化劑.CM-BC 催化劑較高的氧空位濃度(0.726)有利于氧物種的遷移,從而促進甲苯催化氧化反應的進行.在溶膠凝膠法制備催化劑的過程中采用綠色BC 作為造孔劑,可以促進催化劑制備的綠色化發展,但其在催化劑制備過程中的作用機制,有待進一步研究.

