紫花苜蓿鐮刀菌根腐病研究進展
方香玲,張彩霞,南志標
(蘭州大學草地農業生態系統國家重點實驗室,蘭州大學農業農村部草牧業創新重點實驗室,蘭州大學草地農業科技學院,甘肅 蘭州 730020)
紫花苜蓿(Medicagosativa, 簡稱為苜蓿)為多年生豆科牧草,具有栽培歷史悠久、種植面積大、分布廣和利用價值高等特點,被譽為“牧草之王”[1-2]。全世界苜蓿種植面積約3220萬hm2,在美國,紫花苜蓿和小麥(Triticumaestivum)并列成為第三大重要作物;我國紫花苜蓿種植面積約377萬hm2,居各類栽培草地之首,主要分布于西北、華北和東北地區[1-4]。苜蓿蛋白質含量高(初花期粗蛋白含量18%左右)、產量高、適口性好,飼用可增加20%產奶量、提高鮮奶質量,是我國最主要的優質飼草,是發展優質畜牧業重要的物質基礎[5-6];苜蓿根系發達,入土深,是理想的水土保持植物,具有顯著的生態效益[7];較強的固氮能力,可以提高土壤肥力,促進其他植物的生長[8];再生性強、適應性廣、具有耐鹽堿、抗寒、耐旱等特點,適合在我國西北干旱地區種植,對于我國草地畜牧業和農業的可持續發展具有重要的意義[1,9]。隨著產業結構的調整和供給側結構性改革,我國苜蓿種植面積將進一步擴大,預計到2020年新增20多萬hm2,其應用價值也將得到很大提升[3,10]。
國內外苜蓿生產深受根腐病的威脅,嚴重影響苜蓿產量與品質,制約著苜蓿的生產。據統計,全世界每年由根腐病造成的苜蓿產量損失在20%左右,嚴重時高達40%[11-12]。苜蓿根腐病普遍發生于我國西北(甘肅、新疆和青海等)、華北(河北和內蒙古等)和東北地區(黑龍江和吉林等)等苜蓿主要種植區,嚴重地塊苜蓿死亡率達60%以上[13-19]。近年來,隨著我國苜蓿種植面積的進一步擴大和集約化發展,根腐病日趨嚴重。針對該病害,國內外學者已開展一系列研究,主要集中在病害發生及嚴重程度調查、病原菌分離鑒定、致病性和生物學特性測定、苜蓿品種抗性評價以及農業和生物防治等方面[13-18,20-25]。
由鐮刀菌(Fusariumspp.)引起的根腐病,稱為鐮刀菌根腐病(Fusariumroot rot),是苜蓿生產上的主要根部病害,會造成根部腐爛,導致根系吸收水分和養分的功能逐漸減弱直至植株死亡[11]。由于鐮刀菌為土壤習居真菌,能在土壤中長期存活,加上苜蓿為多年生牧草,一次種植可多年利用,隨著種植年限的延長,導致根腐病更加嚴重,但苜蓿生產中已開展的農業及生物防治等措施只能初步控制該病害。鐮刀菌根腐病已成為導致苜蓿品質下降和產量損失的重要因素之一,其有效防治對于實現苜蓿這一重要牧草的可持續生產具有重要的意義。本研究從苜蓿鐮刀菌根腐病的分布與危害、病原種類與生物學特性、侵染源及發病規律、鐮刀菌對苜蓿的致病性及致病機理、苜蓿品種對鐮刀菌的抗病性以及防治方法等方面闡述國內外苜蓿鐮刀菌根腐病的研究進展,并對今后的研究方向進行了展望,以期為苜蓿鐮刀菌根腐病后續研究及其防治新方法的開發利用提供理論依據。
1 苜蓿鐮刀菌根腐病的分布與危害
鐮刀菌根腐病是國內外苜蓿種植區普遍發生的一種土傳病害。該病害最早于1937年在美國報道,后來在加拿大、新西蘭、澳大利亞、印度、埃及和日本等國家陸續報道,有些地區發病率在60%以上[25-29]。鐮刀菌根腐病普遍發生在我國苜蓿種植區如西北地區(甘肅、新疆和陜西等)、東北地區(吉林和黑龍江等)以及華北地區(內蒙古、河北、河南和山西等)[19,30-34](表1)。在西北地區如新疆阿勒泰地區,苜蓿鐮刀菌根腐病常年發生,造成苜蓿死亡率在60%以上[15-16,35-36]。在東北地區如吉林和黑龍江,苜蓿根腐病一般發生在5-8月,發病率達20%~40%,高峰期發病率達92%左右[17,32,37]。在華北地區如內蒙古和河北,由鐮刀菌引起的根腐病發生在6-10月,8月均達到高峰期,發病率在15%~30%[17]。
鐮刀菌在苜蓿全生育期均可引起植株發病,進而縮短苜蓿的壽命及其利用年限,降低該牧草的固氮能力和品質,甚至導致苜蓿喪失其加工價值[16,29,36,38-39]。苜蓿在越冬時消耗貯存的有機物質,而受鐮刀菌侵染的苜蓿植株可溶性糖含量明顯減少,造成次年苜蓿的再生能力減弱、發芽延遲、分蘗數減少和生長緩慢等,逐漸出現地塊凸顯,植株稀疏,嚴重影響草產量[40]。鐮刀菌對苜蓿種子的發芽具有較強的抑制作用;同時可以造成植株代謝紊亂,降低苜蓿的產量和品質,給奶牛業帶來重大隱患[21,41-44]。此外,鐮刀菌可以在土壤中長期存活,逐年累積,導致苜蓿抗病能力降低,由此形成了種植年限越長,病害越嚴重的現象[32]。
2 病原種類與生物學特性
2.1 病原種類
苜蓿根腐病病原種類復雜,且不同國家和地區存在差異,但多與鐮刀菌有關[11,14,17,42-44]。已報道的苜蓿根腐病病原有35種,其中鐮刀菌20種,包括尖孢鐮刀菌(F.oxysporum)、燕麥鐮刀菌(F.avenaceum)、腐皮鐮刀菌(F.solani)、銳頂鐮刀菌(F.acuminatum)、半裸鐮刀菌(F.semitectum)、串珠鐮刀菌(F.moniliforme)、黃色鐮刀菌(F.culmorum)、三線鐮刀菌(F.tricinctum)、接骨木鐮刀菌(F.sambucinum)、鏈狀鐮刀菌(F.fusarioides)、木賊鐮刀菌(F.equisti)、大刀鐮刀菌(F.culmorum)、梨孢鐮刀菌(F.poae)、厚垣鐮刀菌(F.chlamydosporum)、擬枝孢鐮刀菌(F.sporotrichioides)、雪腐鐮刀菌(F.nivale)、禾谷鐮刀菌(F.graminearum)、磚紅鐮刀菌(F.lateritum)、彎角鐮刀菌(F.camptoceras)和層出鐮刀菌(F.proliferatum)。鐮刀菌主要侵染苜蓿根部以及根頸部。發病初期,植株地上部分生長緩慢,葉片發黃,個別枝條萎蔫枯死;后期葉片變黃枯萎,全株萎蔫枯死[45]。患病植株根部有壞死斑,縱切面呈棕色或黑色;主根變短,側根減少,主根導管呈紅褐色或暗褐色條狀變色,維管束呈深褐色,根中空,嚴重時整個根全部腐爛;一般表現在主根和側根的皮層,后期易從土中拔出[16,19,29,41]。
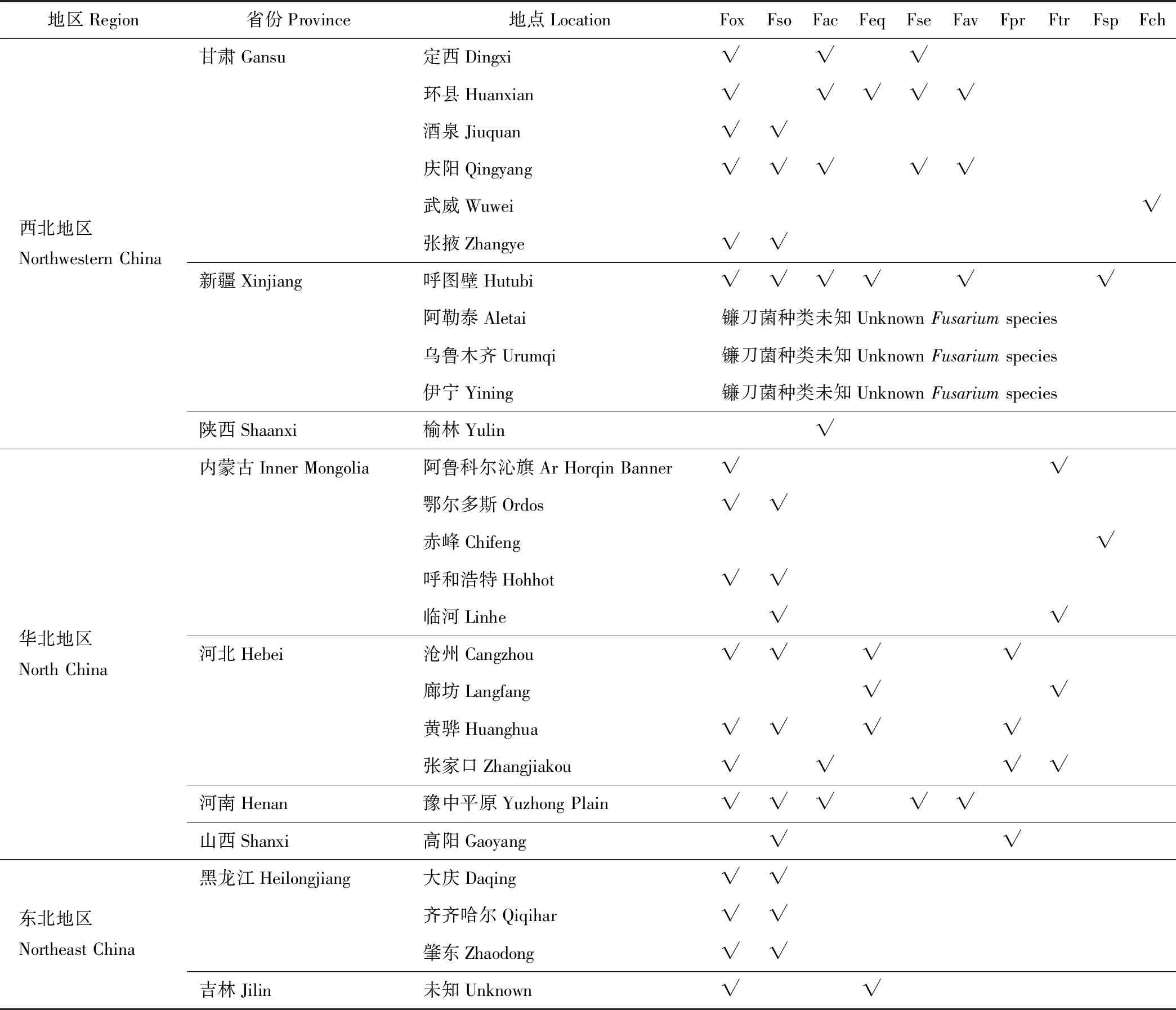
表1 不同鐮刀菌在我國苜蓿種植區的分布
表1根據參考文獻[11-12,17,19,34-35,42,48-50,54,67-68,72-75]匯總。Table 1 was summarized based on references[11-12,17,19,34-35,42,48-50,54,67-68,72-75].
Fox: 尖孢鐮刀菌F.oxysporum; Fso: 腐皮鐮刀菌F.solani; Fac: 銳頂鐮刀菌F.acuminatum; Feq: 木賊鐮刀菌F.equisti; Fse: 半裸鐮刀菌F.semitectum; Fav: 燕麥鐮刀菌F.avenaceum; Fpr: 層出鐮刀菌F.proliferatum; Ftr: 三線鐮刀菌F.tricinctum; Fsp: 擬枝孢鐮刀菌F.sporotrichioides; Fch: 厚垣鐮刀菌F.chlamydosporum. √: 每個地點分離得到的鐮刀菌種類Fusariumspecies isolated from each location.
已開展研究表明,引起我國苜蓿根腐病的鐮刀菌病原種類主要有8種,依次為尖孢鐮刀菌、腐皮鐮刀菌、銳頂鐮刀菌、木賊鐮刀菌、半裸鐮刀菌、燕麥鐮刀菌、層出鐮刀菌和三線鐮刀菌(表1)。其中尖孢鐮刀菌為我國苜蓿根腐病的優勢鐮刀菌種類,占已報道鐮刀菌種類分布地點的74%(23個已報道鐮刀菌種類分布的地點中,17個地點有尖孢鐮刀菌);其次為腐皮鐮刀菌,占已報道鐮刀菌種類分布地點的61%;其余鐮刀菌種類占分布地點的比例都小于50%。內蒙古和黑龍江苜蓿根腐病的優勢鐮刀菌種類為尖孢鐮刀菌和腐皮鐮刀菌;其他省如甘肅省苜蓿根腐病的優勢種類,除尖孢鐮刀菌和腐皮鐮刀菌外,還有銳頂鐮刀菌和半裸鐮刀菌;河北省苜蓿根腐病的優勢種類,除尖孢鐮刀菌外,還有木賊鐮刀菌和層出鐮刀菌;厚垣鐮刀菌目前僅發現為甘肅省武威地區苜蓿根腐病病原。其他國家,如埃及苜蓿根腐病病原主要有尖孢鐮刀菌、半裸鐮刀菌、鏈狀鐮刀菌、木賊鐮刀菌和銳頂鐮刀菌[29];美國苜蓿根腐病的病原主要有腐皮鐮刀菌、燕麥鐮刀菌、銳頂鐮刀菌、三線鐮刀菌、接骨木鐮刀菌和木賊鐮刀菌[27,46];加拿大苜蓿根腐病的主要病原為銳頂鐮刀菌、半裸鐮刀菌、腐皮鐮刀菌、接骨木鐮刀菌、尖孢鐮刀菌、木賊鐮刀菌和燕麥鐮刀菌[28,47]。
2.2 生物學特性
鐮刀菌的生長、產孢和孢子萌發等特性與環境條件如溫度、濕度、pH及營養成分等密切相關。鐮刀菌生長的適宜溫度范圍為20~28 ℃,孢子萌發的適宜溫度范圍為25~32 ℃[11,48-50];不同鐮刀菌在同一溫度下的生長情況存在差異,如35 ℃條件下層出鐮刀菌生長良好,但不利于尖孢鐮刀菌和厚垣鐮刀菌的生長[51-52]。濕度為95%~97%時鐮刀菌引致的苜蓿根腐病發病率最高,而低于75%時鐮刀菌孢子幾乎不能萌發[53]。菌絲生長的適宜pH范圍為5.0~9.0,分生孢子產生和萌發適宜pH范圍為6.0~7.0[11,54]。此外,菌絲的生長、產孢和孢子萌發均需要適宜的氮源和碳源,可溶性淀粉有利于大部分鐮刀菌如尖孢鐮刀菌、木賊鐮刀菌、層出鐮刀菌、三線鐮刀菌、銳頂鐮刀菌和擬枝孢鐮刀菌等菌絲的生長,但不利于厚垣鐮刀菌菌絲的生長;蛋白胨有利于厚垣鐮刀菌和擬枝孢鐮刀菌菌絲的生長;碳源如葡萄糖有利于鐮刀菌孢子萌發但是不利于產孢[11,51-52]。此外,研究表明,銨態氮對鐮刀菌菌絲的生長具有抑制作用[54],因此推測,適度的增施氮肥可以在一定程度上降低鐮刀菌根腐病的發生。雖然已有較多關于鐮刀菌生物學特性方面的報道,但與苜蓿根腐病相關的鐮刀菌生物學特性方面的研究較少,目前僅有尖孢鐮刀菌、腐皮鐮刀菌、擬枝孢鐮刀菌、厚垣鐮刀菌等少數幾種鐮刀菌種類生物學特性的初步報道[11,50-51,53]。鐮刀菌尤其是尖孢鐮刀菌產生的3種無性孢子(小分生孢子、大分生孢子和厚垣孢子),在病害發生和循環中發揮重要作用,孢子數量及存活狀況直接影響著病害的發生及其危害程度[55-57]。
3 侵染源及其發病規律
鐮刀菌為土壤習居菌,主要以菌絲體和孢子形式在病殘體、帶菌種子和土壤中越冬。鐮刀菌尤其尖孢鐮刀菌的厚垣孢子是侵染植物寄主的初侵染源,能夠在土壤中持續存活數十年,一旦侵染條件合適,就再次萌發侵染植物寄主,在病害發生中發揮重要作用;大分生孢子和小分生孢子是侵染植物寄主的二次侵染源,能夠在受侵染的植物表面存活,傳播給相鄰植物[55-57]。因此鐮刀菌厚垣孢子和分生孢子在病害發生和循環中發揮重要作用,其數量及存活狀況直接影響著病害的發生及其危害程度[18,55-60]。鐮刀菌一般從機械損傷以及逆境條件引起的傷口處直接入侵寄主根部,最后導致植株萎蔫死亡[61-62]。其中尖孢鐮刀菌不僅可以侵入植物根部引起根腐病,還可以進入維管束引起植株萎蔫枯死[63]。
苜蓿根腐病的發生和流行不僅受病原菌種類和孢子數量的影響,還受到土壤溫度、濕度和pH以及苜蓿品種抗病能力等多方面因素的影響,其中最主要的是濕度和溫度[36,64]。苜蓿根腐病發生的高峰期會因種植區的溫度和濕度等環境條件的不同而存在差異,如北方地區(如河北張家口、內蒙古科爾沁旗)根腐病發生的高峰期在5-8月[45,65];南方地區(如云南)該病的發病高峰期在8-9月[66]。田間管理也影響苜蓿根腐病的發生和流行,如不合理施肥和灌溉,過度刈割,同一品種多年種植等措施都可以加重苜蓿根腐病[30,35]。但是,關于環境因素對鐮刀菌在連作土壤中存活時間的影響,還缺乏系統的研究,同時,根據苜蓿根腐病發生的高峰期對病害發生趨勢進行預測,綜合分析影響病害發生流行的不同環境因素,特別是降水量、降水次數、溫度及其相互關系,構建預測模型,制定出其預測技術,把握最佳防治時期,是根腐病防治工作中不可或缺的一部分[65]。后期應加強鐮刀菌根腐病田間以及多年生長季的系統調查,全面了解其發生流行規律,為苜蓿的生產實踐提供指導。
4 鐮刀菌對苜蓿的致病性及致病機理
研究表明從苜蓿根腐病植株根部分離獲得的鐮刀菌菌株的致病性因其種間和種內不同菌株而存在差異(表2)。種間不同鐮刀菌菌株對同一苜蓿品種表現不同的致病性,如尖孢鐮刀菌和層出鐮刀菌菌株對中苜1號的致病性均強于腐皮鐮刀菌菌株;尖孢鐮刀菌菌株對隴東苜蓿的致病性強于燕麥鐮刀菌和三線鐮刀菌菌株(表2)。種內不同鐮刀菌菌株對同一苜蓿品種的致病性也存在顯著差異,如腐皮鐮刀菌和半裸鐮刀菌不同菌株對甘農3號均表現出不同程度的致病性(表2),這些表明鐮刀菌種間以及種內不同菌株在致病性方面的復雜性。目前研究鐮刀菌對苜蓿致病性的方法主要有種子接種法、試管幼苗接種法、土壤接種法和浸根接種法等(表2)。不同接種方法所得菌株的致病性強弱不同,如通過兩種不同方法(種子接種法和土壤接種法)分別測定半裸鐮刀菌、銳頂鐮刀菌以及木賊鐮刀菌對隴東苜蓿的致病性,結果表明前者所測得的致病性強于后者(表2);不同接種方式導致病害發病時間不同,如試管幼苗接種法的發病時間比土壤接種法早7~25 d[67],土壤米粒接種體接種的發病時間比孢子懸浮液浸根法早5~8 d[45];此外,同一接種法,進行接種和致病性評價時的時期不同,導致致病性研究結果也不同,如通過種子接種法測定燕麥鐮刀菌對隴東苜蓿接種后14 d的病情指數遠高于甘農3號接種后7 d的病情指數(表2)。此外,苜蓿鐮刀菌根腐病病因復雜,多菌株復合侵染相比較單菌株侵染能提高發病率并縮短潛伏期和發病高峰期。如尖孢鐮刀菌、腐皮鐮刀菌、串珠鐮刀菌和黃色鐮刀菌相互組合侵染苜蓿植株其發病率均達到60%以上[19,48,68]。
雖然已有較多關于鐮刀菌的致病機理研究,但關于鐮刀菌對豆科植物尤其是苜蓿的致病機理還了解甚少,分子機理依然未知。前期研究初步表明,鐮刀菌主要通過產生致病毒素侵染植株,如玉米(Zeamays)赤霉烯酮、鐮刀菌酸、脫氧雪腐鐮刀菌烯醇、雪腐鐮刀菌烯醇和雙乙酸基草鐮刀菌醇等。半裸鐮刀菌產生的玉米赤霉烯酮、雙乙酸基草鐮刀菌醇對苜蓿種子的發芽具有較強的抑制作用,同時造成幼苗萎蔫和變色、植物鮮重減少[69];鐮刀菌酸通過降低線粒體活性氧的含量、阻止ATP合成而導致根系吸收水分能力受阻[24];同時這些毒素可以參與植物的生理活動,造成代謝紊亂,降低苜蓿的產量和品質,給奶牛業帶來重大隱患[21,58,70-71]。
5 苜蓿品種對鐮刀菌的抗病性
5.1 苜蓿品種對鐮刀菌抗病性表現
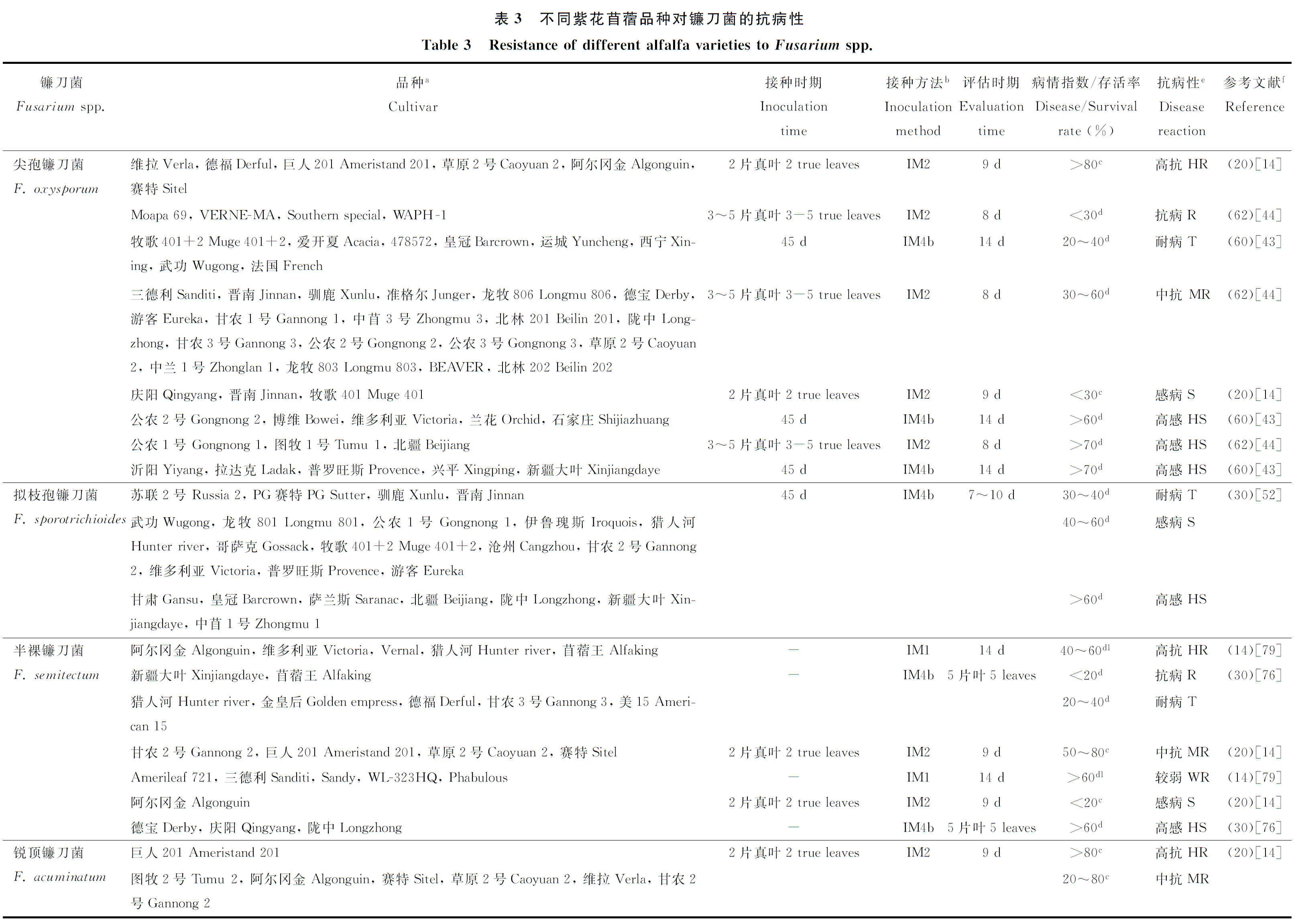
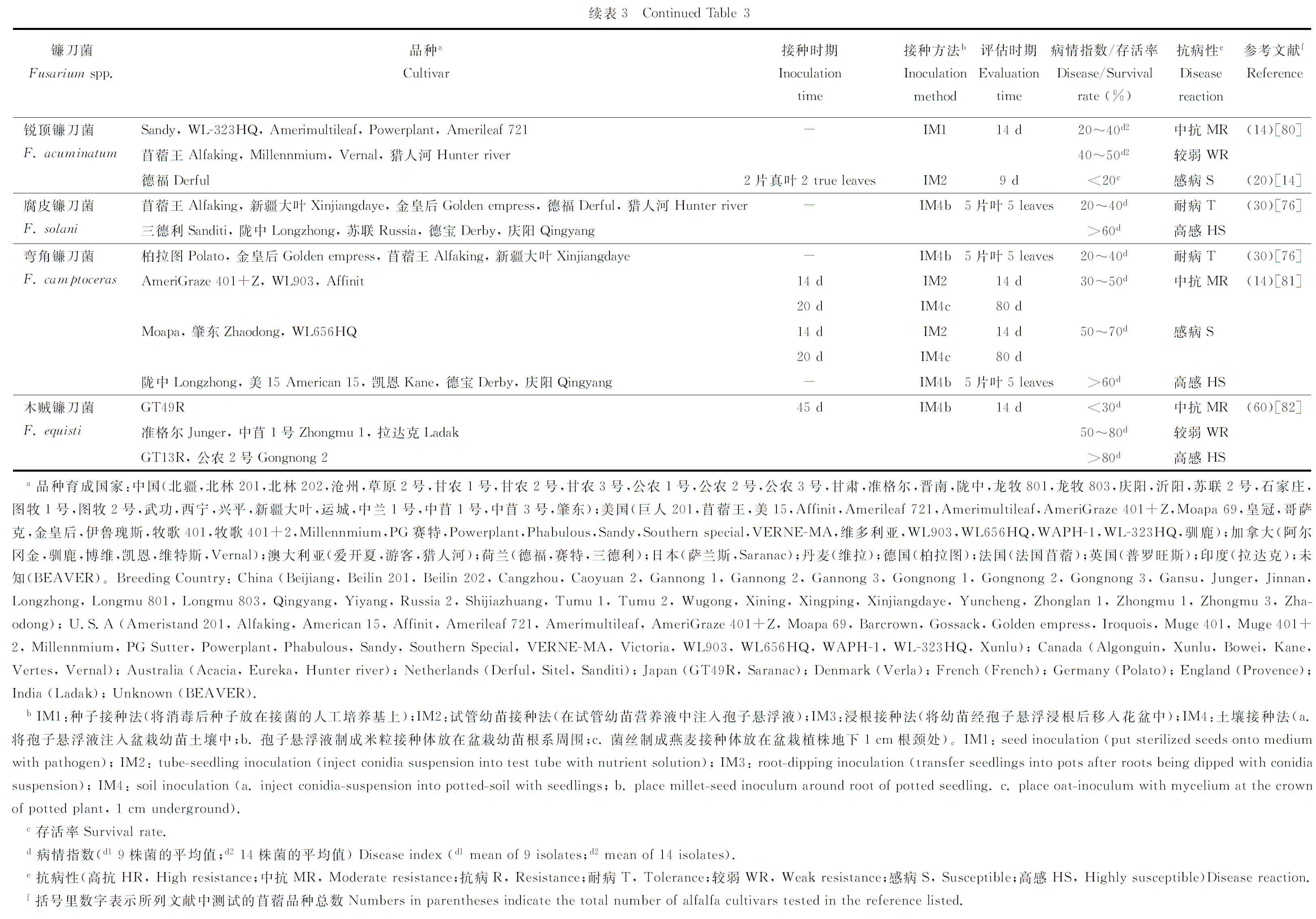
國內外研究人員對苜蓿對鐮刀菌的抗病性表現已進行了一系列研究(表3)。研究表明,同一苜蓿品種對不同種鐮刀菌抗病性存在差異,如德福對尖孢鐮刀菌表現較強的抗性,對銳頂鐮刀菌則表現為感病;隴中對尖孢鐮刀菌表現在為中抗,對擬枝孢鐮刀菌表現為高感(表3)。不同苜蓿品種對同一種鐮刀菌的抗性也存在差異,如新疆大葉對半裸鐮刀菌表現為抗病,德寶和隴中表現為高感;阿爾岡金對尖孢鐮刀菌表現為高抗,德寶和草原2號等表現為中抗(表3)。研究還發現,不同接種方法以及進行接種和病害評估的時期不同,導致紫花苜蓿品種表現的抗性不同,如公農2號對尖孢鐮刀菌抗病性表現,在3~5片葉時采用試管幼苗接種法表現為中抗,但在45 d時采用土壤接種法表現為高感;阿爾岡金對半裸鐮刀菌的抗病性表現,在種子接種條件下接種后14 d表現出較強的抗性,但在試管幼苗接種條件下接種后9 d則表現為感病(表3)。此外,不同試驗條件下苜蓿品種抗病性表現不同,如公農1號對尖孢鐮刀菌以及德寶對半裸鐮刀菌,在室內條件下表現為感病,但自然條件下表現為抗病[44,76]。綜上所述,不同苜蓿品種對鐮刀菌抗病性表現,不但受菌株種類的影響,還受到接種方法、接種和病害評估時期以及試驗條件等的影響。
5.2 苜蓿品種抗病性評價標準
關于抗病性評價指標方面,目前國內外通常根據存活率和病情指數等指標評價苜蓿對鐮刀菌抗病性的強弱,但由于劃分標準不一,所得出的結果不同(表3)。如在同一接種條件下(如試管幼苗接種法),分別根據存活率(劃分為3級)[14]和病情指數(劃分為3級)[44]評價苜蓿品種對尖孢鐮刀菌的抗性,結果得出的抗性程度不一樣,如草原2號對尖孢鐮刀菌分別表現為高抗和中抗(表3)。已開展工作還通過研究接種后植物體內防御性酶活性的變化,評價不同苜蓿品種對鐮刀菌的抗病性。如苜蓿在受到鐮刀菌侵染后,抗病品種防御性酶如苯丙氨酸解氨酶(PAL)的活性高于感病品種;感病品種防御性如過氧化物酶(POD)、過氧化氫酶(CAT)和超氧化物歧化酶(SOD)的活性高于抗病品種[52,77-78]。此外,已開展研究還通過建立對照品種,評價不同苜蓿品種對鐮刀菌的抗病性表現,如黃寧等[44]通過對62個品種對鐮刀菌的抗病性進行了測定,發現不同品種的抗病性存在顯著差異,并首次把抗病品種VERNE-MA、中抗品種公農2號和感病品種北林203作為抗鐮刀菌根腐病評價的對照品種,為苜蓿品種對鐮刀菌根腐病的抗病性評價提供了初步參考。但是,目前對苜蓿抗病性的研究主要集中在田間調查和室內溫室試驗兩個方面,缺乏大田條件下對其抗病性的評價以及對苜蓿抗鐮刀菌分子機理的研究。關于苜蓿對鐮刀菌的抗病性評價方面,目前缺乏統一的評價標準,評價方法比較混亂,導致同一品種出現不同的抗病等級,不能準確地判斷品種的抗病性。今后應制定關于苜蓿對鐮刀菌抗病性評價的統一標準,并通過不同指標如存活率、病情指數和地上、地下生物量等綜合評價苜蓿品種的抗病性,為快速準確地評價苜蓿品種的抗病性奠定基礎。
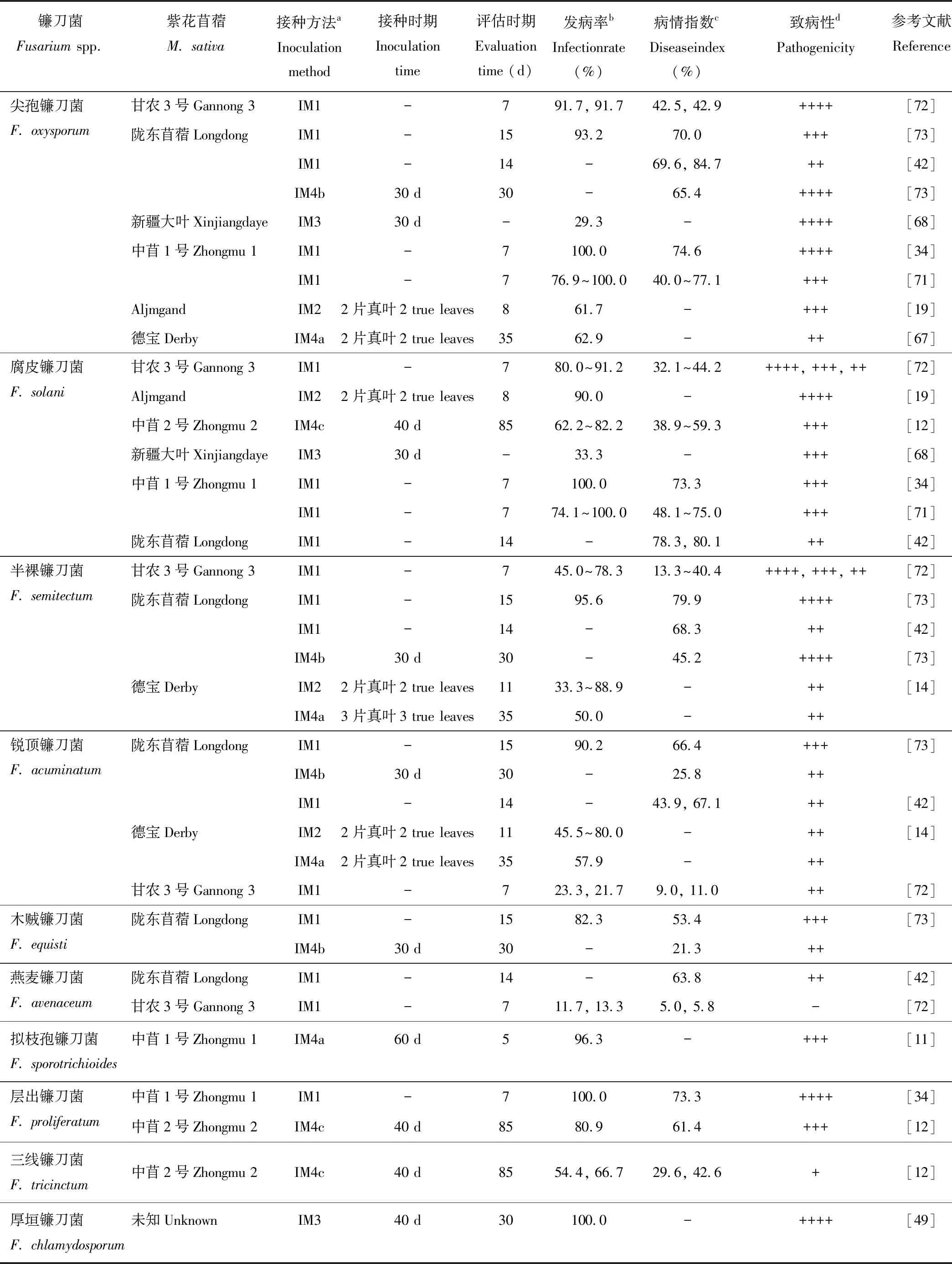
表2 不同鐮刀菌對紫花苜蓿的致病性
aIM1:種子接種法(將消毒后種子放在接菌的人工培養基上);IM2:試管幼苗接種法(在試管幼苗營養液中注入孢子懸浮液);IM3:浸根接種法(將幼苗經孢子懸浮浸根后移入花盆中);IM4:土壤接種法(a. 將孢子懸浮液注入盆栽幼苗土壤中;b. 孢子懸浮液制成米粒接種體放在盆栽幼苗根系周圍;c. 菌絲制成燕麥接種體放在盆栽植株地下1 cm根頸處)。IM1: seed inoculation (put sterilized seeds onto medium with pathogen); IM2: tube-seedling inoculation (inject conidia suspension into test tube with nutrient solution); IM3: root-dipping inoculation (transfer seedlings into pots after roots being dipped with conidia suspension); IM4: soil inoculation (a. inject conidia-suspension into potted-soil with seedlings; b. place millet-seed inoculum around root of potted seedling. c. place oat-inoculum with mycelium at the crown of potted plant, 1 cm underground).
b單一值,1株菌的發病率;兩個數值,2株菌的發病率;區間數值,3株及以上菌株的發病率;-,未知。Single value, infection rate of one isolate; two or more value, infection rate of two or more isolates; -, unknown.
c單一值,一株菌的病情指數;兩個及以上數值,兩株或多株菌的病情指數;-,未知。Single value, disease index of one isolate; two or more value, disease index of two or more isolates; -, unknown.
d致病性強弱:++++,最強;+++,較強;++,致病;+,較弱;-,不致病。Pathogenicity: ++++, strongest; +++, stronger; ++, strong; +, poor; -, non-pathogenicity.
6 防治方法
6.1 選育抗病品種
利用抗病品種防治苜蓿根腐病是最有效的方法,在牧草病害防治體系中占有主導地位。但是目前我國還沒有培育出抗鐮刀菌根腐病的品種,仍依賴于從已有的苜蓿品種中篩選出抗病性相對較強的品種[44]。主要原因是苜蓿抗病品種的選育受以下兩個因素的限制:1)苜蓿是同源四倍體植物,授粉方式為異花授粉,因此高度自交不親和,獲得純化材料較為困難;2)根腐病的病原較為復雜,不同的生態環境引起鐮刀菌根腐病的具體種類不同(表1),要培育適應不同地區抵御不同病原引起的根腐病的抗病品種十分困難。因此,通過傳統的室內和田間篩選很難實現,需要通過分子育種或組織培養等手段培育苜蓿抗病品種。
6.2 加強田間管理
加強田間管理是防治苜蓿根腐病的重要措施。合理的農業管理措施如調節土壤酸堿度、添加作物殘茬、增施堆肥以及輪作等方法可用來控制由鐮刀菌引起的根腐病[83-84]。在苜蓿種植地主要的管理措施首先是要合理密植,播量不宜過大,影響生長;不宜過深,出土慢,增加了土壤中病菌的侵染率[16]。其次,適時刈割,秋季刈割會加重鐮刀菌根腐病的嚴重程度;冬季刈割時留茬不易過短,否則難以越冬[28];選擇適宜的刈割時間和次數在一定程度上可以減輕該病害的發生。另外,科學施肥可以提高苜蓿的抗逆性,如增施鉀可以降低根腐病的發病率和鐮刀菌的入侵;氮∶磷為1∶3可以有效地控制根腐病的發生[85]。
6.3 生物防治
在鐮刀菌根腐病的生物防治方面已經報道的有利用綠色木霉(Trichodermaviride)、芽孢桿菌(Bacillussubtilis)、非致病尖孢鐮刀菌等作為生防菌[63,86-87]。綠色木霉可以產生多種具有生物活性的酶,如幾丁質酶、纖維素酶和木聚糖酶等,可防治由尖孢鐮刀菌引起的根腐病,具有保護和治療的雙重作用[87];從苜蓿根部分離篩選的拮抗細菌枯草芽孢桿菌MB29,既可以抑制苜蓿根腐病菌半裸鐮刀菌、銳頂鐮刀菌、木賊鐮刀菌和尖孢鐮刀菌的生長,同時對苜蓿生長具有促生作用[88];非致病性鐮刀菌是防效較好、較穩定的生防因子,尤其是對鐮刀菌引起的根腐病效果較好[89]。近年來,綠肥的使用也在一定程度上對根腐病有防治作用,主要是由于綠肥可以增加土壤微生物種類、活性以及非致病性鐮刀菌的含量。但是生物防治最重要的是“防”,對于病害還沒有發生時起到保護作用,如果病害發生嚴重,使用拮抗菌的作用沒有化學防治效果好。雖然生物防治受到的關注越來越多,但是在推廣方面還是存在問題,后期需要多方面努力。
6.4 化學防治
化學防治是根腐病防治的有效途徑,但是化學藥品殘留會對土壤及水資源造成嚴重污染。通過種子處理和土壤施藥等方法,枯萎絕和枯腐寧復合使用對鐮刀菌根腐病具有很好的防治作用[90]。甲基托布津、福美雙進行苜蓿種子處理對該病害也具有一定的防治作用[16,58]。大田防治苜蓿鐮刀菌根腐病以有效劑量250 g·hm-250%咯菌腈和43%戊唑醇的防效較好。由于根腐病病原菌主要分布在土壤中且在苗期或成株期都可以從傷口侵入根部,所以對于化學試劑的使用方法具有較高的要求,藥劑量大容易造成環境的污染,量小則達不到防治的效果[18]。
綜上所述,對于苜蓿鐮刀菌根腐病的防治應遵循“防重于治”,對于病害還沒有發生時加強田間監測,同時將抗病品種與田間管理合理結合起來,將選育出來的生長迅速、根系發達的品種種植3年左右,然后每年及時刈割,防止草產量損失,更能有效地防止根腐病的發生。合理的田間管理措施可以改變苜蓿的生長環境,降低病害的發生。化學防治是最直接的方法,篩選有效的化學藥劑可以控制根腐病病原的傳播。
7 問題與展望
7.1 我國苜蓿鐮刀菌根腐病優勢病原菌種類有待進一步明確
已開展研究表明引起我國不同地區苜蓿根腐病的鐮刀菌種類較多,優勢種類依次為尖孢鐮刀菌和腐皮鐮刀菌(表1)。但目前還缺乏關于我國苜蓿所有主要種植區鐮刀菌根腐病病原的大規模分離、系統鑒定和致病性評價,有些苜蓿主要種植區尤其是西北地區的新疆、寧夏和陜西等,苜蓿根腐病的鐮刀菌種類還不明確。因此,今后應進一步明確引致我國苜蓿主要種植區根腐病的優勢鐮刀菌種類以及不同地理和環境區域的優勢鐮刀菌種類,進而研究優勢鐮刀菌種類的生物學特性、對苜蓿的致病性及致病機理以及苜蓿的抗病性和抗病機理等,為苜蓿鐮刀菌根腐病的有效防止提供前期理論依據。
7.2 建立鐮刀菌對苜蓿的致病性評價以及苜蓿對鐮刀菌的抗病性評價標準
關于鐮刀菌對苜蓿的致病性評價,不同學者雖已開展大量研究,但所選植物材料(苜蓿品種)、接種方法、接種時間、病害評估時間、致病性評估指標等不一致,不同菌株對苜蓿的致病性評價缺乏統一的標準,導致不同學者報道的致病性研究結果很難進行對比,且研究結果不一致(表2)。今后應統一進行不同鐮刀菌菌株對苜蓿致病性評價的供試品種、試驗方法和致病性評價指標,為系統比較不同鐮刀菌菌株對苜蓿的致病性奠定基礎,從而快速準確篩選出具有不同致病力的鐮刀菌菌株,為后期致病機理研究提供菌株材料。此外,目前關于鐮刀菌對苜蓿的致病性測定主要集中在單一菌株的室內盆栽致病性研究,對于多種鐮刀菌菌株復合侵染的致病性研究報道較少,今后應加強田間致病性試驗以及多種鐮刀菌菌株復合侵染對苜蓿致病性影響的研究。
關于苜蓿品種對鐮刀菌的抗病性評價方面,不同學者所選病原菌(鐮刀菌菌株)、接種方法、接種時間、病害評估時間和抗病性評估指標等不一致,導致不同學者報道的品種抗病性結果很難進行對比,且研究結果不一致(表3)。此外,進行苜蓿抗病性評價時大多使用單一鐮刀菌菌株,無法確定所篩選品種是否具有廣譜抗病性。今后應規范進行不同品種對鐮刀菌的抗病性評價標準,并研究苜蓿對優勢鐮刀菌種內和種間不同菌株的抗性,從而系統了解不同品種對鐮刀菌的抗病性并篩選廣譜抗病品種,為苜蓿抗鐮刀菌根腐病品種的選育和抗病機理的研究提供植物材料。
7.3 鐮刀菌對苜蓿的致病機理和苜蓿對鐮刀菌的抗病機理
關于鐮刀菌對苜蓿的致病機理,雖然已有較多關于鐮刀菌的致病機理研究,但是關于鐮刀菌對豆科植物尤其是苜蓿的致病機理尤其是分子機理依然未知。今后研究中,應開展苜蓿根腐病優勢鐮刀菌種類種間和種內不同致病力菌株的基因組測序及比較分析,通過轉錄組學研究不同菌株在侵染苜蓿過程中表達的基因,并研究這些基因在鐮刀菌侵染苜蓿過程中的作用,從而揭示鐮刀菌對苜蓿的致病機理。通過開展不同種類鐮刀菌對苜蓿致病機理的研究,發現鐮刀菌主要致病因子,能夠從抑制病原菌致病因子表達角度,為苜蓿根腐病防治新方法的開發應用提供理論依據。苜蓿對鐮刀菌的抗病機理目前也依然未知,今后還應注重開展苜蓿對優勢鐮刀菌種類種間和種內不同致病力菌株的抗病機理研究,尋找苜蓿對鐮刀菌的廣譜和特異性抗病因子,為苜蓿抗鐮刀菌根腐病品種的篩選和培育提供抗性基因,促進苜蓿的可持續生產。
7.4 鐮刀菌孢子形成和萌發的適宜環境條件以及形成和萌發的機理
鐮刀菌尤其是尖孢鐮刀菌產生的3種無性孢子(小分生孢子、大分生孢子和厚垣孢子),在病害發生和循環中發揮重要作用,孢子數量及存活狀況直接影響著病害的發生及其危害程度。但目前關于苜蓿鐮刀菌根腐病病原尤其尖孢鐮刀菌,不同類型孢子形成和萌發的最適環境條件等生物學特性還不明確,后期應開展該方面研究,以期為了解苜蓿根腐病的發病規律提供前期依據。同時開展關于不同類型孢子形成和萌發機理的研究,明確其關鍵調控因子,從而為從調控孢子形成和萌發角度,開發紫花苜蓿鐮刀菌根腐病防治新方法提供理論依據。

