劍麻內參基因篩選與穩定表達分析
張燕梅 王瑞芳 楊子平 鹿志偉 李俊峰 趙艷龍 陸軍迎 周文釗

摘 ?要 ?為了篩選劍麻中穩定表達的內參基因,保證基因表達結果的可靠性,本研究以熱麻1號為材料,采用實時熒光定量RT-PCR方法對來自劍麻轉錄組數據的8個內參基因(EF1α、MADH、ACT2、GAPDH、TUB、ACT54、CYP和EF1β)在煙草疫霉侵染、水楊酸(SA)、茉莉酸甲酯(MeJA)和脫落酸(ABA)處理過程中的表達水平進行檢測,并結合GeNorm、BestKeeper和NormFinder軟件綜合評價8個內參基因的穩定性。結果表明:8個內參基因在不同處理下的表達穩定性存在顯著差異,其中在煙草疫霉侵染和茉莉酸甲酯處理過程中,EF1α表達最穩定,EF1β表達最不穩定。在水楊酸處理過程中,EF1α表達最穩定,ACT2表達最不穩定。在脫落酸處理過程中,GAPDH表達最穩定,ACT54表達最不穩定。該結果為劍麻基因的表達分析提供了可供選擇的內參基因。
關鍵詞 ?劍麻;定量RT-PCR;內參基因
中圖分類號 ?S563.8 ? ? ?文獻標識碼 ?A
Abstract ?In this study, eight reference genes (EF1α, MADH, ACT2, GAPDH, TUB, ACT54, CYP and EF1β) from the transcriptome database, were selected and analyzed in Rema No.1 including Phytophthora nicotianae Breda, MeJA, SA and ABA treatments. Statistical tools, including GeNorm, NormFinder and BestKeeper, were utilized to assess the suitability of reference genes based on the stability rankings for different species. The stability of the eight reference genes was significantly different under different treatments in Rema No.1. For Phytophthora nicotianae Breda and MeJA stresses, EF1α was identified as the most stable gene and EF1β was identified as the least stable gene. For SA stress, EF1α was identified as the most stable gene, and ACT2 was identified as the least stable gene. For ABA stress, GAPDH was identified as the most stable gene, and ACT54 was identified as the least stable gene. The results would provide reliable and optional available reference genes in gene expression analysis of sisal.
Keywords ?sisal; qRT-PCR; reference gene
DOI ?10.3969/j.issn.1000-2561.2019.11.010
劍麻是我國熱區特有的經濟作物之一,劍麻不僅是主要的熱帶纖維原料[1],同時劍麻莖心是釀造龍舌蘭酒的主要原料[2],劍麻麻渣含有較高皂素,可用來制藥[3-4],劍麻也是一種重要的生物質能源[5],近年來,劍麻作為景天酸代謝的模式植物[6],有非常重要的理論和經濟價值。
斑馬紋病是劍麻的主要病害之一,主要由煙草疫霉引起。前期利用轉錄組測序從熱麻1號中篩選了6849個差異表達基因[7],下一步將對部分候選基因進行表達研究,以期了解基因的功能和可能參與的信號途徑。基因表達研究方法很多,其中qRT-PCR技術以其簡單、快速、費用低且靈敏度高等優點成為目前研究的主要方法之一[8],由于不同樣本RNA質量,反轉錄效率以及基因拷貝數等存在較大差異,在采用該方法時,需要一個表達相對穩定的內參基因來進行校正和標準化[9]。目前,龍舌蘭屬中常采用的內參基因有18SrRNA[7, 10]、ACT2[11]、Actin[12]、PU和UBQ11[13],由于基因表達受品種、不同器官以及環境條件影響較大[14-16],為了保證實驗結果真實可靠,根據具體的實驗條件,篩選適宜的內參基因十分必要。本研究從劍麻轉錄組數據中選取8個內參基因[肌動蛋白(ACT2和ACT54)、3-磷酸甘油醛脫氫酶(GAPDH)、親環蛋白(CYP)、β微管蛋白(TUB)、蘋果酸酶(MADH)、轉錄延伸因子(EF1α和EF1β)],利用GeNorm[17]、BestKeeper[18]和NormFinder[19]統計軟件,篩選熱麻1號在煙草疫霉侵染、茉莉酸甲酯(MeJA)、水楊酸(SA)和脫落酸(ABA)處理過程中穩定表達的內參基因。本研究不僅改善了劍麻內參基因少的現狀,還為劍麻基因表達研究提供了可選擇的內參基因,保證了實驗結果的真實可靠。
1 ?材料與方法
1.1 ?材料
用于煙草疫霉接種的為兩年生熱麻1號盆栽苗,用于MeJA、SA和ABA處理的為8~10 cm的熱麻1號組培苗。菌株為本實驗室前期分離保存的煙草疫霉(Phytophthora nicotianae Breda de Haan)。
1.2 ?方法
1.2.1 ?病原接種 ?將保存于PDA斜面的煙草疫霉轉接到V8培養基上,28 ℃培養1周后接種。接種前先用酒精棉反復擦拭葉片,然后用滅菌大頭針刺傷葉片表面,取直徑0.5 cm大小的菌餅將帶菌絲面貼于傷口處,用棉花保濕,每隔2 h加1次水,每個生物學重復當作1個處理,每個處理重復3次。分別在接種0、24、36、48、72 h取熱麻1號葉片,經液氮速凍后?80 ℃保存備用。
1.2.2 ?激素處理 ?取8~10 cm的劍麻組培苗,分別在培養基中加入1 mL SA(10 mmol/L)、MeJA(1 mmol/L)和ABA(0.1 mmol/L)溶液,蓋上蓋子,靜置放于桌面上;每瓶苗當做1個處理,每個處理重復3次;分別在處理前(0 h)、處理3、6、12、24 h取組培苗葉片,液氮速凍后?80 ℃保存備用。
1.2.3 ?RNA提取和cDNA合成 ?用植物RNA提取試劑盒(北京華越洋生物科技有限公司)提取總RNA,取0.5 ?g總RNA用于cDNA第1鏈的合成。cDNA第1鏈的合成采用北京全式金生物技術有限公司的TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix反轉錄試劑盒進行,合成的cDNA按1∶5比例稀釋后?20 ℃保存備用。所有操作均按照試劑盒說明書進行。
1.2.4 ?引物合成 ? 根據轉錄組測序獲得的核酸序列,采用在線引物設計軟件Primer Premier3.0[20]設計內參基因引物,引物長度為18~23 bp,Tm值在57~62 ℃之間,產物大小在100~200 bp之間,并在NCBI上對引物的特異性進行檢測。引物由上海生工生物工程有限公司合成。引物序列見表1。
1.2.5 ?內參基因目的片段的PCR擴增 ? PCR反應體系:2×NOVA Taq-Plus PCR Forest Mix(江蘇愚公生命科技有限公司),10 ?L;引物(10 ?mol/L)F 0.2 ?L,R 0.2 ?L;cDNA 2 ?L;滅菌ddH2O 7.6 ?L。PCR擴增程序:先預變性95 ℃,5 min;然后進入35個循環(95 ℃ 30 s,58 ℃ 1 min,72 ℃ 30 s);最后72 ℃,10 min,擴增產物用2.0%瓊脂糖凝膠電泳進行檢測為單一條帶的引物,將進行下一步的熒光定量PCR擴增。
1.2.6 ?內參基因熒光定量PCR擴增 ? 熒光定量PCR擴增采用北京全式金生物技術有限公司的TransStart? Top Green qPCR SuperMix試劑盒,具體操作按說明書進行。熒光定量PCR反應體系:2×TransStart? Top Green qPCR SuperMix 10 ?L;cDNA 2 ?L;引物(10 ?mol/L)F 0.4 ?L,R 0.4 ?L;滅菌ddH2O 7.2 ?L。擴增程序:先預變性95 ℃,1 min,然后進入45個循環(95 ℃ 10 s,62 ℃ 30 s,72 ℃ 30 s);每個樣品設置3次重復,反應結束后進行溶解曲線分析,根據熔解曲線確定產物的特異性。
1.3 ?數據處理
實時熒光定量RT-PCR后,儀器會自動得出Ct值,首先利用GeNorm[17]、NormFinder[19]和BestKeeper[18]軟件分別計算出不同處理下內參基因的表達穩定性(M值)、穩定值(SV值)和變異系數(CV)/標準偏差(SD)值,并根據M值、SV值和CV/SD值按從小到大對內參基因表達穩定性進行排序,值越小對應的內參基因越穩定。最后根據geNorm、NormFinder和BestKeeper軟件的排序結果,計算出每個內參基因穩定性綜合排序。
2 ?結果與分析
2.1 ?內參基因的選擇
在轉錄組數據分析中,基因表達量的計算常用的是FPKM(fragments per kb per million reads)算法[21],其中FPKM值的高低代表基因轉錄本數的高低。由于劍麻已知的內參基因較少,因此在選擇基因時,根據劍麻轉錄組和表達譜數據,選擇轉錄本數較高的,且在煙草疫霉接種過程中表達穩定的基因作為候選內參基因(表1)。包括肌動蛋白2(ACT2)、3-磷酸甘油醛脫氫酶(GAPDH)、轉錄延伸因子1-(EF1)、親環蛋白(CYP)、β微管蛋白(TUB)、蘋果酸酶(MADH)、轉錄延伸因子1-β(EF1β)、肌動蛋白54(ACT54)。
2.2 ?引物特異性分析
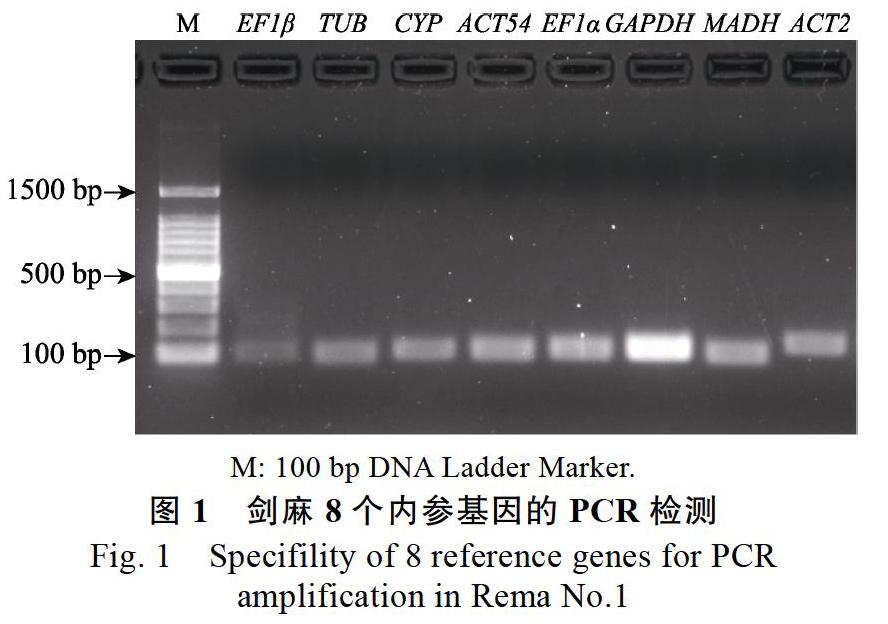
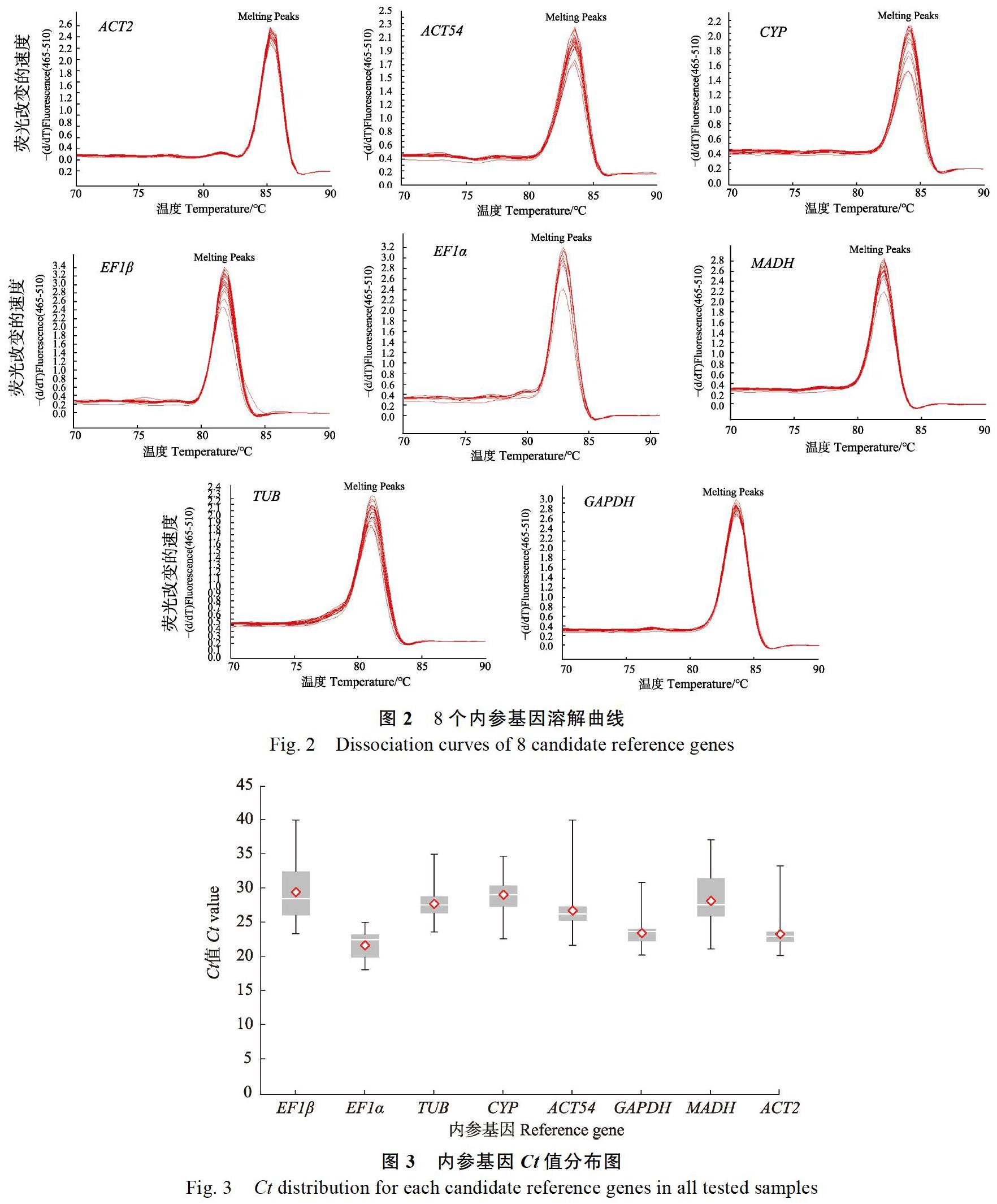
電泳檢測結果顯示8個候選內參基因均擴增出單一條帶,且條帶大小與預期產物相符(圖1),表明引物特異性較好,可用于實時熒光定量RT-PCR分析。而實時熒光定量RT-PCR熔解曲線分析則表明,8個基因的溶解曲線均呈現顯著的單一峰(圖2),可用于內參基因表達穩定性分析。
2.3 ?內參基因表達分析
內參基因的Ct值反映基因的表達水平,Ct值越低表示基因的表達豐度越高。并且同一基因在不同條件下的Ct值變化反應基因表達水平的變化,Ct變化越小則該基因穩定性越好。8個候選內參基因Ct平均值在21.70~29.47之間,其中EF1β的平均Ct值最大,為29.47,即該基因的表達豐度最低,EF1α的Ct平均值最小,為21.70,即該基因的表達豐度最高。從Ct值的分布圖可以看出,8個內參基因的表達豐度從高到低依次為EF1α>ACT2> GAPDH>ACT54>TUB>MADH>CYP>EF1β(圖3)。
2.4 ?內參基因穩定性分析
2.4.1 ?GeNorm分析 ?GeNorm內參分析軟件根據計算出的候選內參基因在不同樣品中的表達穩定性來確定最穩定的內參基因,M值越大,則基因的穩定性越低,M值越小,基因的穩定性越高。一般地,M≤1.5才視為穩定表達[17]。GeNorm分析結果表明,在煙草疫霉侵染過程中,EF1α和MADH的穩定值最低,為0.65,TUB的穩定值最高,為1.14,即在煙草疫霉侵染過程中,EF1α和MADH表達最穩定,TUB表達最不穩定。SA處理過程中,EF1α和GAPDH的M值最小,為0.29,ACT2的M值最大,為1.28,即在SA處理過程中,EF1α和GAPDH表達最穩定,ACT2表達最不穩定。MeJA處理過程中,EF1α和ACT2的M值最小,為0.16,MADH的M值最大,為1.96,即在MeJA處理過程中EF1α和ACT2表達最穩定,MADH表達最不穩定。ABA處理過程中,GAPDH和ACT2的M值最低,為0.82,EF1β的M值最高,為3.28,即在ABA處理過程中,GAPDH和ACT2表達最穩定,EF1β表達最不穩定(圖4)。
2.4.2 ?NormFinder分析 ?NormFinder是結合組內方差與組間方差計算候選內參基因的穩定值進行評價,SV值越小,內參基因表達越穩定[19]。NormFinder分析顯示,在煙草疫霉侵染過程中,EF1α表達最穩定(SV=0.30),TUB表達最不穩定(SV=0.78),在SA處理過程中,GAPDH表達最穩定(SV=0.08),ACT2表達最不穩定(SV= 1.79)。在MeJA處理過程中,ACT2表達最穩定(SV=0.06),MADH表達最不穩定(SV=1.86)。在ABA處理過程中,GAPDH表達最穩定(SV= 0.28),ACT2表達最不穩定(SV=3.78)(圖5)。
2.4.3 ?Bestkeeper分析 ?Bestkeeper是通過計算變異系數和標準偏差來反映內參基因的穩定性,其中變異系數和標準差越小,內參基因的穩定性越好,反之穩定性越差[18]。BestKeeper分析表明,在煙草疫霉侵染過程中,EF1α的CV和SD最小(CV=0.95;SD=0.19),表達最穩定,EF1β表達最不穩定(CV=3.56;SD=0.9)。在SA處理過程中,EF1α表達最穩定(CV=1.3;SD=0.3),ACT2表達最不穩定(CV=5.56;SD=1.34)。在MeJA處理過程中,EF1α表達最穩定(CV=2.39;SD=0.56),MADH表達最不穩定(CV=8.54;SD=2.51)。在ABA處理過程中,EF1α(SD最小,為1.35)和CYP表達最穩定(CV最小,為6.04),ACT54最不穩定(CV=3.46;SD=14.74)(圖6)。
2.4.4 ?綜合性分析 ?對GeNorm、NormFinder和BestKeeper軟件分析得到的穩定性排名求幾何平均值,得到綜合指數排名,指數越小,說明內參基因表達越穩定。由圖7可見,8個候選內參基因在煙草疫霉侵染過程中基因表達穩定性由高到低依次為EF1α、MADH、ACT2、GAPDH、TUB、ACT54、CYP、EF1β;MeJA處理過程中基因表達穩定性由高到低依次為EF1α、ACT2、GAPDH、ACT54、CYP、TUB、EF1β、MADH;SA處理過程中基因表達穩定性由高到低依次為EF1α、GAPDH、ACT54、MADH、EF1β、TUB、CYP、ACT2;ABA處理過程中基因表達穩定性由高到低依次為GAPDH、CYP、ACT2、EF1α、TUB、MADH、EF1β、ACT54(圖7)。
3 ?討論
一般認為,理想的內參基因在不同發育階段、不同組織以及不同逆境條件下表達穩定且表達水平與目標基因相近,并且常常選擇管家基因如ACTIN、TUB、GAPDH、EF1α等作為內參基因[9, 16, 22-23]。但越來越多的研究表明,管家基因的表達水平會受不同實驗條件影響而發生變化[24-25],因此,根據具體的實驗條件選擇穩定的內參基因對基因表達分析尤為重要,并且在多種植物中均有報道[25-27]。
本研究發現,同一基因在不同實驗條件下穩定性存在較大差異,如ACT2在MeJA處理過程中表達最穩定,在SA處理過程中表達最不穩定。研究還發現同一基因家族中的不同成員,表達穩定性也存在較大差異。如EF1α和EF1β在煙草疫霉侵染過程中表達最穩定,EF1β最不穩定。Rudu?等[27]也發現野生燕麥中的GAPDH1和GAPDH2的穩定性也存在很大差異。由此可見,內參基因并不是通用的,其選擇要根據不同的實驗條件而定,同時也說明篩選和開發新的內參基因的重要性。
本研究利用轉錄組數據開發劍麻新的內參基因,通過表達分析證實了新開發的基因EF1α在MeJA、SA和ABA處理過程中表達較常用的Actin[11-12]更穩定。隨著組學時代的發展,利用RNA-Seq挖掘新的內參基因顯得尤為突出也十分重要[28-30]。如Gao等[29]利用轉錄組序列篩選出條斑紫菜適應于失水和低溫等非生物脅迫的內參基因MAP、UBC和FHP,在脫水脅迫下穩定表達的內參基因CGS1和UBC,低溫脅迫下穩定表達的內參基因MAP、UBC和CGS1。Xu等[30]發現Fb15和eIF-4a在水稻胚乳發育過程中的表達比ACT、GAPDH等11個常用的管家基因更穩定。鑒于此,本研究對劍麻煙草疫霉、SA、MeJA和ABA處理后的內參基因進行表達分析,篩選穩定表達的內參基因,為劍麻下一步的基因功能研究提供可供選擇的內參基因,具有十分重要的意義。
參考文獻
[1] Corbin K R, Byrt C S, Bauer S, et al. Prospecting for energy-rich renewable raw materials: Agave leaf case study[J]. PLoS One, 2015, 10(8): e0135382.
[2] Escalante A, López Soto D R, Velázquez Gutiérrez J E, et al. Pulque, a traditional Mexican alcoholic fermented beverage: historical, microbiological, and technical aspects[J]. Frontiers in Microbiology, 2016, 7: 1026.
[3] Pereira G M, Ribeiro M G, da Silva B P, et al. Structural characterization of a new steroidal saponin from Agave angustifolia var. Marginata and a preliminary investigation of its in vivo antiulcerogenic activity and in vitro membrane permeability property[J]. Bioorganic & Medicinal Chemistry Letters, 2017, 27(18): 4345-4349.
[4] López-Romero J C, Ayala-Zavala J F, González-Aquilar G A, et al. Biological activities of agave by-products and their possible applications in foods and pharmaceuticals[J]. Journal of the Science of Food and Agriculture, 2018, 98(7): 2461-2474.
[5] Mielenz J R, Rodriguez M, Thompson O A, et al. Development of agave as a dedicated biomass source: production of biofuels from whole plants[J]. Biotechnology for Biofuels, 2015, 8(1): 79.
[6] Stewart J R. Agave as a model CAM crop system for a warming and drying world[J]. Frontier in Plant Science, 2015, 6: 684.
[7] 張燕梅, 趙艷龍, 李俊峰, 等. 劍麻與煙草疫霉互作過程中的轉錄組研究[J]. 熱帶作物學報, 2018, 39(3): 540-546.
[8] Wang M L, Medrano J F. Real-time PCR for mRNA quantitation[J]. Biotechniques, 2005, 39(1): 75-85.
[9] Kozera B, Rapacz M. Reference genes in real-time PCR[J]. Journal of Applied Genetics, 2013, 54(4): 391-406.
[10] Zhou W Z, Zhang Y M, Lu J Y, et al. Construction and evaluation of normalized cDNA libraries enriched with full-length sequences for rapid discovery of new genes from sisal (Agave sisalana Perr.) different developmental stages[J]. International Journal of Molecular Sciences, 2012, 13(12): 13150-13168.
[11] Abraham Juárez M J, Hernández Cárdenas R, Santoyo Villa J N, et al. Functionally different PIN proteins control auxin flux during bulbil development in Agave tequilana[J]. Journal of Experimental Botany, 2015, 66(13): 3893-3905.
[12] Gao J M, Yang F, Zhang S Q, et al. Expression of a hevein-like gene in transgenic Agave hybrid No.11648 enhances tolerance against zebra stripe disease[J]. Plant Cell Tissue and Organ Culture, 2014, 119(3): 579-585.
[13] Sandoval S C D, Juárez M J A, Simpson J. Agave tequilana MADS genes show novel expression patterns in meristems, developing bulbils and floral organs[J]. Sexual Plant Reproduction, 2012, 25(1): 11-26.
[14] Wang P H, Xiong A S, Gao Z H, et al. Selection of suitable reference genes for RT-qPCR normalization under abiotic stresses and hormone stimulation in persimmon (Diospyros kaki Thunb)[J]. PLoS One, 2016, 11(8): e0160885.
[15] Thellin O, Zorzi W, Lakaye B, et al. Housekeeping genes as internal standards: use and limits[J]. Journal of Biotechnology, 1999, 75(2-3): 291-295.
[16] Lin F, Jiang L, Liu Y, et al. Genome-wide identification of housekeeping genes in maize[J]. Plant Molecular Biology, 2014, 86(4-5): 543-554.
[17] Vandesompele J, DePreter K, Pattyn F, et al. Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes[J]. Genome Biology, 2002, 3(7): RESEARCH0034.
[18] Andersen C L, Jensen J L, ?rntoft T F. Normalization of real-time quantitative reverse transcription-PCR data: a model-based variance estimation approach to identify genes suited for normalization, applied to bladder and colon cancer datasets[J]. Cancer Research, 2004, 64(15): 5245-5250.
[19] Pfaffl M W, Tichopad A, Prgomet C, et al. Determination of stable housekeeping genes, differentially regulated target genes and sample integrity: BestKeeper-excel-basedtool using pair-wise correlations[J]. Biotechnology Letters, 2004, 26(6): 509-515.
[20] Untergasser A, Cutcutache I, Koressaar T, et al. Primer3- new capabilities and interfaces[J]. Nucleic Acids Research, 2012, 40(15): e115.
[21] Mortazavi A, Williams B A, McCue K, et al. Mapping and quantifying mammalian transcriptomes by RNA-Seq[J]. Nature Methods, 2008, 5(7): 621-628.
[22] Dheda K, Huggett J F, Bustin S A, et al. Validation of housekeeping genes for normalizing RNA expression in real-time PCR [J]. Biotechniques, 2004, 37(1): 112-119.
[23] Chervoneva I, Li Y, Schulz S, et al. Selection of optimal reference genes for normalization in quantitative RT-PCR[J]. BMC Bioinformatics, 2010, 11(1): 253.
[24] Sudhakar Reddy P, Srinivas Reddy D, Sivasakthi K, et al. Evaluation of Sorghum Sorghum bicolor (L.) reference genes in various tissues and under abiotic stress conditions for quantitative Real-time PCR data normalization[J]. Frontiers in Plant Science, 2016, 7: 529.
[25] Xu H, Bao J D, Dai J S, et al. Genome-Wide identification of new reference genes for qRT-PCR normalization under high temperature stress in rice endosperm[J]. PLoS One, 2015, 10(11): e0142015.
[26] Narsai R, Ivanova A, Ng S, et al. Defining reference genes in Oryza sativa using organ, development, biotic and abiotic transcriptome datasets[J]. BMC Plant Biology, 2010, 10(1): 56.
[27] Rudu? I, Kepczyński J. Reference gene selection for molecular studies of dormancy in wild oat (Avena fatua L) caryopses by RT-qPCR method[J]. PLoS One, 2018, 13(2): e0192343.
[28] Hu X, Zhang L, Nan S, et al. Selection and validation of reference genes for quantitative real-time PCR in Artemisia sphaerocephala based on transcriptome sequence data[J]. Gene, 2018, 657: 39-49.
[29] Gao D, Kong F, Sun P, et al. Transcriptome-wide identification of optimal reference genes for expression analysis of Pyropia yezoensis responses to abiotic stress[J]. BMC Genomics, 2018, 19(1): 251.
[30] Xu H, Bao J D, Dai J S, et al. Genome-wide identification of new reference genes for qRT-PCR normalization under high temperature stress in rice endosperm[J]. PLoS One, 2015, 10(11): e0142015.

