根際鹽分差異性分布對高粱幼苗生長發育的影響
張華文,王潤豐,徐夢平,劉賓,陳二影,黃瑞冬,周宇飛,王海蓮
根際鹽分差異性分布對高粱幼苗生長發育的影響
張華文1,3,王潤豐1,3,徐夢平1,3,劉賓1,3,陳二影1,3,黃瑞冬2,周宇飛2,王海蓮1,3
(1山東省農業科學院作物研究所,濟南 250100;2沈陽農業大學農學院,沈陽 110866;3山東省特色作物工程實驗室,濟南 250100)
【】鹽堿地鹽分含量在土壤表層的分布通常是不均勻的,研究不均勻鹽脅迫條件下高粱幼苗生長發育和生理生化指標的變化,可為鹽堿地高粱栽培和鹽堿地高效開發利用提供理論依據。利用分根法將高粱根系均勻分成2部分,并分別置于不同濃度(mmol·L-1)NaCl中,設置對照為無鹽脅迫(記作0/0,下同)、不均勻鹽處理(0/200、50/150)和均勻鹽處理(100/100),在人工氣候室培養14 d后取樣,測量生物量、葉面積、SPAD值、根系形態、滲透調節物質、抗氧化酶活性和光合參數等性狀,研究分根鹽脅迫條件下高粱生長發育的變化規律。不均勻鹽脅迫和均勻鹽脅迫均嚴重影響了高粱幼苗的生長發育,顯著降低了高粱幼苗鮮重、干重和葉面積,對葉片的光合能力、抗氧化酶活性和滲透調節物質均有一定程度的影響。然而,不均勻鹽處理50/150和0/200的單株干重比均勻鹽處理提高了21.19%和62.71%,單株鮮重提高了35.39%和86.44%,葉面積提高了13.22%和88.66%;50/150處理低鹽一側根系鮮重和干重分別是高鹽一側的1.90倍和2.10倍,0/200處理無鹽一側根系鮮重和干重分別是鹽脅迫一側的3.02倍和3.75倍。同樣,不均勻鹽處理對局部根系形態影響顯著,低鹽或無鹽一側根系生長明顯增加,50/150和0/200處理低鹽一側的根系長度、根系體積、根尖數和分支數顯著高于高鹽或有鹽脅迫一側根系,進而不均勻鹽脅迫條件下整個根系的根系長度、根系體積、根尖數和分支數都高于均勻鹽脅迫處理,其中0/200處理的各項指標與均勻鹽處理差異均達到顯著性水平(<0.05)。葉片超氧化物歧化酶(SOD)、過氧化氫酶(CAT)和過氧化物酶(POD)活性在不均勻鹽脅迫條件下顯著升高(<0.05);不均勻鹽處理的葉片滲透調節性物質脯氨酸(PRO)和可溶性糖(SS)含量顯著高于均勻鹽處理,丙二醛(MDA)含量顯著下降(<0.05)。不均勻鹽處理條件下植株光合能力相對于均勻鹽處理也得到顯著改善,主要體現在顯著升高的光合速率(n)、氣孔導度(s)和蒸騰速率(r);相較于均勻鹽處理,在不均勻鹽處理條件下50/150、0/200的熒光參數實際光化學效率(ΦPSⅡ)、最大光化學效率(Fv/Fm)和電子傳遞效率(ETR)分別提高了5.64%和19.00%、9.25%和18.89%、1.93%和6.89%,其中0/200處理的ΦPSⅡ和Fv/Fm與100/100處理的差異達到顯著性水平(<0.05)。不均勻鹽處理和均勻鹽處理對高粱幼苗生長均產生抑制,但在不均勻鹽脅迫條件下,由于低鹽或無鹽一側根系補償性增長,整個根系形態得到改善,葉片抗氧化酶活性、滲透調節能力和光合能力均有一定程度提高,因而緩解鹽脅迫對高粱幼苗的危害。
高粱;分根;不均勻鹽處理;光合參數;熒光參數
0 引言
【研究意義】高粱((L.) Moench)是世界上最重要的谷類糧食作物之一,也是中國的重要糧食作物、飼用作物和能源作物,具有耐鹽堿、耐旱、耐澇、耐貧瘠等多重抗性。目前,高粱主要分布于鹽堿、干旱等邊際性土地,在鹽堿地區種植高粱,有利于鹽堿土壤的利用和改良,對擴大耕地面積、增加農民收入、保障糧食安全具有重要意義。由于鹽漬土的形成受多種自然因素和人為因素的影響,鹽堿地鹽分在土壤表層的分布通常是不均勻的[1],這種土壤表層的不均勻分布造成同一單株的根系分布在不同鹽分濃度的土壤環境中,不僅影響地上部的生長發育,而且顯著地影響根系的生長發育和生理特性,進而影響作物的產量和品質[2-3]。因此,研究根際鹽分差異性分布對高粱生長的影響,探索高粱耐鹽機理,對改善局部鹽脅迫程度的高粱種植模式具有重要意義。【前人研究進展】鹽脅迫對植物影響的報道主要在鹽分均勻條件下進行的[4-5],研究發現鹽脅迫對植物的影響主要包括滲透脅迫、離子毒害、活性氧增加和Na+/K+失調,進而導致新陳代謝失調、生長緩慢、甚至死亡[6-8]。也有部分作物(如番茄、黃瓜、苜蓿、葡萄、棉花等)通過分根鹽處理研究鹽分差異性分布對植物生長發育的影響[9-16],發現不均勻鹽脅迫下,植物的生物量高于均勻鹽脅迫下植物的生物量,植物主要是通過低鹽一側大量吸收水分來緩解鹽脅迫造成的生理干旱[16-18];也有研究表明,根系在非脅迫區域大量的增殖,特別是細根在無鹽脅迫區的增加,可以促進水分吸收,緩解鹽脅迫[19]。鹽脅迫通常會破壞植物代謝過程,降低植物光合效率[20],但不均勻鹽脅迫提高了植物的氣孔導度和蒸騰速率[18,21-22]。不均勻鹽脅迫比均勻鹽脅迫可明顯減少Na+在棉花、葡萄體內的積累,增加對K+的吸收,有效緩解鹽害[2,16,23-24]。【本研究切入點】近年來,通過不均勻鹽脅迫研究植物耐鹽性已經成為一種重要手段[1,25],雖然國內外對高粱耐鹽性開展了大量研究,但無論是從耐鹽種質的篩選和鑒定,還是遺傳改良及耐鹽栽培生理等研究,都是在鹽分均勻條件下進行的[26],鹽分差異性分布對高粱耐鹽性影響的研究還鮮見報道。【擬解決的關鍵問題】本研究通過分根試驗將根系處于不同鹽濃度條件下研究鹽分差異分布對高粱幼苗生長發育的影響,并通過分析光合參數、熒光參數、滲透調節物質和抗氧化酶活性等生理指標研究鹽分差異分布能夠緩解高粱苗期鹽脅迫的生理機制,從而為鹽堿地高粱栽培和高效開發利用提供理論依據。
1 材料與方法
1.1 試驗材料與處理
試驗材料為山東省農業科學院作物研究所自主選育的高粱雜交種濟粱1號。高粱根系由初生根、次生根和支持根組成,初生根由胚根發育形成,只有1條。如果由于種子受到機械損傷,在盾片著生部位能長出少數短而細的根,稱為初生不定根,初生根和初生不定根統稱為種子根,高粱幼苗四葉后才開始長次生根。高粱要進行苗期分根試驗,就必須切掉初生根,使其盡早長出不定根,以便進行分根試驗。
挑取整齊一致的高粱種子,用70%的酒精浸泡2 min,蒸餾水沖洗3遍,轉到鋪有2層濾紙、直徑為100 mm的玻璃培養皿中,加入6 mL蒸餾水,封口后放入光照培養箱。待種子根長度為0.8—1.2 cm時,用醫用手術刀從初生根基部切去初生根,然后將切根的種子進行沙培,沙子滅菌處理后裝在育苗盤中,澆灌1/2Hoagland營養液,把種子擺好(根向下),上層覆蓋1 cm厚的濕潤沙子,期間澆灌1次Hoagland營養液,并給予適當干旱鍛煉,以促進根系的發育。培養箱條件:光照14 h,27℃,光照強度10 000 lx;黑暗10 h,22℃,光照強度0。三葉期,將高粱苗小心挖出,沖掉沙子,在水中將根系對等分為2份,分根移栽到中間有隔斷的塑料盒中,每盒5株,水培培養條件為溫度26℃—29℃,濕度65%—75%,緩苗6—8 d,檢查根系的發育情況,將兩側根系發育均勻、幼苗大小一致的3株留作試驗材料,其余淘汰掉。
1.2 試驗設計
試驗共設計4個處理,每個處理重復12次。配置50、100、150和200 mmol·L-1NaCl溶液。一部分高粱幼苗的兩部分根用同一濃度的NaCl溶液處理,形成在兩側的均勻鹽處理(100/100);另一部分幼苗一側根用低濃度NaCl溶液,另一側用高濃度NaCl溶液,形成在兩側根部的不均勻鹽處理(50/150、0/200)。無論均勻鹽處理還是不均勻鹽處理,根區的平均NaCl濃度都為100 mmol·L-1,鹽脅迫14 d后,對相關性狀進行測定,取樣用于生理生化指標分析。
1.3 指標測定
1.3.1 生長指標的測定 將高粱幼苗從分根塑料盒中完整取出,分別對根系和地上部分采樣,清理干凈,測定鮮重。然后把樣品放在105℃烘箱殺青30 min,再于80℃烘干至恒重,稱其干重。用直尺測定葉長和葉寬,并乘以校正系數0.72計算葉面積[27]。
1.3.2 葉片SPAD值的測定 用便攜式葉綠素儀(SPAD-502Plus)測量新展開3個葉片的SPAD(soil and plant analyzer development)值。
1.3.3 葉片抗氧化酶活性和滲透調節物質的測定 采用氮藍四唑法測定超氧化物歧化酶(superoxide dismutase,SOD)活性,采用愈創木酚法測定過氧化物酶(peroxidase,POD)活性[28]。采用紫外吸收法檢測過氧化氫酶(catalase,CAT)活性,采用蒽酮比色法測定可溶性糖(soluble sugar,SS)含量[29]。采用硫代巴比妥酸法測定丙二醛(malondialdehyde,MDA)含量,采用酸性茚三酮法測定脯氨酸(proline,PRO)含量[30]。所有試劑盒均購自蘇州科銘生物技術公司。
1.3.4 根系形態的測定 將高粱幼苗從分根塑料盒中取出,清理干凈,用WinRHIZO植物根系分析測定儀掃描根系,并用其根系分析軟件對根系長度、體積、根尖記數和分支計數等進行分析。
1.3.5 光合參數的測定 每個處理選6株長勢一致的植株,置于太陽光下激活2 h,用Li-6400便攜式光合儀(Li-CORInc, USA)于晴天上午9:00—11:00對各植株最新展開葉片的光合速率、氣孔導度、細胞間隙CO2濃度和蒸騰速率進行測定,測定光源為紅藍人工光源,光照強度1 000 μmol·(m-2s-1)。
1.3.6 熒光參數的測定 用英國Hansatech公司產FMS-2型熒光儀,于晴天上午9:00—11:00,每個處理選6株長勢一致的植株,置于太陽光下2 h,測定最新展開葉片最大光化學效率(optimal/maximal PSⅡefficiency,Fv/Fm)、實際光化學效率(actual photochemical efficiency of PSⅡ,ФPSⅡ)和電子傳遞效率(electron transportation rate,ETR)。
1.4 數據分析和數據可視化
采用Microsoft Excel(ver.2010)對采集的原始數據初步整理和作圖,運用Minitab(ver. 18.0)中的混合線性模型(mixed linear model)進行方差分析(analysis of variance)。
2 結果
2.1 分根鹽處理對高粱幼苗農藝性狀的影響
從表1可以看出,鹽脅迫均顯著降低了高粱幼苗鮮重和干重,與對照相比,100/100、50/150和0/200處理單株鮮重分別降低了55.78%、40.13%和17.55%,單株干重分別比對照降低了44.86%、33.18%和10.28%。但是,與100/100處理相比,不均勻鹽處理50/150和0/200的地上部分鮮重分別提高了23.58%和102.20%,根系鮮重分別提高了49.82%和63.10%,單株鮮重分別提高了35.39%和86.44%;不均勻鹽處理50/150和0/200比均勻鹽處理100/100地上部分干重增加了21.74%和67.39%,根系干重增加了14.81%和40.74%,單株干重分別提高了21.19%和62.71%。對不同鹽處理單側根系鮮重和干重進行分析發現,不均勻鹽處理低鹽或無鹽一側根系鮮重和干重顯著高于高鹽一側,50/150處理低鹽一側根系鮮重是高鹽一側根系的1.90倍,根系干重是高鹽一側的2.10倍;0/200處理無鹽一側根系鮮重是鹽脅迫一側根系的3.02倍,根系干重是鹽脅迫一側根系的3.75倍。50/150處理低鹽一側根系鮮重和干重顯著高于均勻鹽處理,雖然高于無鹽對照,但差異不顯著,0/200處理無鹽一側根系鮮重和干重顯著高于無鹽對照和均勻鹽處理。
分根鹽處理對高粱幼苗葉面積有顯著影響,與對照相比,100/100、50/150和0/200鹽處理葉面積分別降低了60.70%、55.51%和25.86%,并且達到了顯著性水平;不均勻鹽處理50/150和0/200比均勻鹽處理100/100的葉面積分別提高了13.22%和88.66%,其中,0/200和100/100處理葉面積差異達到了顯著性水平(表1)。
2.2 分根鹽處理對根系形態的影響
不同鹽處理對幼苗根系形態有顯著影響,不均勻鹽處理0/200根系長度最高,顯著高于100/100和50/150處理,均勻處理100/100的根系長度顯著低于對照。鹽處理的根系體積與無鹽對照相比都有一定程度的下降,不均勻鹽處理的0/200根系體積顯著高于均勻鹽處理,50/150處理高于均勻處理,但差異不顯著。鹽處理對根尖數和根分支數的影響相似,鹽處理顯著降低了根尖數和根分支數,不均勻鹽處理50/150和0/200比均勻鹽處理根尖數分別增加了5.41%和23.60%,根分支數分別增加了19.40%和76.13%,0/200和100/100處理之間差異達到顯著性水平。不均勻鹽處理對局部根系形態影響顯著,低鹽一側根系生長明顯增加,50/150處理低鹽一側的根系長度、根系體積、根尖數和分支數比高鹽一側分別增加了66.62%、51.39%、47.00%和75.65%,比均勻鹽處理100/100分別增加了27.48%、43.42%、25.47%和52.17%,差異均達到顯著性水平;0/200處理,無鹽一側的根系長度、根系體積、根尖數和分支數比鹽脅迫一側分別增加了164.07%、219.40%、128.21%和296.26%,比均勻鹽處理100/100分別增加了72.99%、181.58%、81.45%和181.28%,差異均達到顯著性水平,比無鹽對照分別增加了49.01%、38.96%、37.95%和3.86%,前三項性狀差異顯著(表2)。
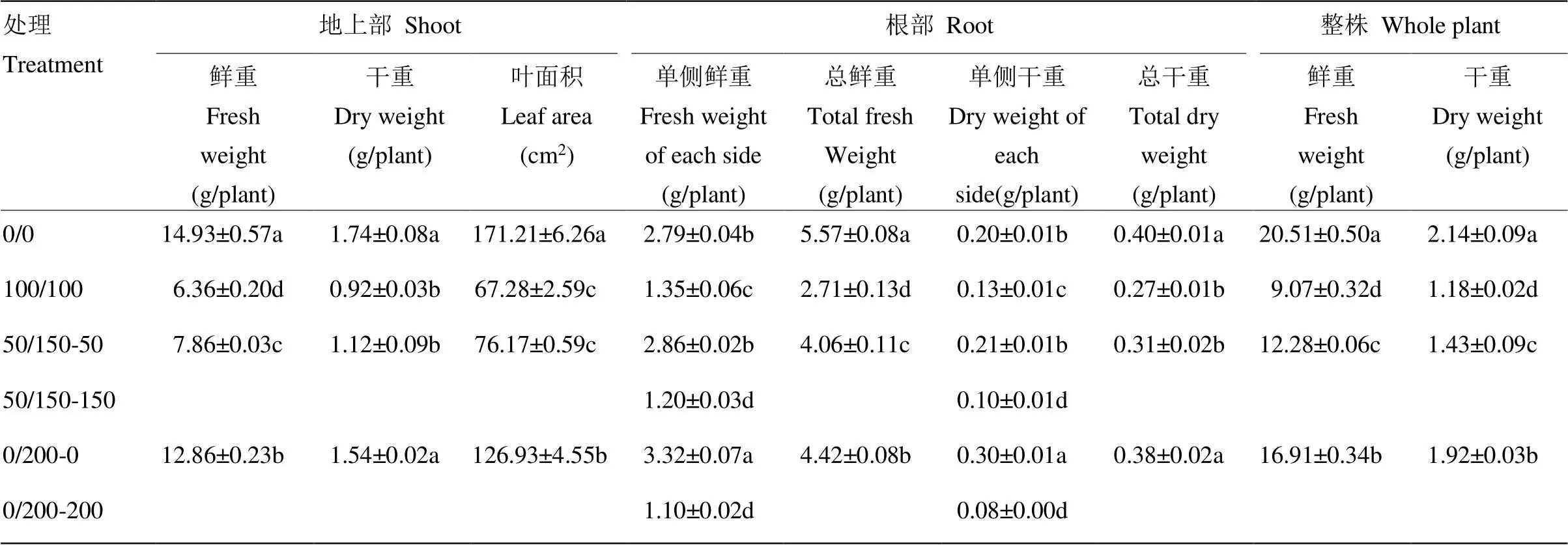
表1 分根鹽處理對高粱幼苗農藝性狀的影響
表中數值為平均值±標準差。同一列不同字母表示差異顯著(<0.05)。“/”兩側的數值分別代表高粱兩側根部NaCl處理濃度(mmol·L-1)。50/150-50、50/150-150、0/200-0和0/200-200表示不均勻鹽處理局部根系所處的NaCl處理濃度(mmol·L-1)。下同
Values in the table are means ± standard deviation (SD). The different letters of the same column indicate the significance of the difference (< 0.05). Values on both sides of the slash mark, “/”, indicate NaCl concentrations for the corresponding root sides. 50/150-50, 50/150-150, 0/200-0, and 0/200-200 indicate the partial-root of different NaCl concentrations under the non-uniform salinity treatments. The same as below
2.3 分根鹽處理對葉片光合作用的影響
對新展開3個葉片的SPAD值進行分析表明,分根鹽處理對幼苗葉片的葉綠素含量有顯著的影響,與無鹽對照相比,分根鹽處理3個葉片的SPAD值都有一定程度的降低,3個葉片無鹽對照與鹽處理的100/100、50/150差異都達到了顯著性水平,與0/200處理差異不顯著。不均勻鹽處理與均勻鹽處理的SPAD值相比較,均有一定程度的提高,0/200處理3個葉片SPAD值顯著高于100/100處理,50/150處理的第1和第2葉片的SPAD值顯著高于100/100處理,第3葉片差異沒有達到顯著性水平,0/200處理的第1和第3葉片的SPAD值顯著高于50/150,第2葉片差異不顯著(圖1)。
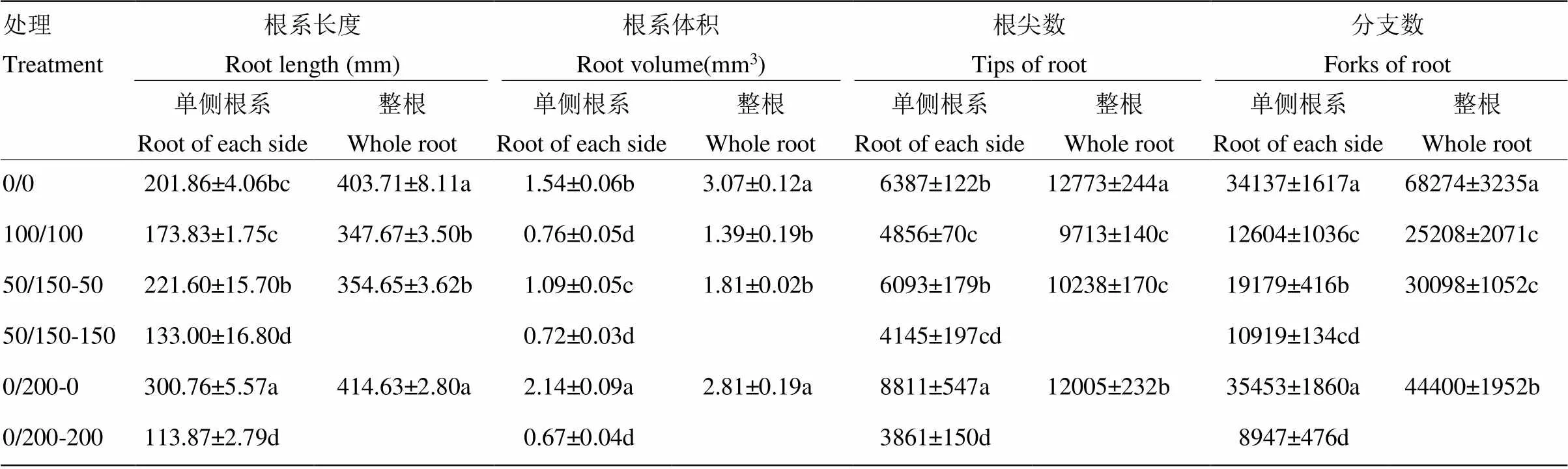
表2 分根鹽處理對高粱根系形態的影響
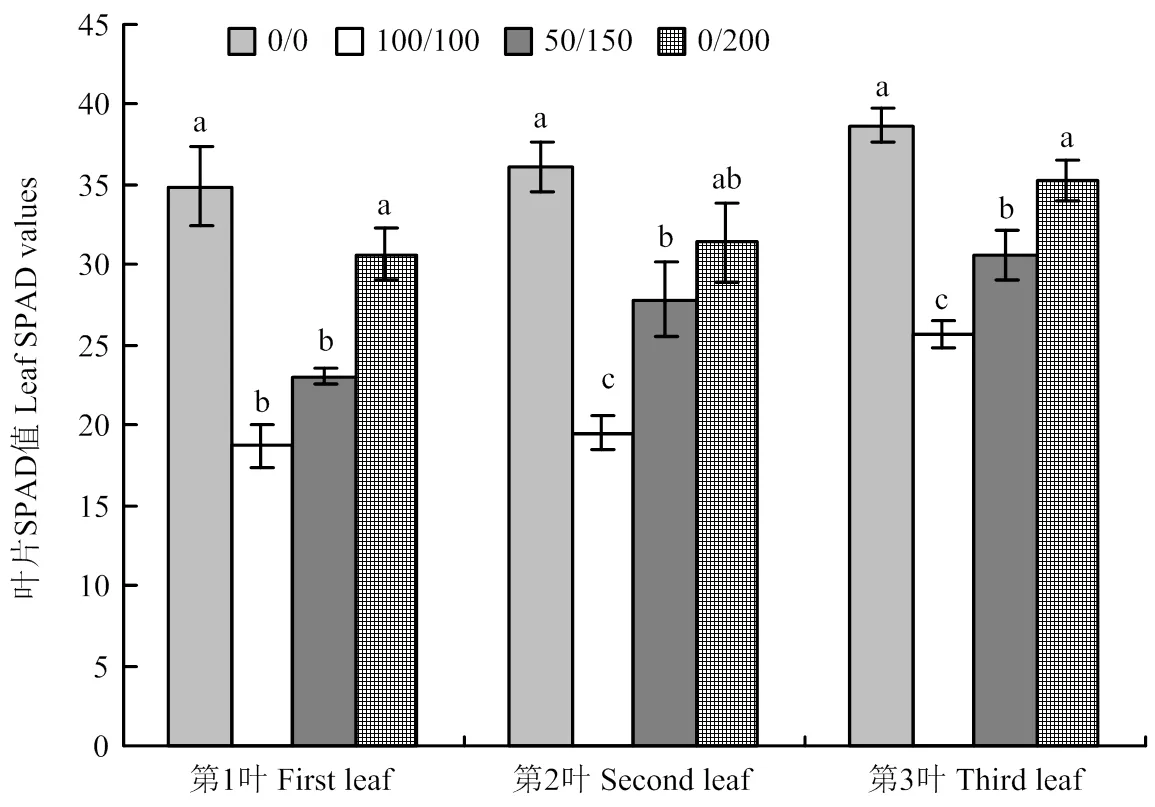
不同字母表示處理間在0.05水平差異顯著 Different letters represent significant difference between different treatments at 0.05 level
研究分根鹽處理對幼苗葉片的光合參數的影響,發現光合速率(net photosynthetic rate,n)、氣孔導度(stomatal conductance,s)和蒸騰速率(transpiration rate,r)都受到顯著的不利影響,對照和鹽處理之間的n、s和r差異達到顯著水平,不均勻鹽處理50/150的n、s、r與均勻鹽處理相比分別提高了155.95%、56.25%和57.14%,0/200處理分別提高了245.24%、87.50%和85.71%;均勻鹽處理細胞間CO2濃度(intercellular CO2concentration,i)顯著高于對照和不均勻鹽處理,對照和不均勻鹽處理之間差異不顯著。
分根鹽處理對ΦPSⅡ、Fv/Fm和ETR都有顯著影響,鹽處理的三項指標都顯著低于對照,不均勻鹽處理的三項指標都高于均勻鹽處理,不均勻鹽處理50/150、0/200的ΦPSⅡ比均勻鹽處理的100/100提高了分別為5.64%和19.00%,Fv/Fm分別提高了1.93%和6.89%、ETR分別提高了9.25%和18.89%,其中0/200處理的ΦPSⅡ和Fv/Fm與100/100處理的差異達到顯著性水平(表3)。
2.4 分根鹽處理對葉片抗氧化酶活性和與滲透調節物質含量的影響
分根鹽處理對葉片抗氧化酶活性與滲透調節物質的影響顯著,4個處理之間的SOD值差異均達到顯著性水平,100/100、50/150、0/200的SOD比對照分別增加了73.68%、122.44%和199.26%,不均勻鹽處理50/150和0/200顯著高于100/100處理,分別提高了28.17%和72.43%。分根鹽處理對CAT的影響與SOD有著相似的結果,鹽處理顯著性提高了CAT的含量水平,不均勻鹽處理顯著高于均勻鹽處理。鹽處理提高了高粱葉片POD含量水平,100/100、50/150、0/200的POD分別提高了6.75%、13.55%和31.72%,不均勻鹽處理50/150和0/200與均勻處理100/100相比分別增加了6.37%和23.40%,其中0/200與均勻處理100/100差異達到顯著水平。鹽處理增加了高粱葉片中MDA含量,100/100、50/150、0/200的MDA含量分別增加了37.64%、13.09%和4.76%,不均勻鹽處理50/150和0/200比均勻鹽處理降低了17.84%和23.89%,差異達顯著水平。鹽處理葉片的PRO和SS含量都有不同程度的增加,鹽分不均勻處理50/150和0/200的SS含量顯著高于均勻鹽處理,0/200處理的PRO含量顯著高于均勻鹽處理(表4)。
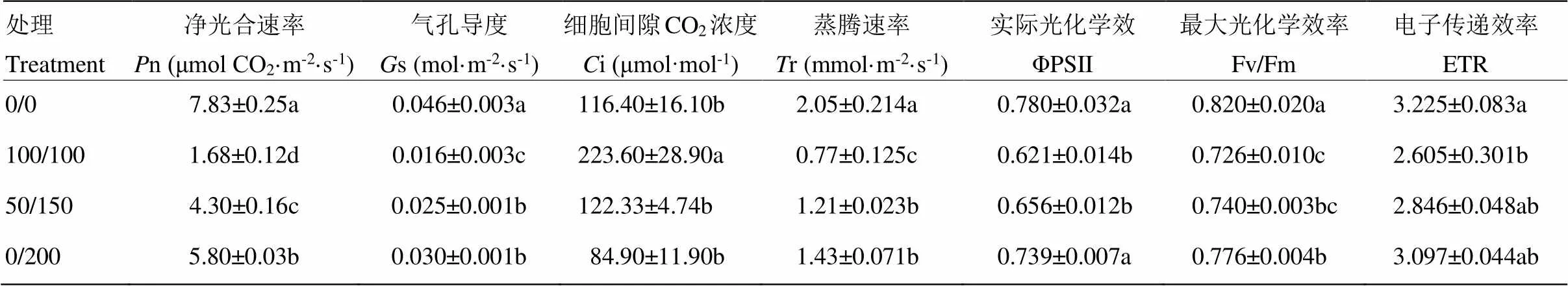
表3 分根鹽處理對高粱光合參數和熒光參數的影響
3 討論
3.1 分根鹽處理對高粱幼苗生長和根系形態的影響
分根于不同鹽濃度處理下研究植物的耐鹽特性引起了眾多學者的重視[1],高粱作為一種耐鹽堿較強的農作物,已有的耐鹽性研究都是在均勻鹽堿條件下進行的[26]。因此,通過利用分根系統模擬高粱根系不同區域受到不均勻鹽分脅迫,研究高粱在該脅迫條件下各種生理生化指標的變化,一方面可以揭示高粱對不均勻鹽分脅迫適應性的生理基礎,另一方面也補充了人們對于高粱耐鹽、抗鹽脅迫的生理認知。前人對棉花[2]、葡萄[16]、苜蓿[17]、冬小麥[22]、番茄[24]、大洋洲濱藜[31]、羊草[32]等植物研究結果顯示,不均勻鹽處理可緩解鹽脅迫對植物的危害,不均勻鹽處理的生物量顯著高于均勻鹽處理條件下的生物量。本文通過分根不同鹽脅迫條件下研究發現不均勻鹽處理能有效減輕鹽脅迫對高粱幼苗造成的傷害,不均勻鹽處理50/150和0/200的單株鮮重和單株干重比均勻鹽處理100/100都有顯著性提高,尤其是低鹽和非鹽脅迫一側的根系鮮重和干重顯著高于高鹽一側。根系是植物吸收養分的主要器官,健壯的根系有助于植物對水分和礦質元素的吸收,從而緩解鹽脅迫對高粱幼苗生長發育的影響。本研究中不均勻鹽脅迫下由于低鹽和非鹽脅迫一側根系長度、根系體積、根尖數和分支數出現了補償性增加,整株根系長度、根系體積、根尖數和分支數等根系形態指標都高于均勻鹽脅迫,這將有利于根系從低鹽或非鹽一側溶液中吸收水分和礦物質,緩解鹽脅迫對高粱幼苗的影響,這與冬小麥[22]通過非鹽脅迫一側根長和根數的顯著增加促進不均勻鹽處理總根長和根數顯著增加的結論一致。
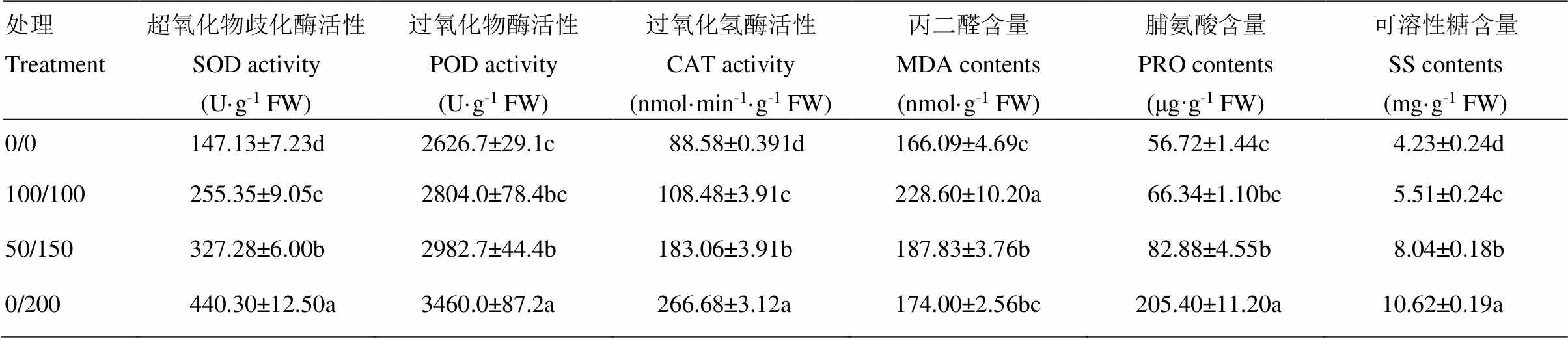
表4 分根鹽處理對葉片抗氧化酶活性與滲透調節物質含量的影響
3.2 分根鹽處理對葉片光合作用的影響
鹽脅迫可導致植物的光合作用降低,鹽脅迫誘導的光合作用降低一般是由滲透脅迫引起的氣孔關閉或者葉綠素含量降低引起的[37],也有學者研究認為,在低鹽濃度下光合作用降低是由于氣孔關閉造成了高粱葉片的凈光合速率下降,在高鹽濃度下是非氣孔關閉造成的,光合參數和葉綠素的熒光參數能夠反應高粱幼苗耐鹽能力[20]。本研究表明不均勻鹽處理與均勻鹽處理的SPAD值相比較,均有一定程度的提高,大部分差異達到顯著性水平,光合速率、氣孔導度和蒸騰速率都顯著受到鹽脅迫的抑制,但是不均勻鹽處理的光合速率、氣孔導度、蒸騰速率顯著高于均勻鹽處理,而均勻鹽處理的細胞間隙CO2濃度顯著高于對照和不均勻鹽處理,對照和不均勻鹽處理之間差異不顯著,這說明均勻鹽處理的葉綠素受到破壞,已經不可恢復,而鹽分不均勻處理對葉綠素破壞較輕,葉綠素含量降幅較小,幼苗有著較高的抗鹽能力,這與不均勻鹽脅迫對葡萄、番茄的影響相似[16,21]。Fv/Fm反映了PSⅡ原初最大光化學效率,ΦPSⅡ反映了PSⅡ實際光化學效率,ETR反映了PSⅡ電子傳遞效率,鹽脅迫可以抑制高粱幼苗PSⅡ原初最大光化學效率和實際光化學效率[20],無論不均勻鹽處理還是均勻鹽處理都顯著降低上述參數[16],本研究鹽脅迫處理的三項熒光參數ΦPSⅡ、Fv/Fm和ETR都顯著低于對照,不均勻鹽處理都高于均勻鹽處理,與前人對其他作物中的研究結果相似。
3.3 分根鹽處理對葉片抗氧化酶活性與滲透調節物質的影響
在鹽脅迫下,抗氧化酶活性受到影響,致使一些活性氧和MDA積累,導致膜脂過氧化,致使植物受到傷害甚至死亡,但植物體內也存在活性氧消除系統,包括SOD、POD、CAT等,并以此來維持活性氧生成與消除的動態平衡[33-34]。滲透調節是植物應對鹽脅迫的重要方式之一,鹽脅迫下,細胞內積累一些物質,如PRO、SS等,以調節細胞內的滲透勢,維持水分平衡,還可以保護細胞內許多重要代謝活動所需的酶類活性[35-36]。在本研究中,不均勻鹽處理的抗氧化酶SOD、POD、CAT活性均大于均勻鹽處理,部分處理差異達到顯著性水平,而在不均勻鹽脅迫處理中MDA含量顯著小于均勻鹽處理,滲透調解物質PRO和SS含量都高于均勻鹽處理,在不均勻鹽處理條件下SOD、POD、CAT等抗氧化酶活性的增加,可以清除膜脂過氧化作用產生的MDA和活性氧,保護膜系統不受破壞,PRO和SS的積累可以維持鹽脅迫下細胞正常的膨脹和代謝功能,從而降低了鹽脅迫對高粱幼苗的影響。
4 結論
無論不均勻鹽處理還是均勻鹽處理,對高粱幼苗生長發育均造成抑制作用,與均勻鹽處理相比,由于不均勻鹽處理低鹽或無鹽一側根系補償性的增長,高粱幼苗整株根系形態得到改善,葉片抗氧化酶活性、滲透調節能力和光合性能均有一定程度的提高,有效緩解了鹽脅迫對高粱幼苗生長發育的影響。
[1] BAZIHIZINA N, BARRETT-LENNARD E G, COLMER T D. Plant growth and physiology under heterogeneous salinity., 2012, 354(1/2): 1-19.
[2] DONG H Z, KONG X Q, LUO Z, LI W J, XIN C S. Unequal salt distribution in the root zone increases growth and yield of cotton., 2010, 33(4): 285-292.
[3] 李少昆. 玉米抗逆減災栽培. 北京: 金盾出版社. 2010: 69-73.
Li S K.. Beijing: Golden Shield. 2010: 69-73. (in Chinese)
[4] FLOWERS T J, COLMER T D. Salinity tolerance in halophytes., 2008, 179: 945-963.
[5] MUNNS R, TESTER M. Mechanisms of salinity tolerance., 2008, 59: 651-681.
[6] GILL S S, TUTEJA N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants., 2010, 48(12): 909-930.
[7] JAMES R A, BLAKE C, BYRT C S, MUNNS R. Major genes for Na+exclusion, Nax1 and Nax2 (wheat HKT1;4 and HKT1;5), decrease Na+accumulation in bread wheat leaves under saline and waterlogged conditions., 2011, 62(8): 2939-2947.
[8] SINGH M, SINGH A, PRASAD S M, SINGH R K. Regulation of plants metabolism in response to salt stress: an omics approach., 2017, 39(2): 17.
[9] SONNEVELD C, VOOGT W. Response of tomatoes () to an unequal distribution of nutrients in the root environment., 1990, 124: 251-256.
[10] MULHOLLAND B J, FUSSELL M, EDMONDSON R N. The effect of split-root salinity stress on tomato leaf expansion, fruit yield and quality., 2002, 77: 509-519.
[11] SUN J J, YANG G W, ZHANG W J, ZHANG Y J. Effects of heterogeneous salinity on growth, water uptake, and tissue ion concentrations of alfalfa., 2016, 408(1/2): 211-226.
[12]KONG X Q, LUO Z, DONG H Z, LI W J, Chen Y Z. Non-uniform salinity in the root zone alleviates salt damage by increasing sodium, water and nutrient transport genes expression in cotton., 2017, 7: 13.
[13] MAVROGIANOPOULOS G, SAVVAS D, VOGLI V. Influence of NaCl-salinity imposed on half of the root system of hydroponically grown tomato on growth, yield, and tissue mineral composition., 2002, 77: 557-564.
[14] TABATABAEI S J, GREGORY P J, HADLEY P. Distribution of nutrients in the root zone affects yield, quality and blossom end rot of tomato fruits., 2004, 79: 158-163.
[15] XIONG X, LIU N, WEI Y Q, BI Y X, LUO J C, XU R X, ZHOU J Q , ZHANG Y J. Effects of non-uniform root zone salinity on growth, ion regulation, and antioxidant defense system in two alfalfa cultivars., 2018, 132: 434-444.
[16] 孫紅, 姜亦文, 于昕, 相廣慶, 姚玉新. 根系局部NaCl處理對葡萄植株傷害度、Na+積累和碳氮分配的影響. 中國農業科學, 2019, 52(7): 1173-1182.
SUN H, JIANG Y W, YU X, XIANG G Q, YAO Y X. Effects of local root zone salinity on grapevine injury, Na+accumulation and allocation of carbon and nitrogen., 2019, 52(7): 1173-1182. (in Chinese)
[17] 孫娟娟,于林清, 趙金梅, 劉洪林, 張英俊. 鹽分不均勻分布對紫花苜蓿生長和離子特征的影響. 中國農業科學, 2017, 50(22): 4299-4306.
SUN J J, YU L Q, ZHAO J M, LIU H L, ZHANG Y J. Effects of heterogeneous root zone salinity on plant growth and ion characteristic in alfalfa., 2017, 50(22): 4299-4306. (in Chinese)
[18] KONG X Q, LUO Z, DONG H Z, ENEJI A E, LI W J. Effects of non-uniform root zone salinity on water use, Na+recirculation, and Na+and H+flux in cotton., 2012, 63(5): 2105-2116. (in Chinese)
[19] 段麗君, 李國元, 汪殿蓓. 絨毛白蠟根區局部鹽脅迫對其生長的影響. 園藝學報, 2018, 45(10): 1989-1998.
DUAN L J, LI G Y, WANG D B. Effect of partial root-zone salt stress on velvet ash()growth., 2018, 45 (10):1989-1998. (in Chinese)
[20] 孫璐, 周宇飛, 李豐先, 肖木輯, 陶冶, 許文娟, 黃瑞冬. 鹽脅迫對高粱幼苗光合作用和熒光特性的影響. 中國農業科學, 2012, 45(16): 3265-3272.
SUN L, ZHOU Y F, LI F X, XIAO M J, TAO Y, XU W J, HUANG R D. Impacts of salt stress on characteristics of photosynthesis and chlorophyll fluorescence of sorghum seedlings., 2012, 45(16): 3265-3272. (in Chinese)
[21] 程貝, 王衛華, 吳忠東. 非均勻鹽脅迫對番茄幼苗耐鹽性的影響. 園藝學報, 2018, 45(5): 887-896.
CHENG B, WANG W H, WU Z D. Effects of non-uniform salt stress on salt tolerance of tomato seedlings., 2018, 45(5): 887-896. (in Chinese)
[22] 楊婷, 謝志霞, 喻瓊. 局部根系鹽脅迫對冬小麥生長和光合特征的影響. 中國生態農業學報, 2014, 22(9): 1074-1078.
YANG T, XIE Z X, YU Q. Partial root growth and the effect of salt stress on photosynthetic characteristics of Winter wheat., 2014, 22(9): 1074-1078. (in Chinese)
[23] 代建龍, 董合忠, 段留生. 鹽分差異分布下不同形態氮素對棉苗生長及主要營養元素吸收的影響. 中國農業大學學報, 2012, 17(4): 9-15.
DAI J L, DONG H Z, DUAN L S. Effects of different forms of nitrogen on cotton seedling growth and absorption of main nutrient elements under different salt distribution., 2012, 174: 9-15. (in Chinese)
[24] 盧穎林, 李慶余, 徐新娟. 全根和分根培養條件下番茄幼苗對不同形態氮素的響應. 南京農業大學學報, 2010, 33(6): 43-49.
LU Y L, Li Q Y, Xu X J. The root and root of tomato seedling cultivation conditions in response to different forms of nitrogen., 2010, 33(6): 43-49. (in Chinese)
[25] 孫娟娟, 張英俊. 植物對鹽分空間不均勻分布的形態和生理響應研究進展. 生態學報, 2017, 37(23): 7791-7798.
SUN J J, ZHANG Y J. A review of plant morphology and physiological response to spatially heterogeneous salinity., 2017, 37 (23): 7791-7798. (in Chinese)
[26] HUANG R D. Research progress on plant tolerance to soil salinity and alkalinity in sorghum., 2018, 17(4): 739-746.
[27] 李雁鳴. 高粱((L.) Moench)葉面積校正值(K值)的初步研究. 河北農業大學學報, 1993, 16(3): 31-36.
Li Y M. Preliminary study on the leaf rectification value(K) of sorghum((L.) Moench)., 1993, 16(3): 31-36. (in Chinese)
[28] 李合生. 植物生理生化實驗原理和技術. 北京: 高等教育出版社, 2000.
LI H S.. Beijing: Higher Education Press, 2000. (in Chinese)
[29] 金麗萍, 崔世茂, 杜金偉, 金彩霞, 吳玉峰, 其日格. 干旱脅迫對不同生態條件下蒙古扁桃葉片PAL和C4H活性的影響. 華北農學報, 2009, 24(5): 118-122.
JIN L P, CUI S M, DU J W, JIN C X, WU Y F, QI R G. Effects of drought stress in different ecological conditions of theMaxim almond leaves in PAL and C4H activity., 2009, 24(5): 118-122. (in Chinese)
[30] 趙世杰, 史國安, 董新純. 植物生理實驗學指導. 北京: 中國農業科學技術出版社, 2002.
ZHAO S J, SHI G A, DONG X C.. Beijing: China Agricultural Science and Technology Press, 2002. (in Chinese)
[31] BAZIHIZINA N, BARRETT-LENNARD E G, COLMER T D. Plant responses to heterogeneous salinity: growth of the halophyteis determined by the root-weighted mean salinity of the root zone., 2012, 63(18): 6347-6358.
[32] 吳銀明, 王平, 劉洪升, 劉淑英, 王娟. NaCl分根脅迫對羊草幼苗生長及其生理生化特性的影響. 西北植物學報, 2007, 27(9): 1807-1813.
WU Y M, WANG P, LIU H S, LIU S Y, WANG J. Effects of NaCl stress on growth and its physiological-biochemical characteristics of split-rootseedlings.,2007, 27(9): 1807-1813. (in Chinese)
[33] GUETA D Y, YANIV Z, ZILINSKAS B A, BEN H G. Salt and oxidative stress: similar and specific responses and their relation to salt tolerance in citrus., 1997, 203: 460-469.
[34] HERNANDEZ J A, JIMENEZ A, MULLINEAUX P, SEVILIA F. Tolerance of pea (L.) to long-term salt stress is associated with induction of antioxidant defenses., 2000, 23: 853-862.
[35] SINGH S K, SHARMA H C, GOSWAMI A M, DATTA S P, SINGH S P. In vitro growth and leaf composition of grapevine cultivars as affected by sodium chloride., 2000, 43: 283-286.
[36] KEREPESI I, GALIBA G. Osmotic and salt stress-induced alternation in soluble carbohydrate content in wheat seedlings., 2000, 40: 482-487.
[37] ASISH K P, ANATH B D. Salt tolerance and salinity effects on plants: a review., 2005, 60: 324-349.
Effects of heterogeneous salinity across rhizosphere on the growth of sorghum seedlings
ZHANG HuaWen1,3,WANG RunFeng1,3,XU MengPing1,3, LIU Bin1,3, CHEN ErYing1,3, HUANG RuiDong2, ZHOU YuFei2, WANG HaiLian1,3
(1Crop Research Institute, Shandong Academy of Agricultural Sciences, Jinan 250100;2;3Featured Crops Engineering Laboratory of Shandong Province, Jinan 250100)
Salt content is usually unevenly distributed in saline-alkali lands. Studies on growth and development, and the changes of physiological and biochemical indexes of sorghum seedlings under non-uniform salt stress could provide a theoretical basis for the cultivation of sorghum in saline-alkali land and the efficient exploitation and utilization of saline-alkali lands.Roots of sorghum were divided into two equal portions by a root-split method and put in uniform and non-uniform NaCl concentration solution, respectively. There were four treatments. No sodium chloride (denoted as 0/0) was the control, 0 and 200 mmol·L-1(denoted as 0/200), 50 mmol·L-1and 150 mmol·L-1(denoted as 50/150) were non-uniform salinity treatments, and 100 mmol·L-1/100 mmol·L-1(denoted as 100/100) were uniform salinity treatment. Healthy sorghum seedlings after growing for 14 days in a growth chamber were sampled for the determination of biomass, leaf area, SPAD, root morphology, osmotic regulators content, anti-oxidative enzyme activity, and photosynthetic parameters.Growth of sorghum both in uniform and non-uniform salt stress conditions was severely inhibited, and significant decrease of fresh weight, biomass, leaf area, root morphology, photosynthetic capacity, anti-oxidative enzyme activity and osmotic substance content accumulation was found. Dry weight per plant was increased by 21.19% and 62.71%, fresh weights of seedlings was increased by 35.39% and 86.44%, and leaf area was increased by 13.22% and 88.66%, respectively under 50/150 and 0/200 compared with those under 100/100. Under 50/150 treatment, fresh and dry weights of roots in the 50 mmol·L-1side were 1.90 and 2.10 times of the 150 mmol·L-1side. Under 0/200 treatment, fresh and dry weights of roots in 0 mmol·L-1side were increased by 3.02 and 3.75 times compared with the 200 mmol·L-1side. Likewise, local root morphology was affected significantly in non-uniform salt treatment. Root length, root volume, root tip number, and root branch number of sorghum seedlings in 50 mmol·L-1side or 0 mmol·L-1were significantly increased compared with 150 mmol·L-1(50/150) or 200 mmol·L-1(0/200) salt stress side, respectively. Root length, root volume, root tip number, and root branch number of the whole root were significantly increased under 0/200 (<0.05) compared with the 100/100 treatment. Activities of SOD, CAT, and POD in leaves were significantly higher under non-uniform salt stress (<0.05). Contents of proline and soluble sugars were significantly increased in leaves with a dramatic reduce in MDA content (<0.05) under the non-uniform salinity treatments. Compared with seedlings under the 100/100 condition. Photosynthesis of sorghum was significantly enhanced under 0/200 and 50/150 salt stresses, which chiefly was reflected by notably increased photosynthetic rate, stomatal conductance, transpiration rate, and decreased intercellular CO2concentration (<0.05). With respect to indexes of fluorescence of photosynthesis, such as ΦPSⅡ, Fv/Fm, and ETR, their values under 50/150 and 0/200 were increased by 5.64% and 19.00%, 9.25% and 18.89%, and 1.93% and 6.89%, respectively. ΦPSⅡand Fv/Fm under 0/200 were significantly different from those under 100/100 (<0.05).Both non-uniform and uniform salt stress treatments caused growth inhibition to sorghum seedlings. However, due to the root compensatory growth of low salt or salt-free side under the non-uniform salt stress condition, whole root morphology, leaf antioxidant enzymes activity, osmotic regulation ability, and photosynthetic capacity were improved in a certain degree. Thus, non-uniform salinity could relieve damages to sorghum seedling initiated by salt stress.
sorghum bicolor; split root; non-uniform salinity; photosynthesis; fluorescence
10.3864/j.issn.0578-1752.2019.22.015

2019-06-05;
2019-08-06
現代農業產業技術體系建設專項(CARS-06-13.5-B23)、山東省農業科學院農業科技創新工程(CXGC2018D02)、山東省重點研發計劃(2019GNC106059)
張華文,E-mail:zhwws518@163.com。王潤豐,E-mail:linus.rw@outlook.com。張華文和王潤豐為同等貢獻作者。通信作者王海蓮,E-mail:wanghailian11@163.com
(責任編輯 李莉)

