高粱苗期耐鹽性轉錄組分析和基因挖掘
董明,再吐尼古麗·庫爾班,呂芃,杜瑞恒,葉凱,侯升林,劉國慶
高粱苗期耐鹽性轉錄組分析和基因挖掘
董明1,再吐尼古麗·庫爾班2,呂芃1,杜瑞恒1,葉凱2,侯升林1,劉國慶1
(1河北省農林科學院谷子研究所/河北省雜糧重點實驗室,石家莊 050035;2新疆農業科學院生物質能源研究所,烏魯木齊 830091)
【】探究高粱耐鹽脅迫響應機制,挖掘高粱耐鹽脅迫基因,為高粱耐鹽育種提供理論基礎。以高粱感鹽品種L甜和耐鹽品種石紅137為供試材料,采用水培試驗。待高粱植株長至三葉一心期,使用2%NaCl溶液對幼苗進行鹽脅迫,分別設置0(對照)、1和24 h處理,每個處理3次重復。測定不同處理樣品株高、根長、干物重、Na+含量和葉綠素相對含量(SPAD值),并依托Illumina HiSeq 2000平臺進行轉錄組測序分析。利用FPKM方法計算基因表達量,在差異表達基因檢測過程中,將差異表達倍數(fold change)≥2且FDR<0.001作為篩選標準。通過Gene Ontology和KEGG Pathway數據庫對參與高粱不同時間鹽脅迫差異表達基因進行分析注釋。鹽脅迫處理對高粱株高、根長、干物重等性狀無顯著影響,對鈉離子含量和SPAD值影響顯著。石紅137株高、根長、鈉離子含量和SPAD值均高于L甜。轉錄組測序結果鑒定得到已知基因26 628個,新基因866個。石紅137中的差異基因數目高于L甜。石紅137中,0 h vs 1 h、0 h vs 24 h、1 h vs 24 h三組的差異基因數目分別為375、4 206和3 750個。感鹽品種L甜中,0 h vs 1 h、0 h vs 24 h、1 h vs 24 h三組的差異基因數目分別為167、2 534和1 612個。GO分析共獲得25個功能注釋,分別為光合作用、細胞物質代謝、翻譯過程以及激素合成等與鹽脅迫相關的差異表達基因。KEGG分析發現鹽脅迫1 h表達差異基因富集在植物激素信號轉導途徑,涉及脫落酸(abscisic acid,ABA)、生長素(auxin,AUX)、細胞分裂素(cytokinin,CTK)、赤霉素(gibberellins,GS)、乙烯(ethylene,ETH)過程等共71個基因。鹽脅迫24 h表達差異基因富集于光合作用相關途徑,涉及Lhca、Lhcb、磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvate carboxylase,PPC)、磷酸核酮糖激酶(phosphorylribonucleic kinase,PRK)等20個基因。類黃酮生物合成代謝途徑差異可能是引起石紅137和L甜的耐鹽能力差異的原因之一,花青素還原酶(anthocyanidin reductase,ANR)和黃酮醇合成酶(flavonol synthase,FLS)參與類黃酮生物合成途徑。高粱的鹽脅迫過程是一個復雜的生物過程,依賴于多個基因在復雜網絡中的平衡表達。鹽脅迫條件下,高粱應對環境刺激受到激素信號轉導和光合作用的控制。類黃酮生物合成途徑在耐鹽品種中起到了重要作用。
高粱;鹽脅迫;轉錄組;基因挖掘
0 引言
【研究意義】鹽脅迫是一類重要的非生物脅迫,嚴重制約了農業的可持續發展[1]。鹽脅迫下,植物的光合作用、呼吸速率以及物質代謝受到嚴重危害,最終導致產量的降低。高粱作為一種重要的糧食兼經濟作物,具有較強的抗旱、耐鹽堿能力[2],但不同品種間耐鹽性存在較大差異。高粱耐鹽基因的鑒定與挖掘能為探討高粱耐鹽的分子機理、培育耐鹽品種提供堅實基礎。【前人研究進展】目前,全球范圍內約有10億hm2的土地存在不同程度的鹽漬化[3]。鹽脅迫對高粱的生長發育有很大影響,根據田間土壤鹽分運行規律,作物在萌發和幼苗生長期間受鹽脅迫的危害尤為嚴重。鹽脅迫除了使植物受到離子脅迫之外,同時使植物受到水脅迫和低氧脅迫等。在鹽漬土上種植耐鹽品種是減輕土壤漬化危害的有效方法。早期大量研究表明鹽脅迫條件下,鹽害主要通過改變土壤溶液滲透勢和離子濃度影響植物根系對礦質元素的吸收[4],從而對植株地上部分產生影響,包括植株的形態發育、水分平衡、質膜透性、光合作用、呼吸作用以及物質代謝等途徑[5-8]。植物對抗鹽脅迫是一個復雜的過程,涉及多個與發育和生理相關的途徑[9]。耐鹽植物的耐鹽性主要體現在植株體內的離子平衡,Na+和Cl-被貯藏在液泡內,保持細胞滲透勢的穩定[10]。部分有機溶質,例如蛋白質、氨基酸等物質也起到穩定細胞滲透勢的作用。目前,在水稻中鑒定出對鹽脅迫反應的基因有280個,耐鹽相關QTL有332個,遍布水稻的整個基因組,耐鹽相關miRNA有29個[11]。RNA-Seq技術可以篩選耐鹽與鹽敏感植株的差異表達基因,鑒定植株響應鹽脅迫應答基因及表達特性,以期更好地理解植物對鹽脅迫響應的分子機制,為進一步鑒定和克隆重要的耐鹽基因,提高植物耐鹽性狀奠定基礎。利用該技術對玉米[12]、小麥[13]和高粱[14-16]等耐鹽影響因子和機理進行了初步探討,對作物耐鹽調控網絡的解析起到了促進作用。王海蓮等[17]利用石紅137和L甜雜交衍生181個重組自交系,發現長時間低鹽脅迫會抑制高粱幼苗生長。在鹽脅迫下控制高粱苗高、苗鮮重和苗干重QTL的表達具有較強的環境特異性,而控制高粱苗高的qSH1-1和qSH7-2在高粱耐鹽遺傳改良中將發揮重要作用。同時研究發現6個主要QTL和5個染色體區域在高粱耐鹽過程中起到關鍵作用[18]。【本研究切入點】目前,對高等植物耐鹽性分子機制的研究主要集中在擬南芥和水稻,在高粱中報道較少,且主要集中在個別轉錄因子的調控分析或赤霉素和多效唑對高粱耐鹽的影響等,對于高粱苗期耐鹽的轉錄組測序分析較少。【擬解決的關鍵問題】本研究對高粱耐鹽品種和感鹽品種進行鹽脅迫處理,通過轉錄組測序研究高粱對抗鹽脅迫的分子機制,同時比較感鹽和耐鹽品種間響應鹽脅迫的差異,為探究高粱耐鹽脅迫機制提供豐富理論途徑,并為高粱耐鹽育種奠定堅實基礎。
1 材料與方法
1.1 試驗材料
根據Wang等[18]研究結果選用感鹽品種L甜和耐鹽品種石紅137為供試材料。試驗材料選取水培方式種植,種子消毒后擺放在培養盒中,在28℃長日照(16 h/8 h)條件下培養。待長至一葉一心,用Hoagland培養液代替水進行培養。在三葉一心期利用2% NaCl溶液進行鹽脅迫處理,處理時間分別為0(對照)、1和24 h,每個處理3次重復。處理結束之后將葉片迅速剪下放入液氮中冷凍,樣品放于-80℃貯藏。干樣取下之后放入105℃烘箱10 min殺青,之后80℃烘干至恒重備用。
1.2 鈉離子含量測定
樣品鈉含量采用HNO3-H2O2方法消煮。稱取樣品0.2 g至消煮管中,加入HNO3-H2O2(4﹕1)混合液5 mL,靜置12 h以上,用江蘇宜興的LNK-872型多功能快速消化器消煮至溶液蒸干。冷卻至室溫,加入5% HNO3溶液8 mL,70℃封口水浴2—3 h,渦旋、靜置,至溶液澄清后轉移至10 mL離心管,用ICP-OES(PerkinElmer OPTIMA 210DV)對樣品進行測定。
1.3 葉綠素相對含量測定
高粱葉片葉綠素相對含量通過日本產SPAD-502型葉綠素儀進行測定。
1.4 cDNA文庫的構建及轉錄組測序
樣品RNA由百邁客生物科技有限公司制備。RNA樣品通過質量檢測進入Illumina HiSeq 2000平臺進行轉錄組測序。下機所得原始數據(raw data)經過過濾得到純凈數據(clean data),純凈數據再與指定參考基因組(Sbicolor_v2.1)比較得到比對數據(mapped data)。
1.5 差異基因的篩選
將樣品處理兩兩比較得到差異基因。在差異表達基因檢測過程中,將Fold Change≥2且FDR<0.001作為篩選標準。差異倍數(fold change)表示兩樣品(組)間表達量的比值。錯誤發現率(false discovery rate,FDR)是通過對差異顯著性值(-value)進行校正得到。采用了公認的Benjamini-Hochberg校正方法對原有假設檢驗得到的顯著性值(-value)進行校正,并最終采用FDR作為差異表達基因篩選的關鍵指標。
1.6 差異基因的注釋和分類
將比較得到的差異基因依次和Nr(NCBI non-redundant protein,NCBI非冗余蛋白)數據庫、Swiss-Prot(Swiss-Prot proteinsequence,瑞士蛋白序列)數據庫、KEGG(Kyoto encyclopedia of genes and genomes,京都基因與基因組百科全書)數據庫、COG(clusters of orthologousgroups of proteins,蛋白直系同源聚類)數據庫和GO(gene ontology,基因本體論數據庫)數據庫中的蛋白序列進行比對,從而獲得與差異基因對應的蛋白功能注釋及功能分類統計。
1.7 實時熒光定量PCR分析(qRT-PCR)
為了驗證高粱耐鹽脅迫轉錄組結果的準確性,從差異基因數據庫中隨機挑選4個基因,利用Primer 6.0設計引物(表1),分析實時熒光定量PCR結果是否與轉錄組結果一致。
2 結果
2.1 鹽脅迫對高粱的影響
鹽脅迫處理能夠影響高粱葉片的鈉離子含量和SPAD值(圖1)。對株高、根長、干物重等性狀無顯著影響,石紅137株高和根長高于L甜(表2)。鹽脅迫處理1 h,植株表型未出現明顯變化。鹽脅迫處理24 h時,植株樣品出現明顯萎蔫(圖2)。與對照相比,2個品種的鈉離子含量均在鹽脅迫處理24 h達到最高,且差異顯著。SPAD值在鹽脅迫處理24 h顯著降低。石紅137在2個時期鹽脅迫處理的鈉離子含量和SPAD值均高于L甜。

表1 實時熒光定量PCR引物
2.2 轉錄組測序結果評估
取2個高粱品種鹽脅迫0、1和24 h葉片樣品,分別提取各個樣品RNA,進行質檢、構建文庫之后,利用Illumina HiSeq平臺進行測序。6個處理18個樣本高通量測序得到序列標簽數在42 082 348—56 174 902,比對到參考基因組的序列標簽數在33 795 395—44 513 494,各樣品的序列標簽與參考基因組的比對效率在76.27%—79.74%。經過測序質量控制,共得到130.80 Gb處理后的數據量,各樣品Q30堿基百分比均不小于92.40%(表3)。將所有的處理后序列標簽組裝并與參考基因組進行比對,鑒定出已知基因26 628個,新基因866個。
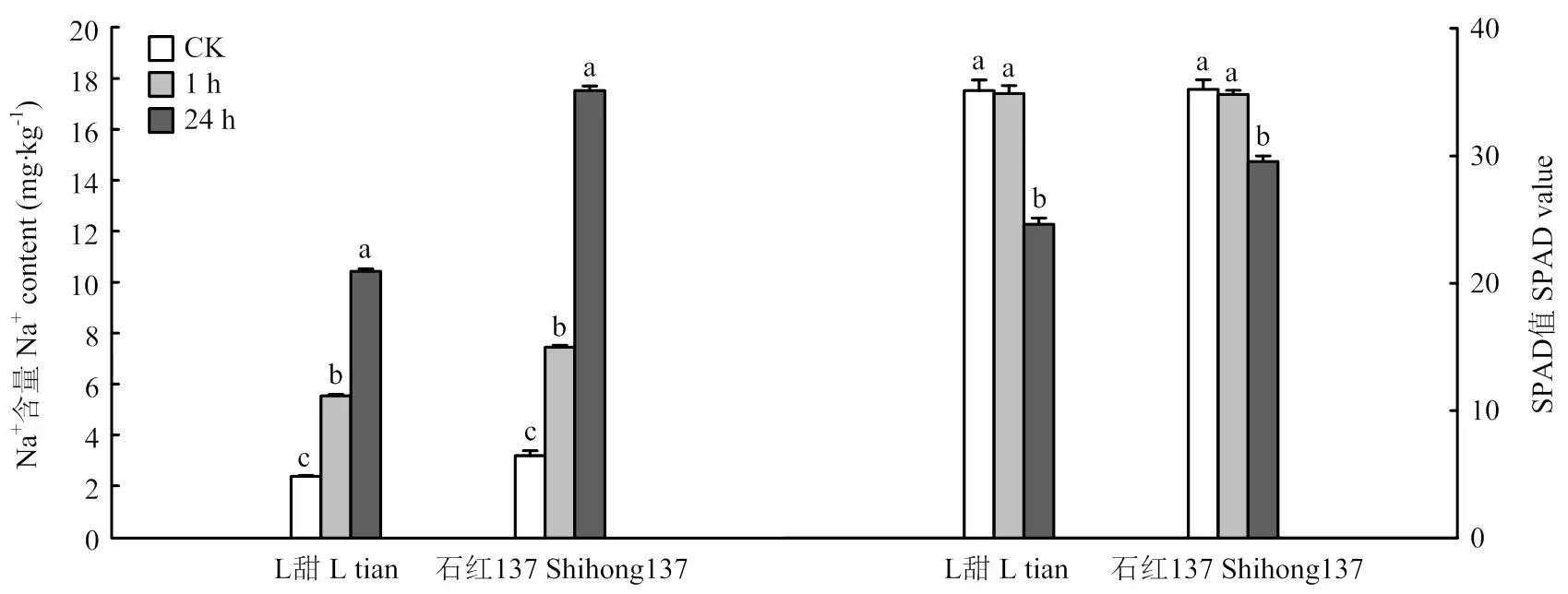
不同小寫字母表示處理間差異達5%顯著水平 Different lowercase letters indicate a significant difference at a 5% level between different treatments

A:鹽脅迫0 h;B:石紅137鹽脅迫處理 A: 0 h salt stress of Shihong137 and L tian; B: Salt stress treatment and control treatment of Shihong137
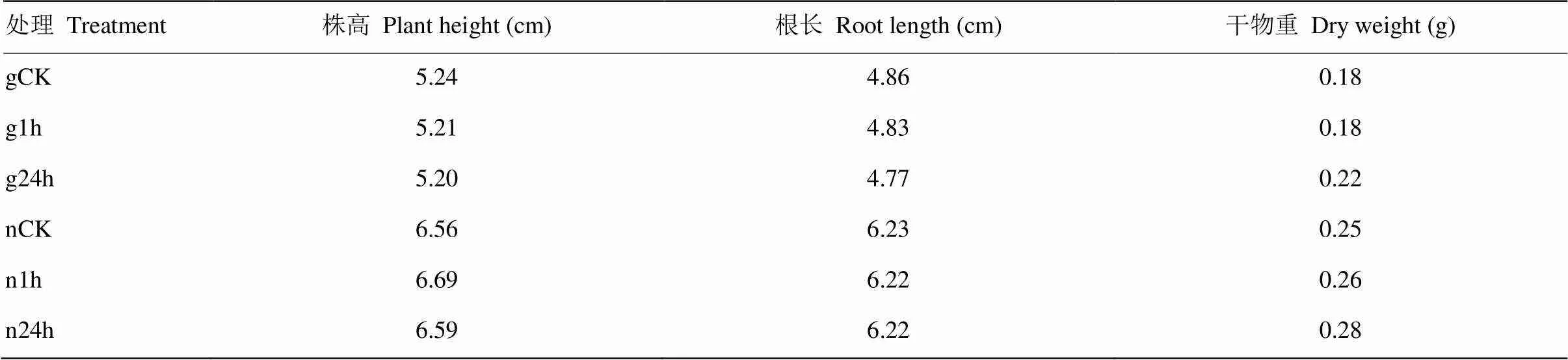
表2 鹽脅迫不同時間農藝性狀統計
g:感鹽品種L甜;n:耐鹽品種石紅137;gCK:L甜對照處理;g1h:L甜鹽脅迫1h處理;g24h:鹽脅迫24 h處理;nCK:石紅137對照處理;n1h:石紅137鹽脅迫1 h處理;n24h:石紅137鹽脅迫24 h處理。下同
g: Salt sensitive variety L tian; n: Salt tolerant variety Shihong 137; gCK: L tian control; g1h: L tian salt stress for 1 h; g24h: L tian salt stress for 24 h; nCK: Shihong 137 control; n1h: Shihong 137 salt stress for 1 h; n24h: Shihong 137 salt stress for 24 h. The same as below
2.3 鹽脅迫不同時期差異基因篩選
不同處理兩兩比較,得到差異基因數目(DEGs)(表4)。耐鹽品種石紅137中,0 h vs 1 h、0 h vs 24 h和1 h vs 24 h的差異基因數目分別為375、4 206和3 750個。感鹽品種L甜中,0 h vs 1 h、0 h vs 24 h和1 h vs 24 h的差異基因數目分別為167、2 534和1 612個。相同處理時間2個品種之間比較,gCK vs nCK、g1h vs n1h和g24h vs n24h的差異基因數目分別為1 240、1 184和1 910。石紅137在鹽脅迫后的差異基因數目明顯高于L甜,鹽脅迫后1 h高出124.55%,24 h高出65.98%。2品種都是在鹽脅迫24 h后DEG數目迅速升高,達到最高值。鹽脅迫24 h DEG數目高于1 h DEG數目,石紅137增加數量較多,增幅1000.00%,而L甜增幅較小,增加965.27%。
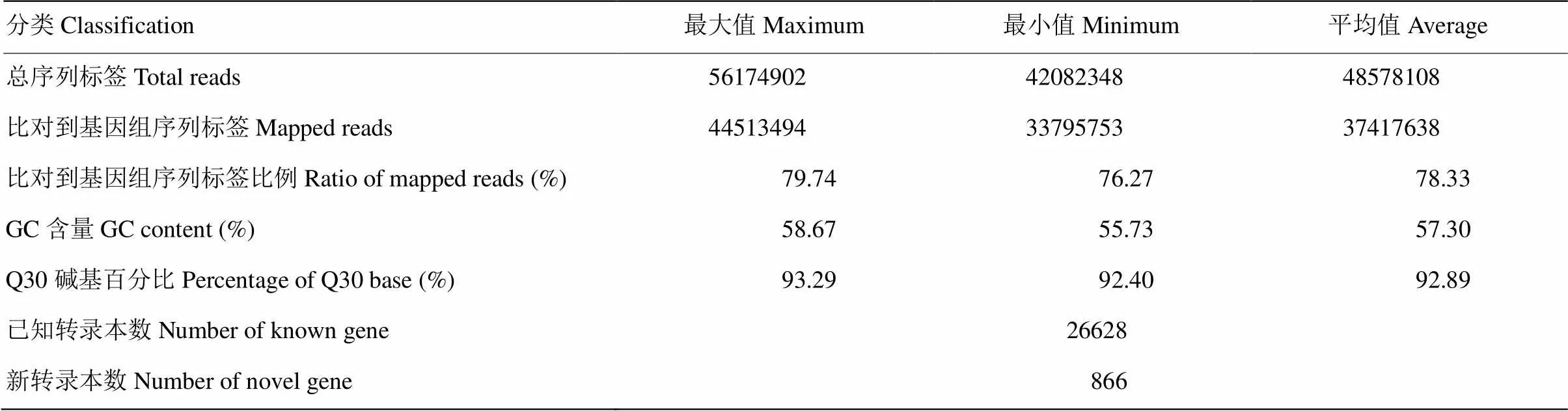
表3 高粱葉片轉錄組測序統計
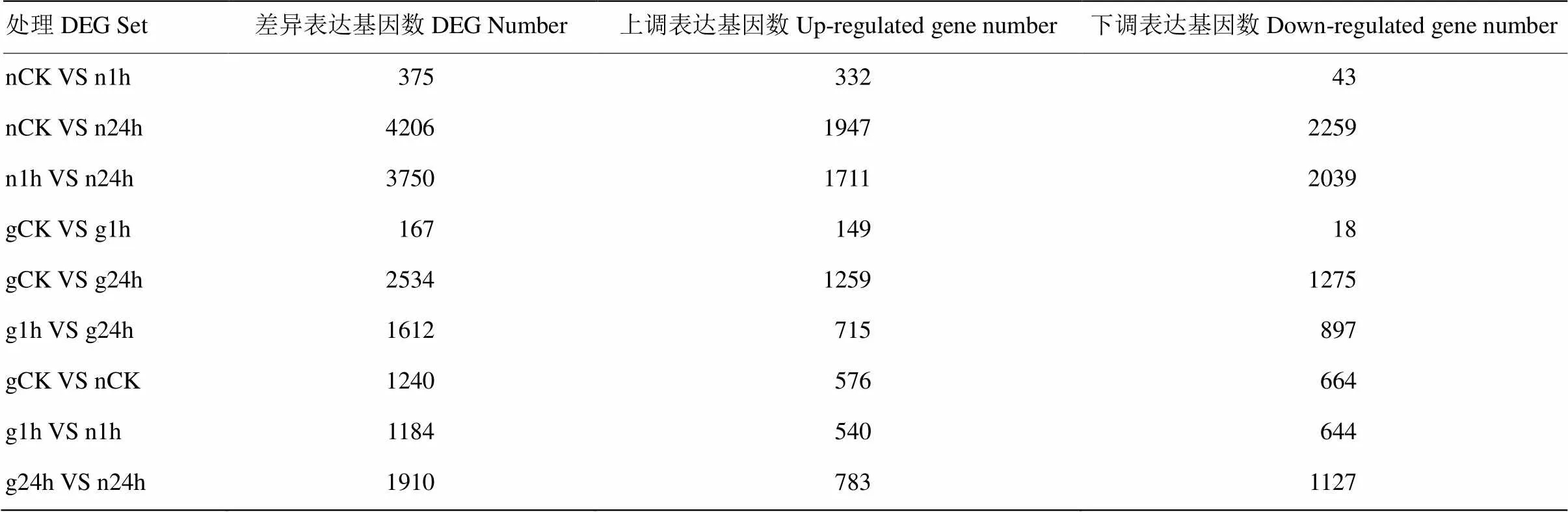
表4 鹽脅迫不同時期差異基因數目
在3組比較中,L甜有13個差異基因共表達,石紅137有51個差異基因共表達。有727個基因在2個品種中共表達。不同品種之間的差異基因表達數目比單個品種中不同處理比較的差異基因表達數目多(圖3)。
2.4 與鹽脅迫相關差異基因
根據GO功能注釋,nCK vs n1h和gCK vs g1h富集差異最為顯著的前10個生物過程可分為3類,且僅有一個不同(表5)。分別為:1)與激素相關:生長激素的響應、吲哚乙酸生物合成;2)與細胞物質代謝相關:谷胱甘肽代謝過程、色氨酸分解代謝過程、脯氨酸轉運、甲硫氨酸生物合成硫代葡萄糖苷過程;3)對脅迫的直接響應:對缺水反應的負調節、細胞對磷缺乏的反應、細胞高滲鹽度反應(nCK vs n1h)/脫黃化(gCK vs g1h)。

表5 高粱葉片中鹽脅迫差異基因的GO富集分析

g:感鹽品種L甜;n:耐鹽品種石紅137;gCK:L甜對照處理;g1h:L甜鹽脅迫1 h處理;g24h:鹽脅迫24 h處理;nCK:石紅137對照處理;n1h:石紅137鹽脅迫1 h處理;n24h:石紅137鹽脅迫24 h處理。下同
nCK vs n24h和gCK vs g24h富集差異最為顯著的前10個生物過程有4個過程不同。nCK vs n24h中GO富集差異最顯著的前十個生物過程分為:1)與光合作用相關過程:光系統Ⅱ組件、類囊體膜組織、光系統Ⅰ中的光合電子運輸、對紅光的反應;2)與細胞物質代謝相關的生物過程:麥芽糖代謝過程、淀粉生物合成、半胱氨酸生物代謝過程、色氨酸分解代謝過程;3)與翻譯相關生物過程:rRNA過程;4)與激素相關的生物過程:對karrikin的響應。gCK vs g24h富集差異最為顯著的前10個生物分為:1)與光合作用相關過程:光系統Ⅱ組件、對紅光的響應、光系統Ⅰ中的光合電子運輸、類囊體膜組織;2)與細胞物質代謝相關的生物過程:戊糖磷酸支路、異戊烯二磷酸生物合成,4-甲基季戊四醇途徑、麥芽糖代謝過程、淀粉生物合成;3)與激素相關生物過程:對karrikin的響應、生長激素的響應。
KEGG富集分析表明,gCK vs g1h和nCK vs n1h差異基因主要富集在植物激素信號傳導途徑。gCK vs g24h和nCK vs n24h差異基因的前五個富集通路中有4個相同:分別為光合器官中的碳固定、碳代謝、氨基酸生物合成和光合作用-天線蛋白。另外一個不同通路在gCK vs g24h和nCK vs n24h分別為丙酮酸代謝和光合作用。g1h vs g24h和n1h vs n24h差異基因的前五個富集通路有4個通路相同,且與gCK vs g24h和nCK vs n24h一致。兩類蛋白與高粱葉片鹽脅迫相關:鹽脅迫早期與植物激素信號相關、鹽脅迫后期主要涉及到光合作用。2個品種的同一時期比較發現CK之間沒有顯著的富集通路,而比較鹽脅迫1 h處理和24 h處理有共同的富集通路類黃酮代謝。
2.5 植物激素信號轉導途徑
植物激素不僅能夠調控植株的生長發育,還參與的植物的非生物脅迫。植物激素信號轉導途徑包含了生長素(IAA)、脫落酸(ABA)、細胞分裂素(CTK)、乙烯(ETH)和赤霉素(GS)(圖4),分別鑒定出基因22、24、11、9和5個。IAA途徑包括AUX、ARF、GH3和SAUR 4個基因家族,ABA途徑包括:ABF、SnRK2、PP2C和PYR/PYL 4個基因家族。SAUR和ABF同源基因全部表達上調,其他同源基因在不同處理中表達模式不同。
2.6 光合作用相關途徑
Lhca、Lhcb、PPC和PRK等20個光合作用相關途徑基因參與耐鹽脅迫過程(表4)。PPC(磷酸烯醇式丙酮酸羧化酶)是參與植物碳固定的關鍵酶,參與光合作用的暗反應。Sobic.002G167000在2個品種中均表達上調,分別上調3.80和5.19倍。Sobic.010G160700在2個品種中均下調表達。Sobic.004G106900和Sobic.007G106500的表達模式在2個品種中表現不同。LHC是一類能夠捕獲光能并能將能量迅速傳至反應中心引起光化學反應的色素蛋白[19],分為2個亞類:Lhca和Lhcb,2個品種中Lhca和Lhcb的同源基因均表達下調。PRK(磷酸核酮糖激酶)參與碳固定和碳代謝2個途徑,PRK 2個同源基因在2個品種中均表達下調(表6),下調基因在2個品種中分別達到1.24—128.71倍和9.99—863.12倍。下調基因倍數在石紅137中高于L甜。
2.7 類黃酮途徑
類黃酮是植物體內重要的次生代謝物之一。通過KEGG富集圖比較分析發現,2個品種在對照不理中無差異顯著的富集通路(圖5)。鹽脅迫1和24 h處理中存在類黃酮生物合成途徑,且差異顯著。花青素還原酶(ANR)Sobic.006G226400和黃酮醇合成酶(FLS)Sobic.004G310100參與到類黃酮生物合成途徑,2個基因在石紅137中的表達量高于L甜(圖6)。


A:gCK vs nCK;B:g1h vs n1h;C:g24h vs n24h
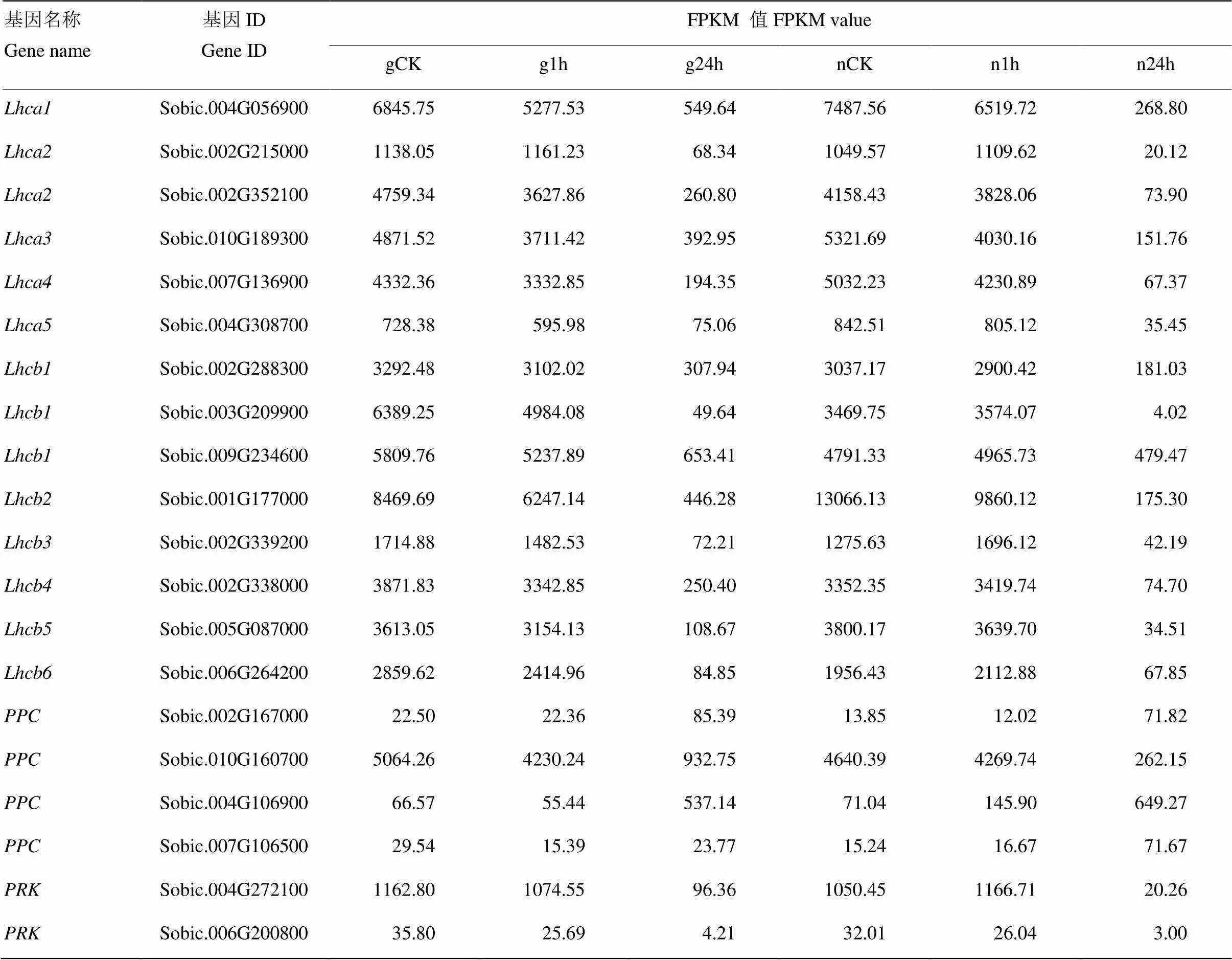
表6 涉及光合作用與鹽脅迫相關的基因
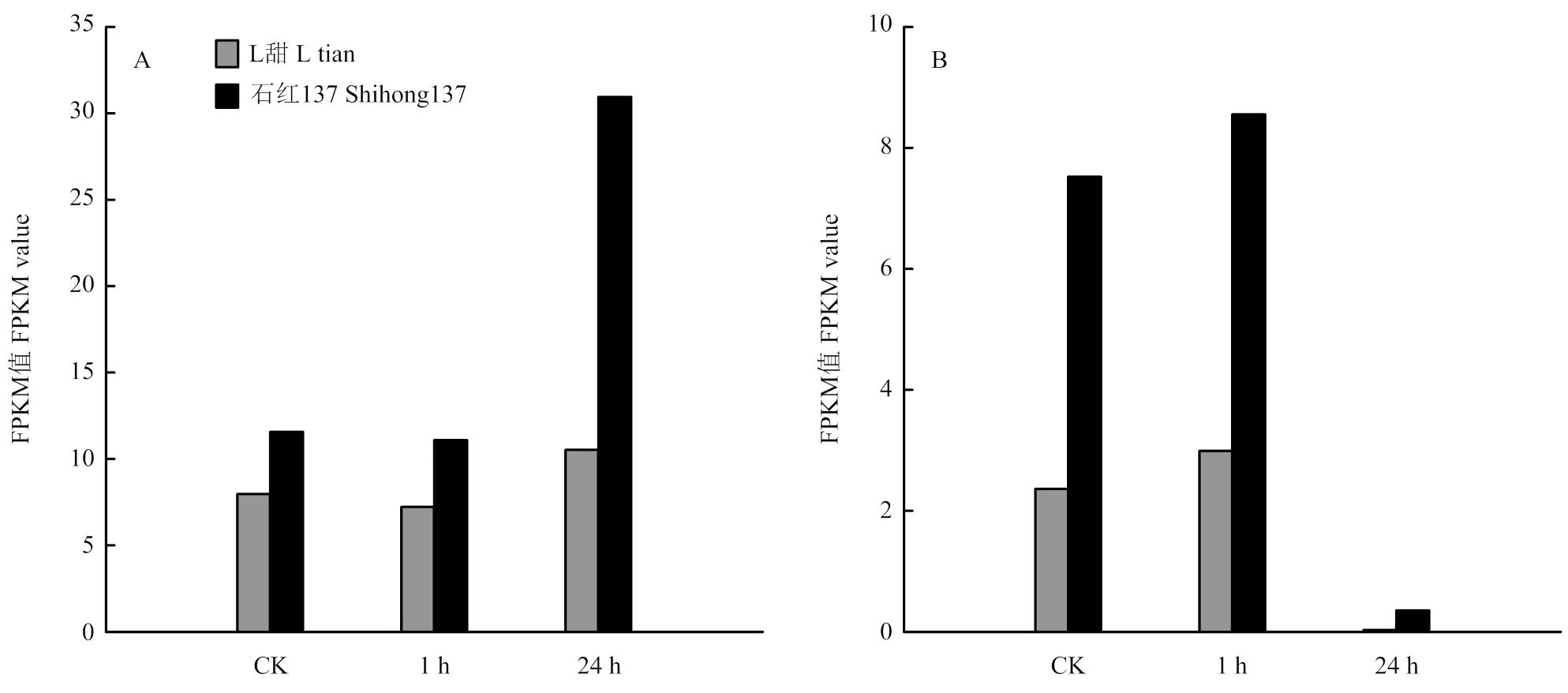
圖6 ANR(A)和FLS(B)在2個品種的FPKM值
2.8 實時熒光定量PCR驗證
為了驗證轉錄組測序結果的可靠性,隨機選取4個與激素信號轉導和光合作用途徑相關基因進行實時熒光定量PCR驗證(圖7)。將qRT-PCR數據和轉錄組數據進行相關性分析,其中有3個基因qRT-PCR結果與轉錄組測序結果顯著相關(<0.05),表明轉錄組測序結果真實可靠。

A:Sobic.006G18400;B:006G034300;C:004G300300
3 討論
高粱葉片對鹽脅迫的響應受到多種途徑的調控,轉錄組的整體分析有利于系統性了解高粱的耐鹽機制。為了篩選高粱耐鹽基因,本研究對2個高粱品種的2個鹽脅迫時期進行了轉錄組測序并對差異基因進行注釋。本研究所選2個高粱品種代表了對鹽脅迫的不同反應。L甜對鹽脅迫的反應要弱于石紅137對鹽脅迫的反應,了解2個品種對鹽脅迫響應的差異,可以揭示控制石紅137的耐鹽基因,從而對高粱耐鹽基因表達形成全面了解。
在2個品種中,total reads最低達到42 082 348,最高達到56 174 902。平均有78.33%的reads比對到了參考基因組(表3)。結果表明,所選數據庫相對完整。其余的注釋基因未在參考基因組中檢測到,鑒定為新基因。
3.1 2個品種中的差異基因
為確定響應鹽脅迫的相應基因,對鹽脅迫處理3個時期的轉錄組差異表達基因進行比較。結果表明,gCK vs g24h和g1h vs g24h差異基因數目明顯高于gCK vs g1h的差異基因數目,與L甜的形態指標變化一致。nCK vs n24h和n1h vs n24h的差異基因數目高于nCK vs n1h,這與Na+離子含量變化相對應。石紅137在鹽脅迫3個時期差異基因的數目均高于L甜的差異基因數目,這表明與感鹽品種L甜相比,耐鹽品種石紅137的有更多的基因參與到鹽脅迫中,為進一步闡明高粱耐鹽的調控機制提供了研究基礎。
GO富集分析顯示,激素響應、光合作用以及碳代謝相關途徑參與到高粱葉片的鹽脅迫中來,有利于高粱及時響應鹽脅迫。KEGG分析還發現差異基因涉及激素信號傳導、光合作用以及類黃酮代謝途徑,這些過程都在高粱應對鹽脅迫過程中起著重要作用。
3.2 植物激素信號轉導途徑
植物激素是重要的次級信號分子,能夠調節多種外界環境刺激[20]。本研究通過轉錄組分析發現生長素(IAA)、脫落酸(ABA)、細胞分裂素(CTK)、乙烯(ETH)、赤霉素(GA)、都參與到高粱葉片的鹽脅迫,這些基因耐鹽脅迫過程中表達模式不同。
ABA在非生物脅迫中起著重要作用,有研究表明高鹽條件下植物會誘導產生ABA,并且ABA信號通路在植物對抗鹽脅迫過程中是必需的[21]。ABA能夠響應干旱、鹽脅迫等多種非生物脅迫[22]。植物體內ABA信號分為依賴ABA途徑和非依賴ABA途徑[23],ABA信號途徑由PYR/PYL/PCAR(ABA受體)、PP2C(蛋白磷酸酶2C家族)、SnRK2(SNF1相關蛋白激酶)和ABF(ABA響應轉錄因子)組成,通過4個部分的調節響應鹽脅迫信號。PYR/PYL能夠通過抑制PP2C,釋放SnRK2激酶,以磷酸化的形式調節ARF活性[24-25]。本研究中ARF的2個同源基因在2個品種中均表達上調,表明ABA含量升高,與Zhu等[22]研究結果一致,表明高粱通過提高植株體內ABA活性來對抗鹽脅迫。
生長素作為調節植物生長發育的植物激素,近年來發現對非生物脅迫也具有重要的調節作用[26-27]。有研究分析發現在非生物脅迫中生長素原初反應相關基因、、、的表達量發生改變[28]。鹽脅迫會使植物因為水分吸收受阻而導致滲透脅迫,研究表明外源增施生長素能夠提高擬南芥葉片的保水能力[29]。本研究獲得參與生長素途徑的基因家族,這些基因在鹽脅迫過程中被顯著調節。AUX/IAA的同源基因Sobic.003G291200在應對鹽脅迫過程中顯著提高。表明高粱應對外界鹽脅迫依賴于AUX/IAA介導的信號過程。
3.3 光合作用相關途徑
后期參與鹽脅迫的途徑為光合作用相關途徑,這些途徑包括光合器官中的碳固定、碳代謝和光合作用-天線蛋白途徑。光合作用是植物生產的能量的主要方式,對植物的生長發育起到至關重要的作用。
光合作用包括2個步驟:光反應階段和暗反應階段。光反應又分為2個階段:原初反應、電子傳遞和光合磷酸化。原初反應包含光能的吸收、傳遞和轉化。本研究中涉及到原初反應的途徑為光合作用-天線蛋白。LHC是一類捕光蛋白復合體,能夠捕獲光能并把能量傳遞至反應中心[19,30]。本研究發現在2個品種中Lhca和Lhcb 2組蛋白的表達量下調。可能是因為在鹽脅迫條件下,細胞內滲透勢升高,為了維持植物細胞內正常的生理活動,高粱葉片LHC多個蛋白下調表達,以降低光合速率,而使高粱適應鹽脅迫環境。PPC是C4作物進行光合作用碳固定的關鍵酶[31],本研究2個PPC同源基因(Sobic.002G167000、Sobic.007G106500)在石紅137中上調表達,一個PPC同源基因(Sobic.010G160700)在石紅137中下調表達,表明高鹽環境對高粱葉片的碳固定產生了影響。PRK是碳代謝的關鍵酶,將5-磷酸核酮糖催化合成1,5-二磷酸核酮糖(RuBP),PRK在2個品種中的下調表達表明,RuBP的再生受到抑制,從而影響光合作用的正常進行。
3.4 類黃酮生物合成途徑
類黃酮是一類植物次生代謝產物,常見的類黃酮包括查爾酮、黃酮醇、黃酮、黃烷醇、黃烷酮、花青素等。比較不同品種對照樣本未發現差異顯著代謝途徑,但對2個時期的鹽脅迫處理樣品進行比較發現共同的差異代謝途徑,即類黃酮生物合成途徑。對參與到此代謝途徑的基因進行比較發現石紅137中花青素還原酶(ANR)和黃酮醇合成酶(FLS)的表達量均高于L甜。結果表明,石紅137在次級代謝產物類黃酮合成過程要強于L甜。研究表明耐鹽植物的耐鹽性主要體現在植株體內的離子平衡,Na+和Cl-被貯藏在液泡內,保持細胞滲透勢的穩定。部分有機溶質,例如蛋白質、氨基酸等物質也起到穩定細胞滲透勢的作用[10]。則次級代謝產物的合成能力可能是石紅137和L甜是否耐鹽的重要原因。
4 結論
高粱的鹽脅迫過程是一個復雜的生物過程,依賴于多個基因在復雜網絡中的平衡表達。鹽脅迫條件下,高粱應對環境刺激受到激素信號轉導和光合作用的控制。類黃酮生物合成途徑在耐鹽品種中起到了重要作用。
[1] KAUSHAL S S. Increased salinization decreases safe drinking water ., 2016, 50(6): 2765-2766.
[2] KHALID N, AQSA T, IQRA, KHALID H, ABDUL M. Induction of salt tolerance in two cultivars of sorghum (L.) by exogenous application of proline at seedling stage., 2010, 10(1): 93-99.
[3] GUZM N-MURILLO M A, ASCENCIO F, LARRINAGA- MAYORAL J A. Germination and ROS detoxification in bell pepper (L.) under NaCl stress and treatment with microalgae extracts., 2013, 250(1): 33-42.
[4] MUNNS R. Comparative physiology of salt and water stress., 2002, 25(2): 239-250.
[5] 高玉紅, 閆生輝, 鄧黎黎. 不同鹽脅迫對甜瓜幼苗根系和地上部生長發育的影響. 江蘇農業科學, 2019, 47(3): 120-123.
GAO Y H, YAN S H, DENG L L. Effects of different salt stress on root and above-ground growth and development of muskmelon seedlings., 2019, 47(3): 120-123. (in Chinese)
[6] GULZAR S, KHAN M A, UNGAR I A. Salt tolerance of a coastal salt marsh grass., 2003, 34(17/18): 2595-2605.
[7] KERKEB L, DONAIRE J P, VENEMA K, RODR GUEZ-ROSALES M P. Tolerance to NaCl induces changes in plasma membrane lipid composition, fluidity and H+-ATPase activity of tomato calli., 2001, 113(2): 217-224.
[8] PARIDA A K, DAS A B, MITTRA B, MOHANTY P. Salt-stress induced alterations in protein profile and protease activity in the mangrove bruguiera parviflora., 2004, 59(5/6): 408-414.
[9] HARE P D, CRESS W A. Metabolic implications of stress-induced proline accumulation in plants., 1997, 21(2): 79-102.
[10] SERRAJ R, SINCLAIR R T. Osmolyte accumulation: can it really help increase crop yield under drought conditions., 2002, 25(3): 33-41.
[11] GANIE S A, MOLLA K A, HENRY R J, BHAT K V, MONDAL T K. Advances in understanding salt tolerance in rice., 2019, 132(4): 851-870.
[12] WANG M, WANG Y, ZHANG Y, LI C, GONG S, YAN S, LI G, HU G, REN H, YANG J, YU T, YANG K. Comparative transcriptome analysis of salt-sensitive and salt-tolerant maize reveals potential mechanisms to enhance salt resistance., 2019, 41(7): 781-801.
[13] AMIRBAKHTIAR N, ISMAILI A, GHAFFARI M R, NAZARIAN FIROUZABADI F, SHOBBAR Z S. Transcriptome response of roots to salt stress in a salinity-tolerant bread wheat cultivar., 2019, 14(3): e0213305.
[14] YANG Z, ZHENG H, WEI X, SONG J, WANG B, SUI N. Transcriptome analysis of sweet sorghum inbred lines differing in salt tolerance provides novel insights into salt exclusion by roots., 2018, 430(1): 423-439.
[15] AKBUDAK M A, FILIZ E, KONTBAY K. DREB2 (dehydration- responsive element-binding protein 2) type transcription factor in sorghum (): genome-wide identification, characterization and expression profiles under cadmium and salt stresses., 2018, 8(10): 426.
[16] FORGHANI A H, ALMODARES A, EHSANPOUR A A. Potential objectives for gibberellic acid and paclobutrazol under salt stress in sweet sorghum ([L.] Moench cv. Sofra)., 2018, 61(1): 113-124.
[17] 王海蓮, 張華文, 劉賓, 楊延兵, 秦嶺, 陳二影, 管延安. 低度鹽脅迫下高粱苗期相關性狀的QTL定位. 分子植物育種, 2017, 15(2): 604-610.
WANG H L, ZHANG H W, LIU B, YANG Y B, QIN L, CHEN E Y, GUAN Y A. QTL mapping for traits related to salt tolerance at seedling stage of Sorghum under low salt stress., 2017, 15(2): 604-610. (in Chinese)
[18] WANG H L. CHEN G L, ZHANG H W, LIU B, YANG Y B, GUAN Y A. Identification of QTLs for salt tolerance at germination and seedling stage ofL. Moench.,2014, 196: 117-127.
[19] 汪仁, 李曉丹, 江玉梅, 賀佳, 彭峰, 夏冰. 石蒜捕光葉綠素a/b結合蛋白基因的克隆和序列分析. 江蘇農業科學, 2011, 39(2): 42-44.
WANG R, LI X D, JIANG Y M, HE J, PENG F, XIA B. Cloning and sequence analysis of light-harvesting chlorophyll a/b binding protein gene from., 2011, 39(2): 42-44. (in Chinese)
[20] DUAN L, DIETRICH D, NG C H, CHAN P M, BHALERAO R, BENNETT M J, DINNENY J R. Endodermal ABA signaling promotes lateral root quiescence during salt stress inseedlings., 2013, 25(1): 324-341.
[21] ACHARD P, CHENG H, DE GRAUWE L, DECAT J, SCHOUTTETEN H, MORITZ T, VANDER S D, PENG J, HARBERD N P. Integration of plant responses to environmentally activated phytohormonal signals., 2006, 311(5757): 91-94.
[22] ZHU J K. Salt and drought stress signal transduction in plants., 2002, 53(1): 247-273.
[23] YAMAGUCHI-SHINOZAKI K, SHINOZAKI K. Transcriptional regulatory networks in cellular responses and tolerance to dehydration and cold stresses., 2006, 57(1): 781-803.
[24] CUTLER S R, RODRIGUEZ P L, FINKELSTEIN R R, ABRAMS S R. Abscisic acid: emergence of a core signaling network., 2010, 61(1): 651-679.
[25] FUJITA Y, NAKASHIMA K, YOSHIDA T, KATAGIRI T, KIDOKORO S, KANAMORI N, UMEZAWA T, FUJITA M, MARUYAMA K, ISHIYAMA K, KOBAYASHI M, NAKASONE S, YAMADA K, ITO T, SHINOZAKI K, YAMAGUCHI-SHINOZAKI K. Three SnRK2 protein kinases are the main positive regulators of abscisic acid signaling in response to water stress in., 2009, 50(12): 2123-2132.
[26] YUAN H, ZHAO K, LEI H, SHEN X, LIU Y, LIAO X, LI T. Genome-wide analysis of the GH3 family in apple (a)., 2013, 14(1): 297.
[27] CHEONG Y H, CHANG H-S, GUPTA R, WANG X, ZHU T, LUAN S. Transcriptional profiling reveals novel interactions between wounding, pathogen, abiotic stress, and hormonal responses in., 2002, 129(2): 661-677.
[28] SONG Y, WANG L, XIONG L. Comprehensive expression profiling analysis of OsIAA gene family in developmental processes and in response to phytohormone and stress treatments., 2009, 229(3): 577-591.
[29] LIU X, ZHANG H, ZHAO Y, FENG Z, LI Q, YANG H Q, LUAN S, LI J, HE Z H. Auxin controls seed dormancy through stimulation of abscisic acid signaling by inducing ARF-mediated ABI3 activation in Arabidopsis ., 2013, 110(38): 15485-15490.
[30] 李安節, 柳振峰. 植物光系統Ⅱ捕光過程的超分子結構基礎. 生物化學與生物物理進展, 2018, 45(9): 935-946.
LI A J, LIU Z F. Supramolecular structural basis of light harvesting in plant photosystem II., 2018, 45(9): 935-946. (in Chinese)
[31] O'LEARY B, PARK J, PLAXTON WILLIAMC. The remarkable diversity of plant PEPC (phosphoenolpyruvate carboxylase): recent insights into the physiological functions and post-translational controls of non-photosynthetic PEPCs., 2011, 436(1): 15-34.
Transcriptome Analysis and Gene Mining of Salt Tolerance in Sorghum Seedlings (L. Moench)
DONG Ming1, KUERBAN Zaituniguli2, Lü Peng1, DU RuiHeng1, Ye Kai2, HOU ShengLin1, LIU GuoQing1
(1Institute of Millet Crops, Hebei Academy of Agriculture & Forestry Sciences/The Key Minor Cereal Crops Laboratory of Hebei Province, Shijiazhuang 050035;2Institute of Bioenergy, Xinjiang Academy of Agriculture Sciences, Urumqi 830091)
【Object】The primary aim of this study was to identify salt tolerance genes and explore the tolerance response mechanism under salt stress in sorghum, which may provide a theoretical basis for sorghum salt tolerance breeding. 【Method】Two sorghum varieties, L-Tian, salt-sensitive and Shihong 137, salt-tolerant were employed as plant materials. The sorghum seedlings were treated with 2% NaCl solution at three-leaf and one heart stage. Three treatments including 0 h (CK), 1 h and 24 h were conducted. The plant height, root length, dry matter weight, Na+content and relative content of chlorophyll (SPAD value) were determined, and the transcriptome sequencing was performed on Illumina HiSeq 2000 platform. The FPKM method was employed to calculate the gene expression level. Both the differential expression fold (Fold Change) ≥ 2 and FDR<0.001 were used as screening criteria to detect the differentially expressed genes. The Gene Ontology and KEGG Pathway databases were used to analyze the differentially expressed genes involved in salt stress at different time points. 【Result】Salt stress had no significant effect on plant height, root length and dry matter weight of sorghum, but had significant effect on Na+content and SPAD value. The plant height, root length, Na+content and SPAD value of Shihong 137 were higher than those of L-tian. Totally 26628 known genes and 866 new genes have been identified from RNA-seq, of which, the number of differentially expressed genes from Shihong 137 is higher than that from L-tian. 375, 4206 and 3750 differentially expressed genes in 0 h vs 1 h, 0 h vs 24 h and 1 h vs 24 h groups had been identified from Shihong 137 respectively. The number of differentially expressed genes of 0 h vs 1 h, 0 h vs 24 h, and 1 h vs 24 h of L-tian was 167, 2534 and 1612, respectively. GO and KEGG analysis revealed that plant hormones such as abscisic acid, auxin, cytokinin, gibberellin and ethylene were involved in the salt tolerance of sorghum at an early stage of salt stress (1h), while Lhca, Lhcb, phosphoenolpyruvate carboxylase, and ribulose phosphate kinase were involved in the salt tolerance at a late stage of salt stress (24 h). The difference in salt tolerance between Shihong 137 and L-tian was mainly caused by the flavonoid biosynthetic metabolic pathway. 【Conclusion】The sorghum response to salt stress is a complex biological process that relies on the balanced expression of multiple genes in complex networks. Under salt stress, sorghum response to environmental stimuli was controlled by both hormonal signal transduction and photosynthesis. The flavonoid biosynthesis pathway played an important role in salt-tolerant varieties.
sorghum (L.); salt stress; transcriptome; gene mining
10.3864/j.issn.0578-1752.2019.22.005

2019-06-17;
2019-09-24
國家自然科學基金(31660435)、國家現代農業產業技術體系(CARS-06-13.5-A10)
董明,E-mail:dddongming@126.com。再吐尼古麗·庫爾班,E-mail:zaytungul@sohu.com。董明和再吐尼古麗·庫爾班為同等貢獻作者。通信作者侯升林,E-mail:shenglinhou@aliyun.com;劉國慶,E-mail:guoqingliu@hotmail.com
(責任編輯 李莉)

