外源茉莉酸甲酯對牛樟芝產總三萜及多糖含量的影響
張知曉 季梅 劉凌 戶連榮
摘要:為了探討茉莉酸甲酯(MeJA)對牛樟芝(Antrodia camphorata)發酵產三萜及多糖的影響及Ca2+對MeJA的誘導作用,向牛樟芝發酵基礎培養基中加入MeJA溶液,設置不同添加濃度(0、25、50、100、200 μmol/L)、不同時間(0、2、4、6、8 d)、不同溶劑3組試驗,培養后檢測牛樟芝生物量、三萜、胞外多糖及胞內多糖的含量,并同樣測試添加CaCl2的效果。結果表明,用MeJA處理牛樟芝,對其發酵產總三萜、多糖具有積極的促進作用,并且于培養4 d時向發酵培養基中添加用吐溫-80溶解的50 μmol/L MeJA溶液,促進作用最佳。此外,在添加MeJA的同時添加CaCl2的處理較僅添加MeJA的處理的牛樟芝生物量、三萜、胞外多糖及胞內多糖含量顯著增加。
關鍵詞:牛樟芝;MeJA;Ca2+;總三萜;多糖
中圖分類號: S646.9文獻標志碼: A
文章編號:1002-1302(2019)19-0133-04
收稿日期:2019-01-03
基金項目:云南省科技計劃項目青年項目(編號:2016FD096)。
作者簡介:張知曉(1988—),女,云南個舊人,碩士,助理研究員,研究方向為森林微生物資源的開發與利用。E-mail:36062613@qq.com。
通信作者:戶連榮,碩士,助理研究員,研究方向為森林生態保護與研究。E-mail:444387051@qq.com。
牛樟芝(Antrodia camphorata)又名樟芝、樟生薄孔菌等,是分屬擔子菌亞門(Basidiomycotina)層菌綱(Hymenomycetes)非褶菌目(Polyporales)多孔菌科(Polyporaceae)薄孔菌屬(Antrodia)的珍稀藥用真菌[1],被譽為“森林中的紅寶石”[2]。牛樟芝中的三萜類物質是其最主要的1種藥用化學成分,可以起到保肝護肝、抑制癌細胞生長、降血壓、抗炎癥的作用,且牛樟芝中三萜類化合物的含量和種類都是靈芝的數倍,樟芝三萜也因此成為開發樟芝的研究重點之一[3]。此外,樟芝中含有的多糖對人體起到提高免疫力、抑制病毒的作用,對保護肝臟也有一定的效果[4]。
茉莉酸甲酯(MeJA)是一種脂肪酸衍生物,在植物中起著信號傳遞的作用,同時能夠明顯促進植物產生次級代謝產物[5]。已有研究表明,將MeJA作為誘導劑添加到靈芝(Ganoderma lucidum)和樺褐孔菌(Inonotus obliquus)的發酵培養基中,發酵后的三萜產量均較對照有明顯提高[6-7]。而在這方面,關于同屬多孔菌目牛樟芝的研究還未見報道。此外,鈣(Ca)是生物生長必需的營養元素,參與構成生物組織,調節生物生長發育,參與調控植物抗逆等生理反應[8]。已有部分研究發現,Ca2+參與MeJA介導的信號轉導過程,如馬泓思等發現,外源Ca2+離子能進一步增強MeJA 誘導的白樺(Betula platyphylla)細胞懸浮液合成三萜類物質的效果[9]。而關于Ca2+促進MeJA誘導真菌合成三萜類物質方面的研究尚未見報道。基于牛樟芝中的三萜、多糖具有極高的藥用價值,本研究以牛樟芝為試驗材料,研究MeJA對牛樟芝2種藥用成分的影響及Ca2+處理對MeJA作用的影響,以期初步探明1種增加牛樟芝三萜及多糖產量的方法。
1 材料與方法
1.1 供試材料
本研究所用菌種為從中國臺灣引進的牛樟芝優良菌株。
1.1.1 培養基和菌株培養條件 基礎培養基配方:25 g葡萄糖,5 g蛋白胨,3 g麥芽糖,3 g酵母提取物,1 g KH2PO4,1 g MgSO4,1 g維生素B1,1 L水,pH值5.5。
孢子懸浮液的制備方法:取已培養20d的牛樟芝培養皿,用20 mL無菌水洗下培養皿表面的孢子備用。
基礎培養方法:在500 mL三角瓶中裝100 mL基礎培養基,接入1 mL牛樟芝孢子懸浮液,搖床上于100 r/min、26 ℃恒溫培養12 d后,收集菌絲。
1.1.2 主要試劑 茉莉酸甲酯,購于Sigma公司;齊墩果酸及其他試劑,購于昆明騰科科技有限公司。
1.2 試驗方法
1.2.1 試驗時間和地點 本試驗于2018年3—7月在云南省林業科學院實驗室內進行。
1.2.2 樣品處理 (1)將MeJA用無水乙醇配制成終濃度為25、50、75、100、200 μmol/L的溶液。采用0.2 μm的無菌針頭式過濾器過濾進行滅菌處理后,在基礎搖瓶發酵方法的基礎上,于4 d后添加到培養基中,添加量為2 μL/mL,搖床培養,每個處理設3個重復。培養結束后取樣分析其生物量、總三萜量、胞內多糖和胞外多糖量。
(2)將MeJA用無水乙醇配制成終濃度為50 μmol/L的溶液。于不同培養時間(培養0、2、4、6、8d)添加到培養基中,搖床培養,每個處理設3個重復。培養結束后取樣分析。
(3)以無水乙醇、吐溫-20、吐溫-80作為助溶劑,將MeJA配制成終濃度為50 μmol/L的溶液,于4 d后添加到培養基中,搖床培養,每個處理設3個重復。培養結束后取樣分析,篩選出MeJA的最佳添加方案。
在MeJA最佳添加方案的基礎上,向培養基中同時添加CaCl2,使CaCl2的終濃度為75 nmol/L。另外設置2組對照組,分別僅向培養基中添加MeJA、CaCl2。設3組獨立試驗。培養結束后取樣分析其生物量、總三萜量、胞內多糖和胞外多糖量。
1.2.3 生物量的測定 生物量的測定方法參照文獻[10]。通過抽濾分離發酵液與菌絲體,菌絲體用蒸餾水反復沖洗至洗液變為無色,置于干燥箱中,于70 ℃烘干至恒質量,對干燥菌絲體用精度為0.001 g的電子天平稱量,即得菌絲體生物量。
1.2.4 菌絲體內總三萜含量的測定 采用香草醛-冰醋酸-高氯酸顯色體系對總三萜含量進行測定。具體步驟參考楊彬君等的方法[11]。
1.2.5 胞外多糖含量的測定 胞外多糖含量的測定方法參照文獻[12]。將發酵液(用濾紙)過濾,取100 mL濾液在 60 ℃ 下旋轉蒸發,使濾液濃縮至原體積的1/3,加3倍體積的無水乙醇靜置沉淀24 h,4 000 r/min離心分離15 min,沉淀經無水乙醇輕輕沖洗后,用烘箱于50 ℃烘干至恒質量,得到胞外粗多糖。
1.2.6 胞內多糖含量的測定 胞內多糖含量的測定方法參照文獻[13]。將菌絲體用烘箱烘干至恒質量,研磨過篩,置于圓底燒瓶中,加30倍體積的水,于80 ℃水浴1 h,水浴提取后,再用超聲波提取30 min,重復2次提取多糖,合并提取液,離心、過濾,濾液用硫酸-苯酚法測定多糖含量。
1.2.7 統計學分析 采用SPSS 11.5軟件對數據進行統計和數理分析。
2 結果與分析
2.1 MeJA不同添加濃度對牛樟芝發酵特性的影響
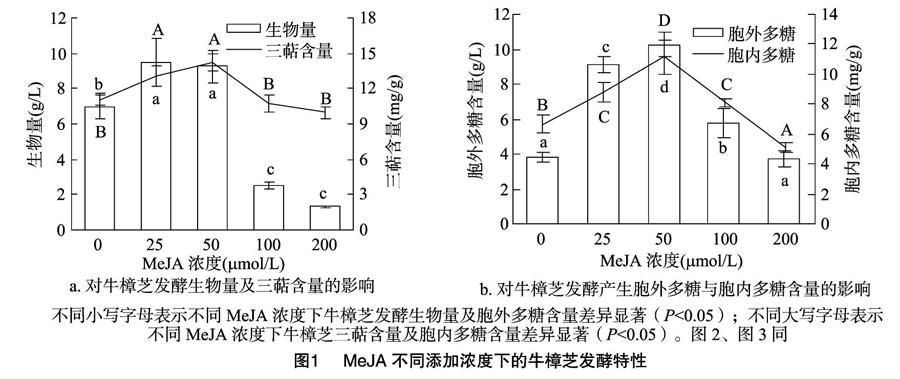
MeJA不同添加濃度對牛樟芝生物量及三萜含量的影響如圖1-a所示,可見當MeJA添加濃度為25 μmol/L時,1L發酵液中的牛樟芝生物量達9.46 g;當MeJA添加濃度為50 μmol/L 時,牛樟芝的生物量達9.25 g/L,與MeJA添加濃度為25 μmol/L處理間的生物量無顯著差異;當MeJA添加濃度為0 μmol/L時,牛樟芝的生物量較MeJA添加濃度為 25 μmol/L 時降低了2.55 g/L,但顯著高于MeJA添加濃度為100、200 μmol/L時的生物量。三萜含量在MeJA添加濃度為50 μmol/L時最高(14.21 mg/g),其次為MeJA添加濃度為25、100 μmol/L的處理,當MeJA添加濃度為0、200 μmol/L時,三萜含量最低。
MeJA不同添加濃度對牛樟芝胞外多糖及胞內多糖含量的影響如圖1-b所示,可見當MeJA添加濃度為50 μmol/L時,牛樟芝胞外多糖、胞內多糖含量均最高,分別為 10.27 g/L、11.5mg/g;當MeJA添加濃度為0、200 μmol/L時,胞外多糖含量均較低,二者間無顯著差異,而當胞內多糖含量最低時,對應的MeJA添加濃度為200 μmol/L。
2.2 MeJA不同添加時間對牛樟芝發酵特性的影響
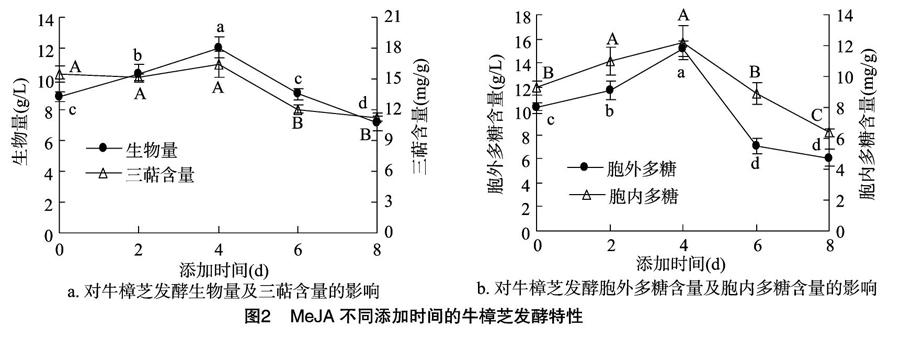
MeJA不同添加時間對牛樟芝生物量及三萜含量的影響如圖2-a所示,可以看出,于培養4 d時添加MeJA發酵的牛樟芝生物量顯著高于其他時間的生物量,為12.04 g/L,而于培養8 d時添加MeJA產生的生物量最低,僅為7.11 g/L。于培養0、2、4 d時添加MeJA的三萜含量分別為15.48、15.12、16.42 mg/g,三者間無顯著差異,但顯著高于其他試驗組。
MeJA不同添加時間對牛樟芝胞外多糖及胞內多糖含量的影響如圖2-b所示,可以看出,于培養4 d時添加MeJA發酵的胞外多糖含量最高,達15.18 g/L,于培養6、8 d時添加MeJA產生的胞外多糖含量較低,分別較培養4 d時降低了53%、60%。同樣,于培養4 d時添加MeJA產生的胞內多糖含量最高(12.2 mg/g),其次是培養2 d時添加MeJA的胞內多糖含量,二者間無顯著差異, 于培養8 d時添加MeJA產生的胞內多糖含量最低,僅為6.4 mg/g。
2.3 MeJA不同溶劑對牛樟芝發酵特性的影響
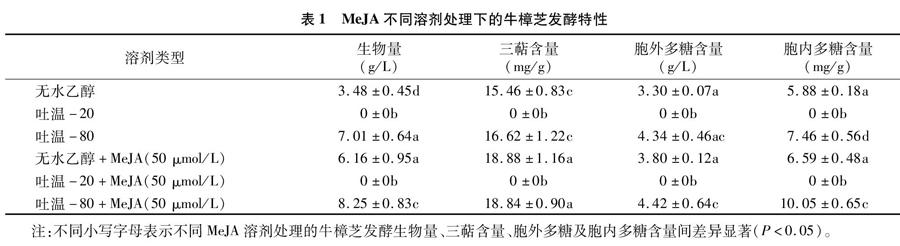
由表1可以看出,以吐溫-80為溶劑的MeJA溶液對牛樟芝發酵后生物量的促進作用最佳,生物量達到8.25 g/L,單獨添加吐溫-80溶液的效果次之;以無水乙醇為溶劑的MeJA溶液處理的生物量為6.16 g/L,單獨添加無水乙醇溶液的生物量為3.48 g/L;以吐溫-20為溶劑的MeJA溶液和單獨添加吐溫-20的溶液發酵的牛樟芝生物量均為0 g/L。幾組處理的三萜含量排序如下:添加MeJA(無水乙醇)溶液≥添加MeJA(吐溫-80)溶液>吐溫-80≥無水乙醇。
比較胞內多糖、胞外多糖含量可知,兩者均在以吐溫-20為溶劑的試驗組最低,次低的是以無水乙醇為溶劑的試驗組,而在以MeJA(吐溫-80)溶液為溶劑的試驗組最高,較無水乙醇試驗組分別提高了71%、34%。
2.4 Ca2+介導MeJA的影響(添加Ca2+對MeJA誘導作用的影響)
如圖3所示,發酵后牛樟芝生物量、胞外多糖含量和胞內多糖含量均呈現出相同的趨勢,表現為MeJA+CaCl2>MeJA>CaCl2>CK,而發酵后的三萜含量為MeJA+CaCl2>MeJA>CK>CaCl2。其中,效果最好的MeJA+CaCl2組牛樟芝的生物量、三萜含量、胞外多糖含量和胞內多糖含量分別為 10.91 g/L、13.48 mg/g、6.36 g/L、8.80 mg/g,分別較CK提高了79.10%、27.90%、77.20%、103.02%。
3 結論與討論
茉莉酸甲酯對多種次生代謝產物的合成具有誘導作用[14],近些年來也陸續出現將其用于微生物發酵上的研究。辛燕花等將MeJA添加于靈芝發酵培養基中,發現它能夠提高靈芝多糖、靈芝酸的產量[15]。楊文建等發明了1種用MeJA溶液噴灑雙孢蘑菇的方法,經證實該方法能夠促進雙孢蘑菇產麥角甾醇[16]。此外,MeJA還能夠促進微生物細胞中萜類物質的合成,Ren等首次將MeJA作為誘導劑添加到靈芝發酵培養基中,發現其靈芝三萜的產量比未經處理的提高了45.3%[6]。向超也證實,用MeJA誘導樺褐孔菌發酵產三萜,其三萜總產量較對照提高了53.2%[7]。本研究結果表明,在液體發酵過程中添加MeJA,能顯著提高牛樟芝發酵的生物量與三萜、胞外多糖、胞內多糖含量,最適宜的添加濃度為50 μmol/L,于培養4d時對各指標的促進效果最佳,以吐溫-80作為溶劑最有利于MeJA發揮促進作用。而有研究發現,吐溫-20對牛樟芝的生長具有強烈的抑制作用,這可能由于其具有較短的碳鏈,作為表面活性劑在細胞壁內表現出較高的擴散率,可能會造成細胞膜受損,或者影響與其他細胞內生物分子的相互作用,甚至會降低細胞的存活率[17]。
目前,MeJA誘導微生物產三萜的機制已經明確,這些萜類化合物都是由單個異戊二烯通過甲羥戊酸途徑合成得到的,MeJA能夠促使甲羥戊酸途徑中hmgs、hmgr、mvd、fps、sqs、osc、lss和ss等相關酶基因的超表達[18-21]。以茯苓為研究對象,探究MeJA誘導其產三萜的效果及機制發現,于發酵第4天添加MeJA溶液(150 μmol/L),可使得到的三萜含量較空白組增加0.55倍;實時熒光定量PCR分析可知,其sqs(甲基戊酸途徑鯊烯合酶基因)和fps(法尼基焦磷酸合成酶基因)的表達水平均發生了顯著上調[22]。任昂也以靈芝為材料,探究了在三萜的生物合成途徑中,關鍵酶編碼基因轉錄受MeJA的影響,結果表明,hmgr、fps、sqs、osc等基因均被誘導表達[23]。
鈣有多種生物學功能,是非常重要的第二信使,通過改變細胞質中游離的Ca2+濃度,可以將細胞表面上接收的信號傳遞到細胞內,并由一系列效應器接收和分析,調節生物生長、發育等生理反應[24],在微生物中,Ca2+經常作為活性酶的輔因子或激活因子發揮作用[25]。在本研究中,同時添加MeJA、CaCl2時,牛樟芝發酵后的生物量、三萜含量、胞外多糖和胞內多糖含量較單獨添加MeJA及其他試驗組明顯提高。結果表明,Ca2+對MeJA誘導牛樟芝發酵產三萜等有用物質起到了積極的介導作用,這與王艷用Ca2+介導MeJA誘導白樺懸浮培養產三萜的試驗結果相似[26]。
參考文獻:
[1]胡 鷗,張君逸,盧 喜. 樟芝及其研究開發概況[J]. 福建熱作科技,2006,31(4):40-42.
[2]馬曉蕾. 臺灣紅寶石——牛樟菇[J]. 中國商貿,2013(19):42-43.
[3]張知曉,季 梅,澤桑梓. 牛樟芝培養技術的研究進展[J]. 熱帶農業科學,2015,35(3):94-99.
[4]于 宏. 樟芝化學成分與生物活性研究進展[J]. 國外醫藥:植物藥分冊,2006,21(5):199-202.
[5]朱宏濤,李 江,李 元,等. 激素類農藥茉莉酸及其甲酯的植物生物活性及其在農業生產中的應用[J]. 農藥,2013,52(8):552-557,562.
[6]Ren A,Qin L,Shi L,et al. Methyl jasmonate induces ganoderic acid biosynthesis in the basidiomycetous fungus Ganoderma lucidum[J]. Bioresource Technology,2010,101(17):6785-6790.
[7]向 超. 液體深層發酵培養的樺褐孔菌三萜化合物的生物合成研究[D]. 杭州:浙江理工大學,2011.
[8]朱縱宇. 鈣的生理作用及鈣肥的施用方法[J]. 西北園藝,2015(6):5-8.
[9]馬泓思,潘亞婕,王 艷,等. Ca2+在介導MeJA誘導白樺懸浮培養三萜合成中的作用[J]. 植物研究,2015,35(1):117-126.
[10]姚秀英. 牛樟芝人工培養條件的初步研究[D]. 濟南:山東師范大學,2011:37-39.
[11]楊彬君,吳建國,吳巖斌,等. 紫外分光光度法測定牛樟芝子實體的總三萜含量[J]. 福建中醫藥,2018,49(4):70-71.[HJ1.77mm]
[12]高玉梅. 香菇液體發酵培養胞外多糖高產菌株的篩選及抗氧化活性研究[D]. 長春:吉林大學,2009:27-28.
[13]葉麗云,林 強,劉 梅,等. 鈣離子和水楊酸誘導靈芝多糖和三萜的合成[J]. 菌物學報,2017,36(2):220-228.
[14]徐 偉,嚴善春. 茉莉酸在植物誘導防御中的作用[J]. 生態學報,2005,25(8):2074-2082.
[15]辛燕花,張鐵丹,楊龍龍,等. 外源茉莉酸甲酯對靈芝多糖及靈芝酸含量的影響[J]. 山西農業大學學報(自然科學版),2017,37(9):656-662.
[16]楊文建,杜恒君,胡秋輝.一種提高雙孢蘑菇中麥角甾醇含量的方法:105706741[P]. 2016-06-29.
[17]陳 程. 誘導劑對樺褐孔菌深層發酵生物合成三萜化合物的影響[D]. 杭州:浙江理工大學,2014.
[18]Ding Y X,Ouyang X,Shang C H,et al. Molecular cloning,characterization,and differential expression of a farnesyl diphosphate synthase gene from the basidiomycetous fungus Ganoderma lucidum[J]. Biosci Biotechnol Biochem,2008,72(6):1571-1579 .
[19]Shang C H,Shi L,Ren A,et al. Molecular cloning,characterization,and differential expression of a lanosterol synthase gene from Ganoderma lucidum[J]. Bioscience Biotechnology and Biochemistry,2010,74(5):974-978.
[20]Shang C H,Zhu F,Li N,et al. Cloning and characterization of a gene encoding HMG-CoA reductase from Ganoderma lucidum and its functional identification in yeast[J]. Bioscience,Biotechnology,and Biochemistry,2008,72(5):1333-1339.
[21]Zhao M W,Liang W Q,Zhang D B,et al. Cloning and characterization of squalene synthase(SQS)gene from Ganoderma lucidum[J]. Journal of Microbiology and Biotechnology,2007,17(7):1106-1112.
[22]陳 林,崔培梧,魯耀邦,等. 茉莉酸甲酯對茯苓三萜生物合成的調控研究[J]. 湖南中醫藥大學學報,2017,37(6):606-610.
[23]任 昂. 茉莉酸甲酯對靈芝三萜生物合成的影響及其靈芝應答基因的差異表達研究[D]. 南京:南京農業大學,2012:31.
[24]余朝閣,李天來,張亢亢,等. 鈣對茉莉酸甲酯誘導番茄抗灰霉病及防御酶活性的調控作用[J]. 中國蔬菜,2012,3(18):166-170.
[25]龐建勛. 產脂肪酶微生物的篩選及鈣對其發酵產酶與酶學性質的影響[D]. 無錫:江南大學,2008:7-8.
[26]王 艷. 鈣離子在SA和MeJA誘導白樺三萜合成中的作用及機制[D]. 哈爾濱:東北林業大學,2014:21.

