油茶樹根際土壤解有機磷細菌的分離、鑒定及解磷能力分析
陳定安 魏小武 張敏


摘 要:為了獲得高效解有機磷細菌,從油茶植株根際土壤中分離到21株解有機磷細菌,采用透明圈法進行復篩,僅有4株細菌能在有機磷培養基上形成明顯的透明圈。4株細菌的D/d值在1.62~2.71之間,其中菌株Y6的D/d值最大,為2.71;發酵上清液有效磷含量為8.50~14.79 mg/L,較CK增加7.88~14.17 mg/L,其中菌株Y6發酵上清液有效磷含量最多,為 14.79 mg/L,較CK增加14.17 mg/L。根據菌株Y6的菌落形態特征和生理生化特征及16S rDNA序列分析結果,初步確定菌株Y6為假單胞菌屬。該菌株有利于改善油茶磷素供應,促進油茶生長,在生物有機肥研制中具有較大潛力。
關鍵詞:解有機磷細菌;假單胞菌;有效磷;油茶
中圖分類號:S154.3文獻標識碼:A文章編號:1006-060X(2019)10-0008-04
Abstract: In order to obtain high-efficiency organophosphate-dissolving bacteria, 21 strains of organophosphate-dissolving bacteria were isolated from the tea-oil rhizosphere soil, and the transparent circle method was used for rescreening. Only 4 bacteria could form obvious transparent circles on the organic phosphorus medium. The D/d values of the four bacteria ranged from 1.62 to 2.71, and the strain Y6 had the largest D/d value of 2.71. The effective phosphorus content of the fermentation supernatant was 8.50-14.79 mg/L, which was 7.88-14.17 mg/L higher than that of CK. The strain Y6 had the highest soluble phosphorus content of 14.79mg/L in the fermentation supernatant, which was 14.17mg/L higher than CK. According to 16S rDNA sequence analysis, morphological, physiological and biochemical characteristics, strain Y6 was initially identified as Pseudomonas. Strain Y6 is beneficial to improving the supply of phosphorus in tea-oil rhizosphere soil and promoting the growth of tea-oil tree. It has great potential in the development of bio-organic fertilizer.
Key words: organophosphate-dissolving bacteria; Pseudomonas; effective phosphorus; tea-oil tree
磷是植物生長所需的主要營養元素之一。農田土壤中全磷的含量高,但是有效磷的含量卻很低。這是因為土壤中的磷主要是以難溶性的化合物存在,絕大部分不能被植物直接吸收利用。我國有74%的耕地土壤存在缺磷現象[1],有機態磷約占土壤全磷量的20%~50%[2]。通常采用施用化學磷肥的方式提供植物所需的磷元素,但是化學磷肥利用率很低,通常只有 5%~25%[3]。解磷菌能將難溶性或不溶性磷轉化為植物可利用的形態,提高土壤中磷元素的利用率。林啟美等[4]通過對農田、草坪、林地和菜地根際土壤溶磷微生物數量和種群結構的研究,發現有機磷細菌主要為芽孢桿菌屬,其次是假單胞菌屬。
油茶是我國所特有的世界4大木本油料樹種之一[5]。截至2018年末,湖南省油茶林總面積達到140.74萬hm2,茶油總產量26.2萬t,產值450億元,居全國首位[6]。茶籽油中含有單不飽和脂肪酸——油酸,能夠降低血液中膽固醇和低密度脂蛋白的濃度,預防心血管疾病的發生[7]。研究表明,油茶根際土壤中存在溶磷菌,可以改良土壤理化性質,促進植物生長,增加作物產量,對生態環境友好[8]。
課題組從健康的油茶植株根際土壤采樣,分離獲得一批可分解有機磷的菌株,從中篩選出一株高效解有機磷細菌,對其解磷能力進行了分析,通過菌落形態特征和生理生化特征以及16S rDNA序列分析,初步確定菌株的分類地位,為微生物肥料的研制提供理論依據,進而達到減少化肥施用量、提高產品質量、降低生產成本的目的。
1 材料與方法
1.1 試驗材料
1.1.1 樣品采集 采集邵陽市油茶林健康的油茶植株根際土壤,置于陰涼處自然風干后于4℃的冰箱內保存備用。
1.1.2 培養基 (1)有機磷培養基:葡萄糖 10 g,(NH4)2SO4 0.5 g,NaCl 0.3 g,KCl 0.3 g,MgSO4·7H2O 0.3 g,FeSO4·7H2O 0.03 g,MnSO4·4H2O 0.03 g,卵磷脂 0.2 g,CaCO3 5.0 g,酵母膏 0.4 g,瓊脂 20 g,dd H2O 1 000?mL,pH值7.0~7.5。(2)LB培養基參見文獻[9]。
2.6 解有機磷細菌Y6的生長曲線
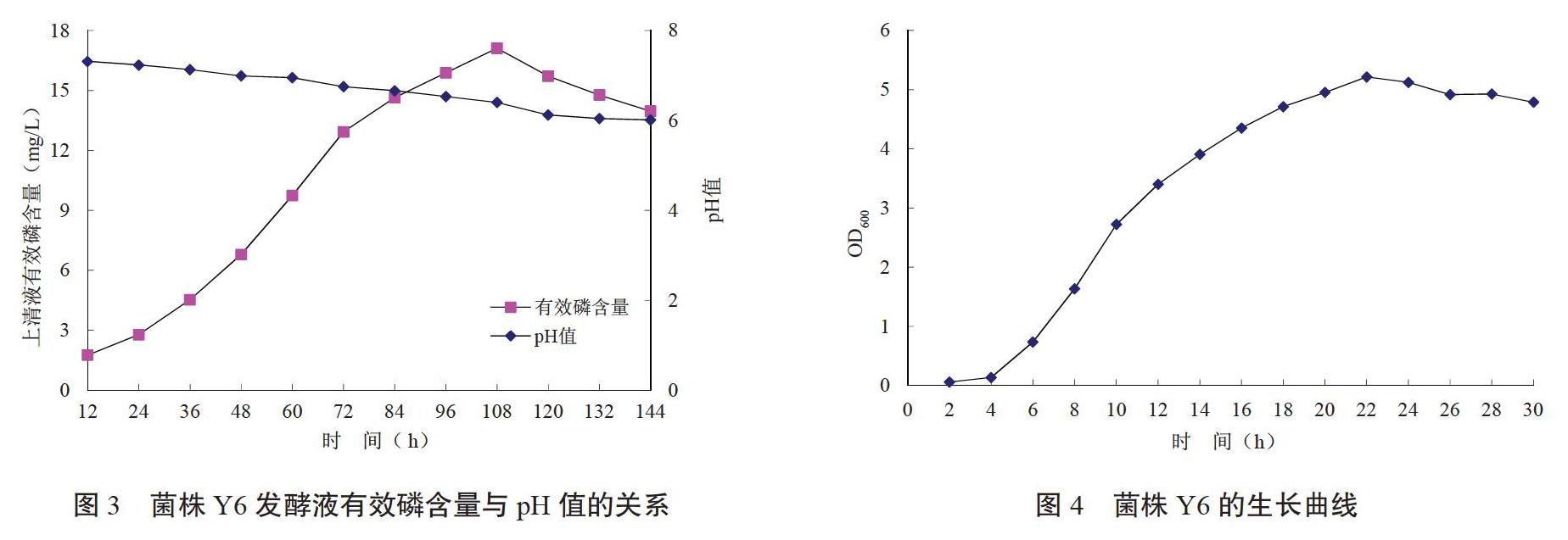
微生物的生長曲線,可以分為延緩期、對數期、穩定期和衰亡期4個階段。從圖4可以看出,在LB液體培養基中,菌株Y6的延緩期在4 h以內,4 h后OD600值迅速增加,進入對數生長期,22 h后OD600值達到最大,為5.21,隨后進入穩定期,并保持相當長時間。
3 結論與討論
目前,解有機磷細菌的分離,主要以卵磷脂作為單一的有機磷來源,解有機磷細菌分泌的磷酸酶將卵磷脂分解為膽堿、甘油、脂肪酸、磷酸,膽堿被進一步分解為胺、有機酸、二氧化碳、醇,最終在有機磷培養基上形成透明圈[11]。課題組從健康的油茶植株根際土壤采樣,共分離到21株在有機磷培養基上有透明圈的菌株,采用溶磷圈法進行復篩,僅有4株細菌能在有機磷培養基上形成明顯的透明圈,其余17株菌沒有透明圈,失去解磷現象。Venkateswarlu 等[12]也報道過大多數解磷細菌經過幾次傳代培養后,會失去解磷能力。
30℃恒溫箱中培養4 d,4株細菌的D/d值在1.62~2.71之間,其中菌株Y6的透明圈直徑(D)為24.9 mm,菌圈直徑(d)為9.2 mm,D/d值最大,為2.71。D/d比值的大小只是說明細菌具有解磷能力,不能判定細菌解磷能力的大小,很多學者有類似的觀點[13-14]。
4株細菌在30℃恒溫搖床振蕩培養4 d后,發酵上清液有效磷含量為8.50~14.79 mg/L,CK上清液有效磷含量為0.62 mg/L,上清液有效磷增加量為7.88~14.17 mg/L,其中菌株Y6發酵上清液有效磷含量最高,為 14.79 mg/L,較CK增加14.17 mg/L。4株細菌的D/d值從大至小排列依次為Y6>Y12>Y11>Y3,而4株細菌發酵上清液有效磷含量由高到低排列依次為Y6>Y3>Y12>Y11,表明解磷細菌D/d 值和發酵上清液有效磷含量之間并不總是呈正相關,這與伍善東等[15]的研究結果一致。
菌株Y6的發酵液pH值隨著培養時間的增加逐步降低,培養144 h后發酵液pH值穩定在6.01。發酵上清液有效磷含量先升高后降低,培養108 h后發酵上清液有效磷含量達最大值,為17.11 mg/L,說明菌株Y6發酵液pH值的變化不是其解有機磷的必要條件。趙小蓉等[16]的研究表明,發酵液有效磷含量與培養液pH值存在一定的相關性,但是培養液pH的下降,并不是解磷的必要條件,對此,很多學者也發現二者的相關性較為微弱[17-18]。發酵培養液pH值的下降與解磷菌分泌有機酸有關,H+還有其他來源,如NH4+/H+交換機制和呼吸作用。目前,認為解有機磷細菌分泌磷酸酶是主要的解磷機理之一,張淑紅[19]認為解有機磷細菌分泌的有機酸、蛋白質和多糖可能也具有一定的溶磷效果。
根據菌株Y6的菌落形態特征和生理生化特征及16S rDNA序列分析結果,初步確定菌株Y6為假單胞菌屬。
參考文獻:
[1] 趙小蓉,林啟美. 微生物解磷的研究進展[J]. 土壤肥料,2001(3):7-11.
[2] 韓 梅,溫志丹,肖亦農,等. 解磷細菌的篩選及對植物病原真菌的拮抗作用[J]. 沈陽農業大學學報,2009,40(5):594-597.
[3] Brookes P C,Poelson D S,Jenkinson D S. Phosphorus in the soil microbial biomass[J]. Soil Biology and Biochemistry,1984,16:169-175.
[4] 林啟美,趙小蓉,孫焱鑫,等. 四種不同生態系統的土壤解磷細菌數量及種群分布[J]. 土壤與環境,2000,9(1):34-37.
[5] 彭紹峰,陳永忠,張日清,等. 油茶果形果色分類及經濟性狀[J]. 中南林業科技大學學報,2007,27(5):33-39.
[6] 2018年湖南油茶產值達450億元--ZAKER新聞[EB/OL]. http://hunan.ifeng.com/a/20190517/7434108_0.shtml,2019-05-17.
[7] 王雁燦,楊 燦,唐小武,等. 油茶籽的營養價值及其應用現狀[J]. 畜牧與飼料科學,2017,38(6):29-32.
[8] 茍志輝. 油茶根際功能菌株的組合優化及菌肥研究[D]. 長沙:中南林業科技大學,2010.
[9] 黃秀梨,夏立秋,辛明秀,等. 微生物學實驗指導[M]. 北京:高等教育出版社,1999.
[10] 東秀珠,蔡妙英. 常見細菌系統鑒定手冊[M]. 北京:科學出版社,2001.
[11] 王 琛,張學雷,崔龍波,等. 印度洋可培養解有機磷細菌的多樣性及解磷特性[J]. 微生物學通報,2015,42(10):1847-1857.
[12] Venkateswarlu B,Rao A V,Raina P. Evaluation of phosphorus solubilisation by microorganisms isolated from aridsoil[J]. Journal of the Indian Society of Soil Science,1984,32(2):273-277.
[13] 王繼雯,甄 靜,謝寶恩,等. 有機磷降解菌的分離篩選及初步鑒定[J]. 河南科學,2011,29(1):31-34.
[14] 劉小玉,付登強,陳良秋,等. 油茶根際溶磷菌的分離、鑒定及溶磷能力研究[J]. 生物技術通報,2015,31(7):169-173.
[15] 伍善東,劉清術,付祖姣,等. 解有機磷拮抗細菌的篩選及其解磷特性和拮抗作用[J]. 江蘇農業學報,2017,33(4):843-847.
[16] 趙小蓉,林啟美,孫焱鑫,等. 細菌解磷能力測定方法的研究[J]. 微生物學通報,2001,28(1):1-4.
[17] 陳 俊,陸俊錕,康麗華,等. 紅樹林溶磷菌的初步鑒定、溶磷能力測定及其優化培養[J]. 微生物學通報,2009,36(8):1183-1188.
[18] 王 琛,田欣欣,曲凌云. 九龍江口解有機磷細菌的解磷特性[J]. 海洋環境科學,2013,32(5):736-740.
[19] 張淑紅. 1株溶磷細菌的篩選及其溶磷物質分析[J]. 河南農業科學,2014,43(8):64-67.
(責任編輯:成 平)

