奶渣蛋白肽的分離純化及其抗氧化活性研究
魏光強,黃琳茹,林詩洋,黃艾祥
(云南農(nóng)業(yè)大學(xué)食品科學(xué)技術(shù)學(xué)院,昆明650201)
0 引 言
奶渣(Milk residue),是藏區(qū)牧民提取酥油后制成的副產(chǎn)品,含有豐富的蛋白質(zhì)[1],是易于保存的優(yōu)質(zhì)蛋白來源。貫筋藤凝乳酶為一種復(fù)合蛋白酶能降解乳中酪蛋白(CN)產(chǎn)生小分子肽,可用于酶解奶渣制備蛋白肽。自由基具有強氧化性,可損害機體的組織和細胞[2-3],引起衰老和慢性疾病,抗氧化肽安全、易吸收,所以開發(fā)天然抗氧化劑成為營養(yǎng)學(xué)研究的熱點[4]。目前,多肽分離純化的方法主要有超濾法[5]、凝膠色譜層析[6]、離子交換層析、吸附層析及高效液相色譜等。
奶渣作為副產(chǎn)品,產(chǎn)量高、價格低廉,除直接食用外,緊局限于干酪素的生產(chǎn)[7-8],本研究采用貫筋藤蛋白酶酶解制備奶渣蛋白肽,通過超濾制備分子量10 ku以下的蛋白肽樣品,采用Q-Sepharose FF層析柱進一步分離純化獲得具有較高抗氧化活性的奶渣蛋白肽組。本研究為進一步深入研究和開發(fā)天然抗氧化蛋白肽以及奶渣制品奠定基礎(chǔ)。
1 實驗
1.1 材料
原料為貫筋藤凝乳酶(由實驗室自制)[9-10]和奶渣。
試劑:2,2-聯(lián)苯基-1-苦基肼基(DPPH),質(zhì)量分數(shù)為30%過氧化氫(H2O2),2,2-聯(lián)氮-雙(3-乙基苯并噻唑啉-6-磺酸)二銨鹽(ABTS),谷胱甘肽(GSH)標(biāo)準品,HPLC≥98%。
1.2 儀器與設(shè)備
Q-Sepharose FF(Q-瓊脂糖凝膠FF),DHG-9070A真空冷凍干燥機,SBS-100數(shù)控計滴自動部分收集器,URA14M 0018分光光度計,RE-52AA旋轉(zhuǎn)蒸發(fā)儀,TGL20M高速冷凍離心機,HL-2恒流泵,磁力加熱攪拌器。
1.3 方法
1.3.1 奶渣蛋白肽的制備
奶渣→超微粉碎→加水溶解→超聲提取→振蕩水浴酶解→離心→取上清液→冷凍干燥→奶渣蛋白肽。
1.3.2 填料Q-Sepharose FF的處理
將溶脹在體積分數(shù)為20%乙醇中的強陰離子填料Q-Sepharose FF攪勻,按實驗所需取出相應(yīng)的量,靜置后,用pH=8.0濃度為20 mmol/L的Tris-HCl起始緩沖液置換體積分數(shù)20%的乙醇溶液3~5次,最終使緩沖液與膠體的體積比為1∶3。
1.3.3 奶渣蛋白肽的Q-Sepharose FF柱層析分離
將處理好的Q-Sepharose FF裝入色譜柱中,接恒流泵,用3倍體積、一定濃度的NaCl溶液平衡色譜柱,待設(shè)置的流速穩(wěn)定后,加入一定濃度的過0.45μm濾膜奶渣蛋白肽,連接好自動部分收集器,收集色譜峰,測定220 nm下的吸光值,繪制色譜峰。
通過單因素實驗優(yōu)化Q-Sepharose FF色譜柱分離的洗脫液(NaCl)濃度、流速、上樣濃度,以獲得最優(yōu)分離純化工藝。
(1)NaCl洗脫濃度的篩選。分別使用濃度為0,0.05 mol/L和0.10 mol/L的NaCl溶液進行洗脫,繪制特征吸收峰峰圖,根據(jù)洗脫峰型確定最佳洗脫液濃度。
(2)洗脫流速的篩選。分別在0.5,1.0 mL/min和2.0 mL/min流速下進行洗脫,記錄數(shù)據(jù),繪制特征吸收峰峰圖,根據(jù)洗脫峰型確定最佳洗脫流速。
(3)上樣濃度的篩選。分別對Q-Sepharose FF柱加載質(zhì)量濃度10,20 mg/mL和40 mg/mL奶渣蛋白肽樣液,使用最佳洗脫液鹽質(zhì)量濃度和流速進行洗脫,繪制特征吸收峰峰圖,根據(jù)洗脫峰型確定最佳上樣質(zhì)量濃度。
1.3.4 抗氧化活性測定
(1)ABTS自由基清除率測定[11]。分別吸取不同樣品的奶渣蛋白肽溶液500μL,加734 nm處吸光度為0.7~0.8的ABTS·+稀釋工作液(濃度為5 mol/L,p H=7.4的PBS稀釋)3.8 mL,室溫下反應(yīng)6 min,于734 nm測定吸光值,以GSH作為對照。
計算采用如下公式:
ABTS·自由基清除率=[(s-sb)/(c-cb)]×100%,
式中:s為ABTS·自由基清除能力吸光度;sb為樣品干擾實驗吸光度(調(diào)零);c為ABTS·工作液吸光度;c b為蒸餾水的吸光度(實驗前調(diào)零)。
(2)DPPH自由基清除率測定[12]。在200μL粗提液中加入2 mL的DPPH甲醇溶液,漩渦振搖后,在室溫下暗處放置10 min,517 nm處測定液體的吸光度,蒸餾水作為空白對照,且代替DPPH溶液調(diào)零,然后測定其吸光值(測定波長為517 nm),以GSH作為對照。其中,計算DPPH自由基清除率公式如下:
DPPH·清除率=[(s-sb)/(c-cb)]×100%,
式中:s為DPPH·自由基清除能力吸光度;sb為樣品干擾試驗吸光度(調(diào)零);c為DPPH甲醇溶液吸光度;cb為蒸餾水吸光度(調(diào)零)。
(3)還原能力測定[13]。取2 mL樣品溶液加入2.5 mL,p H=6.6濃度為0.2 mol/L磷酸鹽緩沖液和質(zhì)量分數(shù)為1%鐵氰化鉀2.5 mL,混合溶液在50℃下恒溫20 min,再加2.5 mL 10%三氯乙酸,離心取上層清液1 mL純水2.5 mL和質(zhì)量分數(shù)為1%的FeCl3溶液0.5 mL,在700 nm處測定吸光值,以去離子水代替樣品溶液作為空白實驗,以GSH作為對照。
(4)羥自由基清除率的測定[14-15]。取2 mL樣品與1.865 mmol/L的1,10-菲咯林溶液1 mL混勻,并加入1 mL濃度為1.865 mol/L的FeSO4·7H2O溶液,再加入1 mL質(zhì)量分數(shù)為0.03%的H2O2開始反應(yīng),37℃下水浴60 min,反應(yīng)混合物在536 nm測定吸光度,以GSH作為對照。
自由基清除率按下列公式計算:
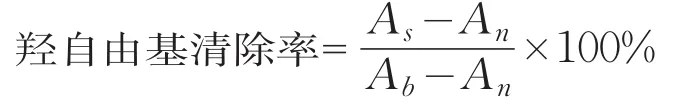
式中:As為對照的吸光度;An為樣品的吸光度;Ab為不加抗氧化劑的吸光度。
(5)抗氧化活性IC50值的測定。將樣品配制成1,2,3,4,5 mg/mL不同質(zhì)量濃度實驗點(≥5),分別測定其ABTS自由基清除率、DPPH自由基清除率、還原能力、羥自由基清除率。以樣品濃度為橫坐標(biāo),測定值為縱坐標(biāo),繪制擬合曲線,從曲線中計算出IC50值。
1.4 數(shù)據(jù)處理與統(tǒng)計分析
采用Origin 2017和Excel 2016對實驗數(shù)據(jù)進行整理,利用spss24對數(shù)據(jù)進行方差顯著性分析。
2 結(jié)果與分析
2.1 奶渣蛋白肽的Q-Sepharose FF柱層析分離
2.1.1 最佳NaCl洗脫濃度
離子交換色譜是通過色譜介質(zhì)與溶質(zhì)之間的靜電作用差異實現(xiàn)分離的一種手段,因而提高流動相的離子強度可抑制介質(zhì)與溶質(zhì)之間的靜電作用從而使溶質(zhì)與介質(zhì)發(fā)生解吸。NaCl洗脫液濃度對奶渣蛋白肽的分離影響如圖1所示。
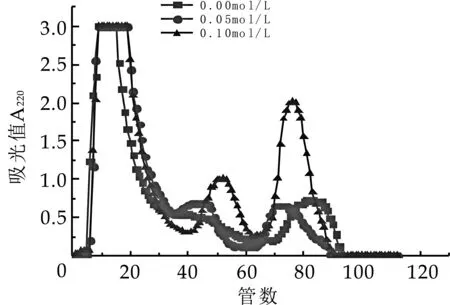
圖1 Q-Sepharose FF洗脫液濃度分離圖譜
由圖1中可看出在NaCl洗脫液濃度為0.10 mol/L時,在220 nm處有3個特征吸收峰,多次試驗,均能分出3個峰,且峰型較好,出峰面積大。用濃度為0.05 mol/L的NaCl溶液洗脫時,在220 nm處也有3個特征吸收峰,但是第二個和第三個特征吸收峰很小;在用純水進行洗脫分離時,在220 nm處僅有兩個特征吸收峰,出峰不完整。純水和濃度0.05 mol/L的NaCl都未達到有效分離,可能的原因是NaCl濃度過低,靜電作用低,未能把多肽洗脫下來。因此,選用濃度為0.10 mol/L的NaCl溶液為最佳洗脫濃度。
2.1.2 最佳洗脫流速
NaCl洗脫流速對奶渣蛋白肽的分離影響如圖2所示。
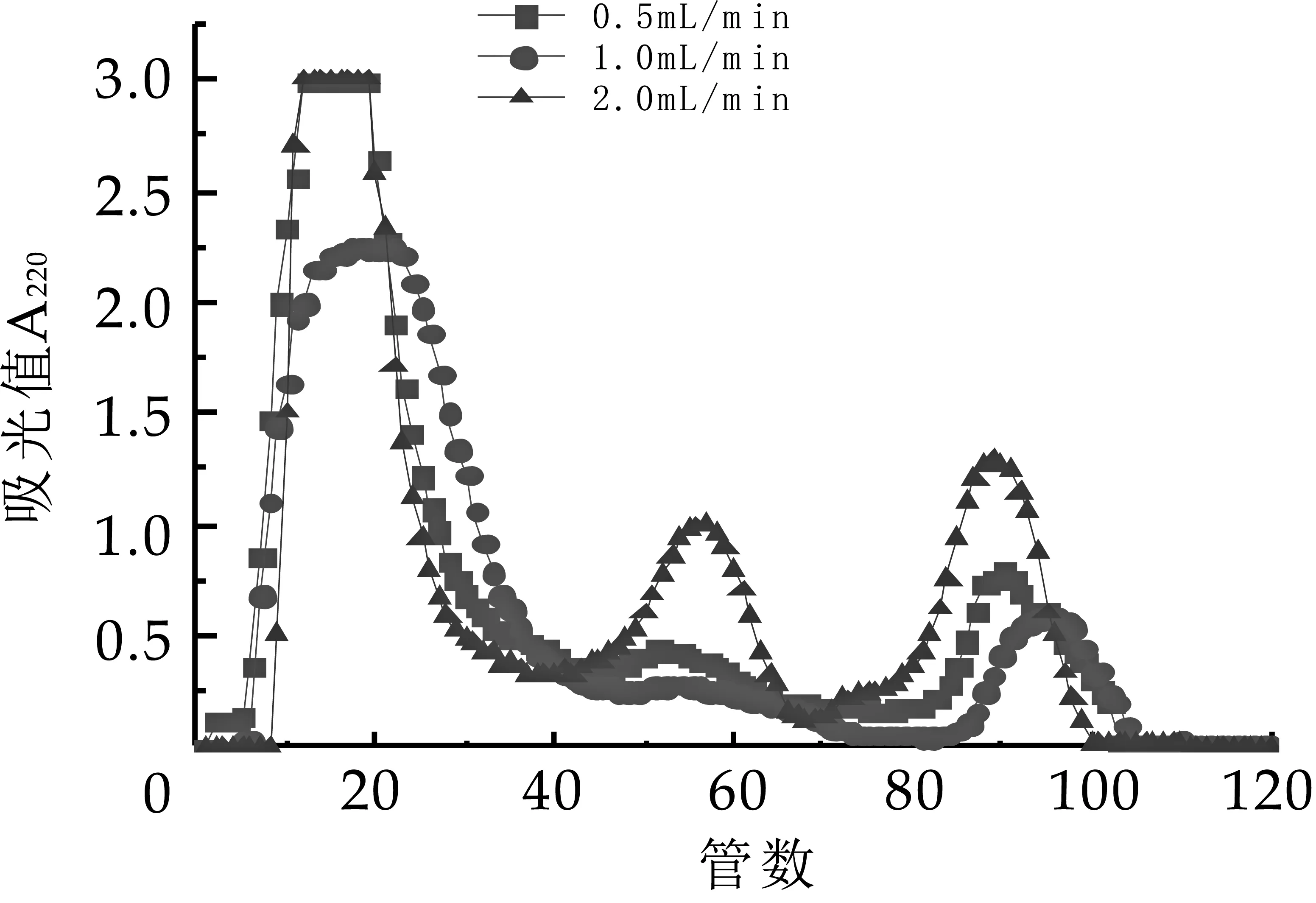
圖2 Q-SepharoseFF洗脫流速分離圖譜
由圖2可看出,隨著洗脫流速的增加,特征吸收峰的出峰時間提前。在流速為1 mL/min時,第一個特征吸收峰明顯降低,第二和第三個吸收峰未完全分離,有相連現(xiàn)象;在流速為0.5 mL/min時,第二個吸收峰譜峰較寬,峰面積較小,洗脫率較低,這可能是洗脫流速較低,柱壓也較低,出現(xiàn)樣品擴散、譜峰變寬,洗脫效率降低。在2.0 mL/min的條件下,分離出來的3個特征吸收峰,峰型和分離效果良好。綜上所述,選擇最佳洗脫流速為2.0 mL/min。
2.1.3 最佳上樣濃度
上樣濃度對奶渣蛋白肽的分離影響如圖3所示。
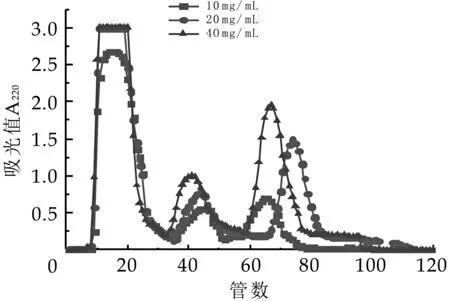
圖3 Q-Sepharose FF上樣濃度分離圖譜
由圖3中可看出,各濃度的奶渣蛋白肽3個特征吸收峰的分離效果較好,隨著濃度的增加,各特征吸收峰均呈現(xiàn)上升趨勢。當(dāng)質(zhì)量濃度為10 mg/mL時,第一個特征吸收峰較好,但第二和第三特征吸收峰的洗脫率較低,這是因為葡聚糖凝膠分離過程中的離子交換、離子排斥、離子包含、疏水作用和吸附作用等二級非體積排阻效應(yīng)使原本極其微弱的峰消失,且若上樣量過少,分離提純得到的各組分就相對較少、濃度較低,造成洗脫液的浪費和實驗效率低下。當(dāng)質(zhì)量濃度為20 mg/mL時,呈現(xiàn)良好的峰型和分離效果,但第二個和第三個特征峰的洗脫率稍低;當(dāng)質(zhì)量濃度為40 mg/mL時,各個峰型和分離效果都較好,綜合考慮,選擇最佳上樣質(zhì)量濃度為40 mg/mL。
2.1.4 奶渣蛋白肽分離純化最佳工藝條件
根據(jù)單因素實驗確定Q-Sepharose FF柱層析最佳洗脫工藝為:洗脫液濃度0.1 mol/L,上樣質(zhì)量濃度40 mg/mL,洗脫流速2.0 mL/min,在此條件下的峰分離度較好,峰型對稱,如圖4所示。圖4中,第一個峰為峰A,第二個為峰B,第三個為峰C。在最佳分離條件下大量收集組分A,B,C;透析48 h后,濃縮冷凍干燥,在-80℃下保存?zhèn)溆谩?/p>
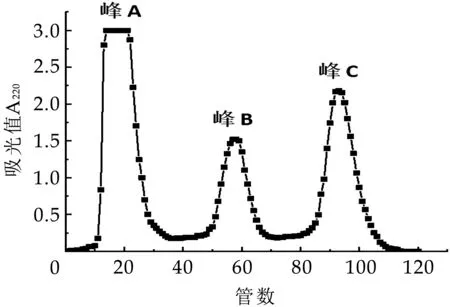
圖4 奶渣蛋白肽的分離純化圖譜
2.2 奶渣蛋白肽抗氧化活性
2.2.1 ABTS自由基清除能力
ABTS自由基為穩(wěn)定的有機自由基,蛋白肽抗氧化能力越強,其提供電子的能力也就越強,與該有機自由基反應(yīng)量越大,反應(yīng)速率也越快,通過測定反應(yīng)液吸光度的變化,能夠反映出樣品抗氧化能力的大小。奶渣蛋白肽的ABTS自由基清除率如圖5所示。
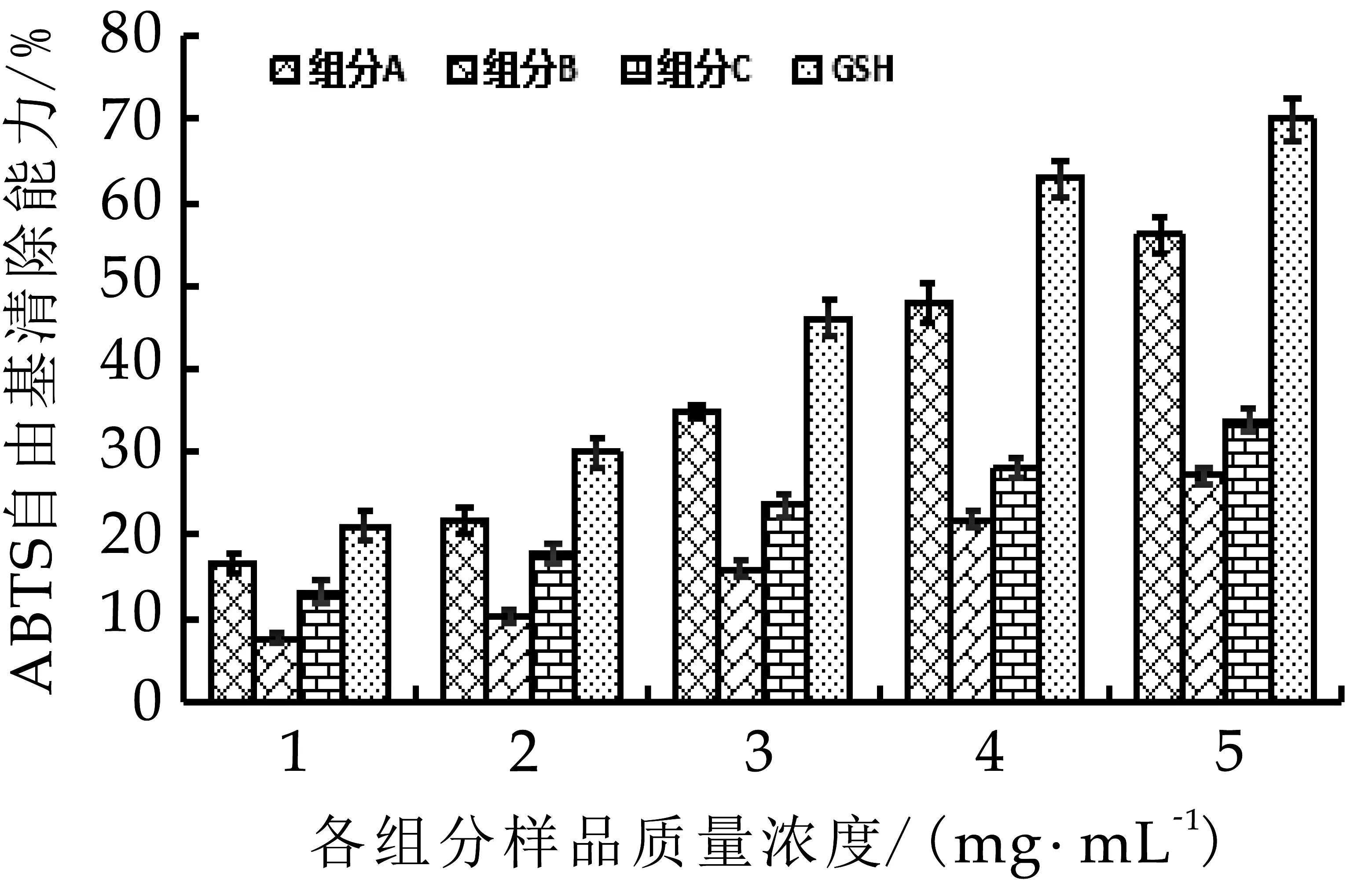
圖5 ABTS自由基清除能力
由圖5可以看出,奶渣蛋白肽分離各組分隨著濃度的提高,ABTS自由基清除活性顯著增強,奶渣蛋白肽組分A的ABTS自由基的清除能力最強,在質(zhì)量濃度是5 mg/mL時,ABTS自由基的清除率為56.12%,而組分B和C的ABTS自由基的清除率相對較弱,分別為27.12%和33.80%。4個組分的ABTS自由基清除能力IC50如表1所示,組分A的IC50最低為4.379 mg/mL。以上結(jié)果表明它們對ABTS自由基清除能力為:組分A>組分C>組分B。此研究與杜昕等[16]通過超濾、凝膠層析法得到分子量小于5 ku,具有較高ABTS自由基清除活性的牦牛血抗氧化肽結(jié)果一致。
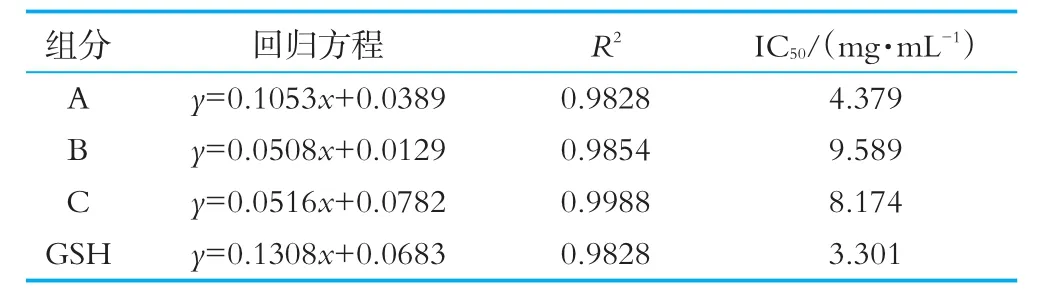
表1 4個組分的ABTS自由基清除能力IC50
2.2.2 DPPH自由基清除率測定
DPPH自由基是人工合成的能穩(wěn)定存在的自由基,是反映物質(zhì)的抗氧化能力的一個重要標(biāo)準。奶渣蛋白肽的DPPH自由基清除率如圖6所示。
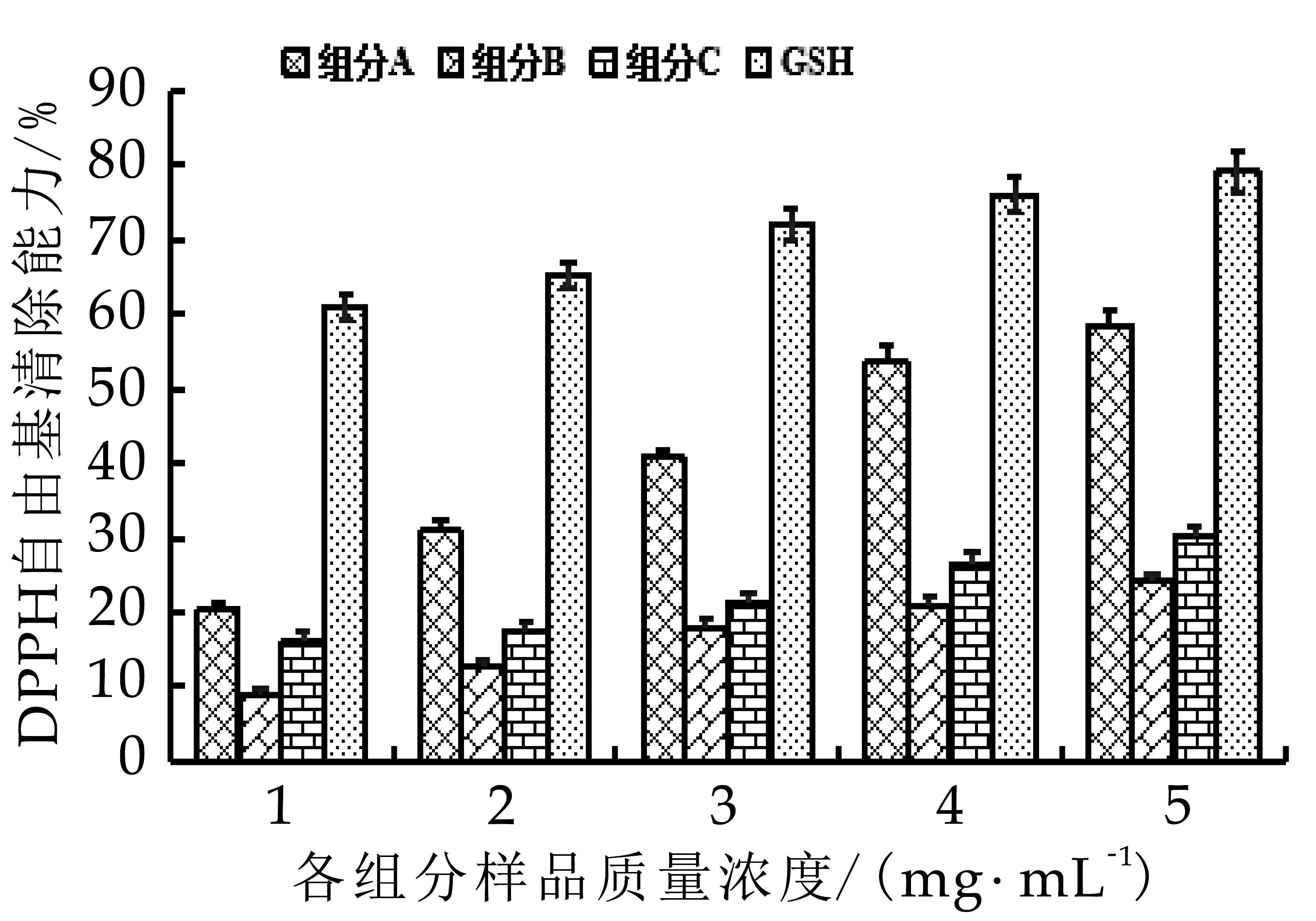
圖6 DPPH自由基清除能力
由圖6可以看出,奶渣蛋白肽分離得到的各組分均具有清除DPPH自由基的能力,且DPPH自由基清除活性表現(xiàn)出顯著的濃度依賴關(guān)系。在質(zhì)量濃度為5 mg/mL時,奶渣蛋白肽組分A,B和C對DPPH自由基清除率分別為58.6%,24.1%和30.2%;組分A的DPPH自由基清除率高于高維東等[17]通過Sephadex G-15分離得到的牦牛酪蛋白DPPH自由基清除率47.9%,說明奶渣蛋白肽具有一定的DPPH自由基清除活性,可能是分離組分A中含有大量的氨基酸基團,能傳遞氫離子或電子給DPPH自由基。4個組分的DPPH自由基清除能力IC50如表2所示,組分A的IC50最低為3.921 mg/mL。以上結(jié)果表明它們對DPPH自由基清除能力:組分A>組分C>組分B。
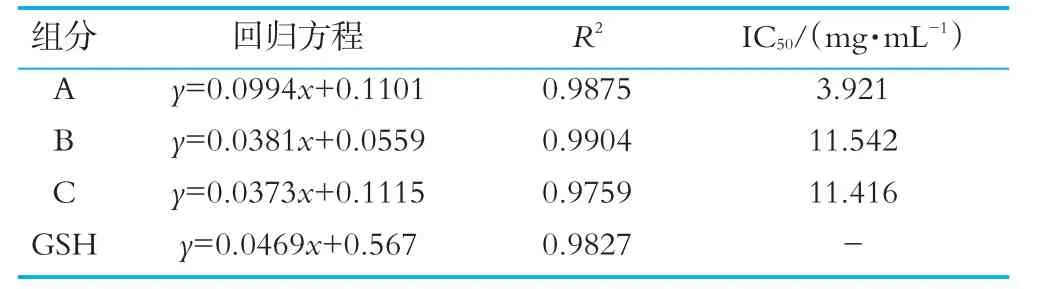
表2 4個組分的DPPH自由基清除能力IC 50
2.2.3 還原能力測定
還原力的測定通常被用來評價抗氧化劑提供電子或氫的能力,奶渣蛋白肽的還原能力如圖7所示。
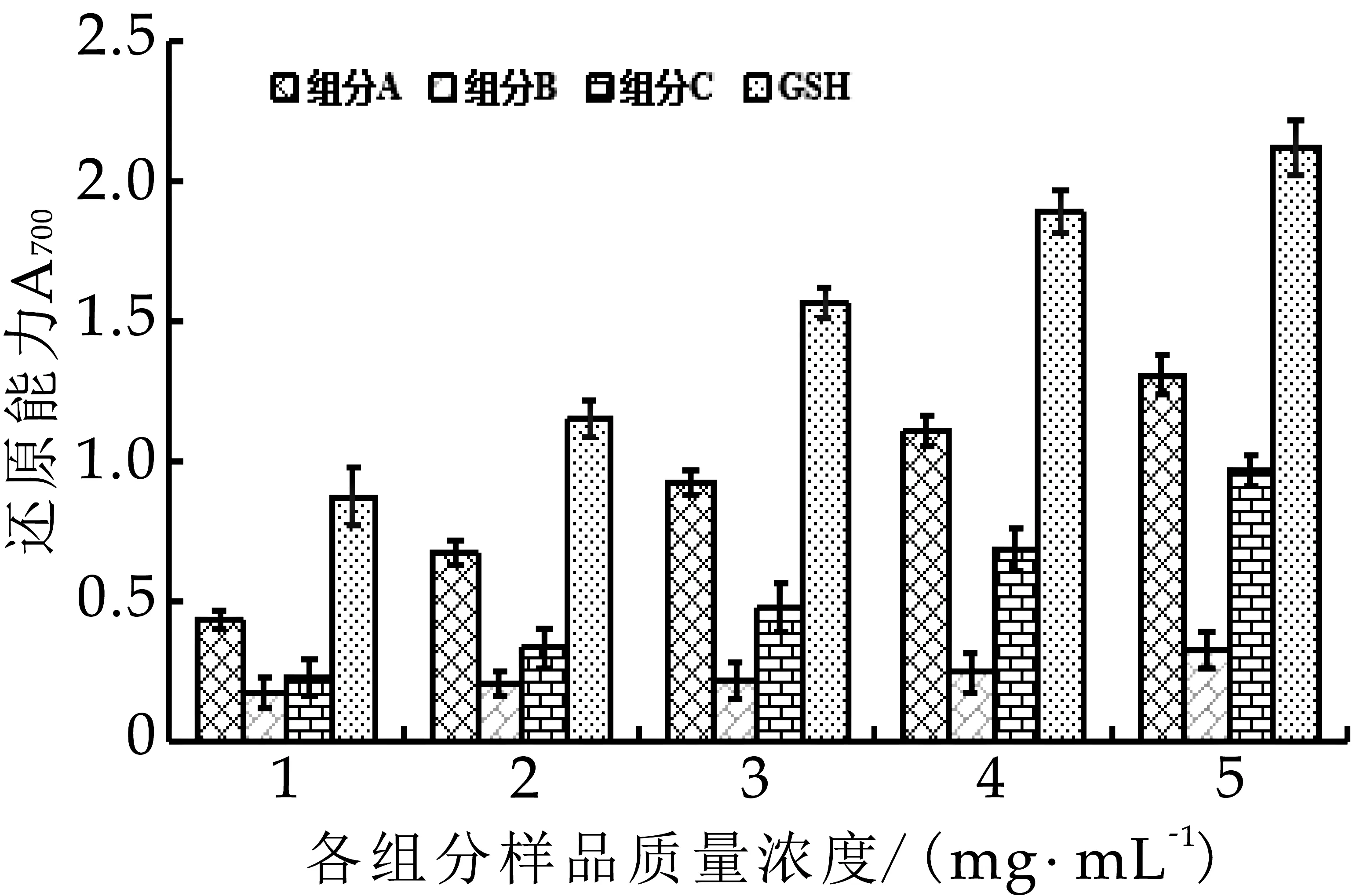
圖7 奶渣蛋白肽的還原能力
由圖7可以看出,奶渣蛋白肽各組分都有一定的還原能力。在奶渣蛋白肽各組分質(zhì)量濃度為1~5 mg/mL時,隨著樣品濃度的增加,還原力也顯著增大,即表現(xiàn)出還原力與其濃度成量效關(guān)系。其中組分A的還原能力最強,在質(zhì)量濃度為5 mg/mL時,其還原能力為1.308,組分B和C的還原能力較弱分別為0.627和0.974。4個組分的還原能力IC50如表3所示,組分A的IC50最低為1.196。以上結(jié)果表明它們的還原能力:組分A>組分C>組分B。
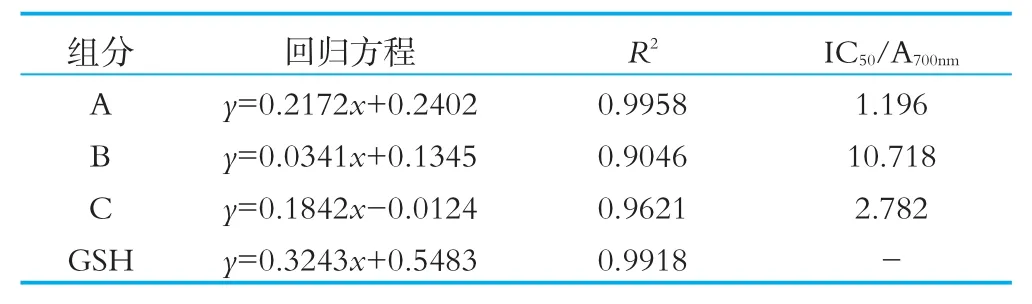
表3 4個組分的還原能力IC50
2.2.4 羥自由基清除率測定
奶渣蛋白肽的羥自由基清除率如圖8所示。
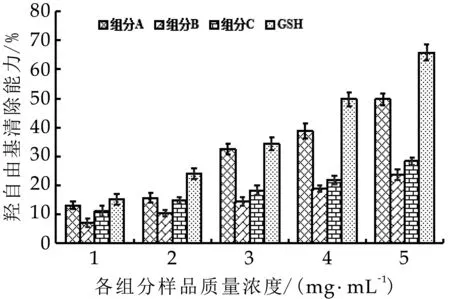
圖8 羥自由基清除能力
由圖8可以看出,奶渣蛋白肽各組分·OH除率與奶渣蛋白肽的濃度呈明顯的正相關(guān),與奶渣蛋白肽分離組分B和C比較,奶渣蛋白肽組分A的·OH清除能力更強。在質(zhì)量濃度為5.0 mg/mL時,奶渣蛋白肽組分A、B和C對·OH清除率分別為49.73%,23.59%和28.34%。4個組分的還原能力IC50如表4所示,組分A的IC50最低為5.076 mg/mL,高于高維東等[17]通過Sephadex G-15分離得到的牦牛酪蛋白組分Ⅱ的·OH清除率IC50值1.4 mg/mL,說明奶渣生產(chǎn)過程中的強酸強堿環(huán)境對奶渣蛋白肽的抗氧化活性有一定的損傷。以上結(jié)果表明它們的·OH清除能力為:組分A>組分C>組分B。
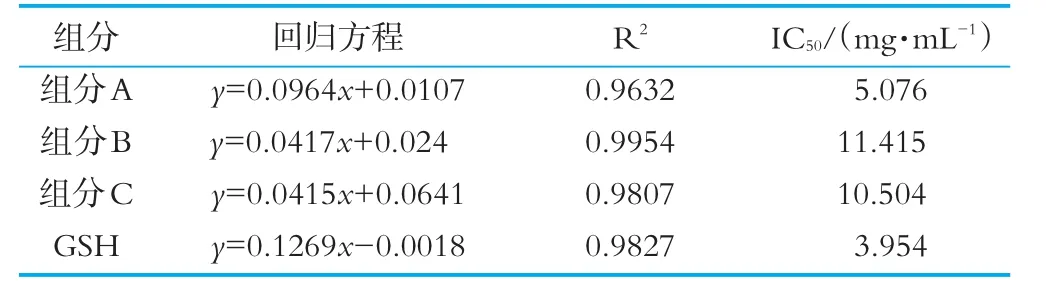
表4 4個組分的羥自由基清除能力IC50
3 結(jié) 論
奶渣蛋白肽Q-Sepharose FF凝膠層析分離的最優(yōu)工藝條件為:洗脫液濃度0.1mol/L,上樣量40 mg/mL,洗脫流速2.0 mL/min,共分離出A,B,C三個組分,其中組分A的抗氧化能力最強,對ABTS自由基清除率的IC50為4.379 mg/mL,DPPH自由基的清除率IC50為3.921 mg/mL,還原能力IC50為1.196,羥自由基清除率IC50為5.076 mg/mL。表明奶渣蛋白肽具有一定的抗氧化活性,為進一步深入研究和開發(fā)具有高抗氧化活性的奶渣蛋白肽奠定基礎(chǔ)。

