高脂飲食誘導CYP4A高表達參與小鼠非酒精性脂肪肝病程研究
高惠芳,曹雅茹,夏宏光,朱項羽,金 涌
非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)患者常表現為高血脂、高極低密度脂蛋白和BMI升高[1]。NAFLD時脂肪組織釋放的游離脂肪酸酯化成甘油三酯(triglyceride,TG)儲存在肝細胞中,并以極低密度脂蛋白的形式運輸到外周[2]。TG本身是沒有毒性作用的,但是脂質代謝途徑的失調產生的脂毒性是疾病發生的主要因素[3]。碳水化合物、糖類、脂肪酸等增加肝臟代謝導致有毒脂質積累,而代謝產物誘導肝細胞氧化應激、損傷和死亡[4]。細胞色素P450(cytochrome P450,CYP)依賴還原型煙酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)提供的電子氧化脂肪酸產生活性氧(reactive oxygen species,ROS)是導致肝細胞損傷的重要原因[5]。 CYP4家族ω-羥基化脂肪酸,該代謝途徑能產生關鍵的脂質介質20-羥基二十烷四烯酸(20-hydroxyeicosatetraenoic acid,20-HETE)[6]。該研究利用高脂乳劑灌胃造成小鼠NAFLD,探究CYP4A高表達時對NAFLD病程的影響。
1 材料與方法
1.1 材料
1.1.1實驗動物 健康雄性C57BL/6小鼠50只,體質量18~22 g,購自安徽醫科大學實驗動物中心。小鼠飼養于12 h光照循環的房間并自由飲食,實驗開始前適養1周。
1.1.2主要試劑 谷丙轉氨酶(alanine aminotransferase,ALT)、谷草轉氨酶(aspartate aminotransferase,AST)、TG試劑盒(南京建成公司);丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)試劑盒(上海Beyotime公司);20-HETE(美國MedChemExpress公司);CYP4A單克隆抗體(美國abcam公司);β-actin多克隆抗體、二抗(北京中杉金橋);熒光倒置顯微鏡(日本Olympus公司);RIPA(上海Beyotime公司);PVDF膜(美國Milipore公司);ECL發光試劑盒(美國Thermo公司)。
1.2 方法
1.2.1高脂乳劑的制備 高脂乳劑含40%的脂肪能量,主要成分包含以下成分:油相:豬油400 g、膽固醇80 g、聚山梨酯-80 50 ml;水相:食用鹽10 g、膽酸鈉10 g、丙硫氧嘧啶10 g、丙二醇175 ml、冰糖156 g、蒸餾水100 ml;水相于60 ℃水浴鍋中加熱后加入到油相中溶解并進行混合。將混合均勻的乳劑進行分裝并存于4 ℃冰箱,用時55 ℃水浴加熱溶解。
1.2.2小鼠分組 將小鼠隨機分為5組,每組10只;采用自制的高脂乳劑進行非酒精脂肪肝造模,設置正常對照組、4周、6周、8周、10周組。眼球取血處死,血液靜置30 min后離心取上清液。肝臟被立即取出并置于冰上,切取部分肝左葉保存于4%多聚甲醛溶液中,剩余組織立即保存在-80 ℃冰箱。
1.2.3肝組織HE染色 肝組織小塊浸泡于4%多聚甲醛溶液中固定24 h后置于一系列濃度梯度的酒精中做脫水處理,脫水后的肝組織浸入蠟液中包埋,然后轉入純二甲苯中浸漬透明數小時。蠟塊在輪式切片機上進行切片,厚度在4~7 μm,切出一片接一片的蠟帶,用毛筆輕托輕放在紙上。將切片貼在潔凈的載玻片上,45 ℃恒溫箱中干燥后進行脫蠟及水化處理,最后進行蘇木精伊紅染色。
1.2.4鼠血清生化檢測 血清樣本中TG、ALT、AST、MDA 和SOD含量水平的測定采用相應試劑盒的生化檢測法,并按操作說明檢測。血清樣品無需前處理可直接用于測定。最后使用酶標儀在各適宜的波長處檢測樣品與試劑的反應液的吸光度,根據OD值計算其濃度。
1.2.5Western blot法檢測CYP4A含量的表達 用裂解液裂解肝組織勻漿提取全蛋白,BCA法定量。10% SDS-PAGE垂直電泳分離蛋白質,電轉到PVDF膜上;用5%脫脂奶粉封閉2 h;CYP4A(1 ∶2 000)、β-actin(1 ∶1 000)抗體4 ℃孵育過夜。后經TBST洗滌3次,每次10 min;室溫孵育辣根過氧化物酶標記二抗1 h;TBST洗膜3次,每次10 min。ECL化學發光法顯示目的蛋白,蛋白條帶用Image J軟件進行分析。
1.2.6肝組織ROS檢測 肝組織ROS表達采用冰凍切片免疫熒光法進行分析,每組至少檢測3只小鼠的肝組織。步驟如下:① 染色:冰凍切片稍甩干后用組化筆在組織周圍畫圈(防止抗體流走),在圈內滴加ROS染液,避光恒溫箱37 ℃孵育30 min。② DAPI復染細胞核:玻片置于PBS(pH 7.4)中在脫色搖床上晃動洗滌3次,每次5 min。切片稍甩干后在圈內滴加DAPI染液,避光室溫孵育10 min。③ 封片:玻片置于PBS(PH 7.4)中在脫色搖床上晃動洗滌3次,每次5 min。切片稍甩干后用抗熒光淬滅封片劑封片。④ 鏡檢拍照:切片于熒光顯微鏡下觀察并采集圖像。
1.2.7液相色譜-串聯質譜法(liquid chromatography-tandem mass spectrometry,LC/MS/MS)檢測肝組織20-HETE含量 樣品預處理步驟如下:取肝臟組織50 mg并用PBS溶液沖洗,加入250 μl甲醇和5 μl甲酸,混勻后用勻漿儀勻漿。超聲(冰浴中進行)破碎,超聲條件:工作時間3 s,間隙時間2 s,工作60次,功率< 400 W。14 000 r/min離心10 min,吸取上清液轉入新的EP管中。加入350 μl雙蒸水和0.5 ml乙酸乙酯,渦旋30 s,以12 000 r/min 離心10 min取出有機相。有機相用氮氣吹干,上樣前用甲醇復溶。使用Waters BEH-C18柱(1.7 μm×210 mm)色譜柱,流動相:甲醇∶0.1%甲酸水=90 ∶10,流速:0.3 ml/min,柱溫:35 ℃,進樣量為10 μl。ESI離子源,負離子MRM模式,毛細管電壓:3 kV,源電壓:40 V,去溶劑氣流量:500 L/h,去溶劑氣溫度:400 ℃,離子源溫度:150 ℃。

2 結果
2.1 肝組織HE染色染色結果見圖1。與對照組比較,高脂乳劑灌胃4周后小鼠肝組織并沒有出現脂肪變性;灌胃6~8周后細胞核周圍出現明顯的脂質物質堆積;灌胃持續到10周后肝細胞內出現明顯的脂肪大泡。HE染色結果表現為隨著高脂乳劑灌胃時間的延長肝細胞脂質堆積逐漸增加。

圖1 C57BL/6小鼠肝組織HE染色×200
A:對照組;B:模型4周組;C:模型6周組;D:模型8周組;E:模型10周組
2.2 小鼠血清TG表達水平與對照組比較,模型8周組的血清TG水平開始明顯升高(F=5.29,P<0.05),模型10周組血清TG水平出現最高水平。見圖2。

圖2 C57BL/6小鼠血清TG含量水平
1:對照組;2:模型4周組;3:模型6周組;4:模型8周組;5:模型10周組;與對照組比較:*P<0.05
2.3 高脂乳劑灌胃后血清轉氨酶ALT和AST的表達變化與對照組比較,模型6周組的ALT水平開始明顯升高(F=2.70,P<0.01)。與對照組比較,模型6周組的AST水平亦明顯增長(F=3.16,P<0.01),并且模型10周組AST水平已明顯高于4周組(P<0.05)。見表1。
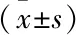
表1 各組C57BL/6小鼠血清ALT及AST的分泌水平
與對照組比較:**P<0.01;與模型4周組比較:#P<0.05
2.4 肝組織CYP4A蛋白表達含量小鼠肝組織主要表達CYP4A10、4A12、4A14,在本研究中是對總CYP4A酶的檢測。與對照組比較,CYP4A蛋白表達含量在第6周時增加1.4倍,第8周和第10周時比第4周分別增加1.4倍和1.5倍。小鼠經過高脂乳劑灌胃后CYP4A蛋白表達水平表現為隨灌胃時間延長而逐漸增加(P<0.01)。見圖3。
2.5 肝組織20-HETE含量檢測采用LC/MS/MS測得的20-HETE表達水平,與對照組比較,模型8周組20-HETE水平開始明顯升高(F=28.64,P<0.01),20-HETE的表達與CYP4A蛋白表達趨勢相一致。見圖4。

圖3 肝組織CYP4A蛋白表達
1:對照組;2:模型4周組;3:模型6周組;4:模型8周組;5:模型10周組;與對照組比較:**P<0.01;與模型4周組比較:#P<0.05,##P<0.01

圖4 肝組織合成的20-HETE水平
1:對照組;2:模型4周組;3:模型6周組;4:模型8周組;5:模型10周組;與對照組比較:**P<0.01
2.6 肝組織ROS表達檢測各組組織熒光染色情況見圖5。應用Image J軟件測得每組平均熒光密度。對照組(0.038±0.006),模型4周組(0.040±0.008),模型6周組(0.050±0.012),模型8周組(0.050±0.011),模型10周組(0.060±0.013);與對照組比較,模型10周組ROS熒光強度明顯增強(F=2.04,P<0.05)。
2.7 血清MDA和SOD的水平MDA水平檢測結果顯示,與對照組比較,模型4周組MDA水平明顯升高(F=62.16,P<0.01);與模型4周組比較,模型6周組MDA水平開始明顯升高,并且隨灌胃時間延長而逐漸增加(P<0.05),8周組的SOD活力水平開始明顯低于對照組(F=5.79,P<0.05),肝組織SOD分泌水平表現為隨MDA沉積增多而逐漸降低。見表2。

圖5 肝組織ROS熒光染色 ×400
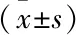
表2 各組C57BL/6小鼠血清MDA和SOD的含量水平
與對照組比較:*P<0.05,**P<0.01;與模型4周組比較:#P<0.05,#P<0.01
3 討論
CYP4A被證明在非酒精性脂肪肝的發展中起到關鍵的作用,CYP4A基因表達可通過饑餓、過氧化物酶體增殖物、高脂飲食和糖尿病被誘導[7]。非酒精性脂肪肝時存在線粒體功能紊亂和內質網應激,因此CYP4家族能ω-羥基化脂肪酸引起ROS的產生[8]。
根據對鼠NAFLD模型影響的探索[9],高脂飲食后鼠血清會有TG、TC、ALT和AST的升高。在本研究中采用高脂乳劑灌胃誘導鼠NAFLD,肝組織HE染色結果分析可以知道灌胃10周可造成較為嚴重的肝細胞脂質堆積。同時血清中游離的TG、ALT和AST水平會相應的升高。這些結果提示該模型適用于NAFLD研究。甘油三酯水平的增加伴隨著CYP4A蛋白表達水平的增長;并且CYP4A能促進脂質的攝取,CYP4A增加肝臟對脂質的攝取被報道為通過增加FAT/CD36的表達實現[10]。
對NAFLD患者的血清脂肪酸分析可知,血清FFA水平升高主要是由二十二碳六烯酸、棕櫚酸、亞油酸、二十碳三烯酸和花生四烯酸組成[11]。花生四烯酸可經過細胞色素的代謝產生大量的ROS而對肝細胞產生氧化應激損傷,從而對NAFLD發揮重要的作用[12]。20-HETE是花生四烯酸經細胞色素CYP4 ω-羥基化的產物。在該研究中20-HETE升高,說明在NAFLD時增加的CYP4A參與了游離脂肪酸的氧化處理。
氧化應激和脂質過氧化伴隨著NAFLD的發展過程;氧化應激主要由大量的ROS誘導發生。氧化應激導致脂質過氧化物升高和抗氧化系統損傷,從而進一步加重肝細胞的損傷。在本研究中肝組織ROS水平最高時脂質過氧化物MDA水平明顯上升而SOD水平明顯降低,這表明CYP4A ω-羥基化作用產生的ROS能引起肝細胞損傷,從而促進NAFLD的發展。CYP4A ω-羥基化脂肪酸產生ROS的特異性將通過體外誘導CYP4A表達實驗來進一步探索。
綜上,高脂乳劑灌胃誘導鼠肝組織CYP4A表達,并隨著脂質堆積的增加而增加。CYP4A ω-羥基化脂肪酸促使ROS的產生引起氧化應激和脂質過氧化而導致肝細胞損傷,因此CYP4A在NAFLD的發展中扮演著重要的角色。據此繪制CYP4A參與NAFLD發展的機制圖(圖6)。

圖6 CYP4A ω-羥基化脂肪酸產生的ROS損傷肝細胞的機制圖

