甲醇芽孢桿菌凝乳酶的重組表達及其結構特性
李 柳,鄭 喆,吳鳳玉,郝一江,趙 笑,曹永強,余志堅,陳 超,楊貞耐,,*
(1.北京食品營養與人類健康高精尖創新中心,食品添加劑與配料北京高校工程研究中心,北京工商大學,北京 100048;2.東君乳業(禹城)有限公司,山東 禹城 251200)
甲醇芽孢桿菌凝乳酶是一種具有凝乳作用的微生物蛋白酶[1]。凝乳酶在干酪生產過程中不僅起凝乳作用,還會影響干酪的質構和風味[2]。小牛皺胃酶因具有高凝乳活性和低非特異性水解活性,所產干酪的質構和風味均符合生產要求[3],此酶已作為商品凝乳酶用于干酪的生產,但由于生產成本高以及屠宰動物引發的倫理問題[4],使得尋找小牛皺胃酶代替品顯得尤為重要。植物凝乳酶來源廣泛,價格低廉,但植物生長周期長,凝乳活性低[5]。微生物凝乳酶易提取,酶活力高,逐漸在干酪生產中占據主導地位[6-8]。近年來隨著干酪需求量的日益增加,人們越來越重視微生物凝乳酶及其基因工程酶的研究開發。大腸桿菌基因克隆原核表達系統表達外源蛋白具有繁殖迅速、培養簡單、操作方便、遺傳穩定、外源蛋白表達量高、易于純化等優點[9-10],重組表達出的凝乳酶可用于干酪的制備和酶特性的后續研究。
蛋白質是生物體功能的執行者和結構的構建者[11-12],蛋白質結構的研究一直是生物學領域的熱點。由于技術手段的限制,利用實驗方法(主要為X-射線晶體衍射、核磁共振)解析蛋白結構投入大、周期長,此外隨著分子生物學技術的成熟,越來越多的基因序列可以輕松被找到,這種序列與結構間不平衡的現象極大地限制了對蛋白質功能及其相關作用機理的理解。蛋白質高級結構的在線模擬技術為蛋白質研究提供了一種新手段[13-15]。Singh等[16]通過氨基酸序列預測了來自蠟狀芽孢桿菌的谷氨酰胺酶的3D模型結構,發現該模型的活性位點富含11 個保守氨基酸殘基,該預測結果針對結腸癌(HCT-116)細胞系確認該酶的抗癌活性有一定的指導意義。杭鋒[17]通過Paenibacillus spp. BD3526凝乳酶酶源的編碼基因和氨基酸序列,對成熟酶進行N-端氨基酸測序,確定了酶源成熟過程中的水解位點,并利用氨基酸序列進行同源比對和親緣關系分析,確定該酶的活性中心位點和酶的分類,基于同源建模方法對其三級結構進行了預測并對模型質量進行評價。
為進一步了解微生物凝乳酶的結構特性,利用從酒曲中分離純化并獲得氨基酸序列的甲醇芽孢桿菌凝乳酶進行實驗[18],將該凝乳酶基因在大腸桿菌中重組表達,并采用生物信息學方法研究其結構特性。
1 材料與方法
1.1 材料與試劑
TOP 10克隆菌株、BL21(DE3)表達菌株 卡梅德生物技術有限公司;蛋白/DNA Marker 美國Thermo Fisher公司;Ni Sepharose Fast Flow 美國GE公司;異丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG) 上海碧云天生物科技公司;瓊脂糖 上海基因公司;質粒小提試劑盒 天根生化科技有限公司;限制性內切酶/T4 DNA連接酶 寶日醫生物技術(北京)有限公司;其他試劑均為國產分析純或化學純。
LB培養基:10 g NaCl,10 g蛋白胨,5 g酵母浸粉,加去離子水至1 L,調pH值至7.0~7.2后分裝滅菌。固體培養基另加瓊脂粉15~20 g。
1.2 儀器與設備
Allegra 21R臺式高速離心機 美國Beckman公司;Biologic LP層析系統、Mini Protean垂直平板電泳系統、Gel Doc2000成像系統 美國Bio-Rad公司;雪花狀制冰機 日本Sanyo公司;PTC-200基因擴增儀 美國MJ Research公司。
1.3 方法
1.3.1 甲醇芽孢桿菌凝乳酶基因的合成
通過NCBI GenBank數據庫(https://www.ncbi.nlm.nih.gov/genbank/)檢索到凝乳酶(I3EB99)的氨基酸序列為759 個氨基酸[18]。根據此氨基酸序列,在DNAMAN軟件的輔助下推導出該基因的核苷酸序列,并以大腸桿菌密碼子使用頻率為基準,對該基因的密碼子進行優化。將優化后的基因序列翻譯成氨基酸序列與優化前蛋白酶的原始氨基酸序列比對,確保優化前后氨基酸序列保持一致。然后將優化后的全基因序列委托卡梅德生物科技有限公司直接進行化學合成,基因序列兩端分別帶有NcoI和XhoI酶切位點。
1.3.2 甲醇芽孢桿菌凝乳酶重組質粒的構建與驗證
1.3.2.1 重組質粒的構建
化學合成的甲醇芽孢桿菌凝乳酶全基因序列直接進行NcoI-XhoI雙酶切,定向插入pET28a(+)質粒表達載體,用T4 DNA連接酶進行連接,構建pET28a(+)重組質粒。蛋白C端融合6×His標簽進行表達純化。
1.3.2.2 TOP10克隆菌株感受態的制備
取-80 ℃冰凍菌株,用劃線法接種于LB固體中,于37 ℃倒置培養12 h。從平板上挑取單個菌落接種至含有3 mL LB培養液的試管中,37 ℃振蕩培養12 h。取菌液1 mL接種至含有100 mL LB培養基的500 mL三角瓶中,37 ℃劇烈振蕩培養約2~3 h(200~300 r/min),當菌落OD600nm值達到0.3~0.4時,將三角瓶取出放于冰上10~15 min,在無菌條件下把菌液倒入50 mL離心管中,并在4 ℃、4 000 r/min離心10 min,然后棄上清液,將管倒置于濾紙上1 min,吸干殘留的培養液,加入10 mL 0.1 mol/L的CaCl2溶液到離心管中,振蕩混勻,懸浮菌體,冰浴30 min,4 ℃、4 000 r/min離心10 min,棄上清液,將管倒置于干濾紙上1 min,吸干殘留的培養液,加4 mL冰預冷的0.1 mol/L的CaCl2重懸浮菌體,每管0.2 mL分裝,至4 ℃保存備用。
1.3.2.3 重組質粒轉化感受態菌株
構建好的pET28a(+)重組質粒表達載體用無菌水溶解后取適量與TOP10克隆菌株感受態混合,冰浴30 min后于42 ℃水浴90 s,立即冰浴2 min。在無菌條件下加入1 mL LB培養基(按照1∶1 000比例稀釋卡那霉素),37 ℃培養30~60 min后,進行涂板,于37 ℃培養箱中倒置培養12~16 h。
1.3.2.4 重組質粒的擴增及鑒定
挑取pET28a(+)重組質粒單個轉化菌落接種至LB液體培養基中培養12 h后,用質粒提取試劑盒進行質粒抽提,用NcoI和XhoI雙酶切重組質粒,酶切產物經1%瓊脂糖凝膠電泳檢測。將雙酶切鑒定的陽性克隆送至卡梅德生物科技有限公司測序,通過DNAMAN軟件對測序結果與優化后的甲醇芽孢桿菌凝乳酶全基因序列進行比對,序列完全正確的重組質粒即為構建成功的重組表達載體。
1.3.3 重組甲醇芽孢桿菌凝乳酶的表達純化
1.3.3.1 pET28a(+)-I3EB99轉化至大腸桿菌Rosetta
將質粒1 μL加入到100 μL感受態細菌中,置冰上20 min,42 ℃熱激90 s,迅速置冰中5 min再加入600 μL LB培養液中,37 ℃、220 r/min振搖1 h。離心后全部涂布于含50 μg/mL Kan+的LB平板,37 ℃倒置培養12 h。
1.3.3.2 IPTG誘導pET28a(+)-I3EB99融合蛋白的表達
挑取轉化平板上的單克隆接種于含50 μg/mL Kan+的10 mL LB培養液的試管中,37 ℃、220 r/min振搖12 h。次日向培養物中加入IPTG至終濃度為0.1 mmol/L,37 ℃、220 r/min振搖4 h,誘導融合蛋白表達。取出1 mL培養物,10 000 r/min條件下室溫離心2 min,棄上清液,用100 μL 1×上樣緩沖液重懸菌體沉淀并直接100 ℃煮樣10 min后進行十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE),挑選誘導表達蛋白的克隆按1∶100接種于50 μg/mL Kan+的1~2 L LB培養液中,37 ℃、220 r/min振搖至菌體OD600nm值為0.6~0.8時向培養物中加入IPTG至終濃度0.1 mmol/L,37 ℃、220 r/min振搖4 h,誘導融合蛋白表達。
1.3.3.3 pET28a(+)-I3EB99融合蛋白的純化
誘導表達融合蛋白的菌液在4 000 r/min條件下離心10 min,收集菌體棄上清液,用磷酸鹽緩沖液重懸菌體再次離心收集菌體,將0.01 mol/L磷酸鹽緩沖液重懸液進行超聲波破碎后按1∶1 000的比例加入cocktail,4 ℃、8 000 r/min離心20 min,取上清液。
利用低壓層析系統,以0.5 mL/min流速上樣至Ni-IDA Binding-Buffer預平衡的Ni-IDA-Sepharose CL-6B親和層析系柱。用Ni-IDA Binding-Buffer(20 mmol/L Tris-HCl,0.15 mol/L NaCl,pH 8.0)以0.5 mL/min流速沖洗,至流出液OD280nm值達到基線;用Ni-IDA Washing-Buffer(20 mmol/L Tris-HCl,10 mmol/L咪唑,0.15 mol/L NaCl,pH 8.0)以1 mL/min流速沖洗,至流出液OD280nm值達到基線;用Ni-IDA Elution-Buffer(20 mmol/L Tris-HCl,50 mmol/L咪唑,0.15 mol/L NaCl,pH 8.0)以1 mL/min流速洗脫目的蛋白,收集流出液;用Ni-IDA Elution-Buffer(20 mmol/L Tris-HCl,100 mmol/L咪唑,0.15 mol/L NaCl,pH 8.0)以1 mL/min流速洗脫目的蛋白,收集流出液;用Ni-IDA Elution-Buffer(20 mmol/L Tris-HCl,150 mmol/L咪唑,0.15 mol/L NaCl,pH 8.0)以1 mL/min流速洗脫目的蛋白,收集流出液;用Ni-IDA Elution-Buffer(20 mmol/L Tris-HCl,300 mmol/L咪唑,0.15 mol/L NaCl,pH 8.0)以1 mL/min流速洗脫目的蛋白,收集流出液。上述收集的蛋白溶液加入透析袋中,用0.01 mol/L磷酸鹽緩沖液(pH 7.2~7.4)進行透析12 h。
1.3.4 凝乳活力的測定
采用Arima等[19]方法。將脫脂乳溶解在濃度為0.01 mol/L的CaCl2溶液中制成10%的脫脂乳溶液,室溫靜置30 min后各量取5 mL分裝到小試管中,于35 ℃恒溫水浴箱中保溫5 min,在35 ℃取重組表達的酶液0.5 mL加入到5 mL裝有10%脫脂乳溶液的試管中,搖勻后開始計時,當開始出現絮狀沉淀時立即停止計時。凝乳活力計算如式(1)所示:

式中:V1為脫脂牛奶溶液體積/mL;t為凝乳時間/s;V2為所加酶液體積/mL;n為稀釋倍數。
1.3.5 金屬離子對甲醇芽孢桿菌凝乳酶凝乳活力的影響
為確定不同金屬離子對凝乳酶凝乳活力的影響,分別用含有50 mmol/L的K+、Na+、Mg2+、Zn2+、Al3+、Cu2+、Fe2+、Ca2+溶液溶解凝乳酶,以去離子水為空白對照,25 ℃孵育30 min,分別按照1.3.4節方法測定凝乳活力。
1.3.6 蛋白水解活力的測定
根據張富新[20]的福林-酚試劑法測定。準確稱取酪蛋白1.0 g用濃乳酸潤濕后,加入pH 3.0的乳酸緩沖液80 mL,在沸水浴中邊加熱邊攪拌直至完全溶解,冷卻后用乳酸緩沖液稀釋至100 mL,即為10 g/L的酪蛋白溶液。
取1 mL酶液于試管中,40 ℃保溫2 min,加入10 g/L酪蛋白1 mL,搖勻后在相同溫度下保溫10 min,再加入0.4 mol/L三氯乙酸溶液2 mL,搖勻終止反應并取出靜置10 min,過濾后加入0.4 mol/L碳酸鈉溶液5 mL,福林試劑使用液1 mL,置于40 ℃水浴中顯色20 min,取出于波長680 nm測定其吸光度,其標準曲線方程為:Y=0.009 5X+0.002 3。蛋白水解活力計算如式(2)所示:

式中:A為樣品吸光度;K為吸光常數;4為反應試劑總體積4 mL;10為反應時間10 min;n為稀釋倍數。
1.3.7 重組甲醇芽孢桿菌凝乳酶質量濃度測定
凝乳酶含量采用Easy II Protein Quantitative Kit BCA試劑盒進行測定[21],實驗步驟參照BCA蛋白定量試劑盒說明書進行:1)先將solution A搖晃混勻,根據樣品數量,按solution A、solution B試劑體積比50∶1配制成BCA工作液,充分混勻;2)標準品的制備:完全溶解蛋白質標準品(2 mg/mL BSA,-20 ℃保存)按照說明書進行稀釋;3)凝乳酶樣品的制備:將凝乳酶樣品進行稀釋;4)將配備好后的標準品和樣品每孔25 μL加入96 孔板中,并做復孔;5)每孔加入200 μL工作液,振蕩混勻30 s;6)將酶標板37 ℃孵育30 min;7)冷卻至室溫后,用酶標儀測定吸光度A562nm;8)根據說明書,作標準曲線,確定凝乳酶終質量濃度。
1.3.8 SDS-PAGE分析
按照朱廣廉等[22]方法進行測定。
1.3.9 甲醇芽孢桿菌凝乳酶的結構預測[23]
分別對甲醇芽孢桿菌凝乳酶的親/疏水性(http://web.expasy.org/protscale/)、跨膜特性(http://www.cbs.dtu.dk/services/TMHMM/)、信號肽(http://www.cbs.dtu.dk/services/SignalP)和二級結構(http://www.cbs.dtu.dk/services/SignalP)進行預測。
登錄PDB(Protein Data Bank)數據庫(http:// www.rcsb.org/pdb/home/home.do)檢索甲醇芽孢桿菌凝乳酶的同源蛋白質,作為其三級結構的預測模板,登錄SWISS -MODEL在線網址(http://www.swissmodel.expasy.org/),選擇Alignment Mode模式,分別上傳凝乳酶的氨基酸序列和模板蛋白的氨基酸序列,對凝乳酶的三級結構進行預測。利用Swiss-Pdb Viewer(https://spdbv.vital-it.ch/)對建立的模型結構進行評估。
2 結果與分析
2.1 甲醇芽孢桿菌凝乳酶基因的密碼子優化設計與全基因合成
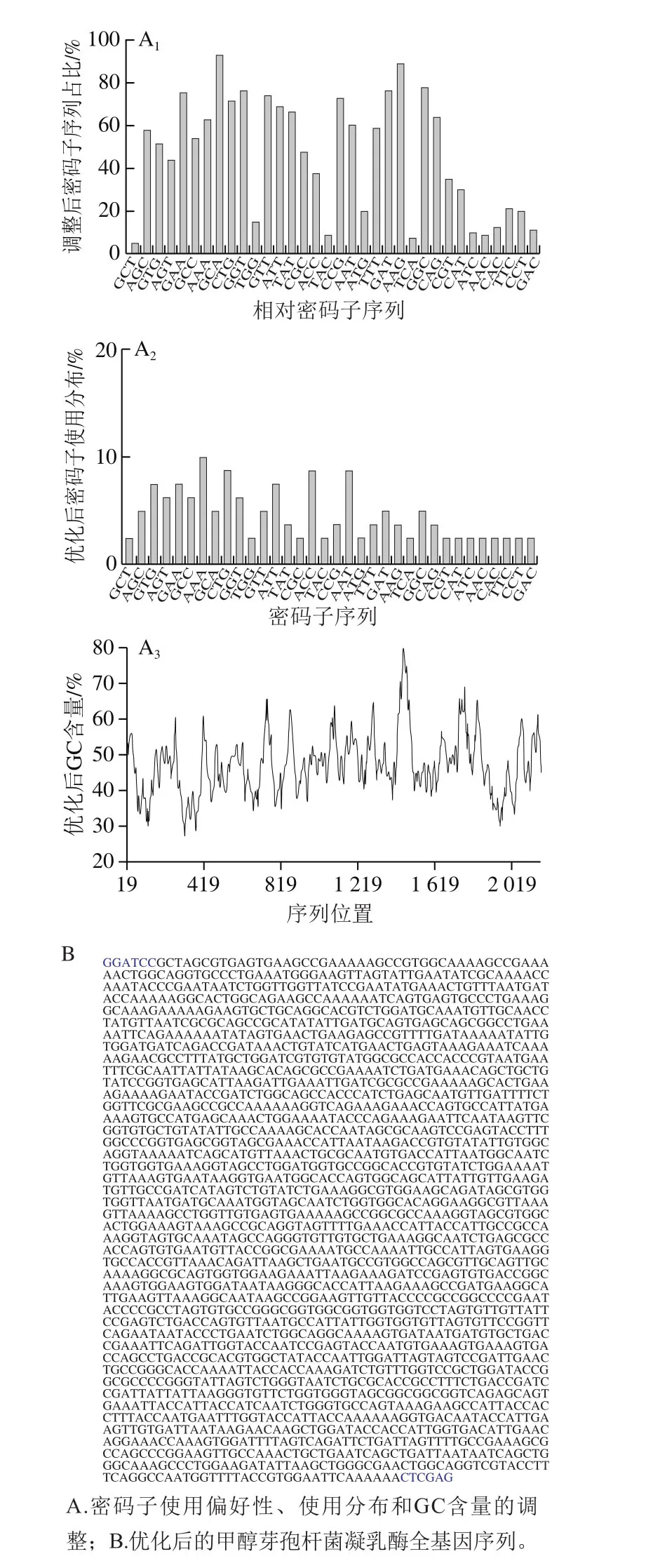
圖1 甲醇芽孢桿菌凝乳酶基因的優化Fig. 1 Optimization of MCE gene from B. methanolicus
按照所選宿主菌大腸桿菌的密碼子使用頻率、密碼子分布和GC含量對甲醇芽孢桿菌凝乳酶基因的密碼子進行優化,結果如圖1所示。優化后的凝乳酶基因所含密碼子大部分由大腸桿菌偏愛密碼子構成而很少含有稀有密碼子,并按照大腸桿菌密碼子的使用頻率進行分布,此外優化后的GC含量為47%,這有利于基因的直接合成(圖1A)。通過化學合成獲得了優化后的甲醇芽孢桿菌凝乳酶全基因序列(圖1B)。將優化后的凝乳酶全基因序列通過DNAMAN軟件翻譯成相應的氨基酸序列,與NCBI中初始的氨基酸序列進行了比對,優化前后氨基酸序列完全一致。
2.2 甲醇芽孢桿菌凝乳酶重組表達載體的構建和鑒定結果
甲醇芽孢桿菌凝乳酶全基因和表達載體pET28a(+)經NcoI和XhoI雙酶切并通過T4 DNA連接酶進行連接后,構建了重組表達載體pET28a(+)-I3EB99,然后轉化到TOP10克隆菌株中發酵培養后用NcoI和XhoI雙酶切,1%瓊脂糖凝膠電泳檢測,發現有2 條電泳條帶(圖2A),其大小剛好與5 369 bp長度的載體片段及2 214 bp長度的目的片段相符,表明目的基因片段已成功連接到表達載體上。
將雙酶切鑒定為陽性的克隆送至卡梅德生物科技有限公司進行測序鑒定,然后將重組質粒的測序結果與甲醇芽孢桿菌凝乳酶的基因序列通過DNAMAN軟件進行比對,發現測序結果與優化后的基因序列完全一致,部分比對結果見圖2B,說明插入的目的基因序列正確,重組表達載體pET28a(+)-I3EB99已構建成功。

圖2 甲醇芽孢桿菌凝乳酶重組表達載體的鑒定Fig. 2 Identification of recombinant expression vector
2.3 甲醇芽孢桿菌凝乳酶在大腸桿菌中的誘導表達
圖3 為重組表達載體在大腸桿菌中誘導表達的SDSPAGE圖,與未誘導相比,分子質量為80.34 kDa的甲醇芽孢桿菌凝乳酶在大腸桿菌中成功誘導表達,挑選表達成功的甲醇芽孢桿菌凝乳酶的克隆子在發酵液中進一步擴大培養,誘導融合蛋白大量表達。

圖3 甲醇芽孢桿菌凝乳酶誘導表達結果Fig. 3 SDS-PAGE pattern showing induced expression of MCE
2.4 重組甲醇芽孢桿菌凝乳酶的分離純化

圖4 甲醇芽孢桿菌凝乳酶的純化結果Fig. 4 Purification of recombinant MCE from B. methanolicus
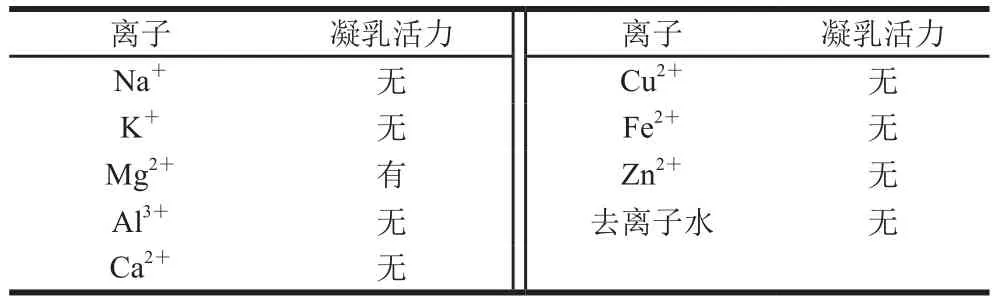
表1 不同金屬離子對甲醇芽孢桿菌凝乳酶凝乳活性的影響Table 1 Effect of different metal ions on recombinant MCA
IPTG誘導表達的融合蛋白pET28a(+)-I3EB99在低溫條件下通過鎳柱進行分離純化,收集洗脫液濃縮透析后對各洗脫峰進行SDS-PAGE,結果發現咪唑濃度為150 mmol/L時蛋白洗脫效果最好(圖4A),但經過反復實驗均發現分子質量為80.34 kDa的目標凝乳酶在純化后的SDS-PAGE結果中存在分子質量約為45 kDa和35 kDa的兩個小分子蛋白,且二者分子質量總和為目標凝乳酶分子質量。因此可推測目標凝乳酶在純化洗脫過程中可能發生了自身剪切,自主降解為兩個小分子蛋白,最終得到的是3 個蛋白混合物,加入蛋白酶抑制劑cocktail后自身降解現象可被部分抑制,有文獻報道指出,乙二胺四乙酸的存在可完全抑制蛋白酶的自身降解[24],但同時也會使酶活完全損失。一般而言內源蛋白的產生和降解都維持在一個平衡狀態,因此在穩定的環境因素下細胞內的蛋白含量也是穩定的[25],但是在體外研究中,蛋白合成過程終止,從而降解大大增強。得到的該蛋白組分只有溶解在含50 mmol/L的Mg2+溶液中時會產生凝乳效果(表1),且具有凝乳活性的蛋白酶組分質量濃度測定結果為0.70 mg/mL,凝乳活力為(15 870±1.17)SU/g,蛋白水解活力為(263.81±0.94)U/g,即凝乳活力/蛋白水解活力(C/P)值為60.16,與文獻中已報道的C/P值為80.45[26]相接近。該酶溶解在其他金屬離子溶液中的蛋白酶不具有凝乳能力,說明此凝乳酶的凝乳活力可通過Mg2+進行活化。待蛋白酶完全降解后得到2 個小分子蛋白后(圖4B),喪失了凝乳能力,說明該蛋白酶在分離純化的同時會發生自我斷裂使保持其具有凝乳活性的蛋白結構遭到破壞。將分離純化后具有凝乳活性的凝乳酶放在-80 ℃保存備用。
2.5 重組甲醇芽孢桿菌凝乳酶的結構特性
2.5.1 甲醇芽孢桿菌凝乳酶的結構預測結果
通過在http://web.expasy.org/protscale/中對凝乳酶的親/疏水性對比結果表明,甲醇芽孢桿菌凝乳酶具有很強的疏水性,在圖5A中表現為負值,疏水性有利于蛋白質向內部折疊形成兩親性α-螺旋或β-折疊,蛋白結構的穩定在很大程度上有賴于分子內的疏水作用。甲醇芽孢桿菌凝乳酶的這一特性與周筠梅等[27]報道的胰凝乳蛋白酶強疏水性保持一致。圖5B顯示該凝乳酶含有少量跨膜區蛋白(膜蛋白),大部分蛋白位于膜外側,膜蛋白是蛋白酶的催化組分,由疏水區組成,以α-螺旋形式存在,位于胞質內,可形成有生物功能的二聚體[28]。從圖5C可以看出,凝乳酶的信號肽位于前30 個氨基酸,信號肽是引導新合成的蛋白質向分泌通路轉移的短肽鏈,是在新合成多肽鏈中用于指導蛋白質跨膜轉移(定位)的N-末端的氨基酸序列[29]。外源蛋白在宿主菌,如大腸桿菌中的表達形式多為細胞內不溶性表達即容易形成包涵體,少數為細胞外分泌表達,利用信號肽引導外源蛋白定位分泌到細胞特定區間,提高可溶性,可避免因包涵體復性帶來的困難[30-31]。在甲醇芽孢桿菌凝乳酶的重組表達中,凝乳酶基因連接上信號肽后在大腸桿菌中得到了分泌表達。圖5D顯示甲醇芽孢桿菌凝乳酶的二級結構預測。二級結構是指多肽鏈中主鏈原子的局部空間排布構象,主要包括α-螺旋、β-折疊和無規卷曲,其中α-螺旋在二級結構中起主要的穩定作用[32],結果顯示該凝乳酶的α-螺旋結構明顯少于β-折疊結構,可能這是此凝乳酶在分離純化過程中易降解的原因。

圖5 甲醇芽孢桿菌凝乳酶的結構分析Fig. 5 Structural analysis of recombinant MCE from B. methanolicus
2.5.2 甲醇芽孢桿菌凝乳酶的序列鑒定
通過NCBI數據庫對凝乳酶的氨基酸序列進行同源比對,選擇序列同源性相似度高的蛋白質構建了發育樹[33](圖6A),發現凝乳酶的同源蛋白為hypothetical protein Bacillus methanolicus,且序列相似度為100%。進一步對這2 種蛋白的氨基酸進行全序列比對,圖6B顯示這2 種蛋白質氨基酸序列完全一致。甲醇芽孢桿菌凝乳酶的同源蛋白為來自甲醇芽孢桿菌的一種未知蛋白,也進一步說明了甲醇芽孢桿菌凝乳酶是一種未知蛋白酶,有廣闊的研究開發前景。

圖6 甲醇芽孢桿菌凝乳酶的同源性分析Fig. 6 Homology analysis of recombinant MCE from B. methanolicus
2.5.3 甲醇芽孢桿菌凝乳酶的高級結構
通過SWISS-MODEL同源建模的方法確定凝乳酶在PDB蛋白數據庫中的模板蛋白2ra1.1.A,序列相似度為30.93%,有文獻指出相似度大于30%即可用同源建模的方法進行蛋白結構預測[34],因此該方法適用于甲醇芽孢桿菌凝乳酶,且GMQE值為0.13,介于0~1之間,QMEAN值為-2.64均說明該模型擬合良好。進一步用Ramachandran圖[35]對模型的可靠性進行評估,94.09%的氨基酸落入核心區,說明構建的三維結構二面角分布和立體構象均較為合理,符合立體化學二面角分布的要求,通過模型評估數據證明該模型可靠。最終得到的甲醇芽孢桿菌凝乳酶的三維結構模型如圖7A所示。
蛋白質主要由碳、氫、氧、氮等化學元素組成,是一類重要的生物大分子。蛋白質維持自身穩定需要正確折疊為一個特定構型,主要通過大量的非共價鍵相互作用(氫鍵、離子鍵、范德華力和疏水作用)實現,此外在一些蛋白質折疊中,一些二硫鍵也起到關鍵作用。為進一步研究甲醇芽孢桿菌凝乳酶的三維結構特性,利用Swiss-Pdb Viewer對其原子構成、氫鍵分布和分子表面的電勢情況進行預測。其中圖7B為甲醇芽孢桿菌凝乳酶的原子分布情況,碳原子、氫原子、氧原子、氮原子共同形成了凝乳酶的結構,包括氨基、羧基以及進一步盤曲折疊形成的多肽鏈等,是必不可少的一部分。圖7C為凝乳酶分子表面所形成的氫鍵,在二級結構如α-螺旋和β-折疊片中,氫鍵廣泛存在并形成復雜網絡[36],從而起到穩定蛋白質二級結構的作用。圖7D為凝乳酶分子表面的靜電勢分布情況,凝乳酶的分子表面幾乎全被高電勢籠罩,使凝乳酶得到很好保護,利于結構的穩定,靜電勢高還可在蛋白互作研究中大大提高分子對接的效率和準確性[37]。
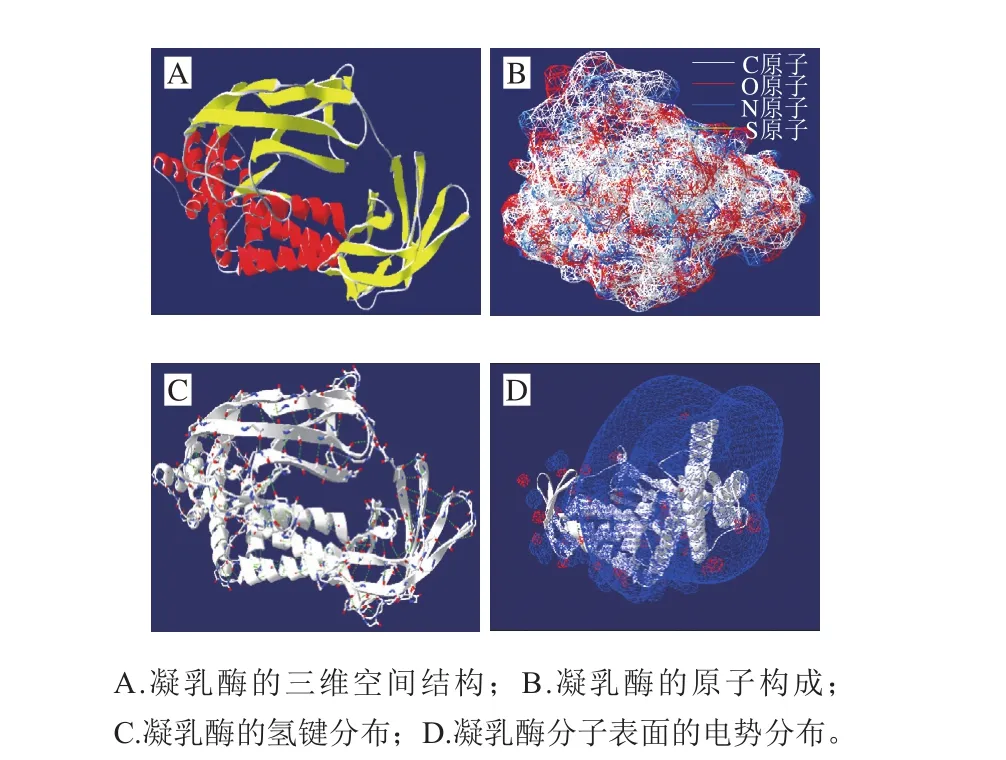
圖7 甲醇芽孢桿菌凝乳酶的高級結構預測結果Fig. 7 Advanced structural prediction of recombinant MCE from B. methanolicus
3 結 論
本研究通過基因工程實驗重組表達出甲醇芽孢桿菌凝乳酶,并對其結構進行了預測。發現該凝乳酶保持其具有凝乳活性的蛋白結構不穩定,在分離純化過程中發生自我剪切主動降解為2 個小分子蛋白且完全降解后喪失凝乳活性,這與該凝乳酶二級結構中α-螺旋含量較少相吻合。此外該凝乳酶具有很強的疏水性,存在跨膜蛋白和信號肽,二級結構較不穩定,并且與來自甲醇芽孢桿菌的hypothetical protein具有同源性且氨基酸序列完全一致,SWISS-MODEL同源建模方法成功確定了甲醇芽孢桿菌凝乳酶在PDB蛋白數據庫中的模板蛋白2ra1.1.A。本實驗為進一步研究甲醇芽孢桿菌凝乳酶的作用機制和功能特性提供了良好的分析依據。

