表面活性劑在生物轉(zhuǎn)化法合成普魯蘭中的作用及生理機(jī)制
王大慧,巨曉敏,衛(wèi)功元*
(蘇州大學(xué)基礎(chǔ)醫(yī)學(xué)與生物科學(xué)學(xué)院,江蘇 蘇州 215123)
普魯蘭是一種由麥芽三糖經(jīng)α-1,6-糖苷鍵聚合而成的微生物多糖,通常由出芽短梗霉(Aureobasidium pullulans)合成并分泌到胞外[1]。作為一種化學(xué)結(jié)構(gòu)獨(dú)特的水溶性高分子物質(zhì),普魯蘭具有良好的可塑性、成膜性和穩(wěn)定性,因而可以安全地應(yīng)用于食品、醫(yī)藥、環(huán)保和輕工等諸多領(lǐng)域[2-4]。2002年,普魯蘭被美國食品藥品監(jiān)督管理局認(rèn)證為GRAS(Generally Regarded As Safe)的微生物多糖[5]。2006年5月19日,國家衛(wèi)生部發(fā)布第8號(hào)公告,將普魯蘭列為新增的4種食品添加劑之一。此后,普魯蘭在市場(chǎng)上的需求量日益增長(zhǎng)。
目前,普魯蘭的生物合成主要采用發(fā)酵法[1,6]。為提高普魯蘭的產(chǎn)量以及合成效率,科研人員分別從培養(yǎng)基設(shè)計(jì)、發(fā)酵條件控制、關(guān)鍵酶活性提升以及跨膜運(yùn)輸?shù)冉嵌葘?duì)普魯蘭的合成過程進(jìn)行研究,確定了一些關(guān)鍵的影響因素[7-9]。其中,表面活性劑的添加對(duì)于促進(jìn)普魯蘭的合成具有明顯的積極作用[10]。常天俊等[11]考察了吐溫40、吐溫60和吐溫80在普魯蘭發(fā)酵生產(chǎn)中的作用,結(jié)果發(fā)現(xiàn)3 種表面活性劑均能促進(jìn)細(xì)胞分泌多糖,添加0.05%吐溫80時(shí)效果最好,不僅能提高約25%普魯蘭產(chǎn)量,而且還可以將發(fā)酵時(shí)間縮短近2 d。Sheng Long等[12-13]發(fā)現(xiàn)在發(fā)酵培養(yǎng)基中加入0.5%(體積分?jǐn)?shù))吐溫80可以顯著提高普魯蘭的產(chǎn)量,認(rèn)為吐溫80加速了細(xì)胞對(duì)營(yíng)養(yǎng)物質(zhì)的攝取,增加了葡萄糖基轉(zhuǎn)移酶活性,提高了細(xì)胞膜脂肪酸的含量,加速了普魯蘭向胞外分泌。Tu Guangwei等[14]在培養(yǎng)基中添加0.05%(體積分?jǐn)?shù))吐溫80,將聚蘋果酸和普魯蘭的產(chǎn)量分別提高了75.08%和27.21%,認(rèn)為吐溫80提高了氧氣攝取速率和CO2釋放速率,上調(diào)了相關(guān)跨膜轉(zhuǎn)運(yùn)因子的轉(zhuǎn)錄水平,最終提高了聯(lián)產(chǎn)發(fā)酵的產(chǎn)量。除此之外,鮮見其他表面活性劑影響普魯蘭生物合成的報(bào)道。
近年來,研究發(fā)現(xiàn)普魯蘭還可以利用全細(xì)胞生物轉(zhuǎn)化的方法合成得到[15]。在生物轉(zhuǎn)化過程中,普魯蘭合成代謝途徑中的3 個(gè)關(guān)鍵酶α-磷酸葡萄糖異構(gòu)酶(α-phosphoglucose mutase,PGM)、尿苷二磷酸葡萄糖焦磷酸化酶(UDP-glucose pyrophosphorylase,UGP)和葡萄糖基轉(zhuǎn)移酶(glucosyltransferase,F(xiàn)KS),能量物質(zhì)ATP的供給與消耗速率,以及細(xì)胞膜的通透性都是決定普魯蘭能否高效合成的影響因素[16]。與調(diào)控細(xì)胞內(nèi)物質(zhì)和能量代謝過程的復(fù)雜性不同,增加微生物細(xì)胞膜通透性可以通過添加表面活性劑得以實(shí)現(xiàn)[17]。然而,表面活性劑對(duì)生物轉(zhuǎn)化合成普魯蘭是否具有促進(jìn)作用以及其中蘊(yùn)含的生理生化機(jī)制至今不得而知。為此,本研究分析食品工業(yè)的非離子型表面活性劑斯潘和吐溫對(duì)生物轉(zhuǎn)化合成普魯蘭的影響,并從細(xì)胞特性、關(guān)鍵酶活性、胞內(nèi)物質(zhì)和能量代謝等角度解析表面活性劑的作用機(jī)制,研究結(jié)果將為進(jìn)一步提高普魯蘭生物合成效率提供新的思路。
1 材料與方法
1.1 材料與試劑
出芽短梗霉CCTCC M 2012259,由蘇州大學(xué)微生物生理與代謝調(diào)控研究室保藏。
種子培養(yǎng)基:采用PDA培養(yǎng)基。馬鈴薯200 g/L,葡萄糖20 g/L,自然pH值。
發(fā)酵培養(yǎng)基[15]:葡萄糖63.97 g/L,酵母粉3.57 g/L,(NH4)2SO40.6 g/L,NaCl 1.0 g/L,K2HPO45.0 g/L,MgSO4·7H2O 0.18 g/L,pH 6.5。
轉(zhuǎn)化液:葡萄糖50 g/L,MgSO4·7H2O 0.2 g/L,pH 6.8。
磷酸葡萄糖變位酶聯(lián)免疫分析測(cè)試盒 上海皓塵生物科技有限公司;尿苷二磷酸葡萄糖焦磷酸化酶聯(lián)免疫分析測(cè)試盒 上海將來實(shí)業(yè)股份有限公司。
1.2 儀器與設(shè)備
1525型高效液相色譜儀 美國Waters公司;BIOTECH-5BGZ攪拌式發(fā)酵罐 上海保興生物設(shè)備工程有限公司;HZ-2010K恒溫?fù)u瓶柜 太倉市華利達(dá)實(shí)驗(yàn)儀器設(shè)備有限公司;J6-MI型冷凍離心機(jī) 美國Beckeman公司;T6新世紀(jì)紫外-可見分光光度計(jì) 北京普析通用儀器有限責(zé)任公司;LDZX-50KBS型立式壓力蒸汽滅菌器 上海申安醫(yī)療器械廠。
1.3 方法
1.3.1 靜息細(xì)胞制備
將在-70 ℃超低溫冰箱中保藏的菌種(1 mL)接入裝有50 mL種子培養(yǎng)基的500 mL三角瓶中,于30 ℃、200 r/min搖床中培養(yǎng)24 h獲得種子。按10%(體積分?jǐn)?shù))的接種量將種子接入裝有3 L發(fā)酵培養(yǎng)基的5 L發(fā)酵罐中,在30 ℃、400 r/min和通氣量3 L/min條件下培養(yǎng)36 h。將發(fā)酵液12 000 r/min離心10 min,用無菌生理鹽水洗滌2 次后制得靜息細(xì)胞。
1.3.2 生物轉(zhuǎn)化
將靜息細(xì)胞均勻懸浮于裝有50 mL轉(zhuǎn)化液的500 mL三角瓶中,置于30 ℃、200 r/min搖床中轉(zhuǎn)化24 h或48 h,初始菌體控制在10 g/L左右(按干細(xì)胞質(zhì)量計(jì))。將無任何表面活性劑添加的生物轉(zhuǎn)化過程定義為空白對(duì)照。
1.3.3 細(xì)胞干質(zhì)量與普魯蘭產(chǎn)量測(cè)定
取20 mL轉(zhuǎn)化液(或發(fā)酵液),80 ℃水浴滅活15 min,冷卻至室溫后12 000 r/min離心10 min。細(xì)胞沉淀用蒸餾水洗滌3 次,離心后于70 ℃烘干至質(zhì)量恒定,計(jì)算得到細(xì)胞干質(zhì)量;取10 mL上清液,加入2 倍體積無水乙醇混勻,4 ℃處理12 h,12 000 r/min離心10 min,將沉淀于70 ℃烘干至質(zhì)量恒定,計(jì)算得到普魯蘭產(chǎn)量。
1.3.4 普魯蘭合成能力的計(jì)算
細(xì)胞轉(zhuǎn)化合成普魯蘭能力的計(jì)算方法參見文獻(xiàn)[15]。生物轉(zhuǎn)化反應(yīng)24 h,取樣檢測(cè)普魯蘭質(zhì)量濃度。將1 g靜息細(xì)胞(干質(zhì)量)在1 h內(nèi)轉(zhuǎn)化葡萄糖合成的普魯蘭質(zhì)量定義為1 個(gè)普魯蘭合成能力,單位為mg/(g·h)。
1.3.5 細(xì)胞存活率的測(cè)定
分別取培養(yǎng)24 h和48 h的轉(zhuǎn)化液,用無菌水稀釋至10-5倍,取100 μL在含有PDA培養(yǎng)基的平板上進(jìn)行涂布,30 ℃恒溫培養(yǎng)48 h,計(jì)數(shù)并計(jì)算細(xì)胞存活率。
1.3.6 無細(xì)胞提取物的制備
取5 mL轉(zhuǎn)化液,4 ℃、12 000 r/min離心10 min,生理鹽水洗滌2 次后,將濕細(xì)胞重新懸浮在5 mL 0.2 mol/L磷酸緩沖溶液(pH 7.0)中,超聲破碎10 min(破碎10 s,間隔10 s),4 ℃、12 000 r/min離心20 min,得到的上清液即為無細(xì)胞提取物,用于測(cè)定胞內(nèi)物質(zhì)含量和關(guān)鍵酶活性。
1.3.7 酶活性測(cè)定
FKS活性測(cè)定方法參見文獻(xiàn)[18]。將0.2 mL含有10 mmol 4-硝基-α-D-吡啶葡萄糖苷的乙酸鈉緩沖液(0.1 mol/L,pH 4.0)與0.2 mL待測(cè)酶液快速混合均勻,在40 ℃水浴中反應(yīng)5 min,隨后加入3 mL甘氨酸-NaOH緩沖液(0.4 mol/L,pH 10.5)終止反應(yīng)。測(cè)定405 nm波長(zhǎng)處的吸光度,由標(biāo)準(zhǔn)曲線計(jì)算產(chǎn)生的4-硝基酚含量。一個(gè)FKS活性單位定義為每分鐘釋放1 μmol 4-硝基酚所需要的酶量。
PGM活性:采用磷酸葡萄糖變位酶聯(lián)免疫分析測(cè)試盒進(jìn)行測(cè)定;UGP活性:采用尿苷二磷酸葡萄糖焦磷酸化酶聯(lián)免疫分析測(cè)試盒進(jìn)行測(cè)定,操作步驟參照試劑盒說明書執(zhí)行。
1.3.8 細(xì)胞膜通透性測(cè)定
采用流式細(xì)胞儀進(jìn)行檢測(cè)[19-20]。將離心收集的細(xì)胞重懸于0.1 mol/L磷酸緩沖溶液(pH 7.0)中,細(xì)胞密度控制在約106個(gè)/mL。將100 μL細(xì)胞懸浮物與1 μL 2.5 mg/L碘化丙啶(propidium iodide,PI)混合,37 ℃避光孵育50 min,加入900 μL磷酸緩沖溶液混勻。利用流式細(xì)胞儀檢測(cè)含有熒光探針的細(xì)胞數(shù),激發(fā)光波長(zhǎng)488 nm,發(fā)射光波長(zhǎng)625 nm。細(xì)胞流速為500 個(gè)/s,計(jì)數(shù)10 000 個(gè)細(xì)胞,計(jì)算PI攝取率。
1.3.9 胞內(nèi)尿苷二磷酸葡萄糖測(cè)定
胞內(nèi)尿苷二磷酸葡萄糖(uridine diphosphate g l u c o s e,U D P G)利用高效液相色譜法進(jìn)行檢測(cè)[21]。Sigma-Aldrich Supelcosil LC-18-DB柱(4.6 mm×250 mm),流動(dòng)相為40 mmol/L三乙胺-乙酸溶液(pH 6.0),流速1 mL/min,檢測(cè)波長(zhǎng)254 nm,柱溫22 ℃,進(jìn)樣量10 μL。
1.3.10 胞內(nèi)ATP和ADP測(cè)定
利用高效液相色譜法進(jìn)行檢測(cè)[21]。Waters 1525反相SunFire C18柱(4.6 mm×250 mm,5 μm),流動(dòng)相為0.01 mol/L磷酸緩沖溶液(pH 6.5),流速1 mL/min,檢測(cè)波長(zhǎng)254 nm,柱溫35 ℃,進(jìn)樣量10 μL。
1.4 數(shù)據(jù)統(tǒng)計(jì)
所有實(shí)驗(yàn)數(shù)據(jù)均為3 組平行樣品檢測(cè)結(jié)果的平均值。Excel 2010軟件作圖。
2 結(jié)果與分析
2.1 斯潘對(duì)生物轉(zhuǎn)化合成普魯蘭的影響
向轉(zhuǎn)化液中分別添加不同質(zhì)量濃度的斯潘20、斯潘40、斯潘60和斯潘80,研究斯潘在生物轉(zhuǎn)化合成普魯蘭中的作用。由圖1可以看出,在考察的質(zhì)量濃度范圍內(nèi)(0~20 g/L),斯潘20對(duì)細(xì)胞的普魯蘭合成能力幾乎沒有影響。斯潘40和斯潘60的添加降低了細(xì)胞合成普魯蘭的能力,且添加質(zhì)量濃度越高,普魯蘭合成能力降低的幅度越大。斯潘80可以提高普魯蘭的合成能力,當(dāng)添加質(zhì)量濃度為20 g/L時(shí),普魯蘭的合成能力提高了46.5%。因此,在底物充足供給的前提下,斯潘80可以顯著提高普魯蘭的生物合成效率。
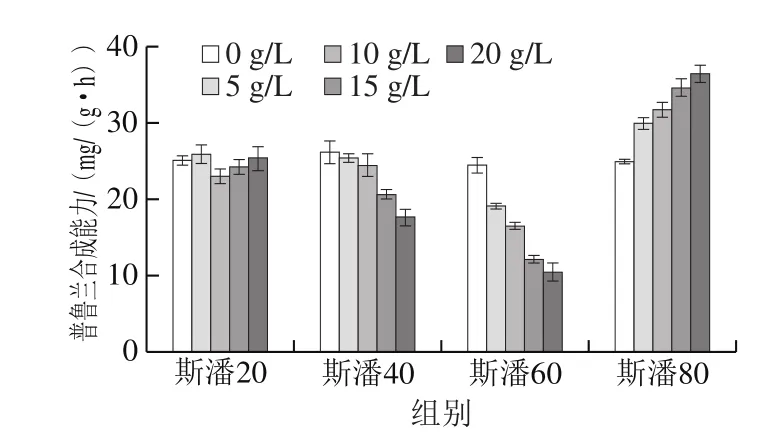
圖1 斯潘對(duì)生物轉(zhuǎn)化合成普魯蘭的影響Fig. 1 Effect of Span on pullulan production
2.2 吐溫對(duì)生物轉(zhuǎn)化合成普魯蘭的影響
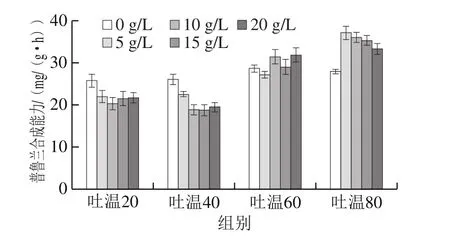
圖2 吐溫對(duì)生物轉(zhuǎn)化合成魯蘭的影響Fig. 2 Effect of Tween on pullulan production
向轉(zhuǎn)化液中添加不同質(zhì)量濃度的吐溫20、吐溫40、吐溫60和吐溫80,研究吐溫在生物轉(zhuǎn)化合成普魯蘭中的作用,結(jié)果見圖2。與對(duì)照相比,吐溫20和吐溫40的添加降低了細(xì)胞的普魯蘭合成能力;吐溫60對(duì)生物轉(zhuǎn)化的影響不顯著;而吐溫80則顯著提高了細(xì)胞的普魯蘭合成能力。當(dāng)吐溫80質(zhì)量濃度為5 g/L時(shí),細(xì)胞合成普魯蘭的能力比對(duì)照提高了32.9%。同樣地,當(dāng)?shù)孜锕┙o充足時(shí),吐溫80也可以明顯提高普魯蘭生物合成的效率。
2.3 斯潘80和吐溫80復(fù)配在生物轉(zhuǎn)化合成普魯蘭中的作用
斯潘80和吐溫80的分子結(jié)構(gòu)中都含有失水山梨醇單油酸酯,彼此的碳?xì)浞肿渔溨g能夠很好地相互吸引,二者復(fù)合使用時(shí)還可以增加體系的穩(wěn)定性[22]。為此,將20 g/L斯潘80和5 g/L吐溫80進(jìn)行復(fù)配,考察其在生物轉(zhuǎn)化合成普魯蘭中的作用。為便于比較,將斯潘80和吐溫80單獨(dú)添加后的普魯蘭產(chǎn)量(24 h和48 h)一并列出,結(jié)果見圖3。與空白對(duì)照相比,無論是單獨(dú)添加還是復(fù)配使用,斯潘80和吐溫80均提高了普魯蘭產(chǎn)量。斯潘80和吐溫80復(fù)配使用的效果最好,但是并未顯示出累加效應(yīng)。
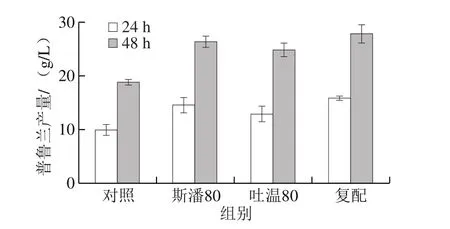
圖3 斯潘80和吐溫80復(fù)配對(duì)生物轉(zhuǎn)化合成普魯蘭的影響Fig. 3 Separate and combined effect of Span 80 and Tween 80 on pullulan production
2.4 表面活性劑提高生物轉(zhuǎn)化合成普魯蘭效率的作用機(jī)制
2.4.1 細(xì)胞存活率
部分表面活性劑與微生物長(zhǎng)期接觸會(huì)影響細(xì)胞生長(zhǎng),甚至?xí)芙饧?xì)胞膜的部分成分而實(shí)現(xiàn)殺菌作用[23]。為考察20 g/L斯潘80、5 g/L吐溫80及其復(fù)配對(duì)細(xì)胞存活率的影響,采用涂布平板的方法,對(duì)參與轉(zhuǎn)化反應(yīng)24 h和48 h后的細(xì)胞進(jìn)行培養(yǎng)并計(jì)數(shù)統(tǒng)計(jì),結(jié)果見表1。與生物轉(zhuǎn)化反應(yīng)起始時(shí)的細(xì)胞總數(shù)(2.15×108個(gè)/mL)相比,單獨(dú)添加斯潘80時(shí)的活細(xì)胞數(shù)略有減少;單獨(dú)添加吐溫80以及復(fù)配對(duì)活細(xì)胞數(shù)影響不大。總體上,斯潘80和吐溫80對(duì)細(xì)胞存活率沒有顯著影響。
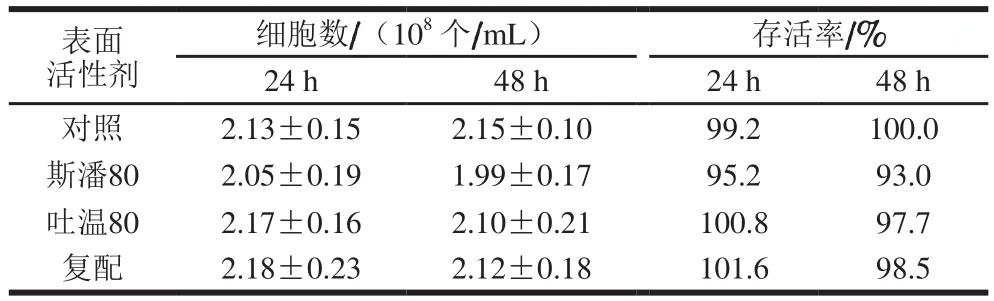
表1 表面活性劑對(duì)細(xì)胞存活率的影響Table 1 Effect of surfactants on survival rate of cells
2.4.2 細(xì)胞膜通透性
在普魯蘭的生物合成過程中,麥芽三糖單體首先在胞內(nèi)合成,然后跨過細(xì)胞膜分泌到胞外并聚合成普魯蘭[1,24],所以,細(xì)胞膜通透性的大小將影響到普魯蘭合成速率的高低。采用流式細(xì)胞儀對(duì)細(xì)胞通透性進(jìn)行測(cè)定,以PI攝取率定量表示細(xì)胞通透性的大小,結(jié)果見圖4。與對(duì)照相比,吐溫80對(duì)PI攝取率的影響很小,而斯潘80則大幅度地提高了PI攝取率(4~5 倍);復(fù)配條件下的PI攝取率與單獨(dú)添加斯潘80的結(jié)果相近。由此可見,斯潘80極大地提高了細(xì)胞膜的通透性,但斯潘80和吐溫80的作用沒有累加性。
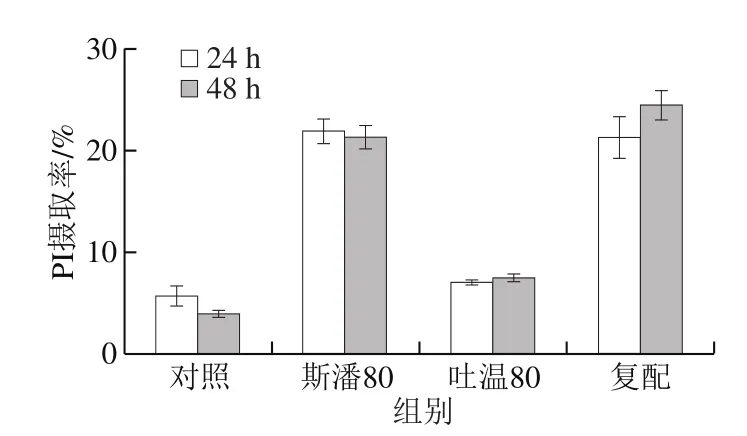
圖4 表面活性劑對(duì)細(xì)胞PI攝取率的影響Fig. 4 Effect of surfactants on PI uptake of cells
2.4.3 普魯蘭合成關(guān)鍵酶活性分析
研究表明,吐溫80在普魯蘭分批發(fā)酵過程中會(huì)提高FKS活性水平[12]。本研究考察斯潘80和吐溫80對(duì)普魯蘭生物合成途徑中3 種關(guān)鍵酶(PGM、UGP和FKS)活性的影響,結(jié)果見圖5。可以發(fā)現(xiàn),在轉(zhuǎn)化反應(yīng)第24小時(shí),除吐溫80對(duì)FKS活性沒有顯著影響外,其他添加條件下的PGM、UGP和FKS活性均明顯高于對(duì)照。在第48小時(shí),斯潘80單獨(dú)添加仍然能提高PGM、UGP和FKS的活性,吐溫80對(duì)3 種關(guān)鍵酶活性均無影響,復(fù)配物僅可以提高FKS活性。此外,由圖5還可以看出,在轉(zhuǎn)化反應(yīng)的前期(24 h),PGM和UGP具有更高的活性;而在轉(zhuǎn)化后期(48 h),F(xiàn)KS活性更高。以上酶活結(jié)果表明,在生物轉(zhuǎn)化合成普魯蘭的過程中,斯潘80對(duì)關(guān)鍵酶活性的提高均具有積極作用,而吐溫80僅在轉(zhuǎn)化前期提高了PGM和UGP的活性。
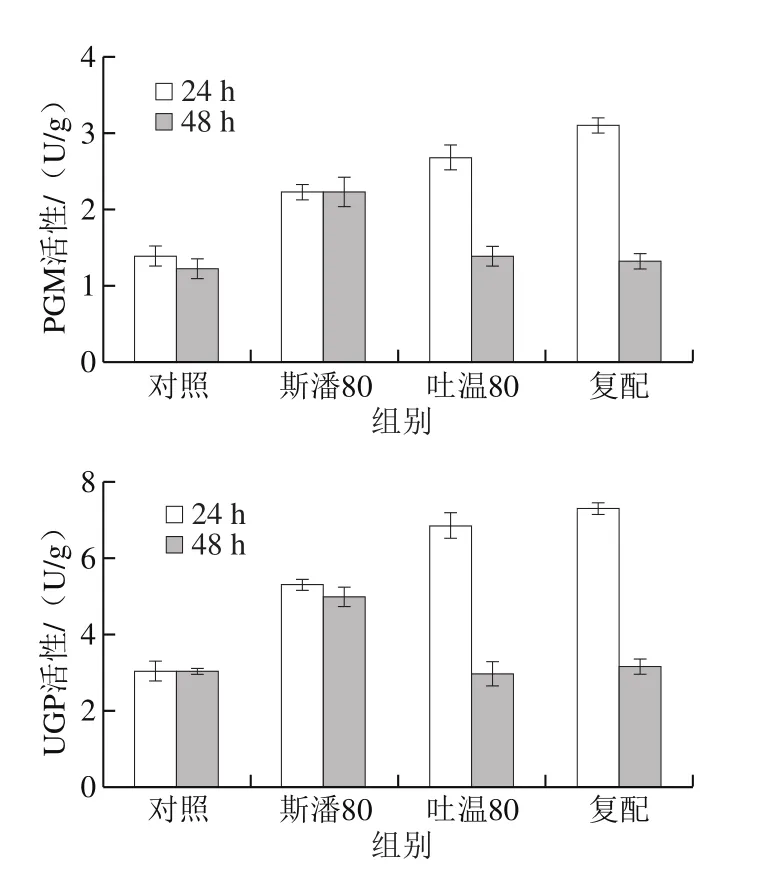
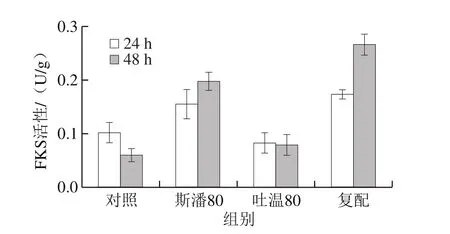
圖5 表面活性劑對(duì)普魯蘭合成關(guān)鍵酶活性的影響Fig. 5 Effect of surfactants on activities of key enzymes involved in pullulan biosynthesis
2.4.4 胞內(nèi)UDPG水平
作為普魯蘭生物合成的最重要的前體物質(zhì)之一,胞內(nèi)UDPG水平是事關(guān)普魯蘭能否高效合成的關(guān)鍵因素[1,21]。在生物轉(zhuǎn)化的24 h和48 h,不同表面活性劑添加方式下的胞內(nèi)UDPG含量見圖6。可以發(fā)現(xiàn),在底物充足的情況下,普魯蘭快速合成時(shí)(第24小時(shí))的胞內(nèi)UDPG水平比第48小時(shí)的高。與對(duì)照相比,斯潘80和吐溫80分別將第24小時(shí)胞內(nèi)UDPG含量提高了40.7%和102.4%。至第48小時(shí),由于底物葡萄糖基本耗盡(數(shù)據(jù)未給出),胞內(nèi)UDPG含量均下降至較低的水平(約1.2 mg/g)。
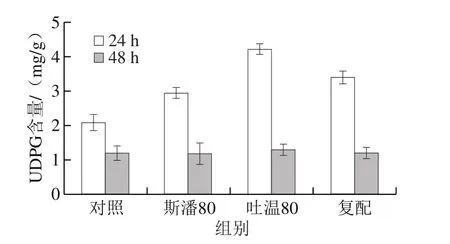
圖6 表面活性劑對(duì)胞內(nèi)UDPG水平的影響Fig. 6 Effect of surfactants on intracellular UDPG level
2.4.5 胞內(nèi)能量代謝物質(zhì)水平及比率
普魯蘭的生物合成離不開能量物質(zhì)的充足供給[16]。測(cè)定不同表面活性劑添加條件下的胞內(nèi)能量物質(zhì)ATP和ADP含量,計(jì)算ATP/ADP比率,結(jié)果見圖7。在第24小時(shí),斯潘80和吐溫80均可以提高胞內(nèi)ATP含量和ATP/ADP比率,體現(xiàn)出比對(duì)照具有更強(qiáng)的ATP再生能力,最終胞內(nèi)有充足的ATP供給用于普魯蘭的快速合成。特別地,吐溫80在提高胞內(nèi)ATP含量和再生方面發(fā)揮著更為重要的作用。至第48小時(shí),斯潘80和吐溫80雖然仍能將胞內(nèi)ATP維持在較高的水平,但ATP的再生能力均低于對(duì)照。
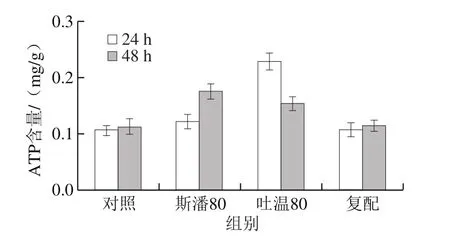
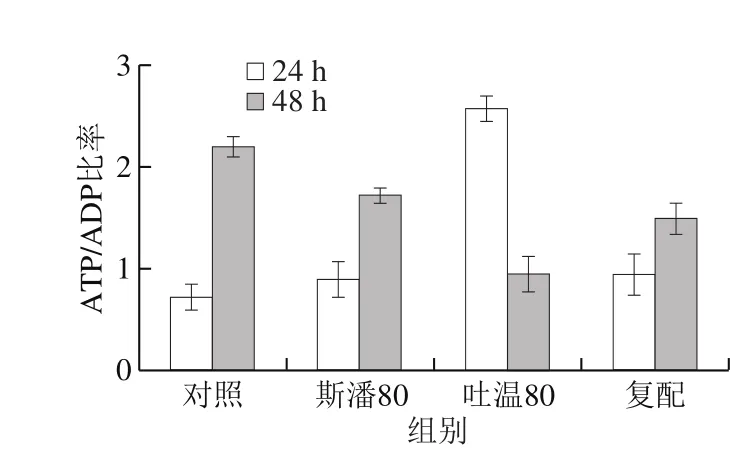
圖7 表面活性劑對(duì)胞內(nèi)ATP水平和ATP/ADP比率的影響Fig. 7 Effect of surfactants on intracellular ATP level and ATP/ADP ratio
3 討 論
表面活性劑素有“工業(yè)味精”的美稱,是一類用途廣泛的精細(xì)化工產(chǎn)品,在食品、藥品以及化妝品制造等領(lǐng)域中均有廣泛應(yīng)用[25]。在微生物發(fā)酵領(lǐng)域,表面活性劑可以通過增大細(xì)胞膜的通透性、改變酶活性調(diào)控細(xì)胞的生長(zhǎng)和產(chǎn)物合成[26-29]。作為非離子型表面活性劑,斯潘和吐溫常以乳化劑的形式應(yīng)用于食品加工中[30]。已有文獻(xiàn)報(bào)道表明,吐溫80在普魯蘭發(fā)酵生產(chǎn)中對(duì)于提高目標(biāo)產(chǎn)物的產(chǎn)量起到了積極作用[11-13]。本研究發(fā)現(xiàn),20 g/L斯潘80和5 g/L吐溫80在全細(xì)胞生物轉(zhuǎn)化合成普魯蘭過程中提高了細(xì)胞合成普魯蘭的能力,同時(shí),普魯蘭的合成效率均高于前人研究的結(jié)果[11-13]。為探究斯潘80和吐溫80提高普魯蘭合成效率的生理機(jī)制,分別從細(xì)胞特性、關(guān)鍵酶活性、物質(zhì)與能量代謝等多個(gè)角度進(jìn)行了探索。
在全細(xì)胞轉(zhuǎn)化過程中,將細(xì)胞始終保持在較高活性是實(shí)現(xiàn)高效轉(zhuǎn)化的基本保障,而部分表面活性劑(如Triton X-100)卻對(duì)細(xì)胞活性表現(xiàn)出一定的抑制作用[31]。本研究細(xì)胞存活率的結(jié)果表明,斯潘80和吐溫80對(duì)細(xì)胞活性幾乎沒有影響,可以確保不同轉(zhuǎn)化條件下的出芽短梗霉細(xì)胞均能維持正常的生理代謝。在此基礎(chǔ)上,斯潘80和吐溫80的添加提高了細(xì)胞膜的通透性,不僅有利于底物進(jìn)入胞內(nèi)與酶作用,還加速了胞內(nèi)合成的普魯蘭跨膜向胞外分泌,進(jìn)而提高了普魯蘭的合成效率。
根據(jù)出芽短梗霉合成普魯蘭的代謝途徑,底物葡萄糖首先在PGM和UGP的催化下合成前體物質(zhì)UDPG,然后UDPG在FKS的作用下合成麥芽三糖單體物質(zhì),最終麥芽三糖在FKS的作用下跨膜聚合形成普魯蘭[1,18,32]。因此,提高PGM和UGP的活性有利于增加胞內(nèi)UDPG的供給,而提高FKS的活性將加速UDPG的消耗,最終促進(jìn)普魯蘭的合成。本研究普魯蘭合成關(guān)鍵酶活性和胞內(nèi)UDPG水平的結(jié)果表明,斯潘80和吐溫80在普魯蘭合成期(24 h)均提高了PGM和UGP的活性,提升了胞內(nèi)UDPG水平。特別地,斯潘80提高了FKS活性,加速了UDPG向普魯蘭的轉(zhuǎn)化。由于吐溫80更有利于胞內(nèi)UDPG的供給,而斯潘80更有利于UDPG的消耗,因此在相同轉(zhuǎn)化時(shí)間下,添加斯潘80獲得的普魯蘭產(chǎn)量比添加吐溫80的結(jié)果要高,體現(xiàn)出更高的普魯蘭合成效率。
與此同時(shí),能量物質(zhì)ATP的供給與消耗速率也是影響普魯蘭生物合成效率的重要因素。胞內(nèi)ATP含量體現(xiàn)ATP合成和利用的綜合結(jié)果,而ATP/ADP比率則反映ATP的再生能力[33]。本研究結(jié)果表明,吐溫80在提高胞內(nèi)ATP含量和促進(jìn)ATP再生方面比斯潘80有更好的效果,能將胞內(nèi)ATP維持在較高的水平,從而為普魯蘭的快速合成提供充足的能量供給。
斯潘80和吐溫80有類似的分子結(jié)構(gòu),使得它們可以復(fù)配使用而增加效果[34]。本研究在單獨(dú)添加的基礎(chǔ)上,也考察了斯潘80和吐溫80復(fù)配在生物轉(zhuǎn)化合成普魯蘭中的作用,復(fù)配條件下的普魯蘭產(chǎn)量和合成效率只比單獨(dú)添加略高,沒有體現(xiàn)出累加效應(yīng)。該結(jié)果可能與斯潘80和吐溫80復(fù)配比例不當(dāng)有關(guān),有待今后進(jìn)一步研究。
綜上,本研究考察了多種表面活性劑在全細(xì)胞生物轉(zhuǎn)化合成普魯蘭中的作用,發(fā)現(xiàn)在轉(zhuǎn)化液中添加20 g/L斯潘80或/和5 g/L吐溫80均有利于普魯蘭合成效率的提高。在此基礎(chǔ)上,檢測(cè)了細(xì)胞存活率、細(xì)胞膜通透性、普魯蘭合成關(guān)鍵酶活性、胞內(nèi)UDPG含量以及能量代謝物質(zhì)水平和比率,部分解析了斯潘80和吐溫80提高普魯蘭合成效率的生理機(jī)制。研究結(jié)果為實(shí)現(xiàn)普魯蘭高產(chǎn)提供了一種可行的方法,同時(shí)也為其他類似結(jié)構(gòu)微生物多糖的高效合成提供新的思路。

