單寧酸與大豆分離蛋白相互作用研究
由耀輝,熊林穎,陳 虹,彭 洋,王 丹,歐 潔,孫緒兵
(1.內江師范學院 化學化工學院,四川 內江641000; 2.內江師范學院 果蔬類廢棄物資源化四川省高等學校重點實驗室,四川 內江641000)
大豆分離蛋白是一類資源豐富、價格低廉、環境友好的植物蛋白,具有良好的成膜性、食品安全性及營養價值,在食品包裝領域展現出良好的應用前景[1]。然而,天然大豆分離蛋白膜的物理化學性能尚不能完全滿足應用需求,需要對其進行改性處理。在眾多改性方法中,交聯改性是一種改善大豆分離蛋白膜性能的有效策略,醛類化合物、環氧化合物、京尼平、碳化二亞胺、谷氨酰胺轉氨酶等常用于對大豆分離蛋白交聯改性以形成互穿網狀結構[2-4],從而改善大豆分離蛋白性能,但是作為食品包裝材料,這些交聯劑在成本及安全性等方面尚存在較大的問題。單寧酸是一類來源廣泛的植物多酚,其與蛋白質有良好交聯能力,并且具有一定的抗氧化和抑菌能力,被認為是一種安全的食品添加劑[5-6]。近年來,已有研究將單寧酸用于對大豆分離蛋白膜改性[7-9]。然而,這些研究工作主要聚焦于單寧酸對大豆分離蛋白膜宏觀性能的影響,鮮有從分子水平揭示單寧酸對大豆分離蛋白結構的影響。
基于此,本文通過熒光光譜研究單寧酸與大豆分離蛋白的作用方式,采用同步熒光光譜、紫外光譜及圓二色譜等方法,研究單寧酸對大豆分離蛋白構象的影響,為開發單寧酸-大豆分離蛋白基復合材料提供理論指導。
1 材料與方法
1.1 試驗材料
大豆分離蛋白(SPI),食品級,臨沂山松生物制品有限公司;單寧酸(相對分子質量為1 701.2),分析純,上海阿拉丁生化科技股份有限公司;其他試劑均為分析純。
F-4600熒光分光光度計,日本日立公司;UV-2000 紫外可見分光光度計;Chirascan圓二色譜儀,英國應用光物理公司。
1.2 試驗方法
1.2.1 樣品的制備
用0.01 mol/L磷酸鹽緩沖液(pH 6.8)分別配制0.2 g/L的大豆分離蛋白溶液、10×10-6mol/L的單寧酸溶液及一系列大豆分離蛋白-單寧酸混合溶液,使混合溶液中大豆分離蛋白溶液的質量濃度固定為0.2 g/L,單寧酸濃度分別為0、1×10-6、2×10-6、4×10-6、6×10-6、8×10-6、10×10-6mol/L(相對大豆分離蛋白質量分數的0、0.85%、1.7%、3.4%、5.1%、6.8%、8.5%)。
1.2.2 熒光光譜
將大豆分離蛋白-單寧酸混合溶液分別在293、313、333 K下作用30 min后測定熒光光譜。內源熒光光譜測試條件:激發波長280 nm,激發和發射狹縫均為5 nm,掃描速度1 200 nm/min,以混合溶液中對應濃度的單寧酸溶液校零,波長掃描范圍295~450 nm。同步熒光光譜測定條件:在293 K下,發射波長與激發波長的差值分別固定15 nm和60 nm。
1.2.3 紫外光譜
在293 K下,以大豆分離蛋白-單寧酸混合溶液中對應濃度的單寧酸溶液校零,于240~350 nm范圍測定大豆分離蛋白-單寧酸混合溶液的紫外吸收光譜。
1.2.4 圓二色譜
取0.2 g/L的大豆分離蛋白溶液、10×10-6mol/L 的單寧酸溶液及對應濃度的大豆分離蛋白-單寧酸溶液,于293 K下作用30 min,在波長190~260 nm、光徑1 mm條件下,掃描遠紫外區圓二色譜,通過扣除磷酸鹽緩沖液及單寧酸溶液背景獲得大豆分離蛋白及大豆分離蛋白-單寧酸的圓二色譜圖。取大豆分離蛋白平均殘基摩爾質量為115 g/mol,將圓二色譜的y軸橢圓率(單位mdeg)轉換為蛋白質的平均殘基摩爾橢圓率(單位deg·cm2/dmol)。通過CDPro軟件處理數據,選擇算法為CONTINLL,參考蛋白為SMP56,計算α-螺旋、β-折疊、β-轉角和無規卷曲的含量。
2 結果與分析
2.1 單寧酸與大豆分離蛋白的作用方式
2.1.1 單寧酸對大豆分離蛋白內源熒光光譜的影響
蛋白質內源熒光的變化可直接反映生色基團自身和周圍微環境的變化。通常認為,當激發波長為280 nm時,可同時激發蛋白質色氨酸和酪氨酸殘基,其中以色氨酸的貢獻為主[10]。以280 nm為激發波長,以大豆分離蛋白-單寧酸溶液在293 K下作用30 min為例,考察不同濃度單寧酸對大豆分離蛋白內源熒光光譜的影響,結果如圖1所示。
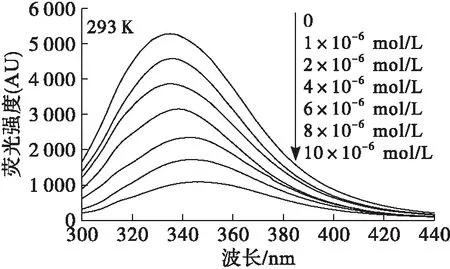
圖1 不同濃度單寧酸對大豆分離蛋白熒光光譜的影響
由圖1可見,隨著單寧酸濃度增加,大豆分離蛋白熒光強度顯著降低,表明單寧酸對大豆分離蛋白的內源熒光產生猝滅作用。同時亦可發現,隨著單寧酸濃度增加,大豆分離蛋白的最大熒光發射波長從335 nm紅移至345 nm。通常認為,最大熒光發射波長紅移表示熒光基團所處微環境更加親水,這一現象表明單寧酸與大豆分離蛋白發生相互作用導致色氨酸和酪氨酸殘基微環境親水性增強。
2.1.2 單寧酸與大豆分離蛋白相互作用的猝滅類型、結合常數及結合位點數
熒光猝滅大致可分為動態猝滅和靜態猝滅兩類。動態猝滅是指激發態的熒光分子通過與猝滅劑分子的碰撞作用,以能量轉移或電荷轉移的機制喪失其激發能而返回基態。靜態猝滅是指熒光分子與猝滅劑分子形成了不發光的基態復合物。在動態猝滅中,動態猝滅常數會隨溫度升高而增大;而在靜態猝滅中,靜態結合常數會隨溫度升高而減小[11-12]。為了探討單寧酸對大豆分離蛋白的熒光猝滅類型,假設其熒光猝滅過程為動態猝滅,利用Stern-Volmer方程[13-14],即:
F0/F=1+Kqτ0=1+Ksv[Q]
(1)
式中:F0和F分別為無單寧酸和有單寧酸時大豆分離蛋白的熒光強度;Kq為擴散碰撞猝滅速率常數(該值越大猝滅效應越顯著),L/(mol·s);τ0為無單寧酸存在時大豆分離蛋白的熒光壽命(通常生物大分子的熒光平均壽命約為10-8s);Ksv為Stern-Volmer 動態猝滅常數,L/mol;[Q]為猝滅劑單寧酸濃度,mol/L。
以F0/F對[Q]作圖,見圖2,相關參數如表1所示。
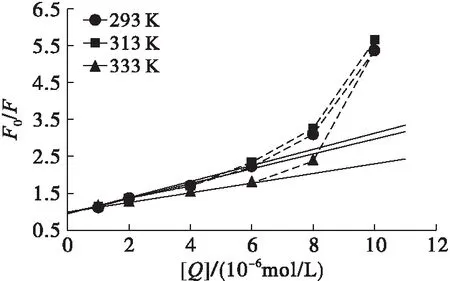
圖2 單寧酸對大豆分離蛋白的Stern-Volmer熒光猝滅圖

溫度/KKsv/(L/mol)Kq/(L/(mol·s))R22932.056×1052.056×10130.971 33131.920×1051.920×10130.986 73331.289×1051.289×10130.999 1
由圖2可知,當單寧酸濃度小于等于6×10-6mol/L時,F0/F與[Q]具有良好的線性關系。當單寧酸濃度超過6×10-6mol/L時,F0/F與[Q]曲線向上彎曲,意味著猝滅作用同時存在著靜態猝滅和動態猝滅[15]。這可能是因為單寧酸濃度越高,其與大豆分離蛋白碰撞概率越大,將引起部分動態猝滅效應。
由表1可知,當溫度為293、313 K和333 K時,單寧酸對大豆分離蛋白的擴散碰撞猝滅速率常數Kq分別為2.056×1013、1.920×1013、1.289×1013L/(mol·s),遠大于文獻[16]得到的各類猝滅劑對生物大分子的最大擴散碰撞猝滅速率常數2.0×1010L/(mol·s)。此外,隨著溫度升高,動態猝滅常數Ksv值減少,這一結果與典型的動態猝滅特征相反。因此,可以認為單寧酸濃度在0~6×10-6mol/L范圍時,其對大豆分離蛋白的熒光猝滅作用主要以靜態猝滅為主。
對于靜態猝滅過程,可采用下式計算結合常數和結合位點數[10]:
lg[(F0-F)/F]=lgKa+nlg[Q]
(2)
式中:Ka為結合常數,L/mol;n為結合位點數。
以lg[(F0-F)/F]對lg[Q]作圖,由擬合直線的斜率和截距可獲得結合位點數及結合常數,相關參數如表2所示。
由表2可知,大豆分離蛋白與單寧酸之間的結合位點數n近似為1,表示大豆分離蛋白與單寧酸形成1∶1復合物。大豆分離蛋白與單寧酸之間的結合常數Ka數量級為106,說明大豆分離蛋白與單寧酸具有較強的結合能力,并且隨著溫度升高結合常數Ka變大,意味著大豆分離蛋白與單寧酸的結合是吸熱過程。

表2 單寧酸與大豆分離蛋白作用的結合位點數、結合常數及熱力學參數
2.1.3 單寧酸與大豆分離蛋白的熱力學參數和作用力
小分子與蛋白質大分子之間的作用力包括氫鍵、范德華力、疏水作用力和靜電引力等。小分子與蛋白質的相互作用能否自發進行取決于體系的吉布斯自由能(ΔG),ΔG<0時有利于反應自發進行。根據反應體系熵變(ΔS)和焓變(ΔH)可大致確定二者之間的作用力:當ΔH>0、ΔS<0時,分子間作用力主要是靜電引力和疏水作用力;當ΔH>0、ΔS>0時,分子間作用力主要是疏水作用力;當ΔH<0、ΔS<0時,分子間作用力主要是范德華力、氫鍵等作用;當ΔH<0、ΔS>0時,分子間作用力主要是靜電引力[17-18]。假設在試驗溫度范圍內焓變的變化較小,則計算公式為:
ln(K2/K1)=-(ΔH/R)(1/T2-1/T1)
(3)
ΔG=-RTlnKa
(4)
ΔS=(ΔH-ΔG)/T
(5)
式中:R為氣體狀態常數,8.314 J/(K·mol);T為試驗溫度,K;K代表相應溫度下反應體系的結合常數Ka,L/mol。由公式(3)、(4)、(5)計算出的熱力學參數見表2。由表2可知,體系ΔH>0,表明大豆分離蛋白與單寧酸之間的相互作用為吸熱反應,升溫有利于反應的進行,同時這也與結合常數Ka隨著溫度的升高而增大的結論相吻合。體系ΔG<0,表明大豆分離蛋白與單寧酸的結合是自發進行的。體系ΔH>0和ΔS>0說明大豆分離蛋白與單寧酸之間的作用力主要是疏水作用力。
2.2 單寧酸對于大豆分離蛋白構象的影響
2.2.1 單寧酸與大豆分離蛋白相互作用的同步熒光光譜
普通熒光光譜不能將蛋白質中色氨酸和酪氨酸相互重疊的熒光峰區分,而同步熒光光譜具有靈敏度高和選擇性好等優點,通過選擇合適的波長差可將色氨酸和酪氨酸殘基的熒光峰分開。當波長差為15 nm 時僅表現為酪氨酸殘基的熒光,當波長差為60 nm 時則顯示色氨酸殘基的熒光[19]。同步熒光光譜最大發射波長的變化,亦可反映氨基酸殘基所處微環境的變化。固定Δλ為15 nm和Δλ為60 nm,研究不同濃度單寧酸對大豆分離蛋白同步熒光光譜的影響,結果如圖3所示。
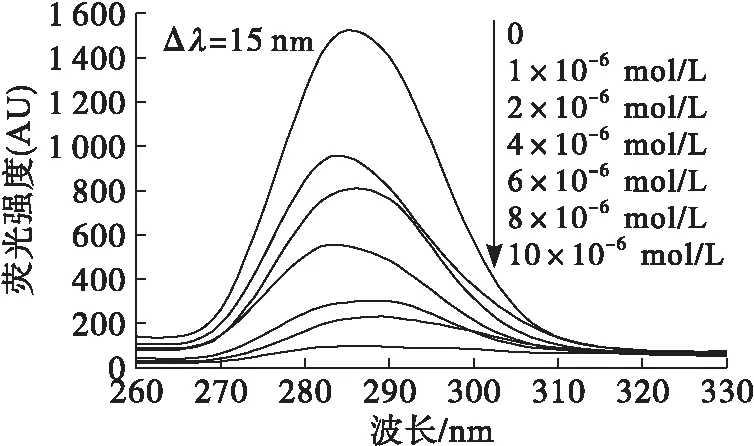
圖3 單寧酸對大豆分離蛋白同步熒光光譜的影響
由圖3可知,隨著單寧酸濃度的增加,大豆分離蛋白的酪氨酸和色氨酸殘基熒光強度均發生明顯猝滅作用,并且色氨酸殘基的最大發射波長紅移幅度(從275 nm紅移至288 nm)大于酪氨酸殘基紅移幅度(從285 nm紅移至291 nm),這一現象表明單寧酸對大豆分離蛋白的色氨酸殘基微環境影響更為顯著[20]。
2.2.2 單寧酸-大豆分離蛋白復合體系的紫外光譜
紫外光譜是表征蛋白質與小分子化合物相互作用的有效方法。不同濃度的單寧酸對于大豆分離蛋白溶液紫外光譜的影響如圖4所示。
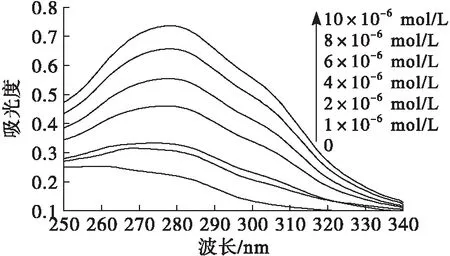
圖4 單寧酸對大豆分離蛋白紫外光譜的影響
由圖4可知,大豆分離蛋白在280 nm波長附近存在一個寬吸收峰,被認為是肽鏈上酪氨酸和色氨酸等芳香雜環的π-π*躍遷引起[21],隨著單寧酸濃度增加,該吸收峰強度明顯增強。這可能是因為單寧酸的加入導致大豆分離蛋白酪氨酸和色氨酸殘基趨向于暴露水相(前文熒光光譜結果),導致吸收峰增強。此外,單寧酸自身具有芳香性,其與大豆分離蛋白形成復合物后有利于π電子的傳遞。
2.2.3 圓二色譜分析
蛋白質二級結構主要包括α-螺旋、β-折疊、β-轉角和無規卷曲。遠紫外區域圓二色譜可定量分析蛋白質溶液中各類型二級結構的相對含量,單寧酸對大豆分離蛋白圓二色譜的影響如圖5所示,經CDPro軟件計算得到的α-螺旋、β-折疊、β-轉角和無規卷曲結構的相對含量如表3所示。

圖5 單寧酸對大豆分離蛋白圓二色譜的影響

樣品α-螺旋β-折疊β-轉角無規卷曲大豆分離蛋白4.242.021.432.2單寧酸-大豆分離蛋白4.841.822.031.5
由圖5和表3可知,大豆分離蛋白的二級結構中主要以β-折疊為主,在測試范圍內,單寧酸對大豆分離蛋白的二級結構有輕微的影響,但并無顯著性差異。薛燕斌等[22]研究表明高良姜素可以與人血清白蛋白相互作用,但對其二級結構的影響較小;Cheng等[23]研究表明順、反式白藜蘆醇對α-乳白蛋白、β-乳球蛋白及牛血清白蛋白的二級結構均沒有顯著影響。
3 結 論
單寧酸對大豆分離蛋白的內源熒光有較強的猝滅作用,在低濃度范圍時,猝滅類型以靜態猝滅為主,在高濃度范圍時,同時存在靜態猝滅和動態猝滅。通過疏水作用,單寧酸與大豆分離蛋白相互作用,并且導致大豆分離蛋白分子鏈舒展,分子中色氨酸、酪氨酸殘基微環境親水性增強。

