吡咯烷酮類螺環化合物與β-分泌酶活性中心的結合機制
劉中婷,鐘謝斌,王汐璆,莊文昌,朱文友
(徐州工程學院 化學化工學院,江蘇 徐州 221111)
阿爾茨海默癥(AD)俗稱老年癡呆,進行性記憶喪失和認知能力下降是該病的典型臨床特征,其主要病理特征是存在神經纖維纏結和細胞外淀粉樣蛋白“斑塊”[1]。斑塊主要由淀粉樣蛋白前體蛋白(APP)的蛋白水解片段組成。隨著對阿爾茨海默癥的不斷深入研究,人們發現β-分泌酶(BACE)是阿爾茨海默病患者腦中斑塊主要成分淀粉樣蛋白前體蛋白水解片段形成的一種關鍵酶。AD 的發生和發展與大腦中斑塊的沉積有直接關系,抑制BACE1的水解作用將會阻斷或減慢斑塊的產生和聚集,從而減緩AD的發生和發展,起到干預治療該疾病的作用[2-4]。抑制BACE1的水解作用已成為阿爾茨海默病患者藥物干預的主要手段[5]。
早期的BACE抑制劑都是肽類藥物,其作用主要是截取APP斷裂位點附近的片段,通過加入非天然的氨基酸,來模擬BACE1與APP作用的過渡態異構體,從而與APP發生競爭性抑制,減少β淀粉樣多肽(Aβ)的產生[6]。雖然肽類抑制劑具有良好的生物相容性,且毒副作用小等優勢,但是肽類抑制劑相對分子質量較大,生物穩定性差,口服利用率低,且不容易通過血腦屏障[7]。因此,小分子化合物抑制劑成為近年來研究BACE1抑制劑一大熱點。與之前的肽類抑制劑相比較,它們具有相對分子質量小、生物代謝活性穩定、膜通透性好等特點。目前,這些非肽類小分子抑制劑一般是通過計算機輔助設計的方法完成的,這種方法大大降低了研發成本,縮短研發周期[8]。本文主要采用分子對接方法,利用AutoDock4.2軟件[9]將20種吡咯烷酮類螺環化合物抑制劑對接到了BACE1的活性中心。基于分子對接方法得到的抑制劑在BACE1活性中心的結合構型,分析了影響抑制劑生物活性的主要因素,揭示其與 BACE1 的作用機制,為抑制劑的設計優化和結構改造提供了重要參考。
1 計算方法
1.1 分子對接
人們已經通過實驗的方法得到了BACE1的晶體結構,BACE1晶體結構在蛋白質數據庫中的PDB編碼為3UDH。我們首先從PDB數據庫中下載了BACE1的晶體結構3UDH。實驗得到的BACE1的晶體結構3UDH的活性中心中含有配體小分子,我們通過Chimera[10]軟件將配體小分子從蛋白質的活性中心剝離。然后使用AutoDock4.2軟件將晶體結構中的水分子刪除,由于實驗得到的晶體結構中并不包含氫原子,在AutoDock4.2軟件中我們對BACE1的極性基團進行加氫處理。并在AutoDock4.2軟件中對蛋白質進行了電荷計算。
本文中所有的分子對接過程均是在AutoDock4.2軟件中完成的。20個抑制劑分子與BACE1的分子對接中,所有的對接格點間隔均設為0.375,所構建的對接盒子大小為42×48×54,中心(x,y,z)設置為20.86,35.66,40.68。所有的分子對接過程均采用剛性對接,即在對接模擬中BACE1的蛋白結構保持不變。本文中所有對接均采用拉馬克遺傳算法(LGA)。在RMSD為2.0?下對對接結果進行構象聚類收集。
1.2 小分子構建
為了研究小分子抑制劑與BACE1的結合機制,我們基于吡咯烷酮類螺環化合物構建了20個小分子BACE1抑制劑,如表1所示。我們將構建的20個BACE1抑制劑采用分子對接方法對接到了BACE1的活性中心。對接過程中,我們考慮了所構建的BCAE1抑制劑所有可以自由旋轉的共價鍵,使抑制劑分子在對接過程中能夠自由旋轉的鍵達到最大值。
2 結果
2.1 BACE1活性中心結構

圖1 BACE1及其活性口袋
我們首先使用Chimera軟件對BACE1的晶體結構進行了,β-分泌酶的活性口袋由Leu30、Asp32、Ser35、Pro70、Tyr71、Thr72、Gln73、Phe108、Trp115、Ile118、Tyr198、Ile226、Asp228、Thr231、Arg235、Val332等殘基構成。
2.2 抑制劑與BACE1之間的結合能
為了考查抑制劑分子與BACE1之間的作用機制,我們使用Autodock4.2分子對接模擬軟件,將20種BACE1抑制劑小分子分別對接到了β-分泌酶的活性中心,得到了20種抑制劑分子與BACE1結合的結合能,如表1所示。
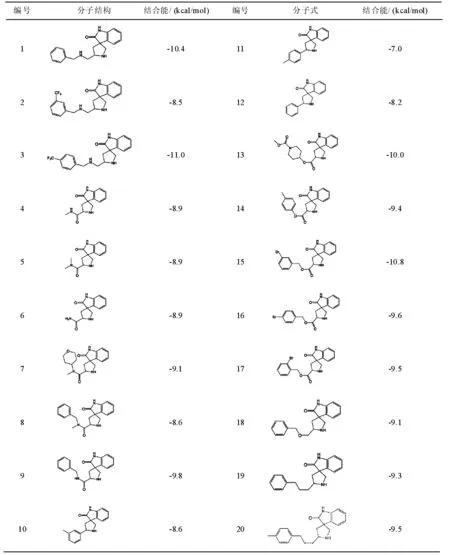
表1 抑制劑分子式及與BACE1對接的結合能
2.3 抑制劑在BACE1活性中心的結合構象
為了考查抑制劑分子在BACE1結合位點的構象,我們將對接結果在均方根偏差RMSD為2.0?的條件下進行了構象聚類分析,將聚類分析得到的構象最大簇在BACE1的活性口袋進行了構象重疊,如圖2所示。此外,為了探究抑制劑分子與BACE1的結合機制,我們選取了每組對接結果中的一個典型構型進行了分析,將每組對接結果的典型構型在BACE1的活性中心顯示,如圖3所示。

圖2 抑制劑小分子在活動中心對接結果重疊圖
3 討論
經Chimera軟件分析可知,BACE1活性口袋中的Leu30、Pro70、Thr72、Phe108、Trp115、Ile118、Ile226、Thr231、Val332等疏水性殘基構成了β-分泌酶活性口袋的疏水通道。
抑制劑分子與BACE1之間的結合能越大,抑制劑分子越容易與BACE1結合。由表1可知,抑制劑分子1、3、13、15與BACE1的之間的結合能較大,它們分別是-10.4、-11.0、-10.0、-10.8 kcal/mol;說明這幾個抑制劑分子能夠很好的與BACE1結合,具有很好的生物活性;而抑制劑分子11、12與BACE1的結合能較小,分別為-7.0、-8.2 kcal/mol,說明這幾個抑制劑分子與BACE1的結合能力較弱。
由圖2可知,20種抑制劑被很好的對接到了BACE1的活性中心,且得到的對接結果都能夠很好的重疊。同時,BACE1活性口袋中的Leu30、Pro70、Thr72、Phe108、Trp115、Ile118、Ile226、Thr231、Val332等疏水性殘基構成的疏水通道很好的將抑制劑分子中的疏水性基團包裹。小分子中的疏水性基團與活性口袋中的等疏水性殘基形成了疏水作用區域,使得受體小分子被包裹在疏水口袋中,從而使小分子被很好的對接到了BACE1的活性口袋中,這種作用有利于構象的穩定。
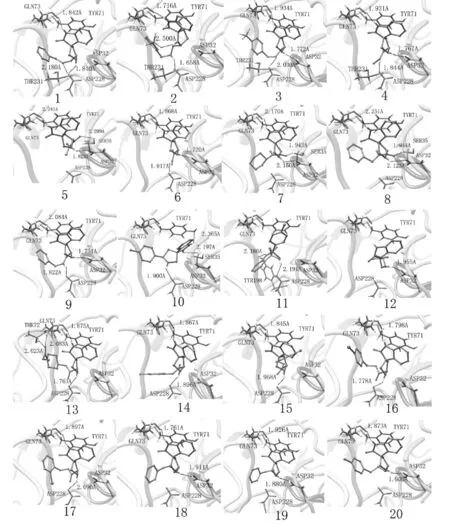
圖3 每組最優結果與活性中心對接構象
從圖3中可知,20種抑制劑分子母體吡咯烷酮亞氨基上的H與活性中心Gln73上的羰基之間形成了非常強的氫鍵作用,這是抑制劑能夠抑制BACE1活性的一個主要因素。此外,抑制劑母體吡咯環上的亞氨基較容易與Asp32上的羧基形成強的氫鍵作用。當抑制劑分子取代基上含有氨基或亞氨基時,取代基上的氨基或亞氨基也較容易和Asp228上的羧基之間形成氫鍵。抑制劑與BACE1活性中心形成的氫鍵網絡將抑制劑分子固定在BACE1的活性中心。這與實驗得到的結論一致[11]。
抑制劑分子與β-分泌酶形成的氫鍵有利于抑制劑小分子與β-分泌酶的結合,降低抑制劑分子與BACE1結合的結合能。由圖3可知,抑制劑分子3除了母體中的吡咯烷酮環上的亞氨基與Gln73形成氫鍵之外,還有另外兩個氫鍵生成,分別是吡咯環上的亞氨基與Asp228生成的氫鍵,以及抑制劑分子取代基上的亞氨基與活性口袋中的Asp228的羰基形成的氫鍵。抑制劑分子3與BACE1之間形成了一個非常強的氫鍵網絡,使抑制劑分子3較容易與BACE1結合,這也是抑制劑分子3與BACE1結合能較低的一個關鍵因素。而抑制劑分子12僅僅只有母體吡咯烷酮、吡咯環上的亞氨基與活性口袋中的Gln73、Asp228形成氫鍵,抑制劑分子12與BACE1之間形成的氫鍵數量較少,這也是抑制劑分子12與BACE1之間結合能較高的一個主要因素。
此外,活性口袋Tyr71側鏈上的苯基還與抑制劑吡咯烷酮核心結構上的苯基以面對面相互平行的方式朝向,兩個苯基之間生成了芳香交互作用,形成了π-π重疊相互作用。π-π堆積作用的形成有利于抑制劑在BACE1活性中心的穩定性,增強吡咯烷酮類螺環化合物抑制劑的生物活性。本文研究結果與實驗報道的結果一致,為以后研究以螺吡咯烷酮核心結構為母體、以β-分泌酶為靶標的新型藥物開發提供了機理支持及指導。
4 結論
本文利用AutoDock4.2程序研究了吡咯烷酮類螺環化合物抑制劑與BACE1之間的作用機制。發現抑制劑與活性口袋中的Gln73、Asp228、Asp32之間形成了非常強的氫鍵網絡。此外,BACE1活性中心Tyr71側鏈上的苯環與抑制劑母體中的苯環形成了π-π堆積作用。π-π堆積作用是吡咯烷酮類螺環化合物與BACE1之間作用的一個典型結構特征。

