單一神經囊泡的電分析化學研究
齊擦毛吉 沙正悅 李鮮嬋

摘?要?近年來,神經活動過程中化學遞質的儲存、釋放和作用規律成為研究熱點。神經囊泡作為執行化學遞質儲存和釋放的主要亞細胞器,一直備受關注。與常見的囊泡分析技術相比,電分析化學方法由于具有較高的時間分辨率和靈敏度,特別是微納米電極的使用,使電分析化學在單一神經囊泡的分析方面顯示出獨特的優勢。近年來,單囊泡電化學計數法和阻抗脈沖法在單囊泡分析方面的研究進展迅速。單囊泡電化學計數法基于電場作用下囊泡膜在電極表面破裂,可實現單一囊泡內儲存神經遞質的定量分析。阻抗脈沖法可通過測定囊泡通過微納米孔時引起的離子電流信號的變化,研究囊泡的尺寸、表面電荷、濃度及柔韌性等參數或特性。本文以單一神經囊泡分析為切入點,介紹了近年來單囊泡電化學計數法與阻抗脈沖法在單一囊泡分析領域的重要進展,展望了這兩種方法在神經化學和生物醫學等領域的應用前景。
關鍵詞?腦科學; 神經囊泡; 電分析化學; 單囊泡原位電化學計數法; 阻抗脈沖法; 評述
1?引 言
近年來, 腦科學的研究得到了越來越廣泛的關注。利用化學、物理和數學等現代技術和方法,研究神經活動中化學物質的釋放和作用規律,已成為在分子水平上研究腦及整個神經系統結構及其功能物質基礎的重要領域。
神經元細胞間的信號傳遞是高等生物(包括人類)發揮其高等認知功能的基礎,如感知、識別和記憶等。在神經系統中,胞吐是神經元間化學信息傳遞的關鍵過程。囊泡在突觸前神經元內裝載神經遞質,如多巴胺、腎上腺素、去甲腎上腺素、血清素、神經肽等,隨后通過多步復雜的生理學過程,包括錨定、成熟、膜融合、釋放等,將裝載的神經遞質釋放到突觸間隙,完成細胞胞吐過程; 被釋放的神經遞質在突觸間隙中被突觸后神經元膜受體識別并攝入,從而完成了神經元間化學信息的傳遞。由此可見,囊泡是執行胞吐的主要亞細胞器,在神經信號轉導方面發揮著至關重要的作用[1,2]。
神經囊泡的物理化學性質,如形態、大小、表面電荷及儲存和釋放神經遞質等,與其生理功能密切相關。研究者通過引入光學標記分子,采用光譜成像的方法對胞吐過程進行研究,這些光學方法在研究胞吐過程中突觸前膜與囊泡膜相互作用、特異蛋白的參與等方面發揮了重要作用[3~5]。但上述方法也存在一些不足,如時間分辨率低(亞秒級至毫秒級)、標記率低、熒光分子易淬滅、定量困難等。1991年, Wightman等建立的單細胞電流法,實現了胞吐過程中單囊泡釋放神經遞質的定量、動態、快速分析[6,7]。隨后的20多年來,研究者用此方法研究了藥物、環境因素等對囊泡釋放神經遞質的影響[8~14]。
近年來,單囊泡電化學計數法的建立和發展,使得單囊泡儲存神經遞質的定量檢測成為可能; 同時,阻抗脈沖法在單囊泡分析方面的初步進展,也促進了其在單囊泡研究領域的應用。本文綜述了近年來這兩種電分析方法在單囊泡分析中的主要研究進展及發展前景。
2?單囊泡原位電化學計數法
2013年,J.E. Rothman, R.W. Schekman 和 T.C. Südhof教授由于研究細胞胞吐主要過程的杰出貢獻而被授予了諾貝爾生理醫學獎,但是關于胞吐的最后一步,即囊泡中的所有遞質在最后一刻是否全部被釋放到突觸間隙,仍存在很大的爭議。為了回答此問題,需要比較囊泡內儲存神經遞質的量以及胞吐過程中囊泡釋放神經遞質的量兩個參數。單細胞電流法的長足發展及應用使得胞吐過程中單囊泡釋放神經遞質的定量分析技術已很成熟。在以往的研究中,研究者通常直接用測得的囊泡釋放神經遞質的量作為其儲存神經遞質的量進行分析,也就是說一般認為胞吐過程中神經遞質會被全部釋放到突觸間隙(全釋放模式)。而越來越多的文獻報道,不同條件下,如不同生理條件[15~19]、刺激物種類和刺激的間隔不同[20~22], 胞吐釋放神經遞質的量是不同的,這也表明胞吐并不是“全有或全無”的過程。因此,發展單囊泡儲存神經遞質的直接定量分析方法對于研究胞吐過程中神經遞質的釋放行為至關重要。
近十年來,瑞典哥德堡大學的Ewing等組在單囊泡內包被神經遞質的定量分析研究方面做出了一系列原創性的工作[23~34],先后發展了毛細管電泳電化學計數法、單囊泡電化學計數法和單囊泡原位電化學計數法,用于單囊泡的電化學分析。
2.1?毛細管電泳?電化學計數法
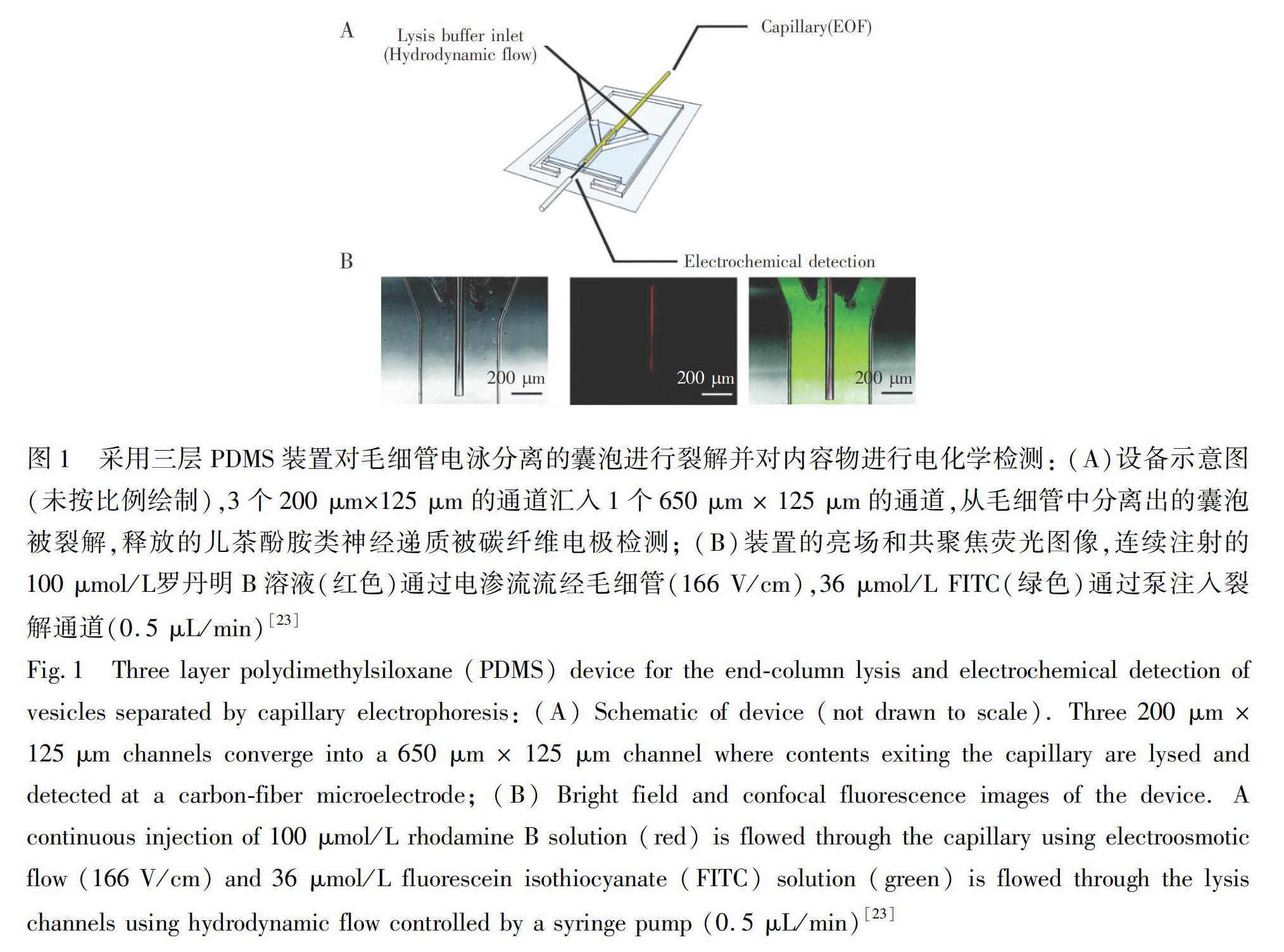
2008年,Omiatek等[23]結合毛細管電泳(CE)、微流控芯片和電化學檢測技術,搭建了首套單囊泡包被神經遞質的定量分析裝置(圖1),將CE分離囊泡、表面活性劑破囊泡膜及微電極檢測包被于囊泡內的神經遞質三個步驟有效地整合在一起。此系統的關鍵在于將CE的毛細管出口固定在PDMS制備的微流控芯片上。此外,在出口處引入高濃度的十二烷基磺酸鈉的囊泡膜裂解液,并巧妙放置柱狀碳纖維微電極,使得在毛細管內通過電場分離出的單個囊泡,被裂解液破膜,隨后神經遞質被電極完全檢測,從而通過多步過程實現了單一囊泡儲存神經遞質的定量測定。采用此方法成功地實現了大鼠腎上腺嗜鉻細胞瘤細胞(PC12細胞)和鼠腦組織中分離出的神經囊泡內包被神經遞質的定量分析[24,25]。然而,此裝置復雜、難于操控,很難推廣。
2.2?單囊泡電化學計數法
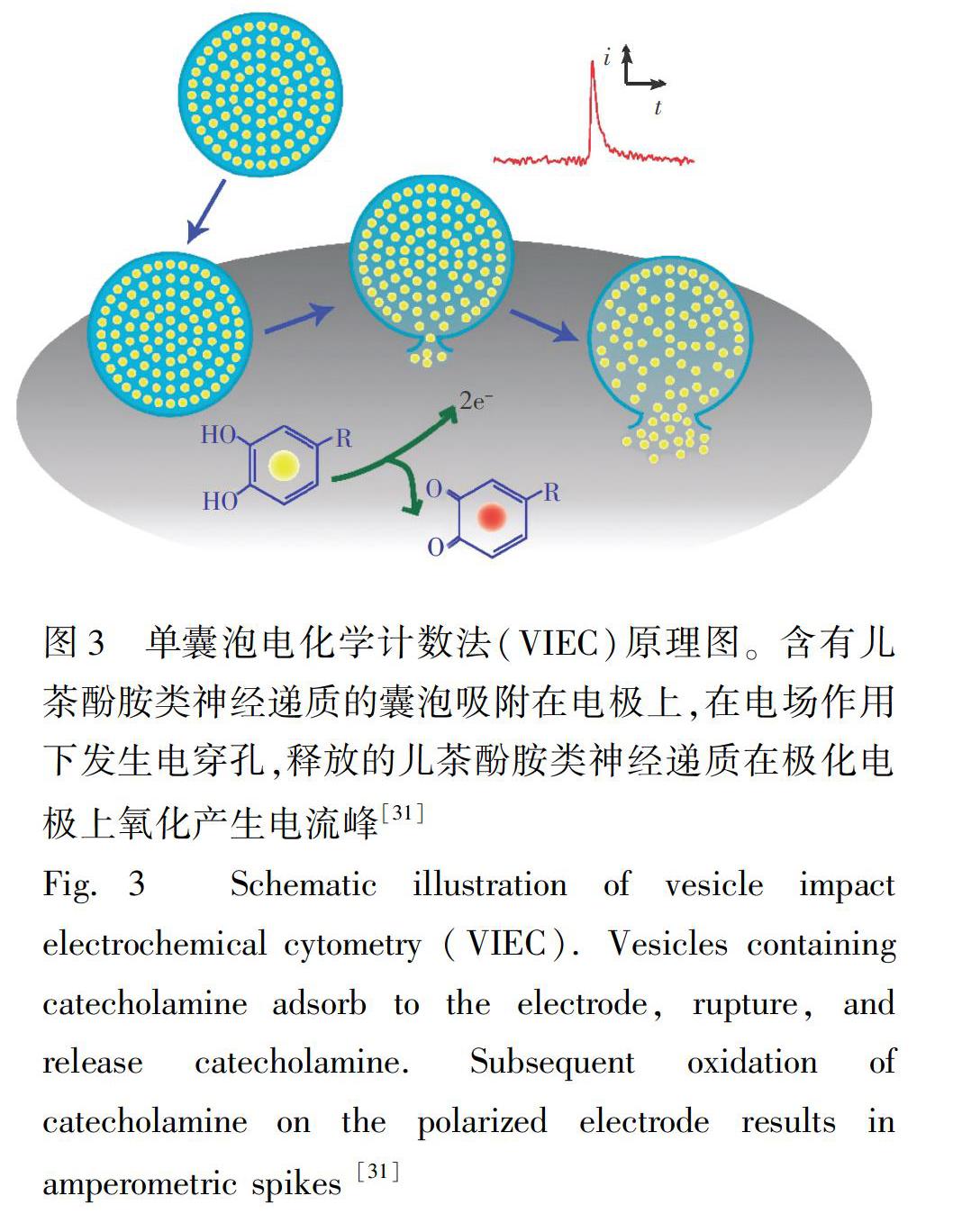
2015年,Dunevall等[26]發展了一種更簡單、可靠的分析方法,即單囊泡電化學計數法(Vesicle impact electrochemical cytometry, VIEC),不需要預先進行電泳分離即可裂解電極表面的單個囊泡,實現單囊泡內包被神經遞質的定量分析。在此方法中,從腎上腺髓質中分離出的腎上腺嗜鉻囊泡在直徑33 μm的盤狀碳電極上發生反應,囊泡內包被的兒茶酚胺類神經遞質被電極電化學氧化,從而實現檢測(圖2), 圖2中每個電化學電流峰對應于1個囊泡在電極上破裂。采用法拉第方程(N=Q/nF)可計算出單個囊泡內儲存神經遞質的量。與胞吐過程中腎上腺嗜鉻細胞釋放神經遞質的量進行統計學比較發現,囊泡中包裹兒茶酚胺類神經遞質的量遠比胞吐釋放的量多。研究者還進行了石英晶體微天平實驗,為囊泡的吸附和破裂提供了證據。
此后,研究者陸續開發了一系列的單囊泡電化學計數法[27~39]。美國德克薩斯州大學奧斯汀分校的Bard研究組[35]與英國牛津大學的Compton研究組發展了相似的方法,定量分析了人工磷脂囊泡內包被化學物質的量[36~38]。研究單囊泡電化學計數法中囊泡破裂、電化學檢測的原理對于確認此方法是否能準確測定囊泡的全部內容物至關重要,同時對于囊泡膜生物物理學研究具有重要意義。
分析VIEC中電流峰發現,相當比例的電流峰起始部分存在與胞吐電流峰類似的前肩峰 (Pre?spike foot),提示在VIEC過程中,囊泡在電極表面形成了一個短暫的納米小孔[31]。數學模擬實驗結果顯示,不同形狀、尺寸的電極上,納米小孔發生的位置對電極上檢測到釋放神經遞質的比例(收集效率)有不同程度的影響[33]。例如,對于直徑33 μm的碳纖維盤電極,開孔發生在囊泡的任何位置上,收集效率均接近100%,這是因為納米級囊泡相對于33 μm的碳纖維盤電極很小,無論囊泡膜哪個位置破裂形成小孔,釋放的神經遞質都會被電極捕獲; 然而,在碳纖維錐電極(長度約4 μm, 底部直徑約1.5 μm)上,開孔發生在電極近端收集效率達到100%,但是開孔發生在電極遠端時收集效率約為75%。 Li等[33]的研究結果表明, 在兩種電極上檢測到的囊泡內容物基本吻合,這也就說明VIEC過程中開孔發生在電極表面。另外,Lovric等[29]的研究表明,VIEC中記錄到的峰頻率隨電極上施加電位(500~900 mV,參比電極為Ag/AgCl)的增大而增高。 這兩方面的結果提示, 在VIEC過程中,電穿孔可能是囊泡膜破裂的主要驅動力。
利用熒光基團修飾膜脂質,可以使囊泡膜在電極表面更容易發生電穿孔。進一步研究發現,熒光基團連接在脂質尾部比連在脂質頭部,會促使囊泡更容易在電極表面破裂。這可能是因為熒光基團在激發光作用下,誘導產生活性氧,從而導致膜磷脂性質發生改變和/或形成水缺陷,使電穿孔更容易發生,而熒光基團處于膜磷脂雙分子層內部時這種作用最強[30]。
此外,通過比較人工磷脂囊泡、人工肽修飾囊泡和哺乳動物囊泡在VIEC中的電流峰的動力學參數,研究者發現,隨著膜內多肽或者膜蛋白比例的增大,囊泡在電極上破裂釋放神經遞質的速度減慢,其中,腎上腺嗜鉻囊泡比人工磷脂囊泡的破裂速度慢10倍以上,表明膜蛋白的存在阻止了電穿孔的發生[29]。將實驗溫度從6℃提高到30℃后,囊泡在電極上破裂的可能性增大約1倍,這可能是因為溫度升高使得囊泡膜內膜蛋白在磷脂雙分子層中運動速率增大,因而使得膜磷脂與電極緊密結合的可能性增大,從而更容易誘發電穿孔的形成[31]。同時,研究發現,尺寸較大的囊泡在VIEC電極上破裂得更早、更頻繁; 同樣地,用多巴胺合成前體L?DOPA處理細胞,從而改變囊泡的尺寸,也觀察到了同樣的趨勢。這可能是因為囊泡與電極接觸面積越大,囊泡膜磷脂與電極形成緊密結合的點位越多,更容易發生電穿孔[31,39]。
對VIEC原理進行小結,通過掃描電鏡表征、尺寸分析、施加電位分析、理論模擬及數據分析等,推導出VIEC中囊泡在電極表面可能經歷了吸附、膜蛋白遷移、電穿孔、神經遞質釋放和電化學定量檢測5個主要步驟(圖3)[31,33]。
2.3?單囊泡原位電化學計數法
為了在活細胞內直接檢測神經囊泡內容物,Li等[27]通過有效地設計和利用納米尖端碳纖維錐電極,進一步發展了單囊泡原位電化學計數法(Intracellular vesicle impact electrochemical cytometry, IVIEC),在活PC12細胞內,實現了囊泡內包被的神經遞質多巴胺的定量檢測。在此方法中,使用納米尖端的碳纖維錐電極插入細胞膜,電極側壁有足夠的反應場所供囊泡在其表面發生一系列過程,釋放出的神經遞質在電極上發生電化學反應而實現了定量檢測(圖4)。此方法是目前可以在活細胞內對納米級尺寸囊泡包被神經遞質定量分析的唯一方法。通過與單細胞電流法檢測的胞吐中囊泡釋放神經遞質的量比較,發現PC12細胞胞吐過程中,大部分囊泡未釋放出其所包被的全部神經遞質,平均釋放比例為64%。此研究結果揭示了胞吐并不是“All?or?None”的量子過程,且部分釋放模式是胞吐的主要方式。
單囊泡原位電化學計數法與單細胞電流法結合,有助于了解胞吐機制及影響該過程的不同因素[28,32,34,40],可以為神經信號轉導的研究提供強有力的技術手段。目前,這兩種方法的結合被越來越多地應用于研究活細胞的分子過程中[28,41,42],如用于研究Zn2+[32]、姜黃素、抗腫瘤藥物順鉑[43, 44]、麻醉劑可卡因與中樞興奮劑利他靈[45,46]?等對神經信號轉導的調控或影響,并發現這些化學物質對胞吐中囊泡釋放神經遞質的比例有不同程度的影響,且這種影響可能與神經功能密切相關。這意味著胞吐中囊泡釋放神經遞質的比例和速度,可作為神經可塑性研究中一個新的作用靶點。相關內容不是本文評述的重點,這里將不再詳述。
3?阻抗脈沖法
關于囊泡尺寸的測量,目前常用的方法有透射電鏡(Transmission electron microscope,TEM)、動態光散射儀(Dynamic light scattering, DLS)和納米示蹤儀(Nanoparticle tracking analysis, NTA)三種技術。但是,這些方法在單一神經囊泡分析方面存在各種不足。如TEM需要對囊泡進行化學固定,可能會引起囊泡尺寸的變化。DLS和NTA可提供囊泡群的信息,但對單一囊泡的分析仍然很困難。Li等[47]基于納米碰撞原理,發展了一種新的針對納米尺寸人工磷脂囊泡的尺寸定量分析方法。在此方法中,他們利用納米顆粒碰撞到超微電極時,有效電極面積的減少與納米顆粒尺寸直接相關的原理,建立了大批量單人工磷脂囊泡的尺寸定量分析方法。以上4種方法雖各有優缺點,但均是對大批量囊泡的尺寸進行整體的定量分析,不能對單一囊泡進行可控性分析。
由于阻抗脈沖分析法具有簡單、免標記、快速、低成本等優點,基于電阻脈沖原理的納米孔或納米通道傳感器已成為基礎研究和實際應用中對單一囊泡分析的潛在重要技術。多項基于阻抗脈沖法的研究使我們對單一囊泡的多方面性質有了深入的了解,如囊泡尺寸、表面電荷、變形現象及囊泡柔韌性等。
3.1?阻抗脈沖法的原理
阻抗脈沖法的基本原理為:通過在充滿電解質的孔隙中施加電勢,測量通過孔隙產生的離子電流來監測納米顆粒的易位過程。以納米囊泡為例,使用錐形玻璃納米孔對囊泡進行原位檢測。使用玻璃毛細管納米孔內的Ag/AgCl電極作為工作電極,本體溶液中正對納米孔外端的Ag/AgCl電極作為參考電極,對納米孔施加偏壓負電位,囊泡在電場作用下在孔隙中發生易位,取代了孔隙中的電解質溶液,降低了電解質通過孔隙的流量從而改變離子電流(圖5)[48]。單個電流脈沖的振幅ΔI、易位時間Δt與單粒子的物理性質有關(如形態和表面電荷)。利用恒壓下離子電流脈沖信號的周期性變化,可對單個囊泡在錐形玻璃納米孔中的原位動態易位進行清晰的觀察和計算。以電流作為時間的函數,可確定囊泡的濃度、電荷、形狀和大小,以及與孔隙的化學和物理相互作用[49]。
3.2?基于阻抗脈沖法的囊泡性質研究進展
3.2.1?囊泡易位的溫度依賴性?Holden等[49]基于阻抗脈沖法,采用單個錐形納米孔實現了多層磷脂囊泡易位過程的直接測量,為了解磷脂囊泡隨溫度變化的特性提供了依據。他們主要研究了半徑為190~450 nm的多層磷脂囊泡通過嵌入在玻璃膜中的單個錐形納米孔的易位行為,發現通過調整納米孔的尺寸和溶液溫度,可實現不同尺寸多層磷脂囊泡的可控性通過。因人工磷脂囊泡通過納米孔時阻抗增大,使得離子電流發生顯著性降低,利用此原理可以逐一檢測單一囊泡通過納米孔的動態過程。多層磷脂囊泡在納米孔中的易位具有溫度依賴性,在高于其轉變溫度(41℃)時,脂質雙分子層處于一種柔性的流體狀態,能夠變形和易位,而在轉變溫度以下,脂質雙分子層相對來說是剛性的,能夠堵塞孔隙。該研究結果表明,人工磷脂囊泡與傳統的無機或有機硬納米顆粒通過納米孔的易位行為不同,利用阻抗脈沖法可定量研究囊泡易位的機理和動力學過程。
3.2.2?施加電壓可改變囊泡易位分析的靈敏度?研究發現,人工磷脂囊泡在納米孔中的易位過程受施加電位的驅動和控制[50]。研究者采用直徑約250 nm的單錐孔納米管,在單電位驅動下對直徑為140 nm的人工磷脂囊泡進行了易位實驗。當囊泡從本體溶液側接近納米管孔并進入錐形側時,在靠近尖端的感應區占據了電解質溶液的有限位置,導致離子電流下降,記錄的電流脈沖的高度、寬度和頻率可反映粒子的大小及濃度。他們利用阻抗脈沖原理,建立了納米磷脂囊泡電壓驅動計數原理,系統地研究了外加電壓對易位事件頻率、易位速度和停留時間的影響(圖6)。研究結果表明,靜電場是磷脂囊泡通過納米管孔易位過程的主要控制因素之一,施加電壓對囊泡分析的靈敏度有顯著影響,可作為一個重要的調節參數。研究結果為磷脂囊泡的易位和分析提供了新的視角,同時證明了納米孔可作為一種操作簡便的囊泡計數平臺,有望用于可植入的活細胞囊泡分析方法。
3.2.3?囊泡易位過程中的電致形變現象?Darvish等[51]比較了聚乙烯納米球和人工磷脂囊泡在相同條件下通過納米孔電極的過程,發現人工磷脂囊泡通過納米孔時引起的離子電流降顯著低于硬聚乙烯納米球。外加電位1 V時,直徑75 nm聚乙烯納米球通過納米孔引起的電流降是同尺寸人工磷脂囊泡的3倍。此結果說明,人工磷脂囊泡通過納米孔時與硬聚乙烯納米球行為不同。
納米級人工磷脂囊泡通過納米孔時電流脈沖信號的電壓依賴行為,說明磷脂囊泡在納米孔內可能存在電致形變現象,即納米磷脂囊泡通過納米孔時,受到一個類似于直流脈沖的強電場,而這種強直流脈沖可使磷脂囊泡發生形變。為了更好地了解人工磷脂囊泡通過納米孔的變形程度及變形的基本機理,研究者以直徑100 nm的人工磷脂囊泡為模型分析物,通過改變囊泡膜磷脂組成制備了不同硬度的磷脂囊泡,研究了其通過納米孔時的電致形變現象(圖7)[51]。結果表明,柔韌性不同的人工磷脂囊泡通過納米孔的電流脈沖特征有顯著差異。通過對不同電壓下電流脈沖高度進行歸一化處理并進行比較,研究者發現磷脂囊泡通過納米孔的變形現象是由孔內電場引起的。另外,研究者采用有限元模擬方法求解了人工磷脂囊泡在納米孔內變形的有效長徑比,量化了磷脂囊泡在納米孔內的變形程度。
此項研究表明,固體納米孔的阻抗脈沖傳感技術可以很好地用于表征納米磷脂囊泡的機械剛性。從中也可知道,納米孔內磷脂囊泡的形狀(近似橢球形)可能與溶液中磷脂囊泡的形狀(球形)有很大的不同,這將影響阻抗脈沖傳感技術用于神經囊泡的尺寸測量。這些發現有可能將納米孔阻抗脈沖傳感技術轉變為一種新的分析工具,用于研究納米尺度囊泡的生物物理性質,特別是了解軟納米顆粒的變形及柔韌性等特性。
3.2.4?納米孔表面特性影響囊泡易位過程?Chen等[48]采用阻抗脈沖法研究了單層磷脂囊泡(SUVs,直徑約50~60 nm)在錐形玻璃納米孔(直徑約14~72 nm)中易位的動力學過程。SUVs作為囊泡模型進,其易位行為可能不同于多層磷脂囊泡,且SUVs的結構更接近于神經囊泡。研究發現,SUVs的易位受納米孔大小、溶液pH值、囊泡濃度和施加電壓等影響。特別值得一提的是,作者研究了納米孔內表面性質對囊泡易位過程的影響,發現使用縮水甘油醚氧基丙基三甲氧基硅烷(GPTMS)或聚?L?組氨酸(PLH)對玻璃納米孔內表面改性后,囊泡易位發生顯著變化(圖8)。當納米孔內表面不經修飾時,表面帶負電荷,SUVs通過納米孔時的電流?時間振蕩曲線規則,表明單個完整的SUV依次地易位通過納米孔(圖8A)。在PLH修飾的玻璃納米孔中,納米孔內表面帶正電荷,由于帶負電的SUVs與帶正電的納米孔表面之間的靜電相互作用,錐形玻璃納米孔內表面可能會捕獲并破壞SUVs的完整結構,從而導致納米孔內易位的只是被洗脫的不規則的小囊泡或破碎的片段(而非完整的SUVs),這反映為電流?時間曲線中的“反向”小而快的電流振蕩 (圖8C)。然而,經GPTMS改性后,玻璃納米孔的內表面呈中性,但界面略呈疏水性。因為SUVs表面的磷酸基團使其在pH 7.4的水溶液中呈親水性,所以將單個SUV驅趕出GPTMS修飾的疏水納米孔需要更長的時間,如圖8B所示。此研究表明不同的帶電表面會影響SUVs在玻璃納米孔中的易位行為。該檢測平臺為利用SUVs 與納米孔相互作用的不同來區分不同類型的SUVs 提供了可能。
4?總結與展望
單囊泡原位電化學計數法和阻抗脈沖分析法在單囊泡神經遞質的定量檢測、囊泡的尺寸及表面性質的研究等方面有了一些突破性的進展,在單一神經囊泡的電化學分析研究中表現出巨大的研究潛能,為在單囊泡水平研究神經信號轉導提供了新的研究手段和發展契機。未來,將這些電化學分析方法與其它先進的分析手段有效結合,更好地發揮電化學分析方法高時空分辨的優點,實現單一囊泡的原位、動態、高通量分析是單囊泡分析領域重要的研究方向之一。這些研究將有助于理解神經囊泡在生理及病理過程中的重要功能,為研究腦科學及其它生物醫學領域重要過程提供強有效的研究手段。
References
1?Huang H, Liu S, Kornberg T B. Science, 2019, 363(6430): 948-955
2?Awasthi A, Ramachandran B, Ahmed S, Benito E, Shinoda Y, Nitzan N, Heukamp A, Rannio S, Martens H, Barth J, Burk K, Wang Y T, Fischer A, Dean C. Science, ?2019, ?363(6422): eaav1483
3?Wilhelm B G,Mandad S, Truckenbrodt S, Kroehnert K, Schaefer C, Rammner B, Koo S J, Classen G A, Krauss M, Haucke V, Urlaub H, Rizzoli S O. Science, ?2014, ?344(6187): 1023-1028
4?Willig K I, Rizzoli S O, Westphal V, Jahn R, Hell S W. Nature, ?2006, ?440(7086): 935-939
5?Saviane C, Silver R A. Nature, ?2006, ?439(7079): 983-987
6?Kawagoe K T, Jankowski J A, Wightman R M. Anal. Chem., 1991, ?63(15): 1589-1594
7?Wightman R M, Jankowski J A, Kennedy R T, Kawagoe K T, Schroeder T J,Leszczyszyn D J, Near J A, Diliberto E J, Viveros O H. Proc. Natl. Acad. Sci. USA, ?1991, ?88(23): 10754-10758
8?Finnegan J M,Pihel K, Cahill P S, Huang L, Zerby S E, Ewing A G, Kennedy R T, Wightman R M. J. Neurochem., ?1996, ?66(5): 1914-1923
9?Mosharov E V, Sulzer D. Nat. Methods, ?2005, ?2(9): 651-658
10?Trouillon R, Ewing A G. Anal. Chem., ?2013, ?85(9): 4822-4828
11?Li Y T, Zhang S?H, Wang X Y, Zhang X W, Oleinick A I, Svir I, Amatore C, Huang W H. Angew. Chem. Int. Ed., ?2015, ?54(32): 9313-9318
12?Majdi S, Berglund E C, Dunevall J, Oleinick A I, Amatore C, Krantz D E, Ewing A G. Angew. Chem. Int. Ed., ?2015, ?54(46): 13609-13612
13?Li X, Mohammadi A S, Ewing A G. J. Electroanal. Chem., ?2016, ?781: 30-35
14?Wang K, Zhao X, Li B, Wang K, Zhang X, Mao L, Ewing A, Lin Y. Anal. Chem., ?2017, ?89(17): 8683-8688
15?Sombers L A, Maxson M M, Ewing A G. J. Neurochem., ?2005, ?93(5): 1122-1131
16?Borges R, Travis E R, Hochstetler S E, Wightman R M. J. Biol. Chem., ?1997, ?272(13): 8325-8331
17?Camacho M, Machado J D, Montesinos M S, Criado M, Borges R. J. Neurochem., ?2006, ?96(2): 324-334
18?Haynes C L, Siff L N, Wightman R M. BBA?Mol. Cell Res., ?2007, ?1773(6): 728-735
19?Machado J D, Morales A, Gomez J F, Borges R. Mol. Pharmacol., ?2001, ?60(3): 514-520
20?Calvo?Gallardo E, López?Gil , Méndez?López I, Martínez?Ramírez C, Padín JF, García A G. J. Neurochem., ?2016, ?139(5): 722-736
21?Pothos E N, Mosharov E, Liu K?P, Setlik W, Haburcak M, Baldini G, Gershon M D, Tamir H, Sulzer D. J. Physiol., ?2002, ?542(2): 453-476
22?Elhamdani A, Palfrey H C, Artalejo C R. Neuron, ?2001, ?31(5): 819-830
23?Omiatek D M, Santillo M F, Heien M L, Ewing A G. Anal. Chem., ?2009, ?81(6): 2294-2302
24?Omiatek D M, Dong Y, Heien M L, Ewing A G. ACS Chem. Neurosci., ?2010, ?1(3): 234-245
25?Omiatek D M, Bressler A J, Cans A S, Andrews A M, Heien M L, Ewing A G. Sci. Rep., ?2013, ?3: 1447
26?Dunevall J, Fathali H, Najafinobar N, Lovric J, Wigstrm J, Cans A S, Ewing A G. J. Am. Chem. Soc., ?2015, ?137(13): 4344-4346
27?Li X, Majdi S, Dunevall J, Fathali H, Ewing A G. Angew. Chem. Int. Ed., ?2015, ?54(41): 11978-11982
28?Li X, Dunevall J, Ewing A G. Acc. Chem. Res., ?2016, ?49: 2347-2354
29?Lovric J, Najafinobar N, Dunevall J, Majdi S, Svir I, Oleinick A, Amatore C, Ewing A G. Faraday Discuss., ?2016, ?193: 65-79
30?Najafinobar N, Lovric J, Majdi S, Dunevall J, Cans A S, Ewing A. Angew. Chem. Int. Ed., ?2016, ?55(48): 15081-15085
31?Li X, Dunevall J, Ren L, Ewing A G. Anal. Chem., ?2017, ?89(17): 9416-9423
32?Ren L, Pour M D, Majdi S, Li X, Malmberg P, Ewing A G. Angew. Chem. Int. Ed., ?2017, ?56(18): 4970-4975
33?Li X, Ren L, Dunevall J, Ye D, White H S, Edwards M A, Ewing A G. ACS Nano, ?2018, ?12(3): 3010-3019
34?Zhu W, Gu C, Dunevall J, Ren L, Zhou X, Ewing A G. Angew. Chem. Int. Ed., ?2019, ?58(13): 4238-4242
35?Lebègue E, Anderson C M, Dick J E, Webb L J, Bard A J. Langmuir, ?2015, ?31(42): 11734-11739
36?Cheng W, Compton R G. Angew. Chem. Int. Ed., ?2014, ?53(50): 13928-13930
37?Cheng W, Compton R G. ChemElectroChem, ?2016, ?3(12): 2017-2020
38?Cheng W, Compton R G. Angew. Chem. Int. Ed., ?2016, ?55(7): 2545-2549
39?Li X, Dunevall J, Ewing A G. Faraday Discuss., ?2018, ?210(0): 353-364
40?Lovric J, Dunevall J, Larsson A, Ren L, Andersson S, Meibom A, Malmberg P, Kurczy M E, Ewing A G. ACS Nano, ?2017, ?11(4): 3446-3455
41?Phan N T N, Li X, Ewing A G. Nat. Rev. Chem., ?2017, ?1: 0048
42?Ren L, Mellander L J, Keighron J, Cans A S, Kurczy M E, Svir I, Oleinick A, Amatore C, Ewing A G Q. Rev. Biophys., ?2016, ?49: e12
43?Li X, Dunevall J, Ewing A G. Angew. Chem. Int. Ed., ?2016, ?55: 9041-9044
44?Mohammadi A S, Li X, Ewing A G. Anal. Chem., ?2018, ?90(14): 8509-8516
45?Ye D, Ewing A. ChemPhysChem, ?2018, ?19(10): 1173-1179
46?Ye D, Gu C, Ewing A. ACS Chem. Neurosci., ?2018, ?9(12): 2941-2947
47?Li Y, Deng H Q, Dick J E, Bard A J. Anal. Chem., ?2015, ?87(21): 11013-11021
48?Chen L, He H, Jin Y. Anal. Chem., ?2015, ?87(1): 522-529
49?Holden D A, Watkins J J, White H S. Langmuir, ?2012, ?28(19): 7572-7577
50?Liu Y, Xu C, Chen X, Wang J, Yu P, Mao L. Electrochem. Commun., ?2018, ?89: 38-42
51?Darvish A, Goyal G, Aneja R, Sundaram R V K, Lee K, Ahn C W, Kim K B, Vlahovska P M, Kim M J. Nanoscale, ?2016, ?8(30): 14420-14431
Electrochemical Analysis of Single Neuronal Vesicles
QI Camaoji, SHA Zheng?Yue, LI Xian?Chan*
(Center for Imaging and Systems Biology, College of Life and Environmental Sciences,
Minzu University of China, Beijing 100081, China)
Abstract?Brain science has attracted more and more attention in the world recently. The storage, release and their function of chemical transmitters are important in neural biology. As the main subcellular organelle for chemical transmitter storage and release, nerve vesicles have attracted much attention. Compared with common vesicle analysis techniques, electroanalytical chemistry has advantages in the analysis of single nerve vesicle due to its high time resolution and sensitivity, especially the use of micro and nano electrodes. In recent years, vesicle impact electrochemical cytometry (VIEC) and resistive?pulse method have been applied rapidly in the field of single vesicles analysis. VIEC can be used to quantitate the storage of neurotransmitters in single vesicles by breaking the vesicle membrane on the electrode surface through electroporation. Resistive?pulse method can be used to measure the size, surface charge, and other parameters or characteristics of vesicles by monitoring the changes of ion current caused by single vesicles passing through micro/nanopores. Focusing on the electro?analysis of single nerve vesicles, this paper mainly introduces the important progress of VIEC and resistive?pulse method in the field of single vesicles analysis in recent years, and has a briefly outlook of the application of these two methods in life analytical chemistry including neuro?analytical chemistry and biomedicine.
Keywords?Brain science; Nerve vesicles; Electroanalytical chemistry; Vesicle impact electrochemical cytometry; Resistive?pulse method; Review

