離子選擇性電極在腦神經化學活體分析中的研究進展
趙麗君 鄭衛 毛蘭群

摘?要?腦功能的實現需要多種離子的共同參與,因此,在活體層次實時監測腦內離子的動態變化,對于理解許多生理病理事件具有重要意義。離子選擇性電極作為一類電化學傳感器,具有成本低、操作簡單、能耗低等特點,被廣泛應用于活體分析等領域。本文以離子選擇性電極的發展歷程為主線,主要對其基本構造及其在腦神經化學活體分析領域的應用進行了評述。
關鍵詞?離子選擇性電極; 活體分析; 腦神經化學; 評述
1?引 言
腦內信息傳遞及與腦神經相關的各種生理病理過程都有化學物質參與,而腦內的各種離子(如H+、Na+、Mg2+、Ca2+等)對維持中樞神經系統(CNS)的正常生理功能發揮了重要作用[1~10]。例如,腦內H+與細胞生長與凋亡、酶的活性、信號轉導和離子傳輸等密切相關[1,2]。K+對于維持細胞正常的滲透壓、保持細胞正常的形態具有重要作用; 同時,還直接參與神經信號的傳導過程[3,4]。Ca2+是參與基因表達、神經遞質釋放、突觸形成和突觸傳導等生理活動的重要信號轉導元素; 并且,作為第二信使,Ca2+參與了調節肌肉收縮、激素分泌、神經遞質釋放、細胞代謝和細胞凋亡等[5~9]。由此可見,腦內離子的濃度必須維持在一定的穩態范圍內才能實現正常的腦神經活動,任何離子濃度的失衡都會對神經系統造成嚴重的影響[9,11~14]。因此,建立腦內離子動態變化的活體實時分析方法,對于了解腦神經活動的基本過程和神經系統性疾病(如帕金森癥、阿茲海默癥、腦缺血等)的發病機制、探索生命活動的化學本質具有重要意義[4,5,9,15]。早在1968年,Bradbury等[16]就利用火焰原子吸收分光光度法,實現了對腦內Ca2+和Mg2+的檢測。隨著分析方法的不斷發展,目前離子的檢測方法主要有原子吸收光譜法、電感耦合等離子體質譜法、核磁共振和熒光成像等[17~21],然而這些分析方法無法滿足在活體動物水平上進行離子濃度的在線實時檢測的要求[22,23]。與上述方法相比,電化學方法具有儀器設備簡單、操作方便,且可以通過靈活設計電化學界面來實現選擇性和穩定性等優點[24,25]。離子選擇性電極(Ion?selective electrode,ISE)作為一類電化學傳感器,具有體積小、攜帶方便、能耗低、成本低等特點,因此被廣泛應用于生命科學、環境監測和過程控制等領域[26, 27]。此外,使用ISE進行檢測時無需對復雜樣品進行預處理,能夠實現樣品的連續檢測,因此在活體分析領域得到了迅速發展。本文對液體接觸式ISE和固態ISE在活體分析領域的應用進行了綜述。
2?液體接觸式ISE在腦神經化學中的應用
傳統的ISE通常稱為液體接觸式離子選擇性電極,它主要是由敏感膜、內參比溶液、內參比電極和惰性腔體組成。其中,敏感膜是ISE的核心,它能將待測離子的活度轉化為可測量的電位值。敏感膜的種類較多,從最早的玻璃膜、鹵化銀薄膜,逐漸發展到聚合物敏感膜。目前,聚合物膜敏感膜的主要成分是離子載體、離子交換劑、增塑劑和聚合物基體材料。其中,離子載體是敏感膜的重要組成部分,它可與待測離子鍵合形成配合物,從而實現對待測離子的選擇性分析; 離子交換劑主要是親脂性鹽,其作用是促進離子的交換過程,降低帶相反電荷的離子對檢測結果的干擾; 增塑劑能夠增強敏感膜的塑性; 聚合物基體用于保證敏感膜具有良好的機械穩定性。Ag/AgCl電極通常用作ISE的內參比電極。
將液接式ISE插入到含有待測離子的溶液中,由于離子敏感膜只允許待測離子通過,這使得敏感膜內外兩側的離子活度不同,因此待測離子會由高濃度向低濃度擴散,導致敏感膜內外兩側電荷分布不均,產生界面電勢,即為ISE的電極電位。ISE的電極電位與溶液中待測離子的活度遵守能斯特方程:
=φ0+RTzLFlnaL(1)
其中, φ為電極電位, φ0為標準電極電位,aL為待測離子活度,zL為待測離子的帶電荷數,R為氣體常數,T為絕對溫度,F為法拉第常數。當aL=1時,可以得到電極的標準電極電位φ0。當工作電極和參比電極在溶液中組成原電池時,所測原電池的電動勢為:
E=E0+SlnaI(2)
其中,E為測得的電動勢; 當aL=1時,得到電極的標準電動勢E0; S是響應斜率,在理想情況下S=2.3026RT/F。在25℃時,S=59.18/zL。
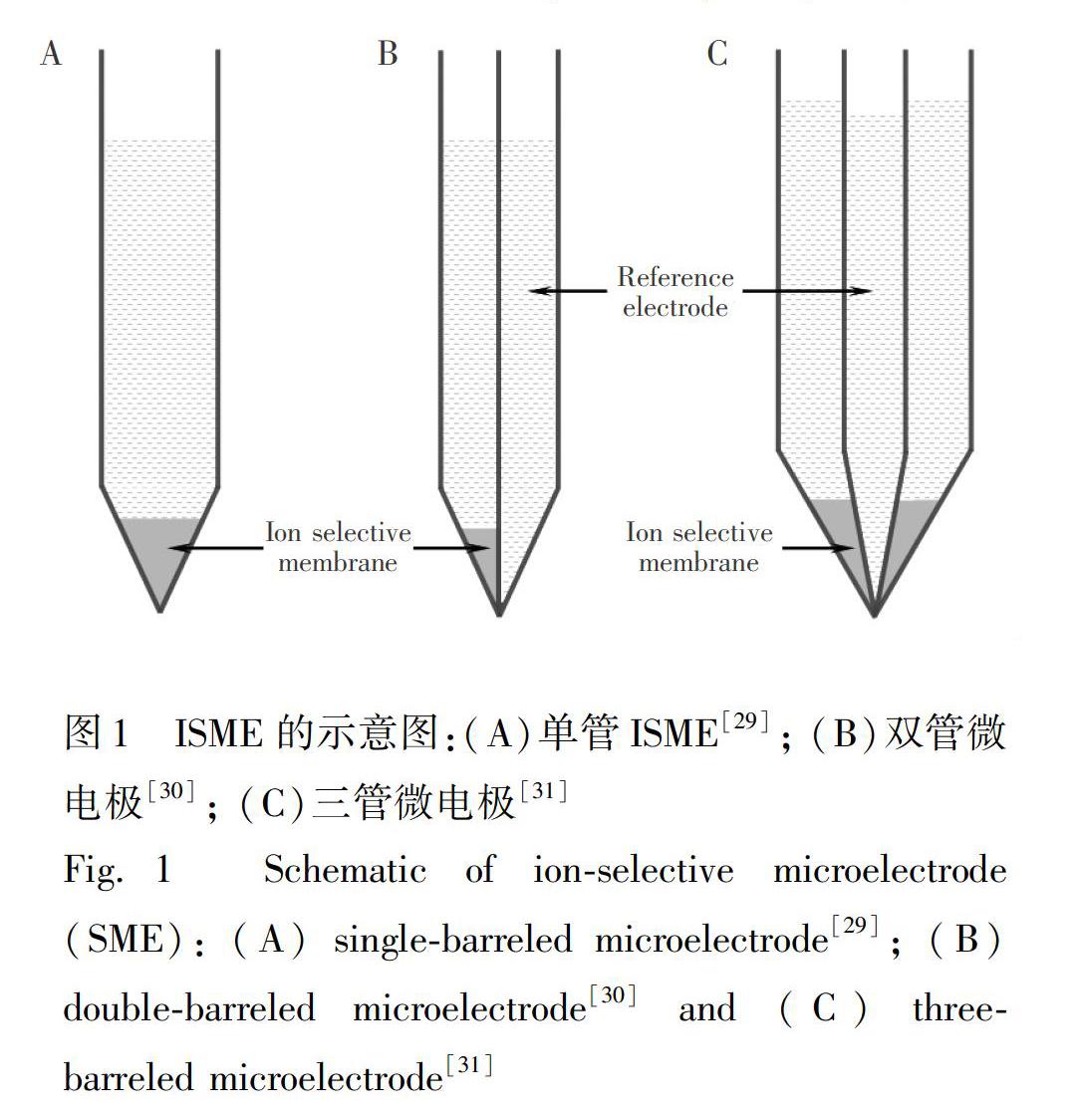
ISE不受待測樣品溶液懸浮物、渾濁度、顏色等因素的影響,且無需樣品分離,因此可直接進行原液或原位的分析。自1959年Hinke等[28]首次將微管電極用于細胞內離子活度的測量以來,基于玻璃管的離子選擇性微電極(Ion?selective microelectrode, ISME)得到了越來越廣泛的應用,特別是在生命科學領域。該類ISME尖端的尺寸可以小到105~106m。在測量時,通常采用兩根玻璃管電極,一根為ISE,尖端填充敏感膜,管內填充內充液,作為指示電極(圖1A)[29], 另一根作為參比電極; 或者直接采用將ISME和參比電極整合在一起的雙管微電極(Double?barreled microelectrode, 圖1B)[30]; 甚至是可實現兩種離子同時檢測的三管微電極(Three?barreled microelectrode, 圖1C)[31]。
2.1?腦片層次
腦內相關神經生理病理過程的研究主要是基于細胞層次、腦片層次和活體層次展開的。其中,細胞層次的研究主要是對相應生理病理模型的神經細胞進行離體培養,然后再以單獨的神經細胞為研究對象,對其進行生物及化學性質的分析。在進行離體培養的體外研究時,神經細胞由于脫離了細胞賴以生存的環境,阻斷了神經細胞與其它細胞之間的相互聯系,因此獲得的研究結果無法還原腦內真實的神經生理病理過程。而腦片層次的研究能夠在一定程度上解決細胞層次研究的局限性,因為單個腦片中包含了研究對象的基本微環境,能夠在一定程度上保留不同細胞之間的神經連接,保證了大腦神經功能的完整性,因此在腦片層次開展腦內離子的研究能夠更加準確的反映出神經生理病理過程的真實情況。
早在1980年,Benninger等[32]就開始利用兩根雙管ISME檢測了海馬腦切片CA1區在順行電刺激下的離子濃度變化,所使用的電極由兩根θ管分別拉制而成(圖2),電極尖端直徑為2~4 μm,K+和Ca2+敏感膜分別采用K+交換樹脂和Ca2+中性載體,發現海馬切片中K+和Ca2+濃度的變化與在體內刺激下獲得的結果相似,該結果對于研究相關離子在腦內微環境中變化的機制和影響具有潛在的應用價值。1983年,Yaari等[33]通過降低大鼠海馬腦切片中的Ca2+濃度來誘導CA1區中的自發癲癇,利用兩根雙管ISME發現癲癇發作期間細胞外Na+濃度降低和K+濃度升高。1987年,Hablitz等[34]用兩根雙管ISME在大鼠新皮質切片上進一步研究了癲癇發作期間細胞外K+和Ca2+的變化。Sick等[35]采用雙管ISME研究了缺氧狀態下海馬腦切片細胞外K+濃度的變化與神經元興奮性的關系。1990年,Mcbain等[36]利用ISME實時測量了四甲基銨根離子(TMA+)在海馬腦切片不同腦區中的擴散情況,并通過擴散方程進行擬合計算得到了細胞外體積分數(EVF),發現CA1區錐體細胞層EVF為0.12,而CA3區的錐體細胞層和顆粒細胞層的EVF分別為0.18和0.15。而且,當海馬腦切片細胞外K+的濃度從3.5 mmol/L升高至8.5 mmol/L時,CA1區的EVF可逆地減少了30%,這主要是由于K+濃度的升高,誘導了CA1區中的自發性癲癇。這些結果表明,海馬腦區不同亞區的細胞外間隙存在差異,這可能是海馬腦區的CA1區在病理條件下更容易遭受損傷的原因。1993年,Leschinger等[37]采用K+濃度升高和Mg2+、Ca2+濃度降低來誘導癲癇發作,利用雙管ISME研究了癲癇發作期間的場電位和細胞外離子濃度的變化。2000年,Holthoff等[38]用ISME研究了電刺激引起的新大腦皮層腦片細胞外間隙和K+濃度的變化,進一步揭示了皮層腦組織的細胞外間隙緩沖機制。由此可見,在腦片層次利用ISME可以實現細胞周圍或完整組織細胞外一種或多種離子的同時檢測,并可結合電生理和膜片鉗等技術,揭示生理病理條件下離子變化機制以及與神經元之間的相互關系。
2.2?活體層次
在腦片層次上開展的與離子相關的研究雖然取得了很多成果,但是由于腦片不能進行長時間培養,因此無法進行長期生理病理過程的研究; 并且在動物死亡過程中細胞也會發生一系列的變化,如細胞膜通透性的改變使得細胞會發生一定程度的水腫。因此,腦片層次上的研究結果不能完全揭示神經系統發生的變化。為了能夠真實地反映出神經系統在各種生理病理過程中對外界刺激的響應,更多的研究者開始在活體層次上開展腦內神經化學物質的研究,這也將使我們可以同時結合行為學研究去更好地認識神經生理病理過程。目前采用ISME開展的針對腦神經化學活體分析的研究主要集中在酸中毒、低血糖癥、癲癇、電刺激、SD和缺血以及物質干預等病理模型引起的離子的變化等方面。
2.2.1?酸中毒?1975年, Heuser等[39]通過兩根ISME連續記錄了貓大腦皮層細胞外pH值和K+濃度的變化。當靜脈注射乙酰唑胺引起腦酸中毒大概10 min后,大腦皮層細胞外pH值下降至0.203±0.0046(n=8),但在該過程中并未發現細胞外K+濃度的變化。該結果與Severinghaus等[40]的觀點相吻合,即碳酸性酸中毒是由乙酰唑胺對腦組織的直接作用引起的。
2.2.2?低血糖癥?Astrup等[41]在1976年使用雙微管ISME(尖端直徑1~2 μm)研究了大鼠發生嚴重低血糖時大腦皮層細胞外的K+濃度變化,發現低血糖引起的腦缺氧會導致大腦皮層中細胞外K+濃度顯著快速增加,表明K+釋放到了細胞外。1984年,Harris等[42]利用三管ISME研究了胰島素誘導的低血糖癥中細胞外Ca2+與K+濃度的變化趨勢以及不穩定化合物三磷酸腺苷(ATP)和磷酸肌酸(PCr)的濃度變化與能量負荷(EC)之間的關系。
2.2.3?癲癇?1977年,Heinemann等[43]用ISME對貓大腦皮層陣發性活動(電刺激或癲癇)中體感皮層細胞外aCa和aK進行了研究,發現重復電刺激對側前爪、丘腦腹外側核和皮層表面時可同時引起aCa的下降和aK的增加,而在癲癇發作期間aCa顯著下降(下降最多可達0.7 mmol/L),而且aCa的下降發生在陣發性放電和aK升高之前。1985年,Siesjo等[44]用ISME研究了癲癇發作和停止后恢復期間大腦皮層細胞內外pH值的變化。
2.2.4?電刺激、SD和缺血?擴散性抑制(Spreading depression, SD)是一種腦內神經細胞去極化后神經活動受到抑制的現象,該過程伴隨離子的重新分布、神經元的腫脹以及神經元和膠質細胞活動的抑制[45~47]。1977年,Nicholson等[48]對大鼠小腦平行纖維?浦肯野細胞回路進行反復電刺激時,用雙管ISME研究了其細胞外Ca2+和K+的濃度變化,發現在該過程中細胞外Ca2+濃度下降到基線濃度的80%左右,K+濃度增加。而在SD過程中和缺氧末期,細胞外Ca2+濃度下降到基線的10%左右。但是,在SD和缺氧過程中,細胞外K+濃度均顯著增加。這些結果表明, 在神經元活動期間,Ca2+濃度會發生變化,并且在SD和缺氧病理模型下Ca2+濃度變化可能是極端的。由于低濃度的Ca2+和K+會影響神經元集合的能力,如細胞外Ca2+濃度的減少會提高軸突的興奮性、減少化學突觸傳遞,因此,他們認為腦細胞外微環境中Ca2+濃度的變化可能是神經元整體行為的重要參數。
Kraig等[49]在1978年利用ISME測定了SD過程中鯰魚小腦細胞外K+、Ca2+、Na+和Cl的濃度變化。他們發現在SD過程中,細胞外K+的濃度從靜息水平的2.3 mmol/L開始上升,大約在K+濃度上升后的20~40 s內(K+濃度超過10 mmol/L時),Ca2+、Na+和Cl的濃度才開始下降。在SD最強烈時,K+上升至35 mmol/L, Ca2+濃度降至0.8 mmol/L(基礎值為2.2 mmol/L),Na+濃度57 mmol/L(基礎值為149 mmol/L),Cl濃度降至47 mmol/L(基礎值為137 mmol/L); 這些結果表明了SD過程中細胞外主要離子濃度變化的幅度和時間順序。1981年,Hansen等[50]用ISME比較了大鼠在SD和缺血兩種情況下大腦皮層間隙離子濃度的變化。在SD和缺血的最初階段,他們觀察到細胞外K+濃度從3 mmol/L增加到約10 mmol/L, 但其它離子的濃度的變化很小。隨著SD和缺血時間的延長,K+濃度在2~3 s的時間內快速增加至55 mmol/L,而此時Na+、Cl和Ca2+的濃度則分別下降至60、75和0.08 mmol/L,同時,這些變化還伴隨著局部電勢的迅速負移。然而,在SD和缺血兩種生理過程中,離子的變化還是存在一些差異。一方面,在SD發生的5~10 s內,K+的濃度開始增大,而缺血持續1~2 min后才開始出現K+濃度的增大。另一方面,各離子濃度的擾動在SD結束后均恢復正常,但在缺血結束后,離子濃度的失衡會持續一段時間,在5 min后K+ 濃度變為75 mmol/L,Na+為50 mmol/L,Cl為72 mmol/L,Ca2+為0.06 mmol/L。 這些結果表明在SD和缺血期間離子濃度的變化可能與細胞的離子通透性有關。
1978年,Nicholson等[51]采用兩根雙管ISME同時檢測了貓小腦皮層細胞外微環境中Ca2+和K+濃度的變化。當給予小腦皮層30 s的局部電刺激時,該腦區的Ca2+濃度從基線的1.2 mmol/L降至0.8 mmol/L,K+濃度從3 mmol/L增加至8 mmol/L,并且離子濃度的變化幅度與刺激的頻率直接相關。同樣地,Hansen等[52]利用ISME對大鼠皮層缺血和皮層SD時細胞外間隙的體積變化進行了研究。采用含有標記物的50 mmol/L膽堿或50 mmol/L三甲基?三?(羥甲基)?甲基銨離子(N?TRIS)的等滲人工腦脊液沖洗皮層表面,并通過雙管ISME監測它們在大腦皮層細胞外的濃度變化。由于這兩種物質都具有較低的細胞滲透性,因此其濃度的變化反映了細胞外間隙的體積變化。該研究發現在SD和缺血期間,細胞外間隙體積收縮為初始體值的50%左右。
1980年,Krnjevic等[53]通過ISME記錄了電刺激海馬傘部和內嗅區時海馬CA3腦區不同深度的細胞外K+和Ca2+活度(aK、aCa)的變化,發現在錐體細胞層中aK和aCa變化最大。而且,當施加10 Hz的刺激時,aK在CA3腦區較寬的深度范圍內都出現了不同程度的升高; 而aCa則僅在錐體細胞層中出現了明顯下降,他們認為大量Ca2+流入錐體細胞層可能與海馬功能的“可塑性”有關。
Ekholm等[54]在1993年探討了短暫性腦缺血過程中能量恢復與Na+/K+轉運之間的關系,其中Na+/K+轉運是通過ISME測定的細胞外K+的濃度變化來反映的。1984年,Mutch等[55]利用雙管ISME研究了SD和全腦缺血過程中大鼠頂葉皮層細胞外pH的變化。Moghaddam等[56]采用ISME測定了SD和缺氧時紋狀體腦區細胞外K+濃度,同時用碳纖維微電極測定腦內多巴胺的濃度。在SD過程中,隨著K+濃度的急劇升高產生了多巴胺的釋放,而在缺氧狀態下,多巴胺的釋放則明顯先于細胞外K+濃度的快速上升。這表明,雖然SD和缺血過程中紋狀體腦區內存在明顯的多巴胺釋放,但在這兩種生理過程中,K+濃度升高與多巴胺釋放的先后順序是不同的,這可能是由不同的機制造成的。Silver等[57]采用ISME對大鼠腦缺血缺氧時細胞內外游離Ca2+濃度的變化進行了研究。Nedergaard等[58]采用ISME研究了大鼠局灶性缺血模型中細胞內和細胞外pH值之間的關系。
2.2.5?物質干預?Zhang等[59]用ISME研究了地佐環平(MK?801)對重度低血糖患者腦細胞aK和aCa的影響。Young等[60]用ISME研究了貓實驗性脊髓損傷時大劑量皮質類固醇對血液量、誘發電位和細胞外Ca2+濃度的影響, 采用大劑量皮質類固醇進行治療對實驗性脊髓損傷血流量、誘發電位和細胞外Ca2+濃度的影響。Heinemann等[61]用ISME檢測了興奮性和抑制性氨基酸電滲作用引起的貓感覺運動皮層細胞外Ca2+的濃度變化。Pumain等[62]用ISME研究了興奮性氨基酸誘導的大鼠運動皮層中的離子濃度變化。
由于ISE使用方法簡單,數據容易處理,儀器設備操作簡單,響應時間較快(在0.1 s到幾秒之間),因此非常適合用于活體腦內離子的檢測。并且,在活體層次利用ISME開展的研究非常有利于探索生理病理條件下離子的變化及其與其他物質或神經元放電等的相互關系,這對于理解疾病的發病機制非常重要, 對于疾病的預防和治療具有指導作用。
3?固態離子選擇性電極的發展及在活體分析中的應用
雖然液體接觸式ISE在單細胞和活體分析方面得到了廣泛地應用,但仍然存在一定的局限性。液體接觸式ISE含有將敏感膜與內參比電極分開的內部填充溶液(通常稱為內充液),因此液體接觸式ISE對內充液的蒸發、樣品溫度和壓強的變化非常敏感[27,63]。此外,樣品和內充液之間存在離子強度的差異,由此產生的滲透壓會導致水流入或流出內充液,從而引起內充液較大的體積變化,導致ISE敏感膜的分層和靈敏度的降低[27]。因此,液體接觸式ISE需要良好的維護,如定期更換內充液。此外,將內充液的體積降低到遠低于毫升水平是比較困難的,這就限制了傳感器的微型化[64]。盡管目前由玻璃微米管制備的有效面積小于100 nm的液體接觸式ISE已經得到了廣泛應用,但由于其具有較大的電阻,使得檢測過程噪音增加、響應速率降低[65],從而限制了液體接觸式ISE的發展和應用。固態ISE(solid?state ion?selective electrode,SS?ISE)可以通過在敏感膜和導電基底之間形成固體接觸來消除液體接觸式ISE內充液的影響。1970年, Hirata等[66]提出了一種全固態Cu2+的ISE(Cu2+ISE),該電極是將Cu2S浸漬的敏感膜直接滴涂在鉑絲上構成。隨后,Cattrall等[67]用涂有Ca2+摻雜聚合物膜的鉑絲構建了第一個包含離子載體的涂絲電極(即覆絲電極,Coated?wire electrode, CWE),該電極通常被認為是最早的SS?ISE。
為了探索SS?ISE在活體分析中的應用,Hao等[23]以碳纖維電極為基底電極,以氫離子敏感膜為識別元件,設計并制備了微型化的氫離子SS?ISE(H+?ISE),制備的H+?ISE在較窄的生理pH范圍內(pH 6.0~8.0)對溶液pH值的變化表現出良好的響應和可逆性,并且不受中樞神經系統中內源性物質的干擾。更重要的是,H+敏感膜無論是在體外 BSA 溶液中,還是在鼠腦內,都表現出了良好的抗蛋白吸附性能,這使得鼠腦內pH值的檢測具有很好的可靠性。因此,利用該H+?ISE發展了一種電位分析方法,實時監測了酸堿紊亂模型下大鼠杏仁核腦區pH值的變化(圖3)。
盡管這類電極制備簡單,但是其電位穩定性卻很難與液體接觸式ISE相媲美。這是由于CWE是將敏感膜直接修飾在導電基底上形成的,由于敏感膜是離子導電的,而導電基底是電子導電的,因此在敏感膜和導電基底之間會形成“block”界面,阻礙了敏感膜與導電基底之間離子與電子的相互轉導,從而產生了一個純電容界面[27, 68]。為了提高 CWE 的電位穩定性,需要在 ISM 與金屬基底之間引入固態轉導層,用于離子與電子的可逆轉導。正如Nikolskii等[69]總結的,為了得到電位穩定且可靠的SS?ISEs,轉導層必須具備以下3個條件:(1)可逆的離子?電子相互轉導; (2)具有較高交換電流密度的理想非極化界面; (3)沒有副反應。目前, 最常用的中間轉導層主要是導電聚合物、碳納米材料和金屬納米顆粒等[27,70~75]。
目前, SS?ISE的離子?電子的轉導機制主要有兩種[27,75]。一種是在轉導層和敏感膜之間形成類似于不對稱電容器的雙電層電容[27,75~77],如圖4A所示,一側是離子(敏感膜中的陰離子和陽離子),另一側是電荷(轉導層中的電子或空穴),在敏感膜和轉導層之間的界面電容依賴于雙電層的電荷量。轉導層主要是碳納米材料和金屬納米顆粒[27,75]。另一種是基于轉導層的氧化還原反應提供的可逆離子?電子的轉導[27,75,78],轉導層的氧化還原反應涉及到了待測離子或者其疏水的對離子,如圖4B所示。該類氧化還原反應包括摻雜小陰離子或者大電解質的導電聚合物,摻雜物質的含量由氧化還原電容和聚合物的導電性控制。導電聚合物既可以被氧化, 又可以被還原,使得它具有氧化還原的緩沖能力。這種類型的轉導層通常是導電聚合物,如聚吡咯(PPy)、聚苯胺(PANI)、聚3?辛基噻吩(POT)和聚(3,4?乙烯二氧噻吩)(PEDOT)等[27,75]。
在SS?ISE應用過程中,研究人員發現SS?ISE仍面臨著一個關鍵問題:導電基底/ISM界面水層的存在[27,63]使得SS?ISE對滲透壓的變化非常敏感,而且不可避免地會發生電位漂移。為了提高電位的穩定性,必須采取有效措施防止形成水層。目前,將疏水的納米材料引入轉導層是阻止水層形成的有效方法,最常用材料主要是碳材料,如碳納米管、炭黑、三維多孔碳、石墨烯、富勒烯、膠體印跡多孔碳和多孔碳球等[27,63]。Zhao等[5]以空心碳納米球(Hollow carbon nanospheres, HCNs)作為轉導層構建了固態Ca2+ISE,發現無轉導層的Ca2+ISE電位漂移為2.2 mV/h,而HCNs作為轉導層改善了SS?ISE電位的長期穩定性(0.020 mV/h)。他們用內部結構為3層的HCNs作為轉導層構建了微型化的Ca2+ISE,并將該電極用于電刺激引起的SD過程中細胞外Ca2+濃度動態變化的研究(圖5),發現在SD過程中大鼠大腦皮層細胞外Ca2+濃度降低了50.0%±7.5%,這表明SD過程中有大量的Ca2+會流入細胞內。該研究成果為SS?ISE的微型化、活體腦內金屬離子和pH值的測量提供了新的平臺。
另外,Zhao等[4]發現氧化石墨炔(Graphdiyne oxide, GDYO)與水的結合速度優于其它含碳材料。因此,他們首次將GDYO 用作SS?ISE的轉導層,同時采用MnO2作為輔助中間層,構建了K+?ISE。通過計時電位法發現,以GDYO?MnO2為轉導層的K+?ISE的電位漂移((11±2) μV/s)明顯低于以MnO2為轉導層的K+?ISE((39±3) μV/s),這表明GDYO獨特的結構和疏水性能夠阻礙和穩定水層,進而提高SS?ISE的電位穩定性。他們進一步以GDYO?MnO2為轉導層構建了微型的K+?ISE,研究了電刺激條件下大鼠大腦皮層細胞外K+濃度的變化,發現電刺激手段使得細胞外的K+濃度增加了3倍。GDYO作為轉導層可推廣到不同的ISE,且不需要復雜的處理步驟,這為腦內離子傳感提供了新的機會。
離子的動態變化越來越多地被認為在許多腦疾病的生理病理學中發揮著關鍵作用,因此,在腦神經科學研究中測量活體大腦中細胞外離子的濃度顯得尤為重要。然而,目前大多數用于直接測量活體腦組織細胞外離子濃度的電極一般是基于玻璃毛細管的液體接觸式ISE,不僅在制作過程中易碎、耗時,而且這種探針只能用于測量大腦中單一深度和位置的細胞外離子濃度。最近,Odijk等[79]設計并制備了一種可在活體動物腦內同時測量不同深度和位置的微型ISE電極,如圖6所示,他們首先在陣列電極上電沉積導電聚合物PEDOT(如圖6D所示), 然后再修飾K+的敏感膜,形成的K+?ISE用于研究野生型小鼠KCl刺激導致的SD過程中大腦皮層細胞外K+濃度的變化,該電極不受pH、值或O2的干擾,具有很好的穩定性和選擇性。而且,單純裸露的PEDOT電極也可用于電位和神經元活動的記錄,該研究為同一電極同時檢測不同深度和不同位置的離子變化和相關神經元的活動奠定了基礎。另外,這種微制造技術還可以將不同種類的傳感器集成到同一個平臺上,實現不同物質的同時檢測。
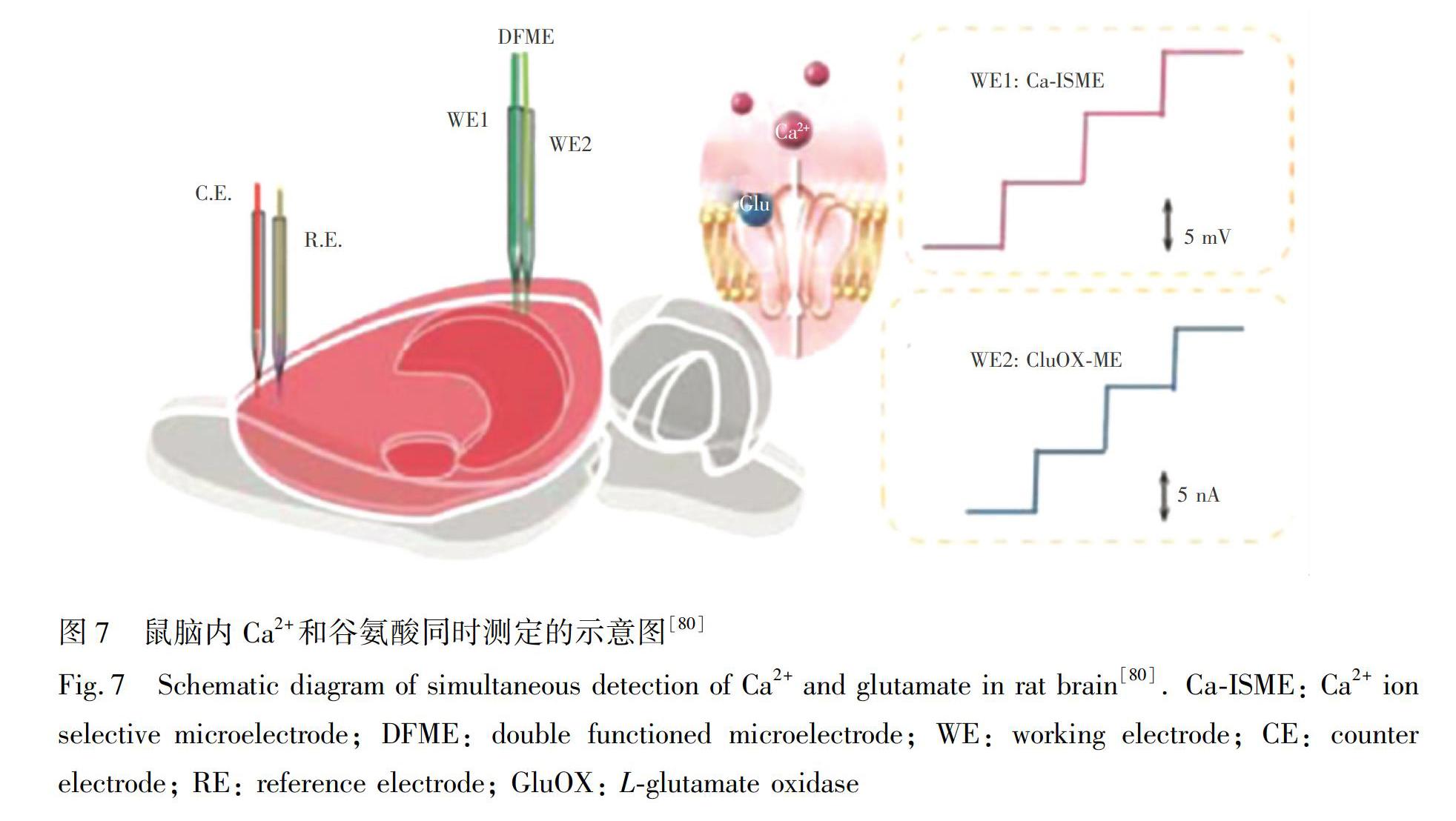
大腦功能的實現依賴于多種化學物質的共同作用,而單一化學物質的檢測難以闡明其信號轉導和疾病發生的生理病理機制。因此,實現大腦中多種物質的同時檢測尤為重要。趙凡等[80]設計并構建了一種能夠同時檢測谷氨酸和Ca2+的新型雙功能微電極(DFME)生物傳感器。該傳感器通過在Pt微電極(Pt?ME)上同時修飾谷氨酸氧化酶GluOX和Pt納米顆粒(PtNPs)用作谷氨酸的電流記錄通道,電沉積的PtNPs大大提高了谷氨酸生物傳感器的靈敏度; 采用全固態Ca2+選擇性微電極作為Ca2+的電位記錄通道(圖7)。該雙功能微電極不僅兩個通道的檢測信號互不干擾,并且具有良好的選擇性和較低的檢測限,已成功應用于大鼠SD和缺血過程中谷氨酸和Ca2+濃度的實時檢測。該研究對理解生理病理過程中谷氨酸和Ca2+的共同作用提供了很好的平臺,而且為兩種或多種化學物質同時檢測提供了一種新的分析方法。
4?ISE在腦神經活體分析化學領域的新進展
近年來, ISE在腦神經化學活體分析中得到了迅速發展和廣泛應用,其中液接式ISE和全固態ISE在腦神經化學活體分析領域仍然占有重要的地位。Filippidis等[81]將液接式ISME和顱內壓(ICP)探針植入大鼠頂葉皮層,用于實時監測大鼠局灶性腦損傷后血管加壓素?1a受體(V1aR)選擇性抑制劑SR49059對細胞外Na+、K+濃度和ICP的調節作用。Haj?Yasein等[82]用液接式ISME評估了水通道蛋白?4(AQP4)缺失對成年小鼠海馬腦區和胼胝體急性切片中活性誘導的K+變化的影響。Yao等[83]研究了AQP4介導的細胞外K+和細胞外間隙(ECS)體積變化對野生型和AQP4缺陷型小鼠皮層擴散性抑制(CSD)去極化的速度、頻率和幅度的影響。Odackal等[84]利用雙管液接式ISME研究了低鈉血癥發生和恢復正常時冠狀腦切片中Ca2+變化的幅度、時間及相應的機制。Haack等[85]演示了雙管液接式ISME的制備和校準,并將該電極用于小鼠海馬腦區急性腦切片,研究了外源性給與谷氨酸受體激動劑或癲癇活動期間細胞外K+濃度的變化。他們還進一步描述了同心ISME的構建,并對比了Na+敏感的雙管電極和同心電極的響應特性。Moon等[86]開發了一種用于同時檢測NO和K+的雙電化學微型傳感器。該傳感器由Pt和Ag的微盤電極構成,其中采用電鍍法對Pt盤表面進行改性,然后用氟化干凝膠對其進行包覆用于檢測NO, 將Ag盤表面氧化成AgCl,在硅烷化后涂覆K+選擇性膜, 用于K+的檢測。該傳感器具有良好的選擇性, 響應時間快, 在體內6 h內具有穩定性,而且該電極尺寸較小,可插入生物組織,因此被用于大鼠癲癇發作時NO和K+動態變化的檢測。Octeau等[87]詳細講述了液接式單極K+?ISME的制備、校準和使用,并將該電極用于成年海馬腦切片電刺激引起的K+的濃度變化的檢測。Zhao等[88]使用TMA+作為ECS的離子示蹤劑,研究了大鼠軀體感覺皮層在SD過程中ECS體積分數α和擴散迂曲度λ的動態變化,其中TMA+的擴散采用液接式雙管ISME進行檢測。另外,ISE本身性能的提高也成為該領域的研究熱點之一,如開發新型的離子載體[89]、 尋找合適的轉導層,提高電位的穩定性和重現性[90~94]、 發展新的信號輸出方法[95,96]、 發展可同時檢測兩種或多種離子的多通道或陣列電極[97,98]等, 這些研究將為ISE在活體分析領域提供更多的發展機會和應用前景。
5?總結與展望
目前,離子選擇性電極的研究取得了較大的發展和進步。相較于傳統ISE,SS?ISE無需特別維護、制備方法簡單、使用壽命較長、響應速度更快、檢測限更低,因此在活體分析領域發揮著越來越重要的作用。未來以下幾個方面將倍受研究者的關注:(1)雖然在過去的幾十年內SS?ISE取得了較大的進步和發展,但是獲得具有可重復的標準電位仍然是的SS?ISE發展面臨的一個巨大挑戰,因此開發具有較大雙電層電容或氧化還原電容的轉導層仍是SS?ISE主要的研究方向之一; (2)SS?ISE與先進微制造技術的兼容性,為制造包含多功能傳感器和可穿戴電子設備的微型化芯片提供了可能,這對于生物活體以及單細胞檢測具有較大的發展前景; (3)SS?ISE有望重振離子選擇性場效應晶體管領域,并與納米線器件相結合,開辟新的可能性; (4)SS?ISE可與無線傳感技術結合實現遠程監控,這對于實現活體動物清醒條件下的測量也十分有效,也可與柔性器件相結合,實現對活體動物的無損傷檢測。
References
1?Li S, Zhang M, Wang J, Yang F, Kang B, Xu J, Chen H. Anal. Chem., 2019, 91(13): 8398-8405
2?Chesler M. Physiol. Rev., ?2003, ?83(4): 1183-1221
3?YANG Cheng, SONG Cai?Qiao, ZHANG Ya?Qi, QU Yao. Chinese J. Anal. Chem., ?2019, ?47(5): 765-771
楊 成, 宋彩僑,張亞旗, 曲 瑤. ?分析化學, 2019, ?47(5): 765-771
4?Zhao L, Jiang Y, Hao J, Wei H, Mao L. Sci. China Chem., ?doi: 10.1007/s11426?019?9516?5
5?Zhao L, Jiang Y, Wei H, Jiang Y, Ma W, Zheng W, Cao A, Mao L. Anal. Chem., ?2019, ?91(7): 4421-4428
6?Pan X, Liu J, Nguyen T, Liu C, Sun J, Teng Y, Fergusson M M, Rovira I I, Allen M, Springer D A, Aponte A M, Gucek M, Balaban R S, Murphy E, Finkel T. Nat. Cell Biol., ?2013, ?15(12): 1464-1472
7?Bading H. Nat. Rev. Neurosci., ?2013, ?14(9): 593-608
8?Nelson M T, French R J, Krueger B K. Nature, ?1984, ?308(5954): 77-80
9?Mattson M P. Aging Cell, ?2007, ?6(3): 337-350
10?Assaf S Y, Chung S H. Nature, ?1984, ?308(5961): 734-736
11?Jentsch T J, Hubner C A, Fuhrmann J C. Nat. Cell Biol., ?2004, ?6(11): 1039-1047
12?Yu J, Chang R C, Tan L. Prog. Neurobiol., ?2009, ?89(3): 240-255
13?Vitvitsky V M, Garg S K, Keep R F, Albin R L, Banerjee R. Biochim. Biophys. Acta, ?2012, ?1822(11): 1671-1681
14?Khanna A, Kahle K T, Walcott B P, Gerzanich V, Simard J M. Transl. Stroke Res., ?2014, ?5(1): 3-16
15?Mani G K, Miyakoda K, Saito A, Yasoda Y, Kajiwara K, Kimura M, Tsuchiya K. ACS Appl. Mater. Interfaces, ?2017, ?9(26): 21651-21659
16?Bradbury M W, Kleeman C R, Bagdoyan H, Berberian A. J. Lab. Clin. Med., ?1968, ?71(5): 884-892
17?XIAO Qing, CHEN Lin, LI Wen?Feng, YANG Li?Qing, CAO Zhong, YU Xin?Yao, LONG Shu, HE Jing?Lin, XIAO Zhong?Liang . Chinese J. Anal. Chem., ?2018, ?46(12): 1886-1894
肖 情, 陳 琳, 李文鋒, 楊麗琴, 曹 忠, 于鑫垚, 龍 姝, 何婧琳, 肖忠良. ?分析化學, 2018, ?46(12): 1886-1894
18??Rossol M, Pierer M, Raulien N, Quandt D, Meusch U, Rothe K, Schubert K, Schoneberg T, Schaefer M, Krugel U, Smajilovic S, Brauner?Osborne H, Baerwald C, Wagner U. Nat. Commun., ?2012, ?3(1): 1-9
19?Petit?Pierre G, Colin P, Laurer E, Deglon J, Bertsch A, Thomas A, Schneider B L, Renaud P. Nat. Commun., ?2017, ?8(1): 1-8
20?Lautenschlager J, Stephens A D, Fusco G, Strohl F, Curry N, Zacharopoulou M, Michel C H, Laine R, Nespovitaya N, Fantham M, Pinotsi D, Zago W, Fraser P, Tandon A, St George?Hyslop P, Rees E, Phillips J J, De Simone A, Kaminski C F, Schierle G S K. Nat. Commun., ?2018, ?9(1): 1-13
21?Raza M, Blair R E, Sombati S, Carter D S, Deshpande L S, DeLorenzo R J. Proc. Natl. Acad. Sci. USA, ?2004, ?101(50): 17522-17527
22?Xiao T, Wu F, Hao J, Zhang M, Yu P, Mao L. Anal. Chem., ?2017, ?89(1): 300-313
23?Hao J, Xiao T, Wu F, Yu P, Mao L. Anal. Chem., ?2016, ?88(22): 11238-11243
24?JIANG Xiao?Jing, LIANG Rong?Ning, QIN Wei. Chinese J. Anal. Chem., ?2018, ?46(9): 1350-1356
姜曉晶, 梁榮寧, 秦 偉. 分析化學, 2018, ?46(9): 1350-1356
47?Pietrobon D, Moskowitz M A. Nat. Rev. Neurosci., ?2014, ?15(6): 379-393
48?Nicholson C, Tenbruggencate G, Steinberg R, Stockle H. Proc. Natl. Acad. Sci. USA, ?1977, ?74(3): 1287-1290
49?Kraig R P, Nicholson C. Neuroscience, ?1978, ?3(11): 1045-1059
50?Hansen A J, Zeuthen T. Acta Physiol. Scand., ?1981, ?113(4): 437-445
51?Nicholson C, Tenbruggencate G, Stockle H, Steinberg R. J. Neurophysiol., ?1978, ?41(4): 1026-1039
52?Hansen A J, Olsen C E. Acta Physiol. Scand., ?1980, ?108(4): 355-36550
53?Krnjevic K, Morris M E, Reiffenstein R J. Can. J. Physiol. Pharmacol., ?1980, ?58(5): 579-583
54?Ekholm A, Katsura K, Kristian T, Liu M, Folbergrova J, Siesjo B K. Brain Res., ?1993, ?604(1?2): 185-191
55?Mutch W A C, Hansen A J. J. Cereb. Blood Flow Metab., ?1984, ?4(1): 17-27
56?Moghaddam B, Schenk J O, Stewart W B, Hansen A J. Can. J. Physiol. Pharmacol., ?1987, ?65(5): 1105-1110
57?Silver I A, Erecinska M. J. Gen. Physiol., ?1990, ?95(5): 837-866
58?Nedergaard M, Kraig R P, Tanabe J, Pulsinelli W A. Am. J. Physiol., ?1991, ?260(3): R581-R588
59?Zhang E T, Hansen A J, Wieloch T, Lauritzen M. J. Cereb. Blood Flow Metab., ?1990, ?10(1): 136-139
60?Young W, Flamm E S. J. Neurosurg., ?1982, ?57(5): 667-673
61?Heinemann U, Pumain R. Exp. Brain Res., ?1980, ?40(3): 247-250
62?Pumain R, Kurcewicz I, Louvel J. Can. J. Physiol. Pharmacol., ?1987, ?65(5): 1067-1077
63?Lindner E, Gyurcsanyi R E. J. Solid State Electrochem., ?2009, ?13(1): 51-68
64?CUI Guang?Wen, HE Run?He, YAO Jian, WANG Jian?Ping, ZHANG Xing?Xiang. Chinese J. Anal. Chem., ?2018, ?46(10): 1669-1676
崔光文, 何潤合, 藥 健, 王建平, 張興祥. 分析化學, 2018, ?46(10): 1669-1676
65?Nicholson C, Rice M E. Neuronal microenvironment, Edited by Boulton A A, Baker G B, Walz W, New Jersey: Humana Press, ?1988: ?247-361
66?Hirata H, Date K. Talanta, ?1970, ?17(9): 883-887
67?Cattrall R W, Freiser H. Anal. Chem., ?1971, ?43(13): 1905-1906
68?Ivanova N M, Levin M B, Mikhelson K N. Russ. Chem. Bull., ?2012, ?61(5): 926-936
69?Nikolskii B P, Materova E A. Ion?Selective Electrode Rev., ?1985, ?7(1): 3-39
70?Bobacka J. Electroanalysis, ?2006, ?18(1): 7-18
71?Bobacka J, Ivaska A, Lewenstam A. Chem. Rev., ?2008, ?108(2): 329-351
72?Bakker E. Anal. Chem., ?2016, ?88(1): 395-413
73?Bieg C, Fuchsberger K, Stelzle M. Anal. Bioanal. Chem., ?2017, ?409(1): 45-61
74?Zdrachek E, Bakker E. Anal. Chem., ?2019, ?91(1): 2-26
75?AN Qing?Bo, JIA Fei, XU Jia?Nan, LI Feng?Hua, NIU Li. Scientia Sinica Chimica, ?2017, ?47(5): 524-531
安清波, 賈 菲, 許佳楠, 李風華, 牛 利. 中國科學: 化學, 2017, ?47(5): 524-531
76?Crespo G A, Macho S, Bobacka J, Rius F X. Anal. Chem., ?2009, ?81(2): 676-681
77?Cuartero M, Bishop J, Walker R, Acres R G, Bakker E, De Marco R, Crespo G A. Chem. Commun., ?2016, ?52(62): 9703-9706
78?Bobacka J. Anal. Chem., ?1999, ?71(21): 4932-4937
79?Odijk M, van der Wouden E J, Olthuis W, Ferrari M D, Tolner E A, van den Maagdenberg A, van den Berg A. Sens. Actuators B, ?2015, ?207: 945-953
80?ZHAO Fan, SHI Guo?Yue, TIAN Yang. Chinese J. Anal. Chem., ?2019, ?47(3): 347-354
趙 凡, 施國躍, 田 陽. 分析化學, 2019, ?47(3): 347-354
81?Filippidis A S, Liang X, Wang W, Parveen S, Baumgarten C M, Marmarou C R. J. Neurotrauma, ?2014, ?31(14): 1258-1267
82?Haj?Yasein N N, Bugge C E, Jensen V, Ostby I, Ottersen O P, Hvalby O, Nagelhus E A. Brain Struct. Funct., ?2015, ?220(4): 2469-2474
83?Yao X, Smith A J, Jin B, Zador Z, Manley G T, Verkman A S. Glia, ?2015, 63(10): 1860-1869
84?Odackal J, Sherpa A D, Patel N, Colbourn R, Hrabetova S. Exp. Neurol., ?2015, ?273: 105-113
85?Haack N, Durry S, Kafitz K W, Chesler M, Rose C R. J. Vis. Exp., ?2015, ?103: 1-15
86?Moon J, Ha Y, Kim M, Sim J, Lee Y, Suh M. Anal. Chem., ?2016, ?88(18): 8942-8948
87?Octeau J C, Faas G, Mody I, Khakh B S. J. Vis. Exp., ?2018, ?135: 1-8
88?Zhao H, Du H, Cai Y, Liu C, Xie Z, Chen K. J. Neurophysiol., ?2019, ?121(5): 1735-1747
89?Guinovart T, Hernandez?Alonso D, Adriaenssens L, Blondeau P, Rius F X, Ballester P, Andrade F J. Biosens. Bioelectron., ?2017, ?87: 587-592
90?He N, Papp S, Lindfors T, Hofler L, Latonen R M, Gyurcsanyi R E. Anal. Chem., ?2017, ?89(4): 2598-2605
91?Wang S, Wu Y, Gu Y, Li T, Luo H, Li L, Bai Y, Li L, Liu L, Cao Y, Ding H, Zhang T. Anal. Chem., ?2017, ?89(19): 10224-10231
92?Boeva Z A, Lindfors T. Sens. Actuators B, ?2016, ?224: 624-631
93?Ishige Y, Klink S, Schuhmann W. Angew. Chem. Int. Ed., ?2016, ?55(15): 4831-4835
94?Szucs J, Lindfors T, Bobacka J, Gyurcsanyi R E. Electroanalysis, ?2016, ?28(4): 778-786
95?Vanamo U, Hupa E, Yrjana V, Bobacka J. Anal. Chem., ?2016, ?88(8): 4369-4374
96?Jarolimova Z, Han T T, Mattinen U, Bobacka J, Bakker E. Anal. Chem., ?2018, ?90(14): 8700-8707
97?Eylem C C, Tastekin M, Kenar A. Talanta, ?2018, ?183: 184-191
98?Zdrachek E, Bakker E. Anal. Chem., ?2018, ?90(12): 7591-7599
Recent Advances of Ion?Selective Electrode for ?in Vivo
Analysis in Brain Neurochemistry
ZHAO Li?Jun1, ZHENG Wei*1, MAO Lan?Qun*2,3
1(College of Materials Science and Chemical Engineering, Harbin Engineering University, Harbin 150001, China)
2(Beijing National Laboratory for Molecular Science, Key Laboratory of Analytical Chemistry for Living Biosystems,
Institute of Chemistry, Chinese Academy of Sciences, Beijing 100190, China)
3(University of Chinese Academy of Sciences, Beijing 100049, China)
Abstract?In the central nervous system, the realization of brain functions cannot be achieved without the participation of many ions, therefore, it is of great significance to real?time monitor the dynamic of ions in the living brain for understanding many physiological and pathological events. As a kind of electrochemical sensor, ion?selective electrode has been widely used for in vivo analysis and other fields in the past half century due to its low cost, simple operation and low energy consumption. This review mainly focuses on the development of ion?selective electrodes, and introduces its basic structure and application in the field of brain neurochemical analysis.
Keywords?Ion?selective electrode; In vivo analysis; Brain neurochemistry; Review

