植入式多通道神經微電極的發展
魏春蓉 裴為華

摘?要?人類的大腦約由800億神經細胞構成,這些神經元之間的連接將大腦組成了一個超復雜的神經網絡,要研究大腦的功能機制,破譯其神經網絡的信息編碼原理,一個重要的方法是在大腦神經元網絡中,同時觀察、記錄盡可能多的單個神經元活動信號。植入式多通道神經微電極作為一種可實時記錄多個神經元峰電位信號的器件,在神經信號的時間分辨率和設備的便捷性方面有著其它神經成像技術不可替代的優點。在不影響大腦功能甚至動物行為的前提下,為了在大腦中植入通道數更多的電極,需要在植入式多通道電極的材料、結構、集成方式和植入及封裝方法等方面不斷地進行改進創新和優化。本文簡要回顧了多通道微電極技術的發展歷史,重點介紹了采用微加工技術制備植入式多通道微電極的發展歷程和研究現狀,對未來的發展趨勢進行了展望。
關鍵詞?植入式神經微電極; 微加工技術; 微通道電極; 薄膜電極; 電極陣列; 評述
1?引 言
18世紀末,意大利生理學家在蛙腿標本首次觀察到生物電信號。19世紀初,神經的靜息電位和動作電位被直接測量到。神經元電信號實際上是神經元細胞膜內外兩側不同帶電離子濃度差造成的電位差,維持及改變電位差是神經元最基本的產生、傳遞和處理信息的基本方式。
神經元是大腦的基本結構和功能單位,當神經元被激活時,其膜電位會發生快速的特征性變化,稱為峰電位(Spike potential, SP)或動作電位(Action potential, AP),峰電位的持續時間約1 ms。神經元活動水平越高,其發放峰電位的頻率也越高。對單個神經元來說,其峰電位的幅值是固定不變的。采用細胞內記錄方法采集的最大電位波動可達到100 mV; 細胞外記錄方法可采集的最大電位波動約為1 mV。 胞內記錄需要使用電極對單個神經細胞進行操作,技術難度大,難以同時記錄多個神經細胞的電信號,限制了其在多通道記錄方面的應用。相對于胞內記錄,胞外記錄盡管獲得的信號幅度小,但卻不需要進行單個細胞操作,在保持較小植入損傷的前提下,可在活體動物內長期追蹤神經元的放電活動[1~3],并且在記錄通道數方面具有很強的可擴展性。
植入式神經微電極是將以離子為載體的神經電信號轉化成以電子為載體的電流或電壓信號的傳感器件。神經電極通常由金屬材料制成,為了傳感測量神經組織中局部區域(單個細胞或神經元群體)的電勢變化,需要對暴露在體液中電極的面積進行限制,方法是僅留出一定的電極面積與體液中的離子接觸,其它部分則通過鍍覆絕緣層的方法與體液隔絕。暴露在絕緣層外的電極面積,通常稱為記錄點或電極位點。當用作胞外記錄的植入式神經微電極放置在神經元附近時,伴隨著神經元活動,記錄點位置處的離子濃度產生變化,進而引起電極電位的變化,由此記錄到神經元的電活動信號。記錄點的大小和界面阻抗[4,5]決定了其所能記錄到的神經信號的特征和信噪比。通常,為記錄單個神經元的峰電位信號,記錄點的大小應與神經元的尺寸相當或更小。因此,胞外記錄電極位點的大小通常在幾十微米以下,但由于電極本底噪聲的限制,電極記錄點的面積不能無限縮小,目前報道的最小記錄點面積為3 μm ×1.5 μm[6]。 對于相同面積大小的電極,阻抗越低,所記錄到的信號質量越好,對電極表面進行材料改性或界面修飾[7~9]可大幅降低界面阻抗,改善電極的信噪比。
胞外記錄的多通道神經微電極可同步記錄自由活動的動物或人的神經信號,經常用于研究神經活動和行為之間的對應關系。記錄到的神經元數量越多,找出兩者之間確定對應關系的可能性就越大,Alivisatos等[10]還在Cell Press上撰文提議要記錄“每個神經元的每個動作電位”。為了增加可同時植入大腦的神經電極的通道數,首先需將單個胞外記錄電極的器件尺寸降低到最小; 其次,需選擇適當的組裝和封裝方法,將多個通道連接并集成在一起,裝配到一個可與放大電路連接的接口上。到目前為止,植入式多通道微電極的通道數量已從上世紀的數十通道發展到上千通道[11~16]; 多通道記錄電極的材料、結構、集成方式和封裝工藝也從最初的金屬微絲電極陣列,發展到現在的以硅材料為代表、微納加工制備方法為主,多種材質和電極結構并存。本文圍繞植入式胞外多通道神經微電極的材料、制備工藝、通道數量規模及功能特點,評述基于金屬、硅和聚合物等多種材質電極的結構特點和制備方法,梳理基于微絲(針)和薄膜兩種電極的發展過程和現狀,總結集成了放大電路等功能單元的作用和效果[17~19],并對植入式多通道神經微電極未來的發展趨勢進行了分析和預測。
2?多通道微絲電極
微絲電極,或者稱為針狀電極,是將細絲或針的最前端暴露作為記錄點,是最早出現的胞外記錄電極類型之一,一般由包裹了絕緣材料的金屬材料制備而成[20],這種電極的特點是一根微絲(針)上只有一個記錄點。神經電極的絕緣材料要求具有低的介電常數、穩定的化學性質、優異的防水性以及良好的生物相容性,一般采用玻璃、陶瓷、聚四氟乙烯(Poly tetra fluoroethylene, PTFE)、聚酰亞胺(Polyimide, PI)或聚對二甲苯(Parylene)等作為電極絕緣材料。常用的電極導電材料有鎳鉻合金、鎢(W)、金(Au)、鉑(Pt)、銥(Ir)等貴金屬材料,這些材料電導率大,化學性質穩定,能長期在體液環境中工作。早在20世紀50年代, Strumwasser等[21]利用直徑80 μm的不銹鋼神經電極記錄了松鼠的神經電信號。Sonnhof等[22]制備了玻璃絕緣的鎢絲電極,通過飽和KNO2腐蝕,將鎢絲記錄點前端變細,在減小損傷的同時提高了對單個神經元放電的分辯能力,在貓的腦干區域清晰記錄到了調控后的神經元放電。為了增加可同時記錄神經元的數量,Tsai等[23]建立了8導和16導多通道金屬絲神經電極陣列,其制備方法是將PTFE絕緣后的金屬微絲按照預設的間距手工組裝排布,固定后焊接在電極接口上,得到了間距為200~300 μm的8通道垂直電極和間距為400~500 μm的16通道平面電極。到目前為止,利用直徑12 ~30 μm預制好的電極絲材料,通過截斷和組裝的方法制作而成的通道數16~32導的電極陣列仍在實驗室廣泛使用[24]。將金屬微絲排布成通道數更多陣列的操作較為困難,如唐世明[25]利用金屬微絲排布了上百通道的高密度電極陣列。在制備方法中,手工操作的比例較大,制備合格的電極需要經驗豐富的操作人員。為了使金屬電極的排布標準化,Fofonoff等[26]采用火花放電及線切割加工方法,在塊狀金屬鈦上以減法的形式加工出電極陣列,然后通過化學腐蝕、針體絕緣、針尖暴露等工藝,最后形成100通道數目的微絲電極陣列,如圖1A所示。此時,所有的針狀電極的根部都還連接在金屬底座上,因此,無論多通道電極陣列的規模有多大,電極與電極之間的間距一致性將得到保障。這時還需在電極根部填充絕緣材料,以固定陣列,并使得陣列間的各通道相互絕緣。最后,通過線切割,將金屬塊狀襯底去除,制備成通道數規模在100導左右、間距和電極形狀一致性都很好的金屬微針電極陣列。
與金屬材料相比,基于硅材料的微加工技術更為豐富和成熟,微電子產業的發展使得硅材料,特別是單晶硅的雜質和缺陷得到了很好的控制。同時,硅材料成本大幅降低,加上硅材料良好的機械特性和生物相容性,與硅工藝兼容的氮化硅、氧化硅等完備的絕緣材料體系,這些條件和優勢使得硅成為加工多通道微電極陣列的最佳材料之一。
1989年,猶他大學的Normann研究組根據之前的經驗積累提出了利用體硅工藝制備微針電極的方案。1991年,Campbell等[27]制備了以長4.2 mm、寬4.2 mm、厚0.12 mm的硅為支撐層的100導硅針微電極陣列,每個針體長1.5 mm,根部直徑80 μm,尖端直徑3~5 μm,針體用PI等材料絕緣,針尖暴露區域長約25 μm, 鍍覆鉑或氧化銥,以改善阻抗特性,可用于記錄皮層內神經信號。在制備方法上,使用厚1.7 mm, 電導率6~20 Ω/cm的N型單晶硅片,在其上采用電子束蒸發鋁并圖形化成與電極通道數對應的圓形陣列,利用正反面的溫度梯度使得鍍覆的鋁熱遷移注入到硅片內形成穿通硅片的柱形鋁(P)型重摻雜區,然后在這些柱形區之間劃槽(留厚0.2 mm),隔離出這些P型重摻雜的硅柱,得到一個留厚區固定且以NPN結相互絕緣的電極坯。電極坯先后經歷動態和靜態各向同型濕法腐蝕[28~30],得到光滑且尖銳的錐形針尖結構。對頂部針尖和針體背面的引出點進行金屬化處理,最后利用PI絕緣并暴露針尖,形成10 ×10的三維陣列電極。在此基礎上,Jones等[31]于1992年利用玻璃代替PN結作為各硅針間的絕緣材料,制備了同種三維神經電極。這種制備硅針電極的工藝得到不斷地改進和完善[32~37],電極功能、一致性和可靠性不斷得到改進和提高,成為為數不多的經過美國食品和藥品管理局(FDA)認證的可用于人大腦皮層神經信號記錄的多通道電極,用于癱瘓病人的運動功能恢復研究方面[3,38~40]。Ajiboye等[3]利用猶他電極和神經信號處理及分析的系統進行了長達2年多的腦電信號監測,并利用記錄的腦電信號操控手臂實現了高位截癱病人的自主進食。與猶他電極采用體硅工藝不同,Zhao 等[41]提出了一種硅線陣電極的工藝,利用薄膜硅工藝制備了多通道神經電極,如圖1B所示,其優點是一致性好、電極陣列的通道數可通過預制的應力點靈活選擇。盡管猶他硅基針式電極在神經科學研究以及腦機接?口應用等方面取得了許多突破,但猶他電極一個硅針一個記錄點的結構特點使得其通道數目難以持續增加,更多的通道數目需要更多的針體和更大體積,過多的針體會導致植入困難,并給腦組織帶來嚴重的損傷。
以猶他電極為代表的體硅電極,延續了金屬微絲電極單通道重復組合的陣列結構,將神經電極的通道數目提升到百導量級,降低了金屬微絲電極對手工操作的依賴。利用光刻等微加工工藝,提高了批量制備多通道神經電極的效率和電極之間的一致性。但由于每根針體結構僅包含一個記錄點,當電極的通道數目增加時,電極尺寸成比例增加,植入損傷隨之而增加,限制了電極通道數目的進一步提升。
3?薄膜電極
薄膜電極是基于平面加工工藝發展出來的神經微電極,一般由支撐層、下絕緣層、導電層和上絕緣層組成。薄膜電極打破了單根針體上僅有一個記錄點的傳統電極結構,充分利用微納加工技術優勢,在一根針體上制備了多個記錄點,增加了記錄通道數,減小了電極尺寸,提高了電極密度。以硅材料為襯底的薄膜電極不僅提高了神經電極的密度,其制備工藝與集成電路制備工藝兼容,還便于與后端神經信號處理電路集成,這一特點大大提高了這種電極結構在通道數和功能方面的可擴展性。
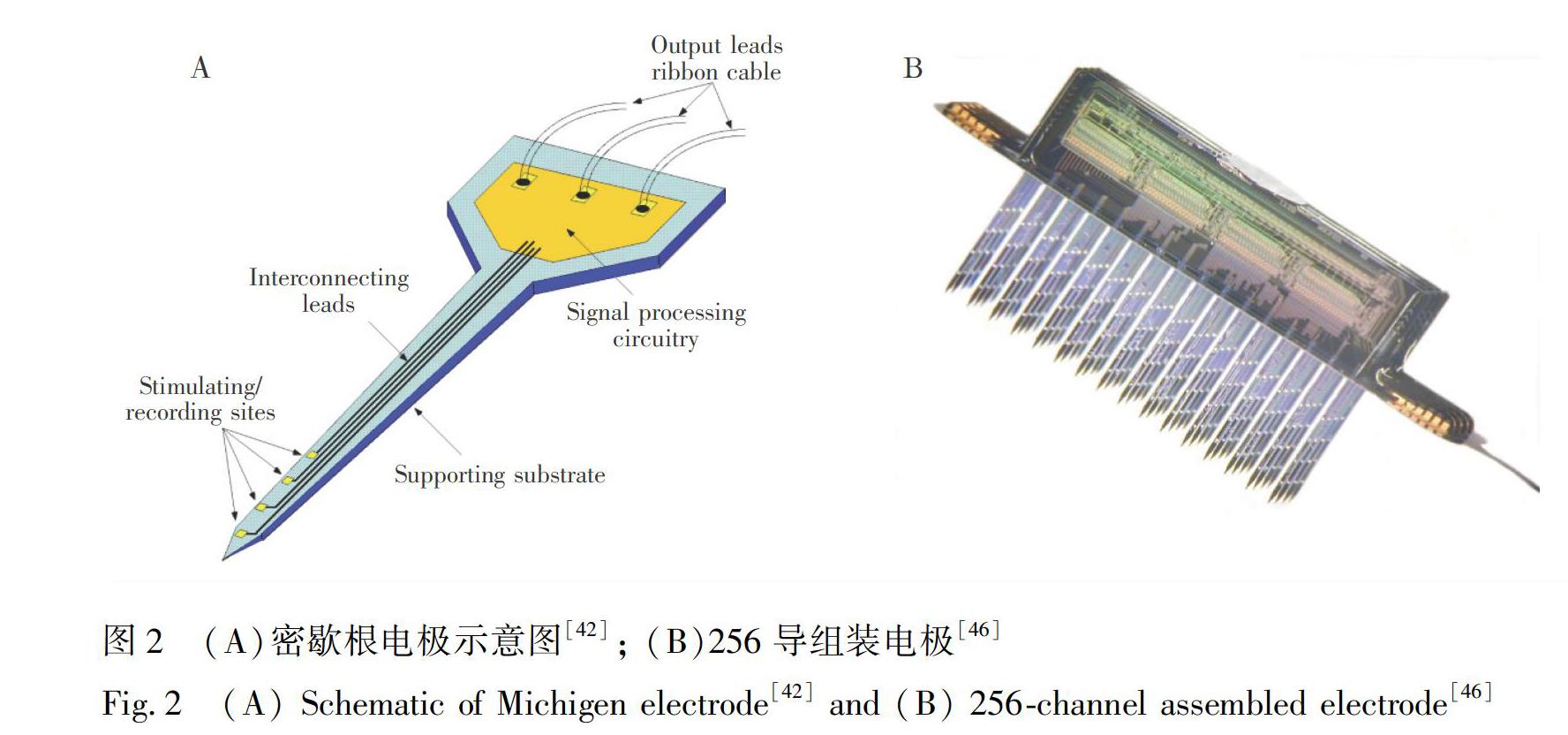
最具代表性的薄膜電極是由Michigan大學開發的電極,其商品名稱為Neuronexs。1985年,Najafi 等[42]制備了長3 mm、寬50 μm、厚15 μm的單針硅基薄膜電極,該電極以硅為支撐層,上下絕緣層是氮化硅和氧化硅的復合膜,夾在兩層絕緣層之間的金屬被加工成4根電極通道導線,包含4個記錄點,如圖2A所示。在制備方法上,使用P型<100>晶向的單晶硅片為襯底,先將硅片氧化,在氧化后的硅片上進行光刻,形成圖形化的光刻膠圖形。在光刻膠的掩膜下刻蝕氧化硅,然后以被刻蝕后的氧化硅層圖形作為掩膜,在1175℃進行濃硼摻雜15 h(濃硼摻雜區一方面可作為自停止腐蝕區用于定義器件層的厚度和平面輪廓,另一方面重摻雜襯底可消除襯底中載流子定向移動帶來的噪聲),隨后去除氧化硅層。然后在硅片表面化學氣相淀積(Chemical vapor deposition,CVD)300 nm/800 nm氧化硅和氮化硅的復合膜作為下絕緣層(復合膜還被用于平衡材料間應力,避免電極針體產生較大的應變),光刻后沉積50 nm鉭,剝離后形成圖形化的鉭導線作為導電層,再CVD沉積氮化硅和氧化硅作為上絕緣層。等離子刻蝕去除記錄點和壓焊點區域的上絕緣層,并在暴露區沉積Au,以改善記錄特性,并形成可壓焊連接的pad區。最后,以濃硼摻雜區的自停止腐蝕特性,在EPW溶液中腐蝕除去非摻雜區,將針體釋放下來。制備完成的Michigan電極壓焊封裝后,在沙鼠小腦皮層記錄到約200 μV的單個神經元放電。基于這一結構和制備工藝,薄膜電極可通過拓展單個器件所包含的電極針體數目以及單個針體上所包含記錄點數目[43~45],不斷增加通道數規模。通過后期電極與電極之間的高密度封裝,能夠得到記錄點通道數成倍增加的薄膜電極陣列。2001年,Wise研究組通過組裝薄膜電極的方式制備了256導神經電極[46~48],如圖2B所示。集成在電極后端的電路旨在減小各通道間串擾并抑制神經電信號的衰減[47,49~51],該電極包含了64個電極針體,針體密度過高,該256通道電極的動物植入實驗未見報告。
3.1?高密度薄膜電極
與微絲電極相似,通過增加針體數目提高通道數的方法勢必會增加電極體積,帶來更大的植入損傷。隨著光刻精度不斷提高,光源波長不斷縮小[52,53],曝光方式和光刻膠不斷改進[54],光刻特征尺寸不斷減小[55~57]。通過壓縮線條寬度,提高單個針體上電極集成密度的多通道電極制備方法,具有更大的通道數擴展潛力。借助納米加工技術及標準微電子加工技術,如CMOS加工工藝,1000導量級的高通量、小尺寸薄膜神經電極不斷涌現[6,58,59]。
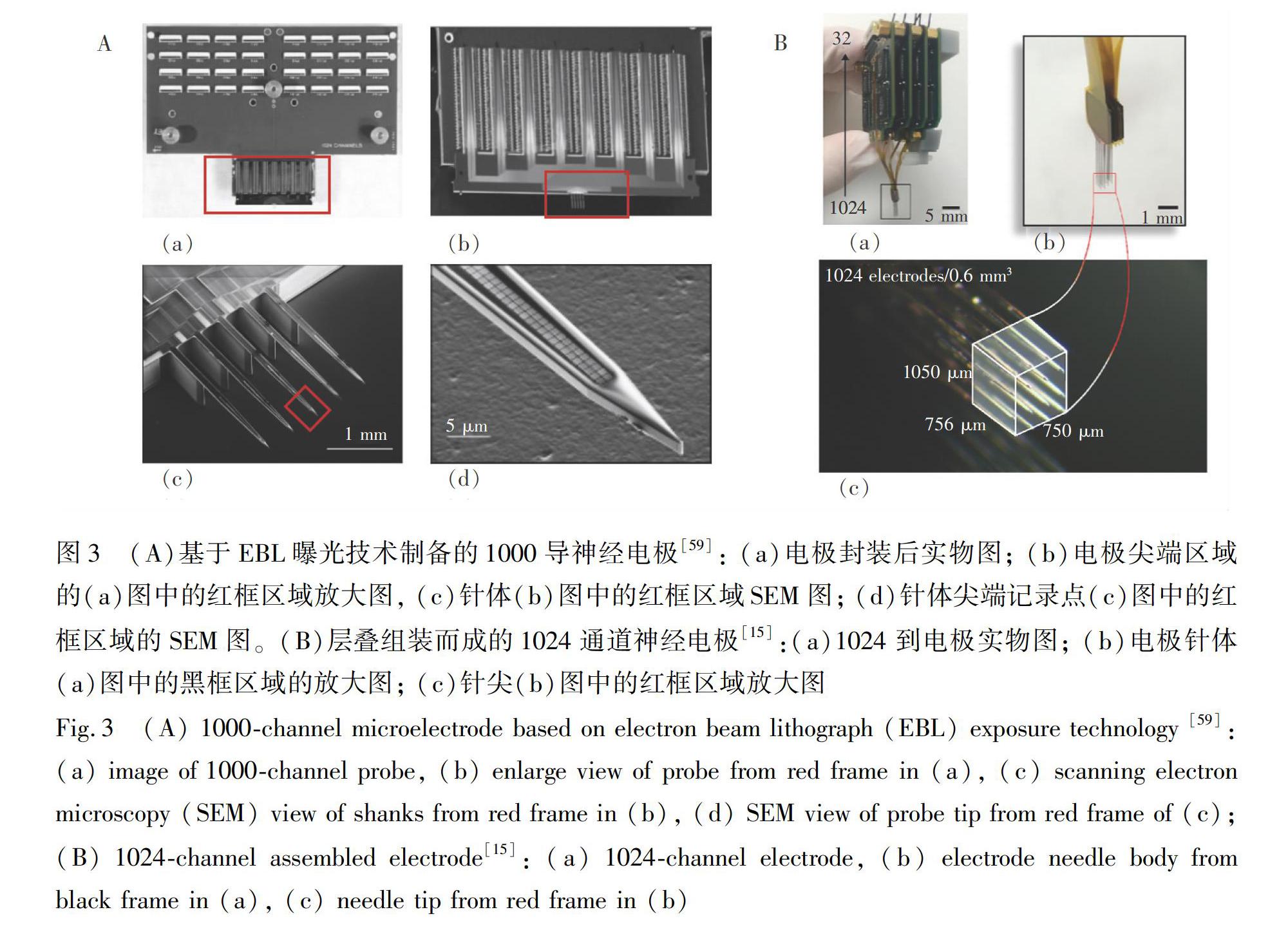
Scholvin等[59]在絕緣層上硅(Silicon on insulator,SOI)上,利用紫外光刻和電子束光刻技術制備了包含5根針體、1000通道數目的神經電極,通過SOI材料的結構設計將每根針體的厚度控制在15 μm。為了減小電極的橫向尺寸,金屬導線采用電子束曝光(Electron beam lithograph,EBL),最小導線寬度僅為200 nm,記錄點尺寸為9 μm ×9 μm,記錄點的中心間距為11 μm,這樣每個針上可緊湊排列200個記錄點。盡管先進的微加工技術能夠將神經電極的針體尺寸減小、記錄點密度增加,但是1000導電極封裝出來的后端體積拉大了電極的整體尺寸,電極實物圖和局部放大圖如圖3A所示,過于龐大的電極后端增加了動物活體實驗的操作難度。與Wise研究組2001年的工作相似,Roso等 [15]利用4個封裝好的256通道的電極通過層疊方式制備了包含16個針體和1024個通道的神經電極陣列(圖3B)。針體上的金屬導線制備采用了納米加工工藝,寬度僅為300 nm。每個針體厚度約21 μm,寬度不超過65 μm,如圖3B所示。導線尺寸的壓縮,使得1024通道電極所包含的針體數量僅為16個,為器件的微創植入和實際應用提供了方便。整個神經電極系統包括前端的硅基電極針體、中端的柔性電線和后端帶有神經信號處理芯片的印刷電路版(Printed circuit board,PCB)。盡管柔性連線為前端的針體的植入操作提供了一定的靈活性,但采集端PCB版體積比較龐大,難以進行慢性動物試驗。
3.2?電極與電路單片集成的薄膜電極
上述兩種電極為實現千導記錄點信號一對一輸出,使得電極后端扇出部分的封裝體積過于龐大,不利于植入動物體內進行活體實驗。薄膜電極與后端電路單片集成,可同時解決通道數擴展和多通道信號扇出的問題。Herbawi等[60]基于0.18 μm CMOS加工技術制備了最多可包含1600個通道的神經電極,該電極長10 mm,寬100 μm,厚50 μm,共包含50塊記錄點區域,每塊區域包含32個記錄點,記錄點尺寸為17 μm×17 μm。通過集成選通電路輸出32導電極信號,極大縮減了需要引出的通道數目和電極后端的引出體積,如圖4A所示。
硅基電極與硅基放大及信號處理電路之間的單片集成,一方面可借助電路的通道復用技術,壓縮電極通道連接需要的引線數量,減小電極后端的引出體積,便于進行動物實驗; 另一方面,硅片集成的放大電路,有助于提高記錄信號的質量。IMEC公司的Raducanu等[12]基于0.13 μm CMOS技術制備了包含1356通道的Neuroseeker神經探針,由1344個尺寸為20 μm × 20 μm的記錄點,外加12個20 μm×80 μm的參考電極點組成,整個針體長8 mm,寬100 μm,厚50 μm。Neuroseeker神經探針支持同時輸出1356導神經信號,也可將兩個記錄點合成為一個記錄點,輸出678導神經信號。每個記錄點帶有前放電路,通過電極基座上的電路對神經信號進行放大、濾波、多路復用和數字化后輸出。
2017年, Jun等[58]報道了一種名為Neuropixels的電極,這種電極是集電極記錄點、放大電路、濾波和數字化于一體的有源神經電極。電極基于0.13 μm CMOS工藝制備而成,單針體上的記錄點為四行交叉的棋盤式排布,記錄位點大小約為12 μm ×12 μm,記錄點間距為20 μm,電極前端寬度僅為70 μm, 厚20 μm。電極包含兩種輸出類型,一種是長5 mm的短柄神經電極,包含384個記錄點,所有記錄點均可同時輸出神經電信號。另一種是長10 mm的長柄神經電極,包含996個記錄點,針體下的開關陣列最多可同時選通276個記錄點輸出,如圖4B所示。該電極在老鼠體內進行了動物實驗,采用兩根這樣的電極同時記錄到跨越5個腦區的700多個神經元發放的電信號。
3.3?多功能薄膜電極
薄膜電極除了可與后端電路集成以外,還能將藥物通道和光源集成在電極上。通過電刺激和藥物注入調控神經元的活動,同時記錄調控后的電活動變化[61]。這種集成了微通道[16,62]和光源[62,63]的多功能神經電極,不僅可用于神經信號記錄,還能給與神經元刺激,實現大腦和外界的雙向交流,為基礎神經科學的研究和臨床應用提供更全面的信息。在這種集成多功能電極的研究方面,Rohatgi等[64]在多通道平面薄膜電極上增加了一個小的石英管,制備了集生物電信號記錄和液體藥物傳輸于一體的多功能神經電極。利用該電極的藥物傳輸通道向小鼠大腦皮層注入河豚毒素,成功抑制了周圍神經元的放電活動。與記錄單個神經元放電信息不同,藥物調控或電刺激很難做到只對單個神經元起作用,無法實現對細胞的選擇性調控。自2005年, Diesseroth研究組先后發表了多篇有關光調控神經細胞活動的論文[65~68],通過轉基因手段使神經元表達對光敏感的離子通道,使用光源能激活或抑制特定的神經元放電,成為研究大腦和調神經元活動的重要手段。
為了配合光遺傳操作對光刺激和電記錄的需求[69~71],Cho等[72]利用微納加工技術制備了集成光波導的16通道神經電極,該電極針體長5 mm,寬80 μm,厚12 μm,如圖5A所示。通過光刻定義和制備了寬62.5 μm的SU?8波導及出光口位置,波導末端用光纖和激光器耦合,耦合損耗為Symbolm@@
3.7 dB(57%),傳輸損耗為?0.22 dB/mm(4.9%)。雖然輸出光功率足夠激活神經元放電,但是集成波導的光電極需要連接光纖,限制了動物的自由活動。為此,Kim等[73]制備了集微電極記錄點、微光電探測器(μ?IPD)、微發光二極管(μ?ILED)和溫度傳感器于一體的多功能神經光電極,如圖5B所示。器件層和輔助植入襯底之間用絲素蛋白柔性連接,植入后可將襯底取出,減小對腦組織的損傷。當器件在體內工作時,μ?ILED進行光刺激,上一層的μ?IPD可探測μ?ILED發光,以精確輸出光功率的大小; 同時,下一層的溫度傳感器檢測μ?ILED附近的溫度,避免過高的溫度對腦組織造成傷害。動物實驗結果顯示,光通道蛋白激活和光源刺激之間具有很強的相關性,驗證了該多功能電極的性能。
3.4?柔性薄膜電極的發展
盡管基于硅、金屬或陶瓷的針式或薄膜的多通道電極在急性記錄和通道數量集成方面取得很好的效果,但由于硅和陶瓷等材料的硬度較大,在慢性植入時,植入器件的硬度與周圍腦組織的機械不匹配會引起慢性的免疫反應[74,75],造成的結果是電極周圍的小膠質細胞和星型膠質細胞增加[76~78],神經元細胞逐漸遠離或被迫與電極隔離,最終導致神經元信號的丟失[79]。目前,基于柔性材料制備的神經電極被證明可改善或減輕神經組織的免疫反應[80,81],在動物實驗中表現出良好的生物相容性[2,6]。Parylene[82]、PI[82]和SU?8[83]等絕緣材料具有低的介電常數、較小的彈性模量和低生物毒性,常被用作制備柔性神經微電極的基底材料。
在柔性電極的研制方面, Wei等[83]利用光學曝光和電子束曝光相結合的方式制備了通道數為8和16的多通道柔性電極。其中金為導電層,SU?8為上下絕緣層,整個器件層厚度大約為1 μm。將導線和記錄點分布在不同平面提高了空間利用率,減小了電極尺寸,增大了電極密度。PEDOT修飾記錄點后將電化學阻抗降到500 KΩ@1 KHz以下,信噪比最高可達到19。植入體內兩個月后的切片觀察結果顯示,周圍幾乎沒有形成組織包裹,神經細胞與柔性電極很好地交融在一起。Lieber研究組[84]設計制備了柔性網狀神經電極,電極采用SU?8為絕緣層,以金鉑為導電層,記錄點直徑為20 μm。在網狀結構的節點上排布了32、64和128導的柔性神經電極,利用空心針頭將網狀電極壓縮后注射植入進顱內,之后網狀結構自行伸展,以記錄大范圍內的神經元放電信號。在此基礎上,該研究組[2]仿照神經元的結構形態制備了類神經元電極,該電極是以SU?8為上下絕緣層、金鉑為導電層的網狀三明治結構。記錄點形狀和尺寸與植入部位的神經元相仿,電極體的彎曲剛度與神經軸突處于同樣數量級,電極阻抗約為500 KΩ@1 KHz。將電極立體注射到生物體內,3個月后并未發現明顯的神經元數量減少,以及星形膠質細胞和小膠質細胞的增加。這種柔性薄膜電極引起的組織損傷和免疫反應小。該研究還提供了新生神經元向這種電極附近遷移的證據。
柔性薄膜電極顯示了良好的生物相容性,但柔性薄膜電極為匹配腦組織的彈性模量而犧牲了剛性,導致無法直接植入。除了上面提到的注射植入方法,為了解決柔性電極植入問題, Kil等[82]使用右旋糖酐葡聚糖作為暫時加固材料輔助柔性電極(Parylene C為絕緣層,金屬鉑為導電層)植入,葡聚糖涂層植入后被溶解吸收。電極植入體內4個月后,組織學檢查在植入區域附近發現少量的膠質瘢痕產生,并在體內葡聚糖溶解區域發現了活體神經元,表明了這種輔助植入材料不會對植入部位的神經元造成損傷。Guan等[6]提出了一種稱為神經流蘇的電極,將分離制作的多條細絲狀柔性電極浸入融化后的聚乙二醇(Polyethylene glycol,PEG),利用液固界面的表面張力在拉出時將16根絲狀電極固定成一束,待PEG固化變硬后輔助流蘇電極植入。電極植入后,PEG被腦液溶解,柔性神經纖維束釋放。植入5周后,觀察切片發現,相較于硅電極,神經流蘇電極周圍有更少的小膠質細胞和星形膠質細胞,證明柔性的神經流蘇電極具有更好的生物相容性。Zhao等[62]提出了柔性電子涂層的概念(Nanoelectronic coating,NEC),制備出了厚度小于1 μm、 包含32導的柔性電極。由于電極的楊氏模量極小,僅利用水的表面張力即可將NEC電極吸附在光纖或其它輔助植入的探針上,待水干后,電極仍可穩定地粘附在輔助植入探針表面。該研究將微型通道給藥器和光纖作為柔性電極的輔助植入工具,在解決柔性電極植入問題的同時,又增加了電極的功能。無論是利用工具輔助植入,還是通過涂覆可在硬軟兩相之間轉變的材料輔助植入,柔性的電極的植入仍是一個需要解決的技術難點。
盡管薄膜柔性電極的生物相容性得到了極大的改善,但柔性薄膜電極,特別是基于超薄聚合物材料的柔性電極,其在體內工作超過一年后的記錄狀態尚未見報道。基于超薄聚合物柔性材料制備的薄膜電極,其本身的長期可靠性還需進一步提高。
4?結 論
多通道神經微電極作為腦科學研究的工具,對推動腦認識的進展發揮了重要的作用[85~87]。在神經工程研究方面,刺激型神經微電極已經應用在帕金森等疾病的治療上。在多通道記錄神經微電極的應用方面,盡管早期的臨床實驗展示了其在提取運動皮層信息、用于假肢控制的可行性,給高位截癱、漸凍癥等病人的康復和生活自理帶去了希望[17,37,88,89],但無論是在生物相容性、穩定性,還是在獲取的信息通量方面,多通道植入神經微電極技術還面臨著許多問題,其走向臨床應用還有許多關鍵技術亟待突破。
首先是電極的記錄點分布問題,目前包含1000個記錄點的電極還處在技術發展的早期,其在植入端的電極記錄點只能集中分布在大腦中某一個或幾個位置,如何將這1000個,甚至更多的記錄點分散到不同的腦區以實現對不同部位的信息抽樣,還存在著較大的困難。其次是電極信號的引出或接口問題,如果將每個記錄點所記錄的全部神經信息無損傳出,需將記錄點通過引線一一連接到放大及處理電路上,即便是在集成了放大及模數轉換電路的電極上,受電路面積、功耗和傳輸帶寬的限制,多通道電極的接口部分的尺寸仍難以滿足要求。在數量眾多的記錄點和有限的放大通道之間采用開關選通的方案可緩解這一矛盾,但終究無法滿足同時記錄更多神經元的需求。一些新出現的材料和傳感器技術,如通過光或電激勵驅動的聚合物,利用其引導柔性電極,或許可實現電極記錄點在體內的自主移動,解決電極記錄點在體內的分散排布問題[90,91]; 利用對電場高敏感的液晶材料制備成高通量電極[92,93],每個記錄點在神經電作用下會有透光性的變化,利用光成像的讀出方法可同時觀察成千甚至上萬個神經元的活動,解決多通道神經電極的扇出問題。
從電極記錄通道數的增長來看,薄膜電極在通道數擴展方面還有一定的增加空間。由于微電子技術加工極限寬度低于10 nm,借助先進的集成電路加工工藝或納米加工技術,薄膜神經微電極的集成通道數,無論是在硅還是柔性聚合物基底上,都有希望大幅度提高。相信隨著材料技術、集成技術和封裝技術的不斷發展,未來能夠制備可記錄百萬神經元[10]的植入式多通道電極。
References
1?Buzsáki G R, Stark E, Berényi A, Khodagholy D, Kipke D R, Yoon E, Wise K D. Neuron, 2015, 86(1): 92-105
2?Yang X, Zhou T, Zwang T J, Hong G, Zhao Y, Viveros R D, Fu T M, Gao T, Lieber C M. Nat. Mater., 2019, 18(5): 510-517
3?Ajiboye A B, Willett F R, Young D R, Memberg W D, Murphy B A, Miller J P, Walter B L, Sweet J A, Hoyen H A, Keith M W, Peckham P H, Simeral J D, Donoghue J P, Hochberg L R, Kirsch R F. Lancet, 2017, 389(10081): 1821-1830
4?Chen S, Pei W, Qiang G, Tang R, Chen Y, Zhao S, Wang H, Chen H. ?Sens. Actuators A, 2013, 193(15): 141-148
5?Wang M H, Ji B W, Gu X W, Tian H C, Kang X Y, Yang B, Wang X L, Chen X, Li C Y, Liu J Q. Biosens. Bioelectron., 2018, 99: 99-107
6?Guan S, Wang J, Gu X, Zhao Y, Hou R, Fan H, Zou L, Gao L, Du M, Li C, Fang Y. Sci Adv., 2019, 5(3): eaav2842
7?Heim M, Yvert B, Kuhn A. J. Physiol. Paris, 2012, 106(3-4): 137-145
8?Cui X Y, Martin D C. Sens. Actuators B, 2003, 89(1-2): 92-102
9?Boehler C, Stieglitz T, Asplund M. Biomaterials, 2015, 67: 346-353
10?Alivisatos A P, Chun M, Church G M, Greenspan R J, Roukes M L, Yuste R. Neuron, 2012, 74(6): 970-974
11?Iii R H O, Wise K D. IEEE J. Soli?St. Circ., 2005, 40(12): 2796-2804
12?Raducanu B C, Yazicioglu R F, Lopez C M, Ballini M, Putzeys J, Wang S, Andrei A, Rochus V, Welkenhuysen M, Helleputte N V, Musa S, Puers R, Kloosterman F, Hoof C V, Fiath R, Ulbert I, Mitra S. Sensors (Basel), 2017, 17(10): 2388
13?Mora Lopez C, Putzeys J, Raducanu B C, Ballini M, Wang S, Andrei A, Rochus V, Vandebriel R, Severi S, van Hoof C, Musa S, van Helleputte N, Yazicioglu R F, Mitra S. IEEE Trans. Biomed. Circuits Syst., 2017, 11(3): 510-522
14?Du J, Blanche T J, Harrison R R, Lester H A, Masmanidis S C. PLoS One, 2011, 6(10): e26204
15?Rios G, Lubenov E V, Chi D, Roukes M L, Siapas A G. Nano Lett., 2016, 16(11): 6857-6862
16?Johnson M D, Franklin R K, Gibson M D, Brown R B, Kipke D R. J. Neurosci. Methods, 2008, 174(1): 62-70
17?Salanova V. Epilepsy Behav., 2018, 88S: 21-24
18?Drobisz D, Damborska A. Behav. Brain. Res., 2019, 359: 266-273
19?Lake W, Hedera P, Konrad P. Neurosurg. Clin. N. Am., 2019, 30(2): 147-159
42?Najafi K, Wise K D, Mochizuki T. ?IEEE T. Electron. Dev., 1985, 32(7): 1206-1211
43?Ji J, Wise K D. IEEE J. Soli?St. Circ., 1992, 27(3): 433-443
44?Perlin G E, Sodagar A M, Wise K D. International Conference of the IEEE Engineering in Medicine & Biology Society, 2016: 2982-2985
45?Kim C, Wise K D. ?Symposium on Vlsi Circuits, Digest of Technical Papers, 1994: 97-98
46?Ghovanloo M, Wise K D, Najafi K. International IEEE Embs Conference on Neural Engineering, 2003: ?138-141
47?Wise K D, Sodagar A M, Yao Y, Gulari M N, Perlin G E, Najafi K. P IEEE., 2008, 96(7): 1184-1202
48?Gingerich M D, Hetke, J F, Anderson, D J, Wise K D. The 11th International Conference on Solid?State Sensorsand Actuators, 2001: 416-419
49?Wise K D, Najafi K. Science, 1991, 254(5036): 1335-1342
50?Najafi K, Wise K D. ?IEEE J. Soli?St. Circ., 1986, 21(6): 1035-1044
51?Bai Q, Wise K D. International Conference of the IEEE Engineering in Medicine & Biology Society, 1998, 4: 1826-1829
52?Fay B. Microelectron. Eng., 2002, 61?2(2): 11-24
53?Bonakdar A, Rezaei M, Brown R L, Fathipour V, Dexheimer E, Jang S J, Mohseni H. Opt. Lett., 2015, 40(11): 2537-2540
54?Brunsvold W R, Crockatt D M, Hefferon G J, Lyons C F. Opt. Eng., 1987, 26(4): 330-336
55?Maile B E, Henschel W, Kurz H, Rienks B, Polman R, Kaars P. ?International Microprocesses & Nanotechnology Conference, 2002: 254-255
56?Pavel E, Jinga S, Andronescu E, Vasile B S, Kada G, Sasahara A, Tosa N, Matei A, Dinescu M, Dinescu A, Vasile O R. Opt. Commun., 2013, 291(6): 259-263
57?Brodie I, Westerberg E R, Cone D R, Muray J J, Williams N, Gasiorek L. IEEE Transact. Electron Dev., 1981, 28(11): 1422-1428
58?Jun J J, Steinmetz N A, Siegle J H, Denman D J, Bauza M, Barbarits B, Lee A K, Anastassiou C A, Andrei A, Aydin C, Barbic M, Blanche T J, Bonin V, Couto J, Dutta B, Gratiy S L, Gutnisky D A, Hausser M, Karsh B, Ledochowitsch P, Lopez C M, Mitelut C, Musa S, Okun M, Pachitariu M, Putzeys J, Rich P D, Rossant C, Sun W L, Svoboda K, Carandini M, Harris K D, Koch C, O'keefe J, Harris T D. Nature, 2017, 551(7679): 232-236
59?Scholvin J, Kinney J P, Bernstein J G, Moore?Kochlacs C, Kopell N, Fonstad C G, Boyden E S. IEEE Trans. Biomed. Eng., 2016, 63(1): 120-130
60?Herbawi A S, Kiessner L, Paul O, Ruther P. International Conference on Solid?state Sensors, 2017: 20-23
61?Dun N J, Mo N. J. Physiol., 1989, 410(1): 267-281
62?Zhao Z, Luan L, Wei X, Zhu H, Li X, Lin S, Siegel J J, Chitwood R A, Xie C. Nano Lett., 2017, 17(8): 4588-4595
63?Bernstein J G, Boyden E S. Trend. Cogn. Sci., 2011, 15(12): 592-600
64?Rohatgi P, Langhals N B, Kipke D R, Patil P G. Neurosurg. Focus., 2009, 27(1): E8
65?Zhang F, Wang L P, Brauner M, Liewald J F, Kay K, Watzke N, Wood P G, Bamberg E, Nagel G, Grottschalk A. Deisseroth K. Nature, 2007, 446(7136): 633-639
66?Boyden E S, Zhang F, Bamberg E, Nagel G, Deisseroth K. Nat. Neurosci., 2005, 8(9): 1263-1268
67?Zhang F, Wang L P, Boyden E S, Deisseroth K. Nat. Method., 2006, 3(10): 785-792
68?Adamantidis A R, Zhang F, Aravanis A M, Deisseroth K, De Lecea L. Nature, 2007, 450(7168): 420-424
69?Wu F, Stark E, Ku P C, Wise K D, Buzsáki G,Yoon E. ?Nature, 2015, 88(6): 1136-1148
70?WANG Fei, ZHANG Xue?Lian, PEI Wei?Hua, CHEN Hong?Da. Semicond. Opt., 2018, 39(5): 68-71
王 飛, 張雪蓮, 裴為華, 陳弘達. 半導體光電, 2018, 39(5): 68-71
71?Chen S, Pei W, Gui Q, Chen Y, Zhao S, Wang H, Chen H. ?J. Neural. Eng., 2013, 10(4): 046020
72?Cho I J, Baac H W, Yoon E. IEEE International Conference on Micro Electro Mechanical Systems, 2010: 995-998
73?Kim T I, Mccall J G, Jung Y H, Huang X, Siuda E R, Li Y, Song J, Song Y M, Pao H A, Kim R H, Lu C, Lee S D, Song I S, Shin G, Al?Hasani R, Kim S, Tan M P, Huang Y, Omenetto F G, Rogers J A, Bruchas M R. Science, 2013, 340(6129): 211-216
74?Polikov V S, Tresco P A, Reichert W M. J. Neurosci. Methods, 2005, 148(1): 1-18
75?Schmidt S, Horch K, Normann R. J. Biomed. Mater. Res., 1993, 27(11): 1393-1399
76?Giordana M T, Attanasio A, Cavalla P, Migheli A, Vigliani M C, Schiffer D. Neuropathol. Appl. Neurobiol., 1994, 20(2): 163-174
77?Szarowski D H, Andersen M D, Retterer S, Spence A J, Isaacson M, Craighead H G, Turner J N, Shain W. Brain Res., 2003, 983(1?2): 23-35
78?Fujita T, Yoshimine T, Maruno M, Hayakawa T. Acta Neurochir (Wien) ., 1998, 140(3): 275-279
79?Mccreery D, Pikov V, Troyk P R. J. Neural Engineer., 2010, 7(3): 036005
80?Lee Y, Kong C, Chang J W, Jun S B. J. Korean Med. Sci., 2019, 34(4): e24
81?Du Z J, Kolarcik C L, Kozai T D Y, Luebben S D, Sapp S A, Zheng X S, Nabity J A, Cui X T. Acta Biomater., 2017, 53: 46-58
82?Kil D, Bovet Carmona M, Ceyssens F, Deprez M, Brancato L, Nuttin B, Balschun D, Puers R. Micromachines (Basel), 2019, 10(1): 61
83?Wei X, Luan L, Zhao Z, Li X, Zhu H, Potnis O, Xie C. Adv. Sci., 2018, 5(6): 1700625
84?Fu T M, Hong G, Viveros R D, Zhou T, Lieber C M. Proc. Natl. Acad. Sci. USA, ?2017, 114(47): E10046-E10055
85?O'doherty J E, Lebedev M A, Ifft P J, Zhuang K Z, Shokur S, Bleuler H, Nicolelis M A. Nature, 2011, 479(7372): 228-231
86?Hubel D H, Wiesel T N. J. Physiol., 1969, 202(1): 251-260
87?Nakazawa K, Mchugh T J, Wilson M A, Tonegawa S. Nat. Rev. Neurosci., 2004, 5(5): 361-372
88?Khan I S, D'agostino E N, Calnan D R, Lee J E, Aronson J P. World Neurosurg., 2019, 126: 638-646
89?Ethier C, Oby E R, Bauman M J, Miller L E. Nature, 2012, 485(7398): 368-371
90?Lu X, Zhang H, Fei G, Yu B, Tong X, Xia H, Zhao Y. Adv. Mater., 2018, ?30(14): e1706597
91?Rogóz M, Zeng H, Xuan C, Wiersma D S, Wasylczyk P. Adv. Opt. Mater., 2016, 4(11): 1902-1902
92?Brodzeli Z, Silvestri L, Michie A, Guo Q, Pozhidaev E P, Chigrinov V, Ladouceur F. Liq. Cryst., 2013, 40(10): 1427-1435
93?Brodzeli Z, Silvestri L, Michie A, Guo Q, Pozhidaev E P, Chigrinov V, Ladouceur F. J. Lightwave. Technol., 2013, 31(17): 2940-2946
Development of Implantable Multichannel Nural Mcroelectrodes
WEI Chun?Rong1,2, PEI Wei?Hua*1
1(The State Key Laboratory on Integrated Optoelectronics, Institute of Semiconductors,
Chinese Academy of Sciences, Beijing 100083, China)
2(University of Chinese Academy of Sciences, Beijing 100049, China)
Abstract?The human brain contains about 80 billion nerve cells, and the connections between neurons form a complicated brain neural network. To study the function of the brain mechanisms and the coding principle of the neural network, an important method is to record single?neuron activity as much as possible at the same time. Implantable multichannel neural microelectrodes is a key device that multiple discharge activities of single neurons and can record the spike potential signal of neurons in real?time. In terms of the temporal resolution of neural signals, microelectrode has irreplaceable advantages over other neuroimaging techniques. How to implant more electrodes with more channels in the brain without affecting the function of the brain requires constant innovation and optimization in the material, structure, integration mode and packaging method of implanting multichannel electrodes. This paper briefly reviews the development history of multichannel microwire technology and focuses on the development history, research status and future development trend of implantable multichannel microelectrode by micromachining technology.
Keywords?Implantable neural microelectrodes; Micromachining technology; Multichannel microelectrodes; thin film electrode; Electrode array; Review

