剖宮產瘢痕妊娠分型治療的臨床分析
郅玲玲,高海英,高萬里,馬秀華,宋風麗
(首都醫科大學大興醫院婦產科,北京 102600)
剖宮產瘢痕妊娠(CSP)指有剖宮產史孕婦,胚胎著床于子宮下段剖宮產切口瘢痕處,是一種特殊部位的異位妊娠,為剖宮產的遠期并發癥之一,近年來由于國內剖宮產率居高不下,此病的發生呈上升趨勢[1]。其可引起胎盤植入、子宮破裂、大出血危及孕婦生命等。目前臨床治療方案眾多,國內外尚未形成統一診斷和治療標準,2016年中華醫學會婦產科分會計劃生育學組對剖宮產瘢痕妊娠形成了新的專家共識,本文基于專家共識,針對不同分型,探討其個體化治療。
一、資料與方法
1.研究對象:按照中華醫學會婦產科分會計劃生育學組的分型標準,收集2012年1月至2018年12月首都醫科大學大興醫院收治的85例剖宮產瘢痕妊娠患者的臨床資料。對其診斷和治療進行回顧性分析,排除臨床資料不全、不能進行分型者。
2.診斷方法:依據剖宮產史及彩色多普勒陰道超聲診斷標準確診,6例行核磁協助診斷。參考“剖宮產術后子宮瘢痕妊娠診治專家共識(2016)”[2],超聲檢查表現為:(1)子宮腔內、宮頸管內空虛,未見妊娠囊;(2)妊娠囊著床于子宮前壁下段肌層(相當于前次剖宮產術手術切口部位),部分妊娠囊內可見胎芽或胎心搏動;(3)子宮前壁肌層的連續性中斷,妊娠囊與膀胱之間的子宮肌層明顯變薄、甚至消失;(4)彩色多普勒血流顯像提示,妊娠囊周邊高速低阻血流信號。
采用中華醫學會婦產科分會計劃生育學組對CSP分型的新的界定標準,即主要依據瘢痕部位子宮肌層的厚度及妊娠囊外凸的程度分型。Ⅰ型:妊娠囊部分或大部分位于子宮腔內,妊娠囊與膀胱間的子宮肌層厚度>3 mm;Ⅱ型:妊娠囊部分或大部分位于子宮腔內,妊娠囊與膀胱間的子宮肌層厚度≤3 mm;Ⅲ型:妊娠囊外凸向膀胱方向,妊娠囊與膀胱之間的子宮肌層明顯變薄或缺失,厚度≤3 mm[2]。按照診斷標準,本組資料中I型40例,Ⅱ型34例,Ⅲ型11例。
3.治療方法:所有患者均做好宮腔填塞和開腹準備,術前備血,充分告知手術風險和可選方案,患者知情選擇。(1)超聲監測下清宮術或清宮術+球囊填塞:對CSP患者行超聲監測下清宮術,如術中宮腔活動性出血給予Foley’s導尿管局部壓迫,尿管球囊內注入15~35 ml生理鹽水,接引流袋,向下牽拉尿管,壓迫子宮下段。觀察5 min,宮頸口無出血,B超腹腔內無液體,子宮下段完整,生命體征平穩,術畢24 h后放出宮腔內生理鹽水。(2)MTX+超聲監測下清宮術:清宮術前肌注MTX(50 mg/m2),一周后復查血β-HCG,再行超聲監測下清宮術。(3)開腹或經陰道瘢痕病灶切除術+修補術:腰麻或硬脊膜外麻醉下,逐層進腹,充分分離膀胱,局部注射垂體后葉素,切除妊娠病灶及瘢痕,分兩層縫合切口,恢復局部解剖。(4)雙側子宮動脈介入栓塞術+清宮術:明膠海綿顆粒栓塞雙側子宮動脈,栓塞術后24 h內彩超監測下清宮。穿刺肢體制動24 h。
4.觀察指標及治愈標準:患者基本信息,臨床癥狀,術中出血量,監測治療后的β-HCG下降情況,住院時間及住院費用,超聲指標(根據超聲分型)及術后監測妊娠包塊情況,術后并發癥情況。治療成功標準:術后 60 d內血清β-HCG降至正常,無陰道出血癥狀,超聲提示宮腔內異常回聲消失[3]。
5.統計學方法:應用SPSS 19.0統計學處理對患者的一般情況進行統計學分析。計量資料采用t檢驗,組間比較采用單因素方差分析。P<0.05為差異具有統計學意義。
二、結果
1.患者一般資料:患者年齡最小24歲,最大43歲,平均年齡33歲;一次剖宮產史72例,2次剖宮產史12例,3次剖宮產史1例;孕次(含本次)2~8次,平均3.5次;發病距上次剖宮產時間5個月至13年,其中1例瘢痕妊娠6年后再次瘢痕妊娠。85例(100%)患者均有停經,45例(53%)有陰道少量出血,12例(14%)有輕微腹痛。停經時間35~78 d,平均(56.25±24.56)d。入院血β-HCG水平范圍1 883~150 000 U/ L。
2.不同型別CSP臨床診治情況:本研究共有60例(I型37例,Ⅱ型23例)選擇清宮術。其中,50例(I型36例,Ⅱ型14例)行單純清宮術,術后6~8周血β-HCG均恢復正常;10例(I型1例,Ⅱ型9例)行清宮術+球囊壓迫,其中8例血β-HCG 8周內下降正常,2例(Ⅱ型8周、11周各1例)β-HCG下降不滿意,分別注射MTX 1次(50 mg/m2),12周血β-HCG均恢復正常。
4例(I型1例,Ⅱ型3例)選擇MTX+清宮術,其中3例一周查β-HCG無明顯下降,行清宮術;1例一周后復查超聲可見胎心搏動(入院時無胎心),患者選擇子宮動脈栓塞+清宮術。
12例行子宮動脈栓塞+清宮術(I型2例,Ⅱ型7例,Ⅲ型3例),其中11例痊愈,但有1例清宮術后26 h發生大面積肺栓塞,經搶救無效死亡。
9例行瘢痕病灶切除+修補術(Ⅱ型1例,Ⅲ型8例),其中開腹病灶切除7例,經陰道病灶切除2例,9例血β-HCG 2~3周恢復正常(表1)。
全部85例CSP患者,除1例(Ⅱ型)行介入+清宮術后因肺栓塞死亡,其余手術均獲成功,無子宮切除,無持續性妊娠。
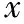
表1 不同型別CSP臨床診治情況(-±s)
注:與介入+清宮術組之外其他各組比較,*P<0.05;與其他各組比較,#P<0.05
應用不同方法治療CSP中,病灶切除術血β-HCG下降至正常時間更快,與介入+清宮術組之外其他各組相比均有統計學差異(P<0.05);病灶切除術者出血量顯著高于其他各治療組(P<0.05);MTX+清宮術住院時間最長,顯著長于其他各組(P<0.05);采用清宮術治療費用最低,介入+清宮術治療費用最高,與其他治療方法相比均有統計學差異(P<0.05)(表1)。
3.特殊病例分析:有2例為外院誤診為早孕行藥流術的CSP III型患者,術后均有陰道不規律出血。其中一例為孕6周外院藥流術后66 d,陰道不規律出血,超聲提示宮腔內異常回聲團伴肌層血流信號豐富,血β-HCG 700 U/L,患者選擇清宮術,術中活動性出血180 ml,家屬要求保守治療,遂行宮腔球囊壓迫,術中監測彩超提示盆腔無游離液,宮腔內無明顯異常,術后3 d、7 d監測血β-HCG分別為87 U/L、75 U/L,β-HCG下降不滿意,病理示蛻膜及絨毛組織,陰道無出血,給予米非司酮口服治療,間斷監測血β-HCG逐漸下降至5.2 U/L,清宮術后無陰道出血及月經來潮。術后50 d無誘因突然出現陰道大量出血,急診來院行開腹探查,見子宮下段膨大約5 cm×5 cm×4 cm,表面紫藍色,子宮瘢痕兩側菲薄,少許滲血,盆腔內積血30 ml,行瘢痕妊娠病灶切除術,術后5 d監測血β-HCG 0.57 U/L,病理示子宮肌壁內可見凝血、纖維素樣壞死及退變的絨毛組織,符合CSP Ⅲ型診斷,痊愈出院。另一例治療過程類似,出院后門診監測血β-HCG下降至10 U/L,又出現陰道大量出血來院,急診行開腹瘢痕切除術,術中見瘢痕處紫藍色、菲薄,行瘢痕切除術痊愈出院。
介入+清宮術后死亡病例:患者35歲,停經45 d,陰道少量出血伴下腹脹痛1 d入院,體重指數29.38 kg/m2,彩超提示CSP II型,血運豐富,子宮動脈介入栓塞術后半小時于彩超引導下行清宮術,術中出血約5 ml,術畢無活動性出血,患者一般情況好,術畢24 h撤除右下肢壓力繃帶后無不適,術畢26 h下床時突然倒地,意識不清,呼吸困難,大便失禁,面色紫紺。即刻測血壓120/80 mmHg,經皮指氧61%,診斷肺栓塞。即刻全院搶救,20 min后出現心跳呼吸驟停,經過胸外按壓,氣管插管呼吸機輔助通氣及強心溶栓等積極搶救無效于6 h后死亡。搶救過程中行心臟彩超提示左室收縮功能減低,右房增大,右室流出道增寬。彩超提示右側下肢靜脈血栓。均支持肺栓塞診斷。
三、討論
CSP是一種罕見的異位妊娠,近年隨著我國剖宮產率的上升,發病率明顯上升,目前發生率已達1/1 800~1/2 216次妊娠[4],近年國內資料報道為1.43/1 000次妊娠[5]。CSP的發病機制尚不清楚,而鑒于CSP發生后可引起胎盤植入、子宮破裂、大出血等嚴重后果,因此對剖宮產指征要嚴格把握,對于無生育要求的婦女,應該采取可靠的避孕措施。
CSP臨床癥狀不典型,與早孕先兆流產及異位妊娠癥狀相似,早期易漏診誤診,提高產科、超聲科醫生意識尤為重要。對于瘢痕子宮再次妊娠婦女建議首選超聲檢查,超聲診斷簡單可靠,特別是經陰道和經腹超聲聯合,不僅可以幫助定位妊娠囊,且有利于明確妊娠囊與子宮前壁下段肌層及膀胱的關系[6]。本研究組85例均經陰道超聲診斷,其中6例為陰道超聲+核磁診斷幫助分型,符合率100%,證明陰道超聲能夠準確診斷CSP,患者并沒有從核磁檢查中獲得更多的益處,故有學者不建議常規行MRI檢查[7]。對于基層超聲科醫師要培訓提高其診治水平幫助臨床醫生做出診斷。
目前有研究認為對于診斷為CSP Ⅰ型或Ⅱ型,強烈要求繼續妊娠的孕婦,在充分知情產前或產后出血、子宮破裂、子宮切除等風險后,可于有急診處理產科大出血、緊急切除子宮等條件的三級醫療中心密切隨訪下期待治療至孕晚期[8]。但因風險高,期待治療的方案尚需深入研究,不能作為常規處理。對于CSP,治療原則仍是盡早發現,盡早治療,減少并發癥。孕周越大,子宮破裂風險也越高。2016年8月,中華醫學會計劃生育學組對瘢痕妊娠的診治形成了中國專家共識[2],提出了新的分型標準,進一步明確了各種治療方案的適應癥。CSP分型對于手術方案的選擇具有重要指導意義。本組研究中顯示I型CSP,實施清宮術或清宮術加球囊壓迫,均治療成功。行介入后清宮術的2例I型CSP,患者除了減少20 ml的出血,沒有更多的獲益,但醫患接受了額外的X線照射且患者花費了高昂的介入費。對于I型可以首選超聲監測下清宮術或清宮術+球囊壓迫。
本組研究中有2例術后確診為CSP Ⅲ型,在外院誤診為早孕行藥流術,術后陰道不規律出血就診者,行清宮術+球囊壓迫,術后血β-HCG下降至很低水平仍然發生陰道大量出血最后行瘢痕切除才得以痊愈。提示對于Ⅲ型胎囊種植于肌層深處者即使清宮術后血β-HCG降至很低,仍有發生大出血風險,臨床要嚴密監測,最好行瘢痕切除修補術。
開腹CSP病灶切除術可于術中切除子宮瘢痕,修補縫合后子宮肌層重新愈合有利于瘢痕的修復,可減少再次發生CSP的風險[9-10],對于CSP Ⅲ型,清宮術大出血風險極大,而介入術后清宮出血風險雖然極大降低,但不能修補局部瘢痕組織,有再次CSP可能。本組病例中即有1例有二次CSP,第一次CSP選擇介入+清宮術,6年后再次妊娠仍為CSP Ⅲ型,第二次手術選擇開腹CSP病灶切除術,術后恢復良好,目前再次妊娠為宮內正常妊娠。對于無生育要求CSP Ⅲ型患者,可行介入+清宮術,而對于有生育要求的患者來說,切除CSP病灶對減少再次CSP是更好的選擇。CSP病灶切除方式眾多,有開腹CSP病灶楔形切除術+修補術,陰式或腹腔鏡,腹腔鏡聯合陰式子宮瘢痕妊娠病灶切除術[3,11-12],總之,需根據患者病情特點和本院實際情況及術者操作熟練程度選擇不同手術方法。保障患者安全是第一選擇。對于需要快速止血者直接開腹修補更能保證患者安全。
本組研究中對于CSPⅡ型臨床選擇多樣化,每種方法各有利弊,術前預防性介入栓塞治療對血流豐富的瘢痕妊娠可明顯減少刮宮術中出血量[13],保證患者安全。此外,子宮動脈栓塞術可作為病情危重合并大出血患者的首選應急治療方法,亦可作為CSP患者術中或術后大出血時的補救措施[14],而對乏血流和較豐富血流的瘢痕妊娠暫無必要,且可能增加患者經濟負擔并導致不必要的風險[13]。本組研究中應用介入+清宮術治療者術中出血少,但其中1例術后發生大面積肺栓塞死亡,分析其肥胖、高齡,加上介入術后右下肢制動,均為發生肺栓塞的高危因素。介入后發生肺栓塞屬于極罕見病例,但也說明介入治療會發生嚴重并發癥。本病例對于臨床如何處理CSP有重要警示作用,本院曾一度減少了術者應用介入后清宮術治療CSP。認真總結經驗教訓,術前要根據患者分型及高危因素充分評估介入栓塞風險,嚴格把握適應證。因介入術后制動下肢,故更要積極給予下肢靜脈驅動,按摩下肢,盡最大可能減少血栓風險。對血流豐富的CSPⅡ型或Ⅲ型可采用介入+清宮術,但要審慎,避免發生死亡等嚴重并發癥。
目前關于單劑量MTX 治療異位妊娠的標準是否適合CSP尚無循證醫學證據,臨床上有MTX聯合UAE、妊娠囊內局部注射或全身單劑量注射MTX等方案治療CSP,具有一定的效果,但治療總時間長,成功率在71%~83%[15]。本組研究中采用藥物治療者較少,只有4例,因其住院周期長,血β-HCG下降不滿意,療效欠佳,需要進一步總結。
綜上,陰道超聲可作為早期診斷CSP的方法,對CSP要盡早治療,I型可首選超聲監測下清宮術;Ⅲ型視其有無生育要求可選擇介入+清宮術或病灶切除術,術前要充分評估介入栓塞風險,術后積極預防血栓;Ⅱ型治療選擇多樣化;根據CSP分型不同及術者擅長合理選擇不同治療方法,可節約醫療資源,減少患者花費,保證患者安全,達到患者收益最大化。

